玉木耳漆酶基因Aclac的克隆及原核表達
蘇文英 譚一羅 劉曉梅 楊和川 秦裕營 李曉 任立凱

摘要:【目的】對玉木耳漆酶基因Aclac進行克隆及原核表達分析,為深入研究漆酶基因在玉木耳子實體發育中的生物學功能提供理論依據。【方法】克隆Aclac基因的cDNA和DNA全長序列,對其進行生物信息學分析,并將目的基因連接至pET-28a質粒上以構建原核表達載體pET28a-Aclac,將其轉化大腸桿菌BL21(DE3)中誘導表達。【結果】克隆獲得的Aclac基因cDNA序列長度為1734 bp,編碼577個氨基酸殘基;Aclac基因DNA序列長度為2521 bp,含14個內含子。AcLAC蛋白理論分子量為64.75 kD,理論等電點為5.70,不穩定指數為34.01,無跨膜區域,存在1個信號肽,在4個銅離子結合區高度保守,且含有Cupredoxin超家族蛋白保守功能域。AcLAC蛋白與真菌的漆酶蛋白聚為一支,其中,AcLAC蛋白與木耳屬真菌的漆酶蛋白親緣關系最近。AcLAC融合蛋白在大腸桿菌BL21(DE3)表達宿主中成功表達,分子量為67 kD。【結論】克隆獲得的Aclac基因屬于Cupredoxin超家族基因,可在原核表達系統中異源表達,推測其與其他真菌漆酶基因在生物學功能上具有一致性,豐富了真菌漆酶資源。
關鍵詞: 玉木耳;漆酶基因;克隆;生物信息學;原核表達
中圖分類號: S646.6 ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ?文獻標志碼: A 文章編號:2095-1191(2021)08-2158-07
Cloning and prokaryotic expression analysis of laccase gene Aclac from Auricularia cornea
SU Wen-ying1, TAN Yi-luo1, LIU Xiao-mei1, YANG He-chuan1,
QIN Yu-ying1, LI Xiao2*, REN Li-kai1*
(1Lianyungang Academy of Agricultural Sciences,Lianyungang, Jiangsu ?222006, China; 2Engineering Research Center of Chinese Ministry of Education for Edible and Medicinal Fungi, Jilin Agricultural University,
Changchun ?130118, China)
Abstract:【Objective】 The cloning and prokaryotic expression analysis of the laccase gene (Aclac) of the Auricula-ria cornea provided a basis for in-depth study of the biological function of the laccase gene in the development of the fruit body of A.cornea. 【Method】Aclac gene of A.cornea was cloned,and the full-length cDNA sequence of the gene was obtained and analyzed by bioinformatics. The target gene was also ligated to the pET-28a plasmid to construct the prokaryo-tic expression vector pET28a-Aclac, and the recombinant plasmid was induced to express in Escherichia coli BL21 (DE3). 【Result】The cloned Aclac gene cDNA sequence was 1734 bp long,encoded 577 amino acids,DNA sequence was 2521 bp,contained 14 introns,the theoretical AcLAC protein molecular weight was 64.75 kD,the isoelectric point was 5.70,the instability index was 34.01,there was no transmembrane region,and it contained a signal peptide.it was highly conserved in 4 copper ion binding regions, and contained the conservative functional domains of the Cupredoxin superfamily protein . The results of phylogenetic analysis showed that AcLAC protein and fungal laccase protein were clustered together. Among them, AcLAC protein had the closest relationship with the Auricularia. AcLAC fusion protein was successfully expressed in E. coli BL21(DE3), and its molecular weight was 67 kD. 【Conclusion】The cloned Aclac gene belongs to the Cupredoxin superfamily gene and can be expressed heterologously in a prokaryotic expression system. It is speculated that it has the same biological function as other fungal laccase genes,and enriches fungal laccase resources.
Key words: Auricularia cornea; laccase gene; cloning; bioinformatics; prokaryotic expression
Foundation item:National Key Research and Development Program of China(2019YFD1001905-33);Financial Grant Support Project of Lianyungang City(QNJJ1923)
0 引言
【研究意義】漆酶(Laccase,EC1.10.3.2)是一種含銅的多酚氧化酶,屬于藍色多銅氧化酶(MCO)家族成員。漆酶最早被日本學者Hikorokuro(1883)在紫膠漆樹(Rhus verniciflua)分泌的汁液中發現,隨后發現在真菌(Thurston,1994)、細菌(Roberts et al.,2002)和昆蟲(Dittmer et al.,2004)中也廣泛存在漆酶。其中,分泌漆酶的真菌主要有擔子菌綱(Basidiomycetes)、子囊菌綱(Ascomycetes)、極少數半知菌綱(Deuteromycetes)及其他低等真菌(Gianfreda et al.,1999)。隨著基因組測序技術的發展,已有大量的真菌漆酶基因被注釋和研究,發現這些漆酶在食藥用菌中發揮不同的功能,比如木質素降解、孢子萌發、色素合成、子實體形成和植物致病性等(Zhang et al.,2015)。玉木耳是毛木耳的白色變種,作為一類重要的白腐菌,其是目前所知最有效、最主要的木質素降解微生物。因此,對玉木耳漆酶基因克隆及表達分析,為豐富漆酶資源及探究玉木耳漆酶基因的生物學功能具有重要意義。【前人研究進展】近年來,許多真菌漆酶基因家族成員相繼被克隆,并通過采用重組技術研究漆酶基因的同源、異源表達及調控機制。Ravalason(2009)將朱紅密孔菌的漆酶基因lac1在黑曲霉中進行融合表達,研究發現重組漆酶菌株具有生物漂白功能,能使軟木牛皮紙漿的漂白度達85% ISO。BAO等(2012)將果生鏈核盤菌的漆酶基因MfLCC2在畢赤酵母中進行誘導表達及體外表達,結果發現該重組漆酶菌株對三氯酚的降解率可達80%,故可作為處理三氯酚污染廢水的候選菌株。Yang等(2012)研究發現漆酶基因lac5930-1在畢赤酵母中的表達可增加谷胱甘肽水平的抗氧化活性,提高酵母對H2O2介導的氧化應激,刺激谷胱甘肽的抗氧化系統,保護細胞免受氧化損傷的抵抗。裴佐蒂(2013)克隆獲得灰蓋鬼傘的漆酶基因CCLCC1Ⅰ,并在畢赤酵母中異源表達,研究發現重組漆酶菌株在發酵4 d后酶活力最高達890 mg/L,且在2,2-聯氮-二(3-乙基-苯并噻唑-6-磺酸二銨鹽(ABTS)作為介體的情況下,對結晶紫和孔雀石綠的降解率分別達77.7%和79.2%。Wang等(2014)克隆獲得Phomopsis liquidambari的漆酶基因lacB3,并在粟酒裂殖酵母中異源表達,將表達產物rLACB3施于種植花生的土壤中,結果發現花生中的香草醛含量增加12%,但土壤中香豆酸、對羥基苯和甲酸含量分別下降21%、27%和40%,表明該漆酶在促進花生生長中有很大潛力。鄭苗苗等(2014,2015)通過對灰樹花和紅平菇中的漆酶基因進行異源表達,結果發現這些重組漆酶對含蒽醌類染料的廢水處理具有很好的應用前景。Zhuo等(2015)從Ganoderma sp. En3中克隆獲得漆酶基因lac-En3-1,并在畢赤酵母中異源表達,研究發現經重組漆酶處理20 h后,孔雀綠、溴苯諾爾蘭、甲基橙和結晶紫的脫色率分別為94.1%、96.2%、80.2%和62.0%。鄭邦曉等(2015)從一株齒毛菌中克隆獲得漆酶基因Lac,并在畢赤酵母中異源表達,發現重組漆酶菌株在含1 mmol/L銅離子的YP培養基中28 ℃發酵15 d達最大酶活力(2.89 U/mL),且在乙酰丁香酮的幫助下,0.4 U/mL重組漆酶對靛類、偶氮類、三苯甲烷類等多種染料的脫色效果最佳。李杰等(2017)將鳳尾菇的漆酶基因Lac4在黑曲霉CICC2462中進行異源表達,結果發現重組漆酶搖瓶發酵最高酶活為1211 U/L,在以ABTS作為介體的情況下可對中性紅、甲基橙及孔雀綠染料發揮降解作用,脫色率分別為13%、11%和44%,而對活性亮藍降解作用不明顯。【本研究切入點】目前對毛木耳漆酶的研究主要集中在高產白腐菌菌株篩選、發酵優化及漆酶對木質素的生物降解等方面(楊建明等,2005;柏曉冉等,2020;徐安民等,2020)。原核表達系統具有培養周期短、成本相對低等特點,被廣泛應用于各種重組蛋白表達。但鮮見玉木耳漆酶基因的克隆及原核表達分析的研究報道。【擬解決的關鍵問題】克隆玉木耳漆酶基因Aclac的cDNA和DNA全長序列,對其進行生物信息學分析,并構建原核表達載體pET28a-Aclac,將其轉化大腸桿菌BL21(DE3)中誘導表達,以期豐富真菌漆酶資源,為深入研究Aclac基因在玉木耳生長過程中的表達情況及漆酶基因改良菌種打下理論基礎。
1 材料與方法
1. 1 試驗材料
玉木耳菌絲由吉林農業大學食藥用菌教育部工程研究中心提供。大腸桿菌(Escherichia coli)DH5α購自北京全式金生物技術有限公司。大腸桿菌BL21(DE3)感受態細胞和原核表達載體pET-28a由連云港市農業科學院保存。植物基因組DNA提取試劑盒購自北京康為世紀生物科技有限公司;UNlQ-10柱式TRIzol總RNA抽提試劑盒和IPTG購自上海生工生物工程股份有限公司;Peasy-T1克隆載體、TransStart FastPfu DNA聚合酶購自北京全式金生物技術有限公司;AxyPrep DNA凝膠回收試劑盒杭州愛思進生物技術有限公司。RevertAid First Strand cDNA Synthesis Kit、EcoRⅠ和Not Ⅰ購自賽默飛世爾科技有限公司。MYG固體/液體培養基(葡萄糖10 g,麥芽糖5 g,酵母浸粉5 g,瓊脂粉10 g,用ddH2O定容至1000 mL),121 ℃高壓滅菌后用于復壯玉木耳菌絲。LB液體培養基(酵母提取物5 g,胰蛋白胨10 g,NaCl 10 g,用ddH2O定容至1000 mL),121 ℃高壓滅菌后用于培養大腸桿菌。
1. 2 試驗方法
1. 2. 1 基因組DNA提取 使用植物基因組DNA提取試劑盒提取玉木耳基因組DNA,具體操作步驟參照說明書進行,提取的DNA于-20 ℃保存備用。
1. 2. 2 總RNA提取及cDNA第一鏈合成 利用UNlQ-10柱式TRIzol總RNA提取試劑盒提取玉木耳總RNA,并用1%瓊脂糖凝膠電泳及微量測定儀NanoDrop ND-1000對其濃度和純度進行檢測。檢測合格后于-80 ℃保存備用。參照RevertAid First Strand cDNA Synthesis Kit試劑盒說明書進行反轉錄合成cDNA第一鏈,于-20 ℃保存備用。
1. 2. 3 基因克隆 從玉木耳轉錄組數據庫中篩選獲得漆酶基因(Cluster-50942.6597)(楊和川等,2020),利用Primer Premier 5.0設計其擴增引物(Lcc-F:5?-ATGCGTTTCTCAACCAACG-3?;Lcc-R:5?-TTACAAGCCCGAATCATTCTTC-3?),委托金唯智生物技術有限責任公司合成。分別以玉木耳基因組DNA和cDNA為模板,利用引物Lcc-F和Lcc-R擴增Aclac基因的DNA和cDNA全長序列。PCR反應體系25.0 μL:5×TransStart FastPfu Buffer 5.0 μL,2.5 mmol/L dNTP Mix 2.0 μL,基因組DNA(或cDNA)模板4.0 μL,上、下游引物(Lcc-F和Lcc-R)各0.5 μL、TransStart FastPfu DNA聚合酶0.5 μL,用ddH2O補足至25.0 μL。擴增程序:95 ℃預變性2 min;95 ℃ 20 s,55 ℃ 20 s,72 ℃ 1 min,進行30個循環;72 ℃延伸10 min,4 ℃保存。將PCR產物經1%瓊脂糖凝膠電泳檢測后,利用AxyPrep DNA凝膠回收試劑盒回收目的片段。
1. 2. 4 載體構建及轉化 將目的片段與Peasy-T1克隆載體連接。連接反應體系:Peasy-T1克隆載體1.0 μL,回收產物4 μL。反應條件為25 ℃,20 min。利用熱激法將重組克隆載體轉化大腸桿菌DH5α感受態細胞,涂布平板,37 ℃過夜培養,挑取單菌落接種于5 mL LB液體培養基(含氨芐青霉素),37 ℃下200 r/min震蕩培養過夜。經菌液PCR鑒定后,挑取陽性克隆送至生工生物工程(上海)股份有限公司進行測序。
1. 2. 5 基因序列分析 利用DNAMAN 8.0將測序結果與參考序列(Cluster-50942.6597)進行比對分析;通過NCBI CDD對蛋白的保守功能域進行預測。運用PredictProtein對蛋白的二級結構進行預測;運用ProtParam對蛋白理化性質進行預測;運用TMpred預測蛋白的跨膜區;運用SignalP 5.0預測信號肽;運用SWISS-MODEL在線工具對蛋白的三級結構進行建模;從NCBI中搜索下載有代表性的細菌及真菌漆酶蛋白的氨基酸序列,并利用MEGA 5.10的鄰接法(Neighbor-joining,NJ)構建系統發育進化樹。
1. 2. 6 原核表達及SDS-PAGE檢測 用限制性內切酶EcoR Ⅰ和Not Ⅰ分別酶切表達載體pET-28a和Aclac基因,利用凝膠回收試劑盒純化回收酶切產物后進行同源重組連接。將重組表達載體pET28a-Aclac轉化宿主菌大腸桿菌BL21(DE3),涂布至含100 μg/mL卡那霉素的抗性平板,挑取陽性菌落至5 mL LB液體培養基(含100 μg/mL卡那霉素)中,37 ℃ 180 r/min在恒溫搖床中震蕩培養過夜;次日將過夜培養物轉接至含100 μg/mL卡那霉素LB液體培養基中,37 ℃ 180 r/min震蕩培養3 h,至OD600值達0.6~0.7;加入終濃度為1 mmol/L的IPTG,20 ℃條件下,180 r/min誘導表達16 h,37 ℃培養4 h,離心收集菌體。利用PBS緩沖液重懸菌體后,通過超聲破碎法(超聲1 s,停3 s,共10 min)破碎菌體,經12000 r/min離心后分離上清液和沉淀。利用SDS-PAGE電泳檢測AcLAC蛋白的表達情況。
2 結果與分析
2. 1 基因克隆結果
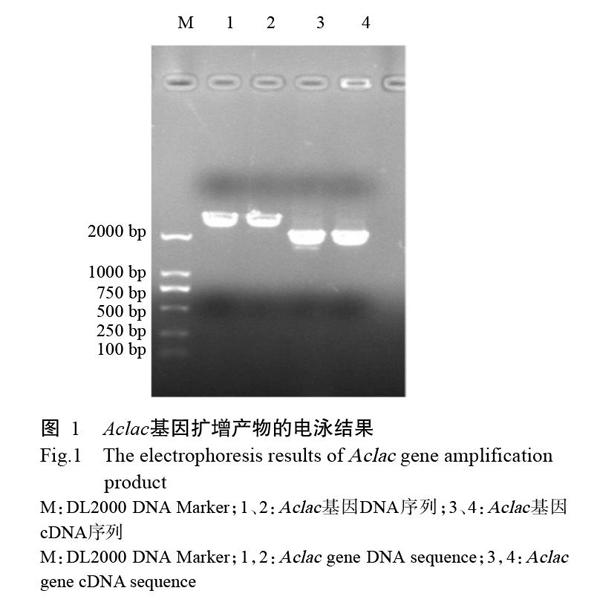
分別以玉木耳基因組DNA和cDNA為模板擴增獲得Aclac基因的DNA和cDNA全長序列,長度約2500和1800 bp,與預期大小基本相符(圖1)。利用DNAMAN 8.0對Aclac基因DNA和cDNA全長序列的測序結果進行比對分析,結果表明,克隆獲得的Aclac基因cDNA序列長度為1734 bp,編碼577個氨基酸殘基;Aclac基因DNA序列長度為2521 bp,含14個內含子。
2. 2 生物信息學分析結果
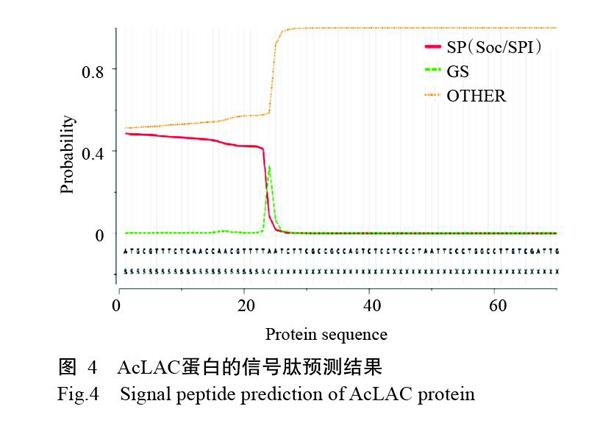
NCBI的CDD預測結果顯示,AcLAC蛋白含有Cupredoxin超家族蛋白保守功能域,表明Aclac基因屬于Cupredoxin超家族基因(圖2)。ProtParam預測結果顯示,AcLAC蛋白的分子量為64.75 kD,理論等電點為5.70;在體外半衰期為30 h,不穩定指數為34.01,表明該蛋白較穩定。PredictProtein預測結果顯示AcLAC蛋白的氨基酸組成如圖3-A所示,以亮氨酸數量最多,半胱氨酸數量最少。通過SWISS-MODEL對AcLAC蛋白的三級結構預測結果如圖3-B所示。TMpred預測結果(圖4和圖5)顯示,AcLAC蛋白不存在跨膜區,但存在1個信號肽結構。
由圖6可知,細菌的漆酶蛋白聚為一支;AcLAC蛋白與真菌的漆酶蛋白聚為一支,其中AcLAC蛋白與木耳屬真菌的漆酶蛋白親緣關系最近。將AcLAC蛋白與黑木耳的漆酶蛋白和lcc5序列進行多序列比對分析,結果發現AcLAC蛋白在銅離子結合區高度保守(圖7)。
2. 3 原核表達結果
將重組表達載體pET28a-Aclac進行雙酶切驗證,結果(圖8)顯示目的基因成功連接至pET-28a質粒上。對Aclac基因在大腸桿菌BL21(DE3)表達宿主中進行異源表達,SDS-PAGE檢測結果(圖9)顯示,AcLAC融合蛋白成功表達,分子量約為67 kD,與預期結果相符。
3 討論
漆酶是木質素合成的關鍵酶之一,其中,真菌漆酶研究最廣泛和深入,目前已在60多種真菌中發現了漆酶,且確定其具有漆酶活性。本研究將克隆獲得的Aclac基因在NCBI進行多序列比對分析,發現該基因與其他真菌漆酶基因序列同源性不高。前人研究也表明,真菌漆酶的來源很多,但整體的漆酶基因序列同源性并不高,如擔子菌與子囊菌漆酶的序列相似性僅為20%~30%,但不同漆酶中銅離子結合區域相對保守(Kumar et al.,2003)。此外,漆酶基因中含有相當多的內含子,其中一些也高度保守(Colao et al.,2003)。Kumar等(2003)對60多個真菌漆酶蛋白序列進行比對分析,結果發現漆酶蛋白包含4個保守區域,且這4個保守區域為漆酶蛋白的特征序列。本研究將獲得的AcLAC蛋白序列與GenBank中登錄的其他真菌漆酶蛋白序列進行比對,發現AcLAC蛋白序列中含有4個保守的銅離子結合區,推測不同真菌的漆酶基因在生物學功能上具有一致性。
毛木耳是一類重要的白腐菌。白腐菌是目前所知最有效、最主要的木質素降解微生物,在工業生產中有廣泛的應用價值。通過對毛木耳產漆酶基因進行異源表達,獲得分泌高活性漆酶的重組菌,可為木質素酶在生產實踐上的應用提供理論參考。楊建明等(2008)利用PCR和RACE技術首次從毛木耳中克隆獲得1個新漆酶基因的cDNA和DNA全長序列,并在畢赤酵母中進行異源表達。本研究為深入探究玉木耳漆酶基因的生物學功能,從玉木耳中克隆獲得漆酶基因Aclac,并構建其原核表達載體,通過原核表達系統對Aclac基因進行異源表達。但潘程遠(2009)研究發現,利用原核表達系統表達漆酶蛋白時,未檢測到活性,可能是因為漆酶是一種高糖基化修飾的酶,而原核表達系統不具備對重組蛋白進行二級結構修飾的能力,故獲得的重組蛋白不具有漆酶活性。此外,漆酶的應用方面存在表達困難、熱穩定性和pH耐受性較差及酶活力較低等問題,國內外學者則通過優化啟動子、信號肽及提高基因表達量和酶活力(Garg et al.,2012;Kristiina et al.,2013;Lin et al.,2013)解決這些問題。本研究僅初步對玉木耳漆酶基因進行異源表達,如何實現漆酶的高效異源表達及獲得高酶活力的漆酶有待深入研究。
4 結論
克隆獲得的Aclac基因屬于Cupredoxin超家族基因,可在原核表達系統中異源表達,推測其與其他真菌漆酶基因在生物學功能上具有一致性,豐富了真菌漆酶資源。
參考文獻:
柏曉冉,朱孟娟,張少巖,周佳,李曉博,李壯,孟麗. 2020. 毛木耳對孔雀石綠染料降解條件的優化[J]. 菌物學報,36(6):1175-1186. [Bai X R,Zhu M J,Zhang S Y,Zhou J,Li X B,Li Z,Meng L. 2020. Optimization of decolorization conditions of malachite green dye by Auricularia cornea[J]. Mycosystema,36(6):1175-1186.] doi:10.13346/j.mycosystema.200069.
李杰,李雙,于盛竹,劉歡歡,張會. 2017. 鳳尾菇(Pleurotus sajor-caju)漆酶lac4基因在黑曲霉中表達研究[J]. 東北農業大學學報,48(4):7-14. [Li J,Li S,Yu S Z,Liu H H,Zhang H. 2017. Expression of Pleurotus sajor-caju laccase Lac4 in Aspergillus niger[J]. Journal of Northeast Agricultural University,48(4):7-14.] doi:10.19720/j.cnki.issn.1005-9369.2017.04.002.
潘程遠. 2009. 雞樅菌與淡色庫蚊及家蠅中漆酶編碼基因的克隆與表達[D]. 杭州:浙江大學. [Pan C Y. 2009. Clo-ning and expression of genes encoding laccases in Termitomyces albuminosus,Culex pipiens pallens and Musca domestica[D]. Hangzhou:Zhejiang University.]
楊建明,張小敏,邢增濤,陳明杰,曹暉,譚琦,潘迎捷. 2005. 毛木耳漆酶純化及其部分漆酶特性的研究[J]. 菌物學報,24(1):61-70. [Yang J M,Zhang X M,Xing Z T,Chen M J,Cao H,Tan Q,Pan Y J. 2005. Purification and properties of laccase produced by Auricularia polytrica[J]. Microbiology,24(1):61-70.]
楊建明,孟鑫,徐鑫,張磊,李強,成漠,潘迎捷. 2008. 毛木耳漆酶基因的克隆、序列分析及其鑒定[J]. 微生物學通報,35(11):1708-1714. [Yang J M,Meng X,Xu X,Zhang L,Li Q,Cheng M,Pan Y J. 2008. Cloning,sequence analysis and chacterization of laccase gene in Auricularia polytrica[J]. Microbiology,35(11):1708-1714.]
裴佐蒂. 2013. 灰蓋鬼傘漆酶在畢赤酵母中的異源表達及其酶學特性分析[D]. 上海:上海海洋大學. [Pei Z D. 2013. Overexpression of laccase I from Coprinus cinereus in Pichia pastoris and characterization assay[D]. Shanghai:Shanghai Ocean University.]
徐安民,李力,馬森,王曉曦. 2020. 毛木耳5.584產漆酶發酵條件優化及降解麥麩的研究[J]. 河南工業大學學報:自然科學版,41(3):65-71. [Xu A M,Li L,Ma S,Wang X X. 2020. Study on the optimization of laccase fermentation conditions and the degradation of wheat bran by Auricularia polytricha 5.584[J]. Journal of Henan University of Technology(Natural Science Edition),41(3):65-71.] doi:10.16433/j.1673-2383.2020. 03.011.
楊和川,蘇文英,譚一羅,周振玲,秦裕營,李曉. 2020. 玉木耳轉錄組測序及褐變相關基因的挖掘[J]. 江西農業學報,32(5):7-12. [Yang H C,Su W Y,Tan Y L,Zhou Z L,Qin Y Y,Li X. 2020. Transcriptome sequencing of Auricularia cornea and investigating of genes involved in browning[J]. Acta Agriculturae Jiangxi,32(5):7-12.] doi:10.19386/j.cnki.jxnyxb.2020.05.02.
鄭邦曉,余湘萍,葉秀云,林娟,楊捷. 2015. 齒毛菌漆酶的基因克隆、異源表達及脫色研究[J]. 福州大學學報:自然科學版,43(2):285-292. [Zheng B X,Yu X P,Ye X Y,Lin J,Yang J. 2015. Gene cloning,heterologous expression and decolorization study of a novel laccase gene from Cerrena sp.[J]. Journal of Fuzhou University(Natural Science Edition),43(2):285-292.]
鄭苗苗,邵淑麗,張東向,張令昂,焦戰戰. 2014. 紅平菇漆酶基因異源表達及對染料脫色的研究[J]. 紡織學報,35(12):84-90. [Zheng M M,Shao S L,Zhang D X,Zhang L A,Jiao Z Z. 2014. Heterologous expression of Pleurotus djamor laccase gene in Pichia pastoris and decolorization on dyes by recombinant laccase[J]. Journal of Textile Research,35(12):84-90.] doi:10.13475/j.fzxb.201412008 407.
鄭苗苗,伊洪偉,邵淑麗,李波,吳鵬,張令昂,焦戰戰,董銀燕. 2015. 灰樹花漆酶基因異源高效表達及對茜素紅染料的脫色[J]. 中國食品學報,15(12):31-38. [Zheng M M,Yi H W,Shao S L,Li B,Wu P,Zhang L A,Jiao Z Z,Dong Y Y. 2015. High output of a Grifola frondosa laccase in Pichia pastoris and alizarin red dye decolorization of a laccase gene from white rot fungus[J]. Journal of Chinese Institute of Food Science and Technology,15(12):1-38.] doi:10.16429/ j.1009-7848.2015.12.005.
Bao W H,Peng R H,Zhang Z,Tian Y S,Zhao W,Xue Y,Gao J J,Yao Q H. 2012. Expression,characterization and 2,4,6-trichlorophenol degradation of laccase from Moni-linia fructigena[J]. Molecular Biology Reports,39(4):3871-3877. doi:10.1007/s11033-011-1166-7.
Colao M C,Garzillo A M,Buonocore V,Schiesser A,Ruzzi M. 2003. Primary structure and transcription analysis of a laccase-encoding gene from the basidiomycete Trame-tes trogii[J]. Applied Microbiology and Biotechnology,63(2):153-158. doi:10.1007/s00253-003-1429-x.
Dittmer N T,Suderman R J,Jiang H,Zhu Y C,Gorman M J,Kramer K J,Kanost M R .2004. Characterization of cDNAs encoding putative laccase-like multicopper oxidases and developmental expression in the tobacco hornworm,Manduca sexta,and the malaria mosquito,Anopheles gambiae[J]. Insect Biochemistry and Molecular Biology,34(1):29-41. doi:10.1016/j.ibmb.2003.08.003.
Garg N,Bieler N,Kenzom T,Chhabra M,Mishra S. 2012. Cloning,sequence analysis,expression of Cyathus bulleri laccase in Pichia pastoris and characterization of recombinant laccase[J]. BMC Biotechnology,12(1):75-75. doi:10.1186/1472-6750-12-75.
Gianfreda L,Xu F,Bollag J M. 1999. Laccases:A useful group of oxidoreductive enzymes[J]. Bioremediation Journal,3(1):1-26. doi:10.1080/10889869991219163.
Hikorokuro Y. 1883. LXIII.—Chemistry of lacquer(Urushi). Part I. communication from the chemical society of Tokio[J]. Journal of the Chemical Society,Transactions,43(1):472-486. doi:10.1039/CT8834300472.
Kristiina H,Mkel M R,Taina L,Jaana K,Alexey C,Ludmila G,David B A. 2013. Heterologous expression and structural characterization of two low pH laccases from a biopulping white-rot fungus physisporinus rivulosus[J]. Applied Microbiology and Biotechnology,97(4):1589-1599. doi:10.1007/s00253-012-4011-6.
Kumar S V S,Phale P S,Durani S,Wangikar P P. 2003. Combined sequence and structure analysis of the fungal laccase family[J]. Biotechnology & Bioengineering,83(4):386-394. doi:10.1002/bit.10681.
Lin Y Q,Zhang Z,Tian Y S,Zhao W,Zhu B,Xu Z S,Peng R H,Yao Q H. 2013. Purification and characterization of a novel laccase from Coprinus cinereus and decolorization of different chemically dyes[J]. Molecular Biology Reports,40(2):1487-1494. doi:10.1007/s11033-012-2191-x.
Ravalason H,Gimbert I H,Record E,Frédérique B,Grisel S,Weert S D,Hondel C A,Asther M,Conil M,Sigoillot J. 2009. Fusion of a family 1 carbohydrate binding module of Aspergillus niger to the Pycnoporus cinnabarinus laccase for efficient softwood kraft pulp biobleaching[J]. Journal of Biotechnology,142(3-4):220-226. doi:10.1016/j.jbiotec.2009.04.013.
Roberts S A,Weichsel A,Grass G,Thakali K,Montfort W R. 2002. Crystal structure and electron transfer kinetics of CueO,a multicopper oxidase required for copper homeostasis in Escherichia coli[J]. Proceedings of the National Academy of Sciences,99(5):2766-2771. doi:10.2307/3058023.
Thurston C F. 1994. The structure and function of fungal laccases[J]. Microbiology,140(1):19-26. doi:10.1099/135 00872-140-1-19.
Wang H W,Zhu H,Liang X F,Du W,Dai C C. 2014. Mole-cular cloning and expression of a novel laccase showing thermo- and acid-stability from the endophytic fungus Phomopsis liquidambari and its potential for growth promotion of plants[J]. Biotechnology Letters,36:167-173. doi: 10.1007/s10529-013-1347-7.
Yang Y,Fan F F,Zhuo R,Ma F Y,Gong Y M,Wan X,Jiang M L,Zhang X Y. 2012. Expression of the laccase gene from a white rot fungus in Pichia pastoris can enhance the resistance of this yeast to H2O2-mediated oxidative stress by stimulating the glutathione-based antioxidative system[J]. Applied & Environmental Microbiology,78(16):5845-5854. doi:10.1128/aem.00218-12.
Zhang J,Chen H,Chen M,Ren A,Huang J,Wang H,Zhao M,Feng Z. 2015. Cloning and functional analysis of a laccasegene during fruiting body formation in Hypsizygus marmoreus[J]. Microbiological Research,179:54-63. doi:10.1016/j.micres.2015.06.005.
Zhuo R,He F,Zhang X Y,Yang Y. 2015. Characterization of a yeast recombinant laccase rLAC-EN3-1 and its application in decolorizing synthetic dye with the coexistence of metal ions and organic solvents[J]. Biochemical Enginee-ring Journal,93:63-72. doi:10.1016/j.bej.2014.09.004.
(責任編輯 陳 燕)
收稿日期:2020-09-18
基金項目:國家重點研發計劃項目(2019YFD1001905-33);連云港市財政專項(QNJJ1923)
通訊作者:李曉(1976-),https://orcid.org/0000-0003-0657-4673,副教授,主要從事食用菌教學、科研和產業化開發研究工作,E-mail:lxmogu@163.com;任立凱(1981-),https://orcid.org/0000-0002-9409-8840,副研究員,從事作物遺傳育種研究工作,E-mail:2949823@qq.com
第一作者:蘇文英(1992-),https://orcid.org/0000-0002-4687-2854,主要從事食用菌遺傳育種研究工作,E-mail:18004425758@163.com

