小鼠動情周期卵巢、子宮及輸卵管中氧化應激水平及意義
楊延周,陳敏慧,李可可
(1.寧夏醫科大學生育力保持教育部重點實驗室,銀川750004;2.寧夏醫科大學第二臨床醫學院,銀川市第一人民醫院急診科,銀川750001)
近年來有研究[1-2]顯示,氧化應激(oxidative stress,OS)和適度的活性氧(reactive oxygen species,ROS)在雌性哺乳動物生殖過程中起著重要的作用,過多的ROS可引起生殖系統疾病。有研究[3]報道,生理水平的ROS參與許多的雌性生殖過程,如卵泡發育、卵母細胞成熟和排卵。此外,累積的OS和抗氧化劑還原型谷胱甘肽(glutathione,GSH)的耗竭引起細胞凋亡,ROS引起卵泡閉鎖和顆粒細胞凋亡。
動情周期是雌性哺乳動物生殖系統特征之一,動情周期中激素和生殖器官可發生節律性變化[4],而生殖器官如卵巢和子宮的節律性變化受類固醇激素的調控。小鼠血清雌二醇(estrogen,E2)水平在動情前期達到峰值,一直持續到動情期直到排卵,在動情后期降低,在間情期維持較低的基礎水平,孕激素(progesterone,P4)的節律性變化與雌激素相反[5],此外,動情周期中的促乳素也發生節律性的變化[6]。近來的研究[7]發現,E2與心血管的OS密切相關,P4與人黃素化的顆粒細胞功能密切相關[8]。
盡管OS參與多個哺乳動物生殖過程[9-11],但是OS在雌性哺乳動物動情周期中的動態變化尚不清楚,動情周期OS動態變化是否與類固醇激素的變化相關也不清楚。因此,本研究主要探究了動情周期的OS水平,進而為揭示其在雌性小鼠生殖過程中的作用及機制奠定基礎,對進一步揭示生殖疾病的發病機制具有重要的作用及意義。
1 材料與方法
1.1 實驗動物
6~8周齡ICR雌性小鼠購自寧夏醫科大學實驗動物中心(動物許可證號:2020-0001)。實驗動物飼養在特定的溫度及適度條件下,給予標準的飼料喂養,并且自由飲食,所有的實驗操作程序都嚴格按照寧夏醫科大學動物倫理委員會的要求進行。應用陰道涂片方法確定小鼠的動情周期[12-14]。
1.2 免疫組織化學
收集小鼠動情前期、動情期、動情后期及間情期的輸卵管傘部、壺腹部、峽部和子宮角,并立即固定在4%的多聚甲醛中,24 h后組織經脫水、透明及浸蠟處理之后,用石蠟包埋,切片(厚度為6 μm)。石蠟切片經過脫蠟、脫水之后進行抗原熱(96~98℃)修復20 min,抗原修復液為0.1 mol·L-1檸檬酸、0.1 mol·L-1檸檬酸鈉和水按9∶41∶450配制。免疫組化程序按相關文獻[14-16]及試劑盒說明書(天根生化科技有限公司,北京)操作如下:0.3%過氧化氫-甲醇處理10 min消除內源性過氧化物酶,0.01 mol·L-1PBS液洗片3次,每次5 min,10%山羊血清處理30 min以消除非特異性結合。然后分別加入兔抗超氧化物歧化酶1(SOD1)(1∶200;abcam,ab183881)和兔抗8-羥基鳥嘌呤DNA糖苷酶1(OGG1)(1∶200;proteintech,15125-1-AP)抗體,4℃過夜,0.01 mol·L-1PBS洗片3次,每次5 min;加入山羊抗兔二抗,孵育1 h后,0.01 mol·L-1PBS洗片3次,每次5 min;DAB顯色(天根生化科技有限公司,北京),蘇木精復染細胞核后中性樹膠封片。在顯微鏡下觀察組織顯色情況,棕黃色為陽性,即蛋白表達部位。
1.3 實時熒光定量(PCR)實驗
收集小鼠動情前期、動情期、動情后期及間情期的卵巢和子宮角,立即加入Trizol提取卵巢和子宮總RNA,RNA提取按照本實驗室常規操作進行。測定提取的RNA的OD值,并計算RNA濃度,隨之進行反轉錄,反轉錄過程按照試劑盒(RR036Q,TaKaRa)操作程序進行,10 μL體系包括:5X PrimeScriptTMRT Master Mix(Perfect Real Time)2 μL,總RNA 500 ng,加無RNA酶水至10 μL;反轉錄條件為:37℃15 min,85℃5 s,4℃暫時保存或直接用于下游qPCR反應。熒光定量PCR程序按照試劑盒說明書(RR820A,TaKaRa)進行。20 μL體系包括:TB GreenTMPremix Ex TaqⅡ(Tli RNaseH Plus)(2×)10 μL,上游引物(10 μmol·L-1)0.8 μL,下游引物(10 μmol·L-1)0.8 μL,cDNA 2 μL,ROX Reference Dye or DyeⅡ(50×)0.4 μL,滅菌水6 μL,總體積20 μL;反應條件根據試劑盒說明書及PCR儀采用兩步法:1)預變性:重復1個循環,95℃30 s;2)PCR反應:40個循環,95℃5 s,60℃30 s。引物序列見表1。
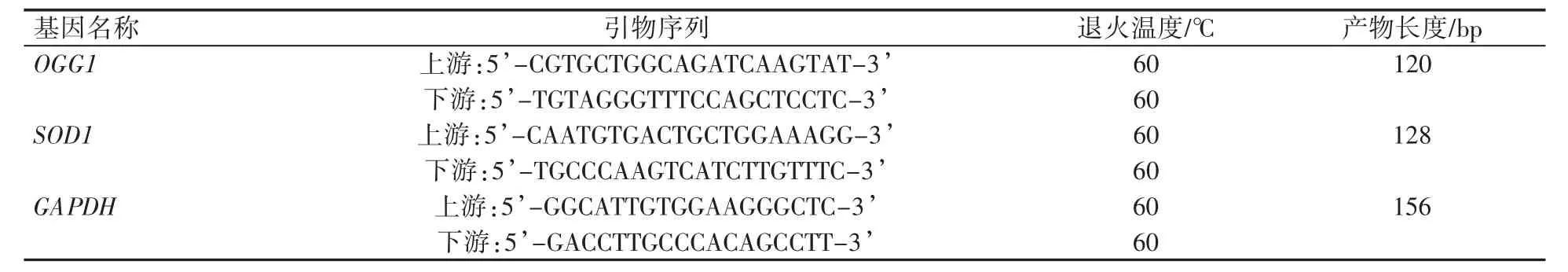
表1 引物序列
1.4 Western blot實驗
動情前期、動情期、動情后期及間情期卵巢和子宮角的OGG1和SOD1蛋白表達水平應用Western blot方法進行檢測,具體操作方法參考本課題組已發表文章[17]。步驟如下:提取總蛋白后應用BCA法測定蛋白濃度,然后行SDS-PAGE電泳,電泳后轉膜,5%脫脂奶粉室溫搖床振蕩封閉1 h后,加入稀釋好的兔抗SOD1(1∶1 000;abcam,ab183881)和 兔 抗OGG1(1∶1 000;proteintech,15125-1-AP)抗體,4℃搖床孵育過夜,應用TBST緩沖液洗膜3次(每次15 min),加入稀釋好的山羊抗兔二抗,室溫下孵育1 h后TBST緩沖液振蕩沖洗3次(每次15 min)。最后根據ECL化學發光試劑盒(Thermol,美國)說明書在聚偏二氟乙烯(PVDF)膜上加入適量發光液曝光。Western blot條帶灰度值應用Image J軟件進行統計。
1.5 統計學方法
采用SPSS 22.0軟件對數據進行分析。所有實驗每個組至少重復3次,計量資料以均數±標準差(±s)表示,組間比較采用t檢驗或方差分析。P≤0.05為差異有統計學意義。
2 結果
2.1 小鼠動情周期不同階段子宮角和輸卵管SOD1免疫組化結果
SOD1蛋白主要定位于子宮內膜腔上皮和腺上皮細胞,定位于輸卵管上皮細胞。間情期子宮角SOD1呈現高陽性表達,動情前期有弱陽性表達,動情期和動情后期無陽性。動情期所有輸卵管SOD1呈現高陽性染色,動情期中輸卵管壺腹部比傘部和峽部有更深的染色,在動情前期和動情后期輸卵管傘部、峽部有弱陽性,壺腹部無陽性,間情期無陽性,見圖1。
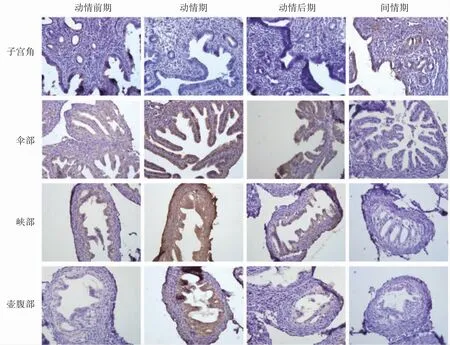
圖1 小鼠動情周期子宮角和輸卵管傘部、峽部和壺腹部SOD1的免疫組化結果(×400)
2.2 小鼠動情周期不同階段子宮角和輸卵管OGG1免疫組化結果
OGG1蛋白定位與SOD1一致。OGG1在動情前期子宮角有弱陽性表達,間情期有較高陽性的表達,動情期和動情后期呈陰性染色。OGG1在動情期所有輸卵管呈現高陽性染色,但是在輸卵管傘部有更深的染色,動情前期和動情后期的OGG1染色呈陰性,而在間情期輸卵管壺腹部和峽部有較弱的染色,在傘部觀察不到染色,見圖2。
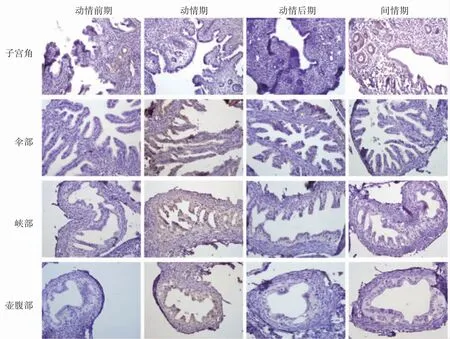
圖2 小鼠動情周期子宮角和輸卵管傘部、峽部和壺腹部OGG1的免疫組化結果(×400)
2.3 小鼠動情周期不同階段血清中OS指標
ELISA方法檢測動情周期血清中8-羥基脫氧鳥苷(8-OHdG)、丙二醛(MDA)、GSH和超氧化物歧化酶(SOD)的水平。結果顯示:動情期血清中8-OHdG和MDA的含量高于其他實驗組(P<0.05);動情前期的GSH含量高于其他實驗組(P<0.05),SOD在動情周期的各個階段差異無統計學意義,見圖3。
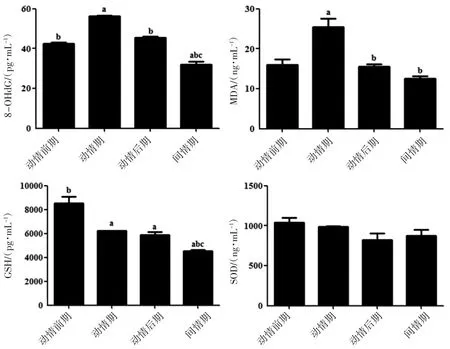
圖3 ELISA方法檢測小鼠動情周期不同階段血清中的OS指標
2.4 小鼠動情周期不同階段卵巢和子宮角組織中SOD1和OGG1基因水平表達
PCR實驗檢測小鼠動情周期不同階段卵巢和子宮角中SOD1和OGG1的mRNA表達,結果顯示動情期卵巢、子宮角中SOD1和OGG1的mRNA水平低于間情期(P均<0.05),見圖4。
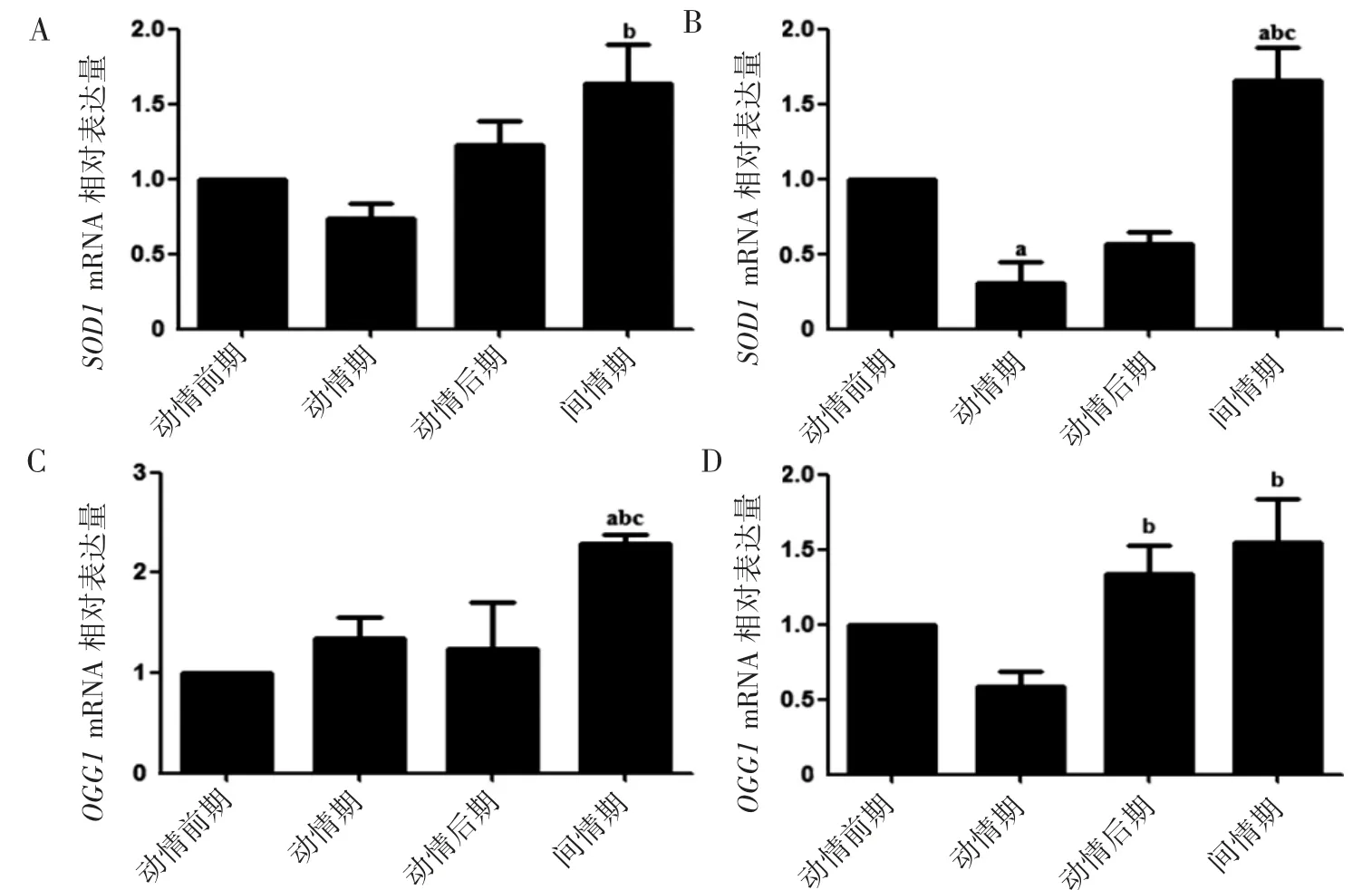
圖4 PCR實驗檢測小鼠動情周期不同階段卵巢和子宮角中SOD1和OGG1的mRNA表達
2.5 小鼠動情周期不同階段卵巢和子宮角組織中SOD1和OGG1蛋白表達的結果
Western blot檢測小鼠動情周期不同階段卵巢和子宮角中SOD1和OGG1的蛋白表達,SOD1和OGG1在卵巢、子宮角組織中的蛋白表達情況與PCR結果一致,動情期SOD1和OGG1蛋白水平低于間情期(P均<0.05),見圖5。
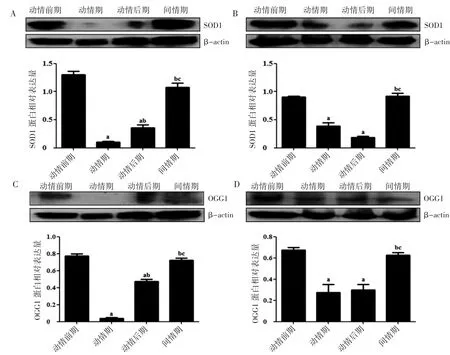
圖5 Western blot檢測小鼠動情周期不同階段卵巢和子宮角中SOD1和OGG1的蛋白表達
3 討論
OS是由于機體ROS產生過多,從而造成氧化/抗氧化失衡的狀態。而機體促氧化與抗氧化失衡可導致許多生殖疾病,如子宮內膜炎、多囊卵巢綜合征及一些不明原因的不孕[18],但是正常動情周期中的OS水平如何變化尚不清楚。正常小鼠動情周期中OS標記物MDA、8-OHdG以及抗氧化標記物SOD和GSH在動情周期不同階段血清中的表達規律如何變化亦不完全清楚。本研究結果顯示,MDA、8-OHdG、SOD、GSH廣泛地表達于小鼠動情周期的各個階段,證明正常小鼠卵巢組織中OS狀態和抗氧化防御系統存在于動情周期的各個階段,在動情期高水平表達的8-OHdG和MDA說明在動情期OS水平最高。而出現這種高水平的OS狀態可能與正常小鼠卵巢組織中生殖活動及相關疾病有關[19]。且動情周期中的OS變化規律可能與雌激素、孕激素的變化密切相關。的確,許多研究證實雌激素、孕激素參與調節OS及ROS[20]。
SOD是抗氧化酶類,與卵母細胞質量相關,可保護卵母細胞免受損傷。哺乳動物中SOD主要有三種亞型:細胞內CuZn-SOD(SOD1)存在于胞質中,線粒體Mn-SOD(SOD2)分布于線粒體基質,細胞外CuZn-SOD(SOD3)分布于細胞外液、局部淋巴、骨液和血漿。但主要以SOD1為主,占90%。因此,本研究主要探究了SOD1在小鼠動情周期卵巢、輸卵管及子宮角中的變化規律。卵泡液中高水平的SOD可有效減輕卵母細胞及卵丘細胞中OS導致的DNA損傷,從而使卵母細胞成功受精。故SOD表達于正常小鼠動情周期的各個階段,揭示了卵巢組織、細胞抗OS的存在和SOD的抗氧化保護作用。GSH是儲存于卵母細胞中的主要非酶類抗氧化物,其可保護受精卵及早期胚胎免受OS傷害。相比于未成熟卵母細胞,成熟的卵母細胞中含有更高水平的GSH,據此認為高水平GSH是卵母細胞胞質成熟的標志。GSH在維持細胞內還原狀態、保護細胞免受OS傷害中起重要作用,GSH在細胞和胚胎中不僅起防御氧化損傷的作用,還發揮著多種重要作用,如參與DNA合成、轉錄、細胞因子活化及凋亡過程,GSH也執行多種細胞內及細胞外功能,對ROS類及外源性物質有解毒作用。所以GSH高表達在正常小鼠卵巢動情周期的前期可能與卵母細胞的成熟、抗氧化保護作用有關。因此,OS狀態及ROS水平的高低在正常小鼠中可能與生殖器官中生理、病理活動密切相關。如促進卵母細胞受精作用;對卵母細胞的DNA、蛋白質、脂質有損害和及時保護作用;排卵;卵子發育;卵母細胞的成熟等。
排卵是一個復雜的生殖過程,也是一個類炎癥過程[21],且受到多種因素的調控,包括前列腺素、水解酶、細胞因子、一氧化氮、類固醇激素及ROS。排卵前卵泡的ROS水平被認為是誘導排卵的主要因素之一[19],特別是在排卵的過程中產生大量的ROS[22],而排卵發生在動情期,因此,動情期高水平的氧化應激可能參與排卵過程。此外,促黃體生成素(LH)脈沖在誘發排卵過程中發揮著至關重要的作用,而LH脈沖過程中產生的炎癥因子誘導ROS的產生,抑制這些炎癥因子導致排卵失敗。因此,ROS及OS是排卵必不可少的物質[23]。ROS水平的升高及抗氧化水平的降低可促進排卵[23]。本研究結果顯示,在子宮角、卵巢中的SOD1和OGG1的mRNA、蛋白表達水平及輸卵管、子宮角中SOD1和OGG1免疫組化定位,在小鼠動情周期中不斷發生變化,間情期表達量較高,在動情期表達量較低,提示SOD1和OGG1在動情周期中發揮重要作用。子宮是孕育生命的場所,也是胚胎著床發生的主要場所,在動情期子宮的SOD1具有抗氧化、防衰老、防止細胞核內DNA損傷、調節氧等維持正常細胞活性的重要生理功能,還具有調節細胞、保護基因組的作用,SOD1也可以調節細胞的分裂、生長及代謝進程。所以SOD1在正常小鼠子宮角、卵巢中的表達規律與改善OS狀態以及參與子宮角、卵巢器官中早期胚胎的發育和保護組織、細胞免受損害有關。OGG1基因為管家基因,在所有的組織器官中均可表達,OGG1有修復線粒體DNA損傷的功能,在子宮角、卵巢器官間情期中高表達,因而推測正常小鼠動情周期的OGG1在維持遺傳物質的穩定及胚胎發育過程中發揮重要作用。
本研究結果顯示,子宮角與輸卵管中SOD1和OGG1的免疫組化定位在小鼠動情周期中也不斷發生變化,SOD1在動情期呈高陽性表達,而且在動情期壺腹部表達更高,間情期無表達;OGG1也在動情期有高陽性表達,在傘部表達更高,動情前期和動情后期無陽性。輸卵管是受精和早期胚胎發育的場所,在動情周期不同階段,可能與配子的相互作用和早期胚胎的發育有關,SOD1和OGG1這種高表達揭示正常小鼠動情期在OS因素的影響下可能與輸卵管受精和早期胚胎發育以及保護受精卵有關,進而引起輸卵管在生化和生理學上發生相應的變化。
綜上所述,OS水平在小鼠正常的生殖器官動情周期的各個階段是不同的,其表達范型可能與小鼠的排卵、受精及早期胚胎發育密切相關,且受到雌孕激素的調控。

