Gjb2在高糖誘導的HEI-OC1細胞株凋亡及其與氧化應激中的作用
王大華 何茜 趙凱 程思 何清
1 中國礦業大學
2 中國礦業大學附屬醫院
3 鄂東醫療集團黃石市中心醫院
4 鄂東醫療集團黃石市婦幼保健院
聽力損傷是人類最常見的感覺神經損傷,它影響了超過6%的世界人口[1],因此,這種殘疾造成了非常嚴重的社會和經濟影響[2]。聽力損傷有許多原因,其中最常見的是老年性耳聾[3,4]。除了這些因素,越來越多的證據表明聽力損傷是糖尿病的另一種致殘性并發癥[5,6]。大多數聽力損傷病例是由于內耳中的機械感受器——感覺毛細胞的退化造成的[7-9]。
Gjb2基因位于染色體13q12上,Gjb2基因突變是聽力障礙的最常見原因[10,11]。有文獻研究將Gjb2小鼠的聽覺表型與耳蝸導管中的細胞凋亡和氧化損傷聯系起來[12],但是Gjb2對耳蝸毛細胞的凋亡和氧化應激的調控作用尚不明確。因此在本課題中,選取HEI-OC1細胞株,通過高糖處理,并在細胞中過表達Gjb2,深入研究Gjb2在高糖誘導的HEIOC1細胞株凋亡與氧化應激中的作用,為保護高糖引起的HEI-OC1細胞株損傷提供了新的潛在靶點。
1 材料與方法
1.1 HEI-OC1細胞培養和高糖處理
House Ear Institute-Organ of Corti 1 (HEI-OC1)細胞在37℃,5% CO2的培養條件培養,在對數生長期收集細胞用于后續實驗[13]。對于血糖處理,HEIOC1細胞用不同濃度 (5.5、11、22、33 mM)的血糖處理24 h。根據葛均波等主編的內科學(第9版)可知有效血漿滲透壓公式為:Posm=2×(Na++K+)+Glu。其中血糖濃度對其影響較小,血鈉濃度對其影響較高。根據公式可估算出實驗中各組血糖對應的有效血漿滲透壓分別:control組-295mOsm;5.5mM組-300.5mOsm;11mM組-306mOsm;22mM組-317mOsm;33mM組-328mOsm。
1.2 細胞轉染
過表達Gjb2的質粒 (pcDNA-Gjb2)和對照質粒 (pcDNA-NC)均購自 GenePharma Co.(上海,中國)。按照Lipofectamine 2000 (Invitrogen)說明書轉染pcDNA-NC和pcDNA-Gjb2[14]。細胞轉染48h后進行后續實驗。
1.3 Tunel實驗
用2%福爾馬林在37℃固定各組細胞24h,用0.1% Triton X‐100在冰上滲透2min,然后在37℃黑暗條件下用50 μl Tunel反應混合物孵育1h,加入DAPI染核 5min。在熒光顯微鏡(LSM880,Zeiss,Germany)下觀察結果[15]。
1.4 流式細胞術檢測凋亡[16]
按照Annexin-V-FITC細胞凋亡檢測試劑盒(4030ES20,Sigma,San Francisco,California,USA)的說明,按 1:2:50 比例將 Annexin-V-FITC、PI、HEPES緩存液配成Annexin-V-FITC/PI染液。每100 μL染液重懸1×106個細胞,振蕩混勻,室溫孵育15 min后加入1 mL HEPES緩存液,振蕩混勻。以488 nm波長激發525、620 nm帶通濾片分別檢測FITC、PI熒光,檢測細胞凋亡情況。
1.5 RT-qPCR
采 用 RNeasy Mini Kit(Qiagen,Valencia,CA,USA)提取總RNA,使用逆轉錄試劑盒 (RR047A,Takara,Japan)進 行逆 轉 錄 得到 cDNA。 使 用SYBR? Premix Ex TaqTM II(Perfect Real Time)kit(DRR081,Takara,Japan)和實時熒光定量 PCR 儀(ABI 7500,ABI,Foster City,CA,USA)中進行qRTPCR反應,引物由上海生工合成(引物序列見表1)。記錄各孔 Ct值,以 GAPDH[17]為內參,采用公式 2-ΔΔCt法計算產物相對表達量。
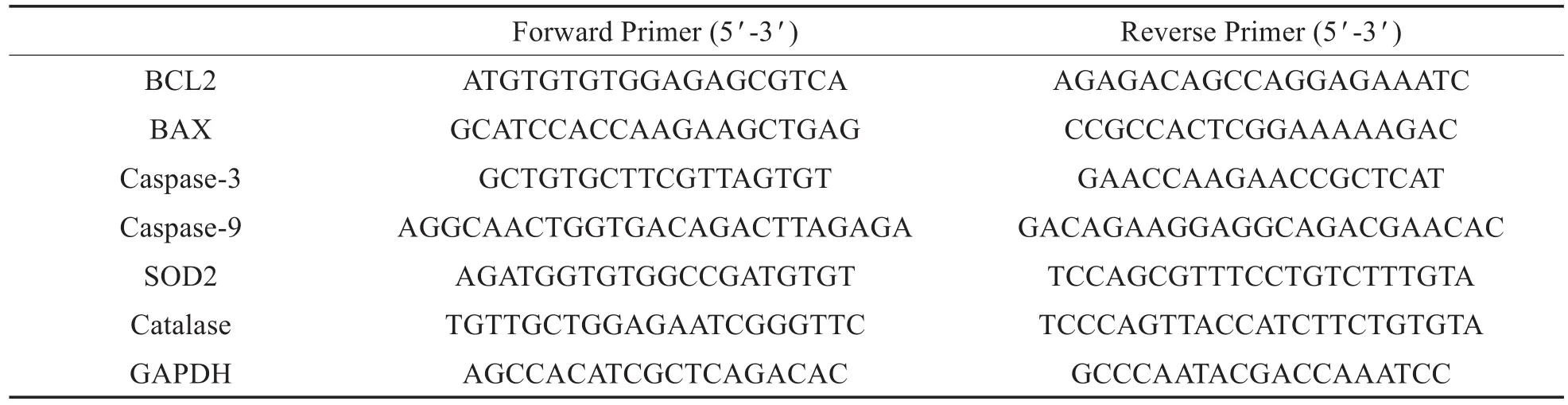
表1 qPCR引物Table 1 qPCR primers
1.6 Western blot
蛋白用10% SDS-PAGE進行分離電轉移到PVDF膜,5% BSA室溫封閉2 h,分別加入稀釋的一抗,4℃孵育過夜,洗膜后,二抗IgG室溫孵育1 h,ECL工作液 (美國EMD Millipore公司)顯影。用Image Pro Plus 6.0進行灰度定量,β-actin作為內參。所有抗體均購自Abcam (Cambridge,UK),每次實驗重復3次[18]。
1.7 流式細胞術檢測ROS生成[19]
用PBS洗滌細胞,并在50μL反應體積中以105個細胞重懸。5-(and-6)-chloromethyl-20,70-di‐chlorodihydrofluorescein diacetate (CM-H2DCFDA)在最終濃度為5μM時用于測量細胞質活性氧水平。細胞在黑暗中于37℃孵育30min,在C6 Accuri?流式細胞儀上,在λem=530±30nm處測量CMH2DCFDA的熒光。使用FlowJo軟件分析數據。
1.8 統計學分析
所有數據均采用SPSS21.0統計學軟件(USA)進行處理,計量資料采用均值±標準差的形式表示,多組間比較采用one-way ANOVA分析。P<0.05表示差異具有顯著性統計學意義。
2 結果
2.1 高糖誘導HEI-OC1細胞凋亡
HEI-OC1細胞經高糖處理后,首先通過Tunel實驗檢測了HEI-OC1細胞的凋亡情況,結果顯示與Control組比較,HG組HEI-OC1細胞凋亡率顯著升高(圖1A)。同時流式細胞術檢測細胞凋亡結果也顯示與Control組比較,高糖處理后,凋亡率顯著升高(圖 1B)。RT-qPCR 結果顯示,與 Control組比較,高糖處理后BCL2的mRNA表達顯著降低,而BAX、Caspase-3、Caspase-9的mRNA表達則顯著升高(圖1C)。Western blot實驗也呈現了類似的結果,高糖處理后BCL2的蛋白表達顯著降低,而BAX、Cleaved-Caspase-3、Cleaved-Caspase-9的蛋白表達則顯著升高(圖1D)。上述所有結果提示高糖處理誘導HEI-OC1細胞的凋亡。
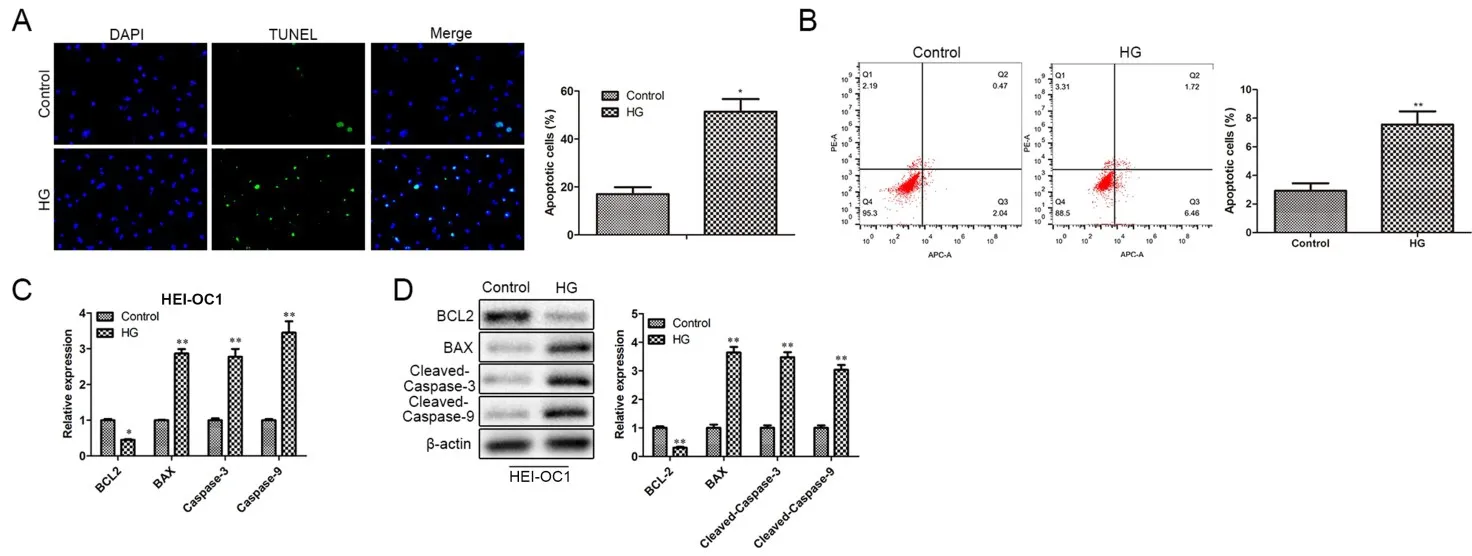
圖1 高糖誘導HEI-OC1細胞凋亡。A.Tunel實驗檢測HEI-OC1細胞的凋亡情況;B.流式細胞術檢測細胞凋亡;C.RT-qPCR檢測了BCL2、BAX、Caspase-3、Caspase-9的mRNA表達;D.Western blot檢測BCL2、BAX、Cleaved-Caspase-3、Cleaved-Caspase-9的蛋白表達;與Control組比較,*表示P<0.05,**表示P<0.01,n=3。Fig.1 High glucose induces apoptosis of HEI-OC1 cells.A.Tunel experiment to detect the apoptosis of HEI-OC1 cells;B.Flow cytometry to detect cell apoptosis;C.RT-qPCR to detect the mRNA expression of BCL2,BAX,Caspase-3 and Caspase-9;D.Western blot detected the protein expression of BCL2,BAX,Cleaved-Caspase-3,and Cleaved-Caspase-9;compared with the Control group,*P<0.05,**P<0.01,n=3.
2.2 高糖誘導HEI-OC1細胞發生氧化應激
為了證實高糖處理對細胞氧化應激的影響,采用流式細胞術檢測高糖處理后HEI-OC1細胞內ROS的生成。結果顯示,與Control組比較,高糖處理后細胞內ROS水平顯著升高(圖2A)。RT-qPCR和Western blot結果顯示,高糖處理顯著誘導了SOD2和catalase的mRNA和蛋白表達(圖2B,C)。
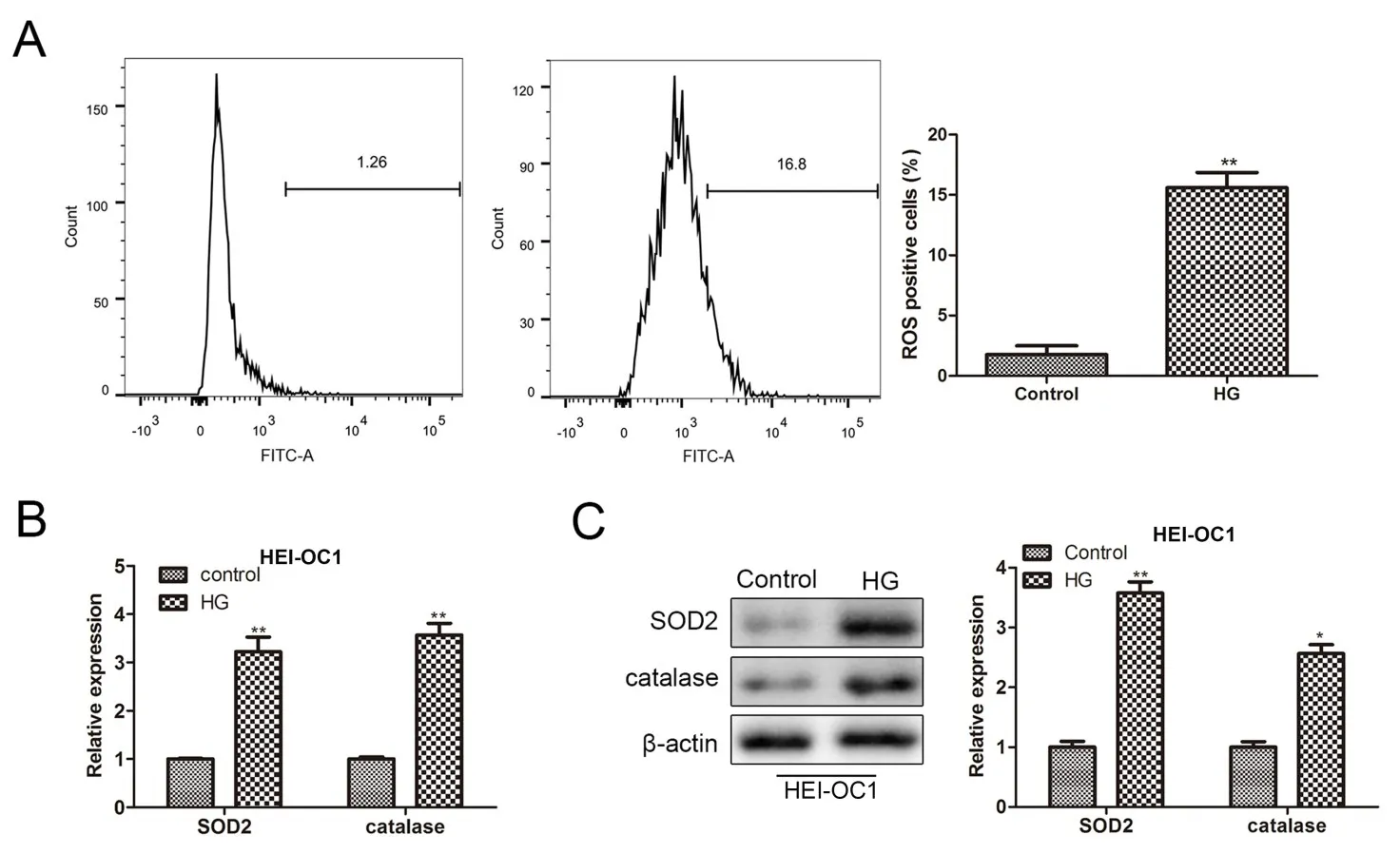
圖2 高糖誘導HEI-OC1細胞發生氧化應激。A.流式細胞術檢測HEI-OC1細胞內ROS的生成;B.RT-qPCR檢SOD2和catalase的mRNA表達;C.Western blot檢測高糖處理后HEI-OC1細胞中SOD2和catalase的蛋白表達;與Control組比較,*表示P<0.05,**表示P<0.01,n=3。Fig.2 High glucose induces oxidative stress in HEI-OC1 cells.A.Flow cytometry to detect ROS generation in HEI-OC1 cells;B.RT-qPCR to detect SOD2 and catalase mRNA expression;C.Western blot to detect SOD2 and catalase protein expression in HEI-OC1 cells after high glucose treatment;compared with the Control group,*P<0.05,**P<0.01,n=3.
2.3 高糖抑制Gjb2的表達
為了確認高糖處理對細胞凋亡和氧化應激的作用機制,不同濃度的血糖處理細胞后,通過RT-qPCR檢測Gjb2的表達,結果顯示與Control組比較,隨著血糖濃度的升高Gjb2的表達顯著降低,在血糖濃度為22 mM時Gjb2的表達達到最低(圖3A)。接下來選擇22 mM血糖濃度處理不同時間后,通過RT-qPCR檢測Gjb2的表達,結果顯示與0h比較,22 mM血糖分別處理細胞8、16、24h時,Gjb2的表達顯著降低,24h后,隨著處理時間的延長,Gjb2的表達無顯著變化(圖3B)。22 mM血糖處理24h作為后續細胞實驗條件。
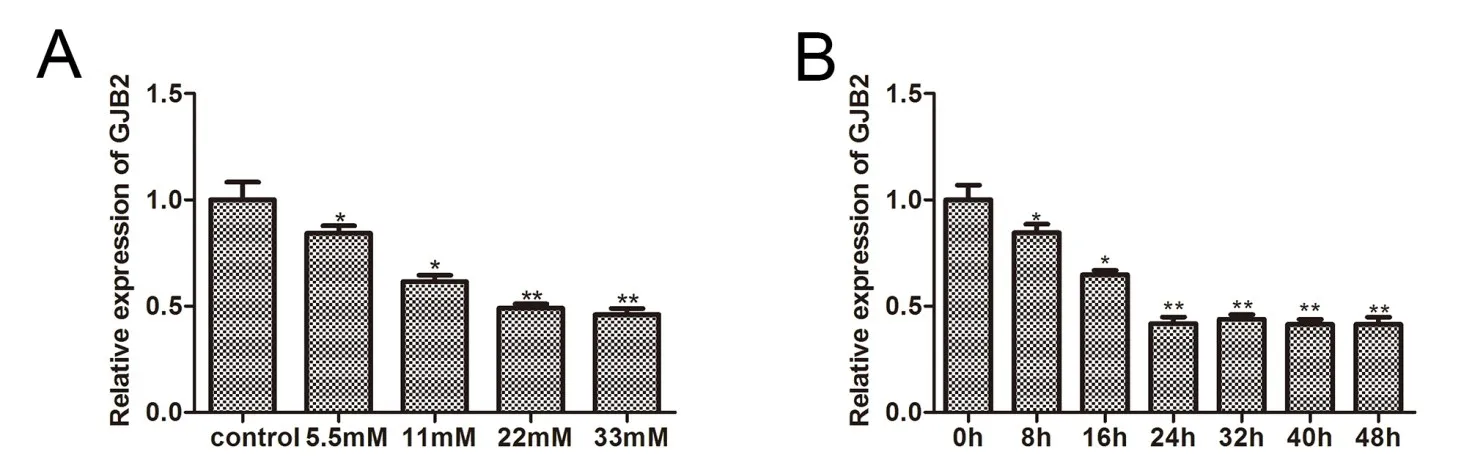
圖3 高糖影響Gjb2的表達。A.不同濃度血糖處理細胞后,RT-qPCR檢測Gjb2的表達;與Control組比較,*表示P<0.05,**表示P<0.01。B.22 mM血糖濃度處理不同時間后,RT-qPCR檢測細胞中Gjb2的表達;與0h比較,*表示P<0.05,**表示P<0.01,n=3。Fig.3 High glucose affects the expression of Gjb2.A.After treating the cells with different concentrations of blood glucose,RT-qPCR detects the expression of Gjb2;compared with the Control group,*P<0.05,**P<0.01;B.After 22 mM blood glucose concentration treatment for different time,RT-qPCR detects the expression of Gjb2 in the cells;compared with 0h,*P<0.05,**P<0.01,n=3.
2.4 過表達Gjb2抑制高糖誘導的細胞凋亡
為了進一步確認Gjb2在高糖誘導的細胞凋亡中的作用,在過表達Gjb2的同時用高糖處理細胞。Tunel和流式細胞術被用來檢測細胞凋亡的變化,結果顯示與pcDNA-NC組比較,高糖能夠顯著誘導細胞凋亡,而過表達Gjb2則能逆轉高糖誘導的細胞凋亡(圖4A,B)。RT-qPCR檢測結果顯示,高糖能夠顯著誘導細胞中BAX、Caspase-3、Caspase-9的mRNA表達,BCL2的mRNA表達則被顯著抑制(圖4C)。Western blot實驗結果顯示,高糖能夠顯著誘導細胞中 BAX、Cleaved-Caspase-3、Cleaved-Caspase-9的蛋白表達,而過表達Gjb2則能逆轉高糖對BAX、Cleaved-Caspase-3、Cleaved-Caspase-9表達的促進作用;BCL2的檢測結果則于BAX趨勢相反(圖4D)。
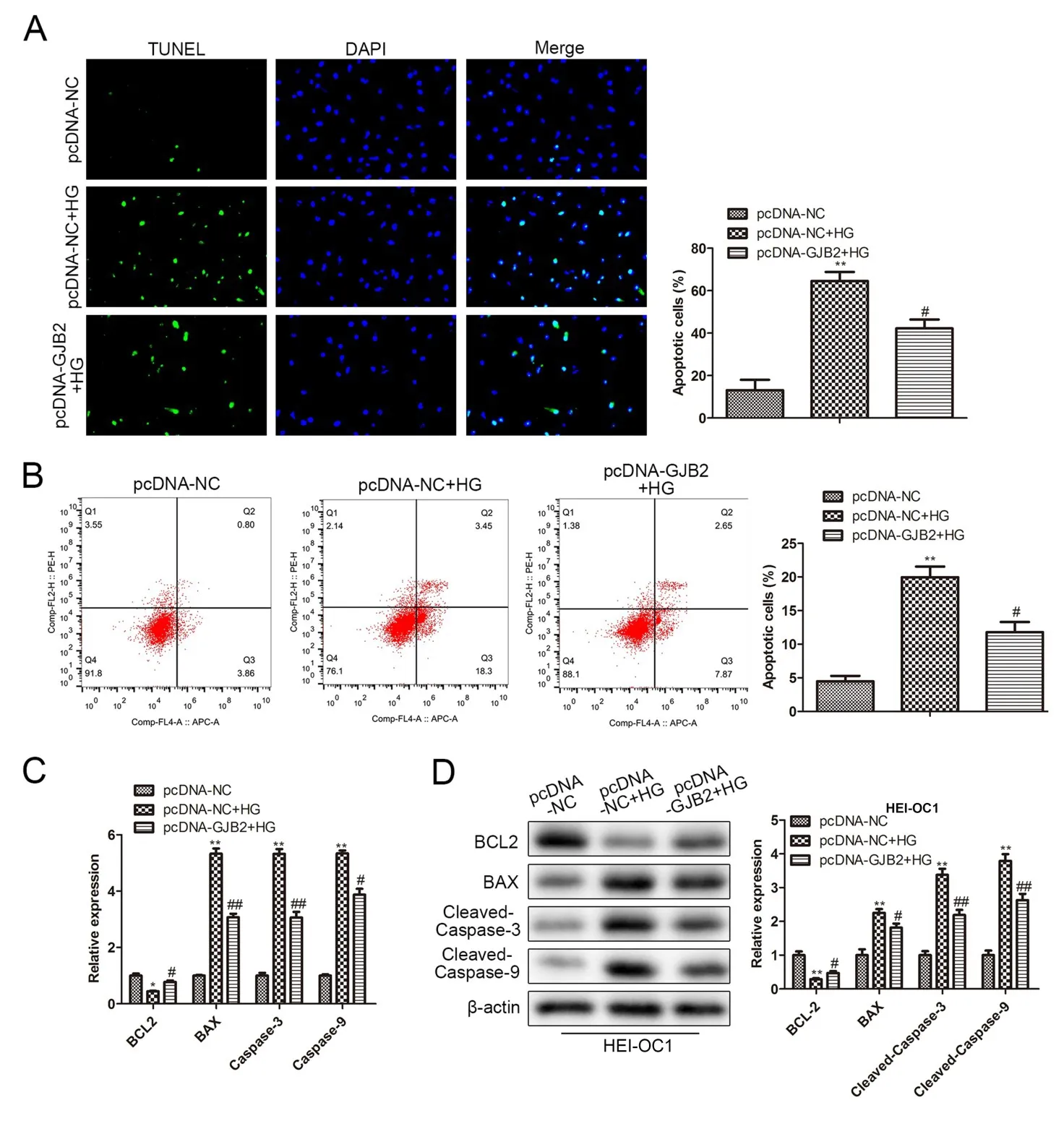
圖4 過表達Gjb2抑制高糖誘導的細胞凋亡。A.Tunel實驗檢測HEI-OC1細胞的凋亡情況;B.流式細胞術檢測細胞凋亡;C.RT-qPCR檢測了BCL2、BAX、Caspase-3、Caspase-9的mRNA表達;D.Western blot檢測BCL2、BAX、Cleaved-Caspase-3、Cleaved-Caspase-9的蛋白表達;與pcDNA-NC組比較,*表示P<0.05,**表示P<0.01;與pcDNA-NC+HG組比較,#表示P<0.05,##表示P<0.01,n=3。Fig.4 Overexpression of Gjb2 inhibits cell apoptosis induced by high glucose.A.Tunel experiment to detect the apoptosis of HEI-OC1 cells;B.Flow cytometry to detect cell apoptosis;C.RT-qPCR to detect the mRNA expression of BCL2,BAX,Caspase-3 and Caspase-9;D.Western blot detection of protein expression of BCL2,BAX,Cleaved-Caspase-3,Cleaved-Caspase-9;compared with pcDNA-NC group,*P<0.05,**P<0.01;compared with pcDNA-NC+Comparison of HG group,#P<0.05,##P<0.01,n=3.
2.5 過表達Gjb2抑制高糖誘導的細胞氧化應激
為了確認Gjb2在高糖誘導的細胞氧化應激中的作用,HEI-OC1細胞中過表達Gjb2后,通過流式細胞術檢測細胞內ROS的生成。結果顯示,高糖處理顯著提高了ROS,而過表達Gjb2則能逆轉高糖誘導的ROS的生成(圖5A)。RT-qPCR和Western blot結果顯示高糖處理能夠顯著促進SOD2和catalase的mRNA和蛋白表達,而過表達Gjb2則能逆轉高糖對SOD2和catalase表達的促進作用(圖5B,C)。
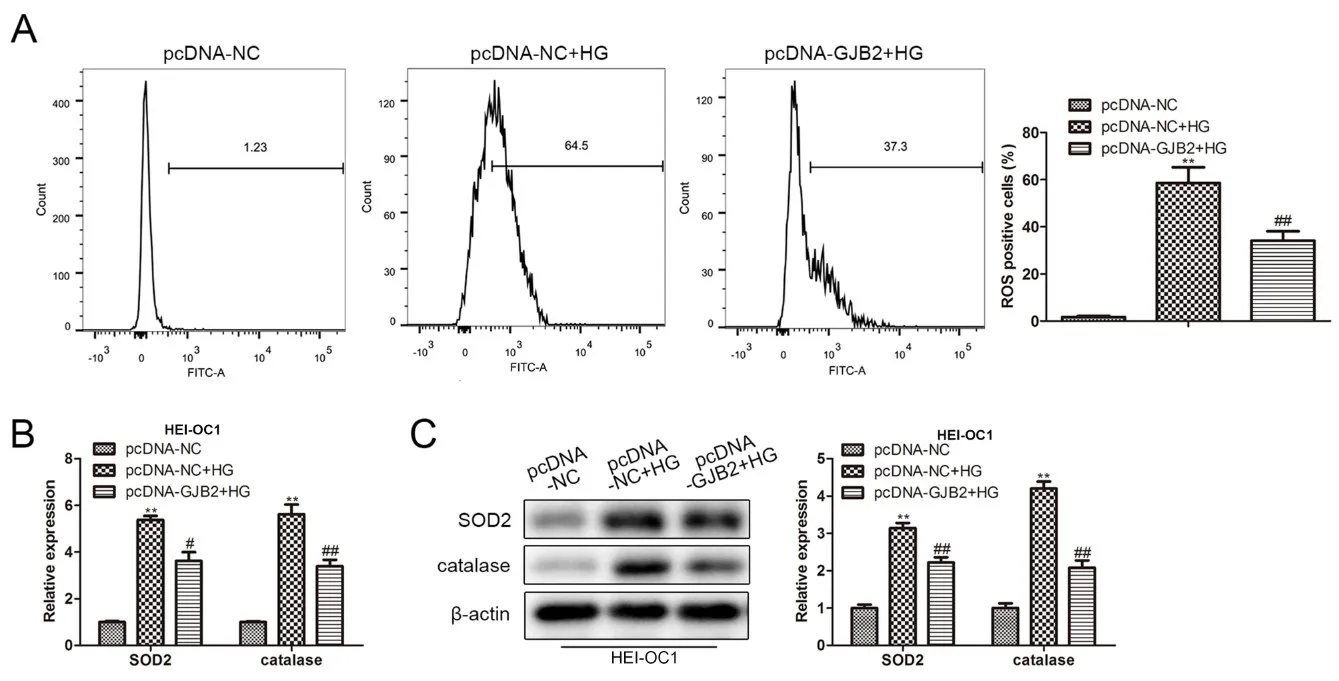
圖5 過表達Gjb2抑制高糖誘導的細胞氧化應激。A.流式細胞術檢測高糖處理后HEI-OC1細胞內ROS的生成;B.RT-qP‐CR檢測高糖處理后HEI-OC1細胞中SOD2和catalase的mRNA表達;C.Western blot檢測高糖處理后HEI-OC1細胞中SOD2和catalase的蛋白表達;與pcDNA-NC組比較,**表示P<0.01;與pcDNA-NC+HG組比較,#表示P<0.05,##表示P<0.01,n=3。Fig.5 Overexpression of Gjb2 inhibits cell oxidative stress induced by high glucose.A.Flow cytometry to detect the generation of ROS in HEI-OC1 cells after high glucose treatment;B.RT-qPCR to detect the mRNA expression of SOD2 and catalase in HEI-OC1 cells after high glucose treatment;C.Western blot detection The protein expression of SOD2 and catalase in HEI-OC1 cells after high glucose treatment;compared with pcDNA-NC group,**P<0.01;compared with pcDNA-NC+HG group,#P<0.05,##P<0.01,n=3.
3 討論
聽力損傷和糖尿病是世界上最普遍的兩種致殘情況[20]。在基于人口的研究中發現,糖尿病和聽力損傷之間有很大程度的關聯[21]。眾所周知,糖尿病與神經病變和微血管損傷有關,尤其影響周圍血管和神經的功能[22,23]。在糖尿病發展過程中,耳蝸和聽覺神經也有很高的損傷風險,如毛細胞數量減少,導致永久性聽力損失或平衡障礙[6],然而,糖尿病和聽力損傷過程之間的關聯的潛在機制在很大程度上仍然未知。
因此,本研究利用高血糖處理HEI-OC1細胞株,進一步研究高血糖誘導HEI-OC1細胞凋亡與氧化應激的作用機制,為保護高血糖引起的HEIOC1細胞損傷提供了新的潛在靶點。
本研究將HEI-OC1細胞株進行高糖處理后,檢測了HEI-OC1細胞的凋亡和氧化應激。結果顯示,高糖處理后HEI-OC1細胞凋亡率顯著升高,細胞內ROS水平顯著增加,同時伴隨著細胞凋亡和氧化應激相關基因和蛋白表達的升高。氧自由基的形成是導致多種類型聽力損傷的關鍵介質[24,25]。研究表明耳蝸組織中的ROS是由線粒體產生的[26,27]。活性氧的積累阻斷了內源性解毒途徑,導致脂質、蛋白質和核酸的氧化修飾和損傷。最終,激活凋亡信號通路,包括c-Jun-N末端激酶和P38 MAPK通路被激活,這可能誘導HEI-OC1細胞凋亡[28]。氧化應激以及隨之而來的組織損傷,持續的高葡萄糖水平導致氧化應激和耳蝸毛細胞的不可逆損傷[29]。與這一觀點相一致,一些抗氧化劑和增強內在抗氧化防御的試劑已被證明能夠保護耳蝸HEI-OC1細胞免于凋亡[30]。
為了進一步檢測高糖誘導HEI-OC1細胞凋亡和氧化應激的深入機制,本研究用不同濃度的血糖處理HEI-OC1細胞不同時間后,檢測了Gjb2的表達變化,發現高血糖會抑制Gjb2的表達。編碼縫隙連接蛋白Cx26的基因Gjb2的突變是感音神經性聽力損傷的最常見原因[12]。Gjb2基因的突變占不同人群中所有非綜合征性耳聾病例的四分之一[31]。先前的研究表明,出生后早期Gjb2基因的敲除可導致小鼠模型外毛細胞的丟失[32]。有文獻報道縫隙連接蛋白的敲除,導致能量代謝出現障礙,高耗能細胞出現葡萄糖短缺,進而導致ATP不足,導致大量的超氧化物產生,而超氧化物的聚集,通過凋亡途徑會導致耳蝸中細胞凋亡并最終導致耳蝸聽覺功能的喪失[33]。Gjb2基因過度表達,會誘導機體蛋白激酶(PKC)的活化,進而發揮抗凋亡抗氧化應激的作用[34]。
研究已經發現,Cx26在耳蝸縫隙連接中高度表達,Cx26缺陷引起耳蝸細胞之間的連接障礙進而導致縫隙連接通道的滲透性改變,而細胞間的連接又依賴于細胞外基質,Cx26缺陷會引起細胞外基質的異常,進而細胞間的連接出現障礙和異常[35]。近幾年,有文獻報道,Cx30(-/-)小鼠中缺乏縫隙連接蛋白connexin30(Cx30)會導致血管紋內皮細胞屏障的破壞,進而影響聽力[36,37]。耳蝸毛細胞一旦失去周圍細胞的連接和支持,失去細胞-基質之間的正常相互作用,必然造成耳蝸毛細胞的位置改變,并引起所謂的“厭食”性“自殺”行為[38,39]。本研究的結果顯示,在高血糖處理HEI-OC1細胞的同時,在細胞中過表達Gjb2后,結果發現過表達Gjb2能夠抑制高糖誘導的HEI-OC1細胞凋亡和氧化應激。與文獻報道相一致。細胞外基質表達異常,引發細胞間的電荷選擇性改變和信號傳遞及營養和能量供應障礙,進而造成“失聯”細胞因細胞間連接的外基質損害而發生失巢凋亡[40]。
綜上所述,在高糖誘導的HEI-OC1細胞凋亡和氧化應激中,過表達Gjb2能夠發揮HEI-OC1細胞保護作用,這為保護高糖引起的HEI-OC1細胞損傷提供了新的潛在靶點。

