貯運過程中刺身魚水分的變化
趙波,應曉國,張美超,3,龔晨輝,徐坤俐,王遠會,楊澤鵬,萬海倫,陳廣川,吳韜,唐勇*
1(西華大學 食品與生物工程學院,四川 成都,610039) 2(浙江海洋大學 食品與醫藥學院,浙江 舟山,316022)3(茂縣科學技術和農業畜牧局,四川 阿壩州,623200) 4(成都奕陽現代食品安全技術研究中心,四川 成都,610000)
刺身魚是可作生食的一類魚,包括了不同的漁業種類,刺身又稱生魚片,具有豐富的營養價值,是一道廣受世界各地消費者青睞的菜肴[1]。魚類生物體含水量高,整個體系中的水分占總質量的65%~80%,且肌纖維細,極易腐敗變質。因此,活魚捕撈后通常通過低溫來保持原有的色澤和新鮮度。經過凍結后,雖然抑制了魚體內的微生物生長,減弱了酶活性[2],但在冷凍過程中魚體內的水轉化為冰晶,會對魚體組織細胞產生一定的破壞性[3],導致其水分受到影響,顏色、風味和質地等也隨之發生變化[4-5],致使刺身魚品質明顯下降,但不同貯運過程對刺身魚品質影響的程度有所不同。目前行業中仍存在將捕撈上岸的刺身魚置于不同溫度條件進行貯運的現實情況,因此研究刺身魚在不同貯運期間的水分遷移以及分布等變化對其品質保鮮和經濟價值具有積極意義。
傳統的水分含量檢測方法無法做到對水分狀態、分布及遷移等的測量,不能確切直觀地反映體系中的水分結合特征[6]。SNCHEZ-ALONSO等[7]和MCDONNELL等[8]利用低場核磁共振技術(low-field nuclear magnetic resonance, LF-NMR)分別對冷凍鱈魚和鹽腌豬肉進行了研究,發現橫向弛豫時間(T2)對不同的冷凍條件和鹽腌濃度敏感,在這2種過程中均存在水分遷移的現象。近年來,由于其具有快速無損、操作簡便、直觀明了、穩定性高[9]等優點,越來越多的研究者運用LF-NMR和核磁共振成像(magnetic resonance imaging, MRI)進行食品中的水分分析。T2主要提供水在食物基質中的結合性質,以此反映食物中不同狀態的水分群如結合水、不易流動水和自由水。而MRI則顯示水的空間分布及變化,二者是研究水在各種食品中的狀態、流動性和分布的有力工具,可以為水的遷移提供直接信息[10-11]。
目前,已有許多學者對貯藏過程中的果蔬等食品的水分進行了探究。如馮愛博等[12]和羅潔瑩等[13]分別對貯藏過程中的雷竹筍和鷹嘴蜜桃進行了系統的水分研究。但對魚類的水分研究大都集中在加工過程當中[14-16]。為豐富魚類在貯運過程中的水分研究,本研究結合實際情況將刺身魚置于3種不同溫度條件下進行貯藏,以模擬不同的貯運過程中刺身魚內水分隨貯藏時間變化的影響,為其貯運過程的品質研究提供支撐和參考。
1 材料與方法
1.1 材料與試劑
刺身魚選用虹鱒(Oncorhynchusmykiss),由四川省雅安市天全縣潤兆漁業提供,每條魚的質量為3.5~4.5 kg; 蘇木素染液、伊紅染液,珠海貝索生物技術有限公司;40%(體積分數)甲醛、無水磷酸氫二鈉、二水磷酸二氫鈉、無水乙醇、二甲苯、鹽酸,均為分析純,成都市科隆化學有限公司。
1.2 儀器與設備
溫度標簽,成都奕陽現代食品安全技術研究中心;ULTS 1368型超低溫冰箱,賽默飛世爾(蘇州)儀器有限公司;BCD-568 WDPF型冰箱,海爾集團;MesoMR23-040V-1型低場核磁共振儀,蘇州紐邁析儀器股份有限公司;RM 2016型轉輪式切片機,德國徠卡;JT-12S型自動組織脫水機,武漢俊杰電子有限公司;BMJ-A型包埋機,常州郊區中威電子儀器廠;RS 36 型全自動染色機,常州派斯杰醫療設備有限公司;PHY-Ⅲ型病理組織漂烘儀,常州市中威電子儀器有限公司;Pannoramic 250型數字切片掃描儀,濟南丹吉爾電子有限公司。
1.3 實驗方法
1.3.1 刺身魚前處理
將新鮮購回的刺身魚處死,去頭去尾、去骨去皮、去內臟,用蒸餾水將其血污清洗干凈,分割成8 cm×4 cm×4 cm的魚塊,用保鮮膜包裹后隨機分成3組進行貯藏。(1)低溫處理組:將魚塊置于-18 ℃條件下長期貯藏;(2)超低溫處理組:將魚塊置于-78 ℃條件下長期貯藏;(3)轉組:在-78 ℃條件下使魚塊中心溫度快速從室溫下降至-18 ℃,再迅速轉移到-18 ℃長期貯藏。
1.3.2 凍結曲線測定
取9個溫度標簽,設置其采集時間間隔為300 s,采集次數為80次,將其啟動后分別放至9個新鮮魚塊的中心部位,用保鮮膜包裹后隨機分為3組進行相應的處理,以對不同溫度貯藏條件下的刺身魚塊進行凍結溫度的監測,每組3個平行。待采集時間終止后取出魚塊中的標簽讀取數據并做記錄,繪制不同處理條件下的凍結曲線。
1.3.3 低場核磁水分測定及1H成像分析
將刺身魚塊取出,于4 ℃解凍24 h后修整成大小為2 cm×2 cm×2 cm的方塊,用濾紙吸去魚塊表面的水分,裝入核磁管中,分別對3種不同溫度貯藏條件下貯藏了0、4、8、12、16、20、24周的刺身魚水分進行測定,每組3個平行。在正式對樣品進行測試之前,需要用標準油樣在Q-FID序列下對儀器和系統進行校正。校正完成后,反復試驗直到找到樣品的最佳脈沖重復序列時間,最后在Q-CPMG序列下對樣品進行水分測定。參數設置為:工作溫度32 ℃,質子共振頻率20 MHz,采樣點數240 154,脈沖重復序列時間3 500 ms,采樣頻率200 kHz,累加次數2,回波時間0.2 ms。將測得的數據進行反演,得到各水分群對應的弛豫時間及峰積分面積。
水分測定完成之后利用核磁共振成像系統對樣品進行成像處理。在成像之前,需用標準油樣對儀器和成像系統進行校正,成像后用儀器自帶的圖像處理軟件對圖片進行統一映射和偽彩處理。參數設置為:以俯視圖為成像方位,重復時間500 ms,回波時間20 ms。
1.3.4 HE染色分析
配制10%(體積分數)中性甲醛固定液,將在3種 不同溫度貯藏條件下貯藏了24周的刺身魚樣品分別取出后快速修整為2 cm×2 cm×2 cm的方塊,并迅速放入配好的固定液中持續固定48~72 h。將固定好的樣品取出依次進行脫水、包埋、切片等操作,最終制得切片樣品。而后將其脫蠟,使用蘇木精染色后沖洗,再用鹽酸酒精分化,再次沖洗后放入50 ℃的溫水中或弱堿性水溶液返藍,直到出現藍色為止。取出用自來水沖洗后放入85%的酒精,再用伊紅對其染色,水洗后用梯度酒精進行脫水,經二甲苯透明后利用中性樹膠封固。最后用數字切片掃描儀對切片進行圖像采集,選擇要觀察的區域放大(×100),觀察刺身魚的肌纖維狀態及冰晶形成情況。
1.4 數據分析
所有實驗數據均用SPSS 26.0做方差分析及差異顯著性分析,作圖利用Origin Pro 9.0進行繪制。
2 結果與分析
2.1 不同溫度貯藏條件下刺身魚的凍結曲線
利用溫度標簽獲得了3種不同溫度貯藏條件下的刺身魚樣品中心溫度隨凍結時間的變化曲線,其凍結點在-1.8 ℃左右,這與魚肉的凍結點在-2.0~-0.6 ℃相符合[17]。如圖1所示,刺身魚降溫過程可大致分為3個階段。在第一階段,3種不同溫度貯藏條件下的刺身魚中心溫度從初溫快速降低至-1.8 ℃, 這是因為此時刺身魚放出的熱量是顯熱,這部分熱量與全部放出的熱量相比,其值較小,所以降溫速度快,曲線較陡[18];在第二階段,3組刺身魚樣品中心溫度從凍結點降低至-5 ℃過程中降溫速率緩慢,并且都在-1.8 ℃持續了一段時間,在圖中表現為重疊。其中-18 ℃低溫處理組的持續時間最長,達到了64 min,而該組通過第二階段的時間長達152 min。 這是因為此時為冰結晶最大生成帶,刺身魚中的大部分水結成冰晶,放出大量的潛熱,而在整個凍結過程中,刺身魚的絕大部分熱量都在此階段放出,因此刺身魚在該階段的降溫速率慢,凍結曲線平坦;在第三階段,經過潛熱釋放帶之后,3組刺身魚中心溫度從-5 ℃繼續下降至終溫,其降溫速率開始上升,凍結曲線斜率增大。此時放出的熱量一部分是由于已結晶的部分繼續降溫至凍結終溫,另一部分是由于剩余少量的水繼續結晶[19],所以此時的曲線不如第一階段陡峭。

圖1 不同貯藏條件下刺身魚的凍結曲線
食品中心溫度通過冰結晶最大生成帶的熱交換對食品凍結速度的影響很大,而凍結速度不僅關系到食品中冰晶的大小,更是關系到食品中的水分遷移[20]。比較3種不同貯藏條件下刺身魚中心溫度通過冰結晶最大生成帶的時間發現,超低溫處理組和轉組用時29 min,與低溫處理組(152 min)相比明顯耗時較短;對于3組刺身魚中心溫度從初溫降至終溫的整個凍結過程中,超低溫處理組(終溫為-78 ℃)耗時385 min,低溫處理組(終溫為-18 ℃)耗時400 min, 而轉組(終溫為-18 ℃)僅耗時86 min。由此可見,貯藏溫度越低,刺身魚中心溫度降溫速率越快,且其經過冰結晶最大生成帶的時間越短,越有利于刺身魚快速凍結。
2.2 不同溫度貯藏條件下刺身魚的水分分析
2.2.1 不同溫度貯藏條件下刺身魚的低場核磁共振圖譜
LF-NMR可用于評價水分在食品中的呈現狀態,圖2對刺身魚弛豫時間數據進行多指數擬合,得到不同溫度貯藏條件下刺身魚弛豫時間隨貯藏時間變化的低場核磁共振圖譜。如圖2所示,在3種不同溫度貯藏條件下,刺身魚樣品在0~10 000 ms之間均呈現出3~4個峰,弛豫時間T2越短,說明水分的自由度越低[21]。其中,弛豫時間最短的水分群T2b(0~10 ms)被認為是與大分子緊密結合且不受外界條件影響的結合水;弛豫時間最長的水分群T22和T23(100~10 000 ms) 是主要依靠毛細管凝結作用存在于肌纖維蛋白網絡外的自由水[22];而弛豫時間介于兩者之間的水分群T21(10~100 ms)是被困在蛋白密集的肌纖維網絡中的不易流動水[23]。因此可以看出,不同溫度貯藏條件下的刺身魚在貯藏期間均存在著3種不同狀態的水分群,且其中的不易流動水為刺身魚的主要水分群。
不同的橫向弛豫時間對應的峰面積表示不同狀態水分的相對含量,如圖2所示,各水分群的峰面積隨著貯藏時間的延長而變化,表明3種不同溫度貯藏條件下的刺身魚均存在著不同程度的遷移情況。且隨著貯藏時間的延長,各水分群對應的弛豫時間均呈現出右移趨勢,這與ZHANG等[24]和LI等[25]分別對豬最長肌和速凍豬肉肉餅在凍藏期間的水分研究結論一致。但在圖2-c中,超低溫處理組的弛豫時間右移程度與低溫處理組和轉組相比較小,這說明貯藏溫度越低,對刺身魚水分自由度的影響越小[21]。由圖2可知,3種不同溫度貯藏條件下的刺身魚在貯藏后期都出現了自由度更高的一組水分群T23,這可能是由于貯藏過程中形成的冰晶和再結晶對刺身魚細胞造成了機械損傷,同時在凍結過程中離開細胞進入細胞外間隙的水無法返回細胞內間隙[26],最終導致刺身魚內自由水增加,水分自由度增大。
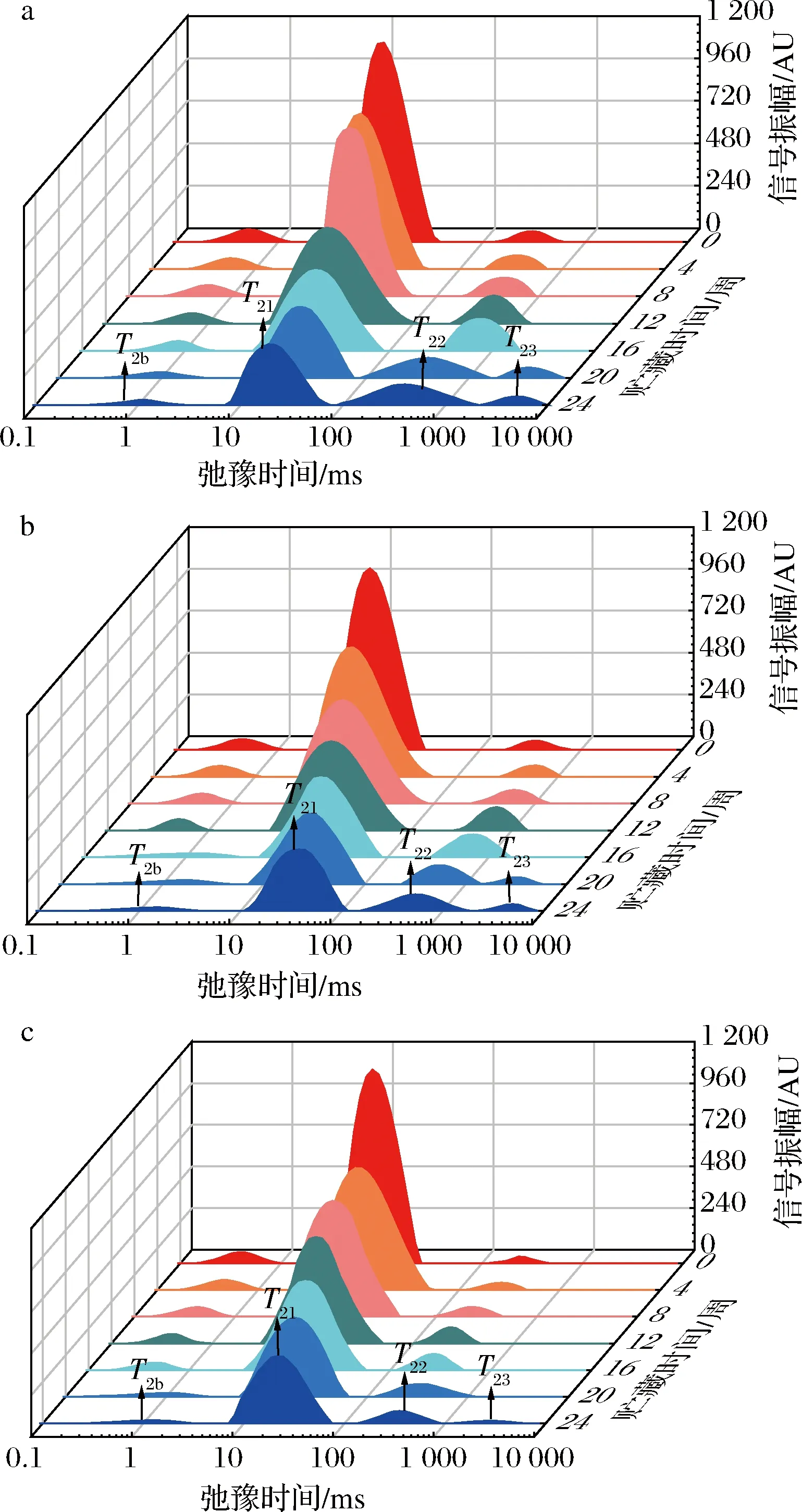
a-低溫處理組; b-轉組;c-超低溫處理組
2.2.2 不同溫度貯藏條件下刺身魚的水分含量
圖3和圖4分別表示了不同溫度貯藏條件下的刺身魚在貯藏期間水分總峰面積的變化情況和其內部各水分群的相對含量變化情況。如圖3所示,貯藏溫度越低,刺身魚中水分總峰面積越小,但在貯藏過程中,同一貯藏時間下轉組和超低溫處理組的水分總峰面積差別不顯著(P>0.05)。3種不同溫度貯藏條件下的刺身魚在其貯藏期間的水分總峰面積均呈現顯著下降的趨勢(P<0.05),這是因為不易流動水是其中主要的水分群,受不易流動水的含量影響最大,因此呈現出與圖7中相同的下降趨勢。而在圖4中,0~24周的貯藏期內,3種貯藏條件下的刺身魚內結合水相對含量的波動較為平緩,且變化幅度較小,均在4.3%~5.0%左右,這是因為結合水是與大分子緊密結合的水分群,受溫度等外界條件的影響極小。低溫處理組、超低溫處理組和轉組的刺身魚在貯藏過程中的不易流動水相對含量均隨著時間的延長顯著減少(P<0.05),分別從91.63%、93.73%、92.36%下降至61.18%、81.34%、72.40%,而自由水隨時間延長顯著增加(P<0.05),分別由3.45%、 1.74%、3.12%增加至34.36%、14.28%、 23.23%。但在貯藏前期,不同貯藏條件下的刺身魚內不易流動水和自由水變化均不顯著(P>0.05)。這表明不同溫度貯藏條件下刺身魚內均存在不易流動水向自由水遷移的現象,但這種水分遷移的程度受溫度影響較大,貯藏溫度越低,刺身魚內水分遷移的量越少。

圖3 不同貯藏條件下刺身魚水分總峰面積隨貯藏時間的變化

a-結合水相對含量;b-不易流動水相對含量;c-自由水相對含量
2.2.3 不同溫度貯藏條件下刺身魚的MRI成像
作為一種無損的食品基質內部結構可視化技術,MRI已廣泛應用于食品水分分布的研究[27]。為了更直觀地了解刺身魚在貯運過程中內部水分的變化信息,對不同溫度貯藏條件下的刺身魚進行了MRI成像分析。圖像經過偽彩處理后如圖5所示,圖中越亮(越趨近于黃色)的區域表示1H密度信號越強,該區域的水分越多;反之(越趨近于藍色),則1H密度信號越弱,該區域的水分越少。隨著貯藏時間的延長,3種 不同溫度貯藏條件下的刺身魚MRI圖的亮度均呈現出由高到低的衰減趨勢,這與其水分總峰面積的變化相符。在貯藏中期,1H密度信號從內部區域到外部區域呈不斷增強的趨勢,這表明水從肌纖維內逐漸排出,遷移到肌纖維間隙[28]。到貯藏后期,刺身魚中的水分重新恢復均勻分布,但樣品邊緣信號較弱,外部輪廓較為模糊。這可能是因為貯藏達到后期,刺身魚肌纖維組織損壞嚴重,導致體系對水分子的束縛能力下降,使得水分逐漸恢復均勻分布[29]。從不同溫度的貯藏條件來看,低溫處理組的偽彩圖像亮度減弱最明顯,說明刺身魚在此條件下的水分流失最嚴重。

圖5 不同貯藏條件下刺身魚的MRI成像
2.3 不同溫度貯藏條件下刺身魚的HE染色分析
為了觀察刺身魚的肌纖維狀態以及冰晶的形成狀況,通過HE染色的方式對其進行了處理。圖6展示了在不同溫度貯藏條件下貯藏了24周的刺身魚肌纖維組織狀態、冰晶大小及分布情況。圖中紅色片狀區域為刺身魚正常肌纖維組織,淺紅色點狀區域為損壞的肌纖維組織,而白色空洞區域則為冰晶。由圖6可知,刺身魚肌纖維分布均勻。其中,低溫處理組的刺身魚內肌纖維壞死溶解最多,在一個視野內的冰晶最少且體積最大;轉組的刺身魚內肌纖維壞死溶解較少,形成的冰晶較低溫處理組多且小;超低溫處理組的刺身魚內肌纖維保持最好,形成的冰晶最多且體積最小。冰晶的形成會對刺身魚肌肉組織造成損害,且這種損害是不可逆的,冰晶越大,刺身魚肌肉組織受到的損傷越大[30-31],同時這也是水分從肌纖維內的不易流動水向肌纖維外的自由水遷移的重要原因。因此,低溫處理組的刺身魚肌纖維壞死溶解最多,導致該組刺身魚體系內的持水能力最差,水分損失最為嚴重。而超低溫處理組因其經過冰結晶最大生成帶的時間最短,凍結速度最快,組織細胞內向細胞外轉移的水分少,能使那些尚處于原來狀態的汁液迅速形成量多而細小的冰晶,對組織造成的損傷小,所以該組的肌纖維能較完整地保持。HE染色的微觀觀察結果為冰晶對肌纖維造成的機械損傷提供了直接證據,并且支撐和驗證了LF-NMR以及MRI對刺身魚水分研究的結果。
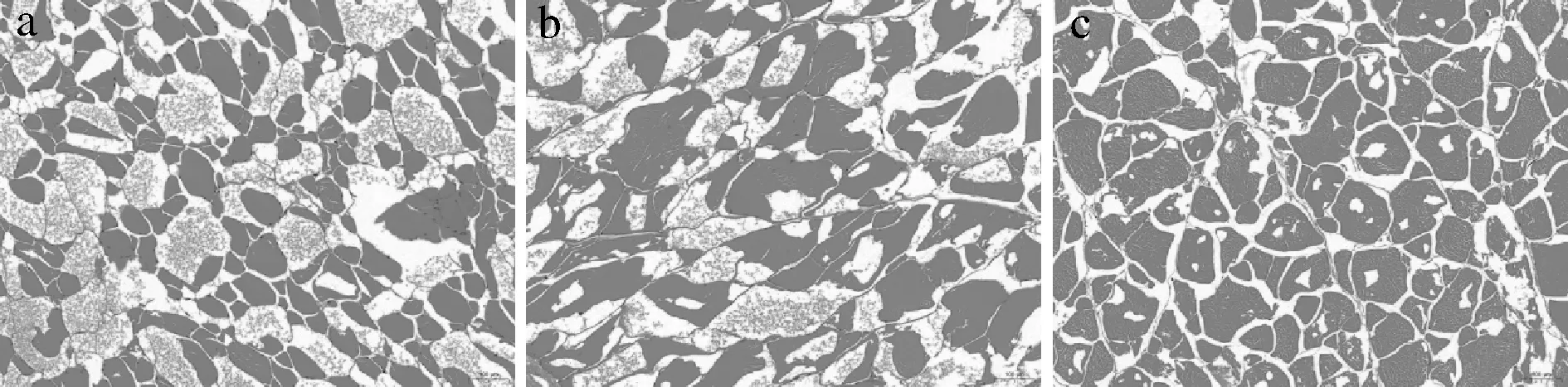
a-低溫處理組; b-轉組; c-超低溫處理組
3 結論
通過LF-NMR和HE染色分析對低溫處理組、超低溫處理組、轉組3種不同溫度貯藏過程中刺身魚內水分隨貯藏時間的變化進行了探究。研究發現,在3種不同溫度貯藏過程中的刺身魚內均存在結合水、不易流動水和自由水3種不同狀態的水分群,其中不易流動水為刺身魚的主要水分群;在0~24周的貯藏期內,低溫處理組、超低溫處理組和轉組中的不易流動水和自由水相對含量隨貯藏時間變化顯著(P<0.05), 其中不易流動水相對含量分別從91.63%、93.73%、92.36%下降至61.18%、81.34%、72.40%,自由水分別由3.45%、1.74%、3.12%增加至34.36%、14.28%、23.23%,而結合水相對含量在3種貯藏過程中均處于4.3%~5.0%,波動幅度均較小;水分分布則由貯藏初期的均勻分布變化為由內向外遷移,到貯藏后期又重新恢復均勻狀態,且3種不同溫度貯藏條件下的刺身魚均有不同程度的水分流失。此外,超低溫處理組和轉組的刺身魚通過冰結晶最大生成帶的時間最短,均為29 min,更有利于刺身魚快速凍結。結合HE染色結果可知,在超低溫處理組中,刺身魚內形成的冰晶尺寸最小,對肌纖維造成的機械損傷小,有利于肌纖維的完整保持和體系內持水力的維持,水分遷移量更少。因此,一直處于超低溫條件下進行貯運的刺身魚在水分和肌纖維保持方面都具有良好的效果,能更好地保證其凍結品質。