利用異源表達挖掘纖維堆囊菌So0157-2的新型天然產物
周海波,申琪瑤,陳漢娜,王宗杰,李越中,張友明,卞小瑩
(山東大學,微生物技術國家重點實驗室,山東 青島 266237)
黏細菌屬于革蘭氏陰性細菌,是新穎活性天然產物的重要來源,具有巨大的藥用開發潛力。目前已從黏細菌中發現了大約100多種次級代謝產物的基本結構和600多種結構類似物。這些化合物不僅結構類型豐富,包括聚酮類、非核糖體肽、萜類以及其他雜合的結構類型,同時也顯示了廣泛的生物活性,如抗菌、抗腫瘤、抗病毒、免疫抑制、抗瘧等[1-6]。
隨著基因組測序技術的發展,越來越多的基因組信息分析表明黏細菌基因組所蘊藏的生物合成基因簇(biosynthetic gene cluster,BGC)合成新穎次級代謝產物的潛力遠遠超出了目前已分離獲得的化合物的數目。例如,抗腫瘤藥物埃博霉素(epothilone)的產生菌纖維堆囊菌So0157-2(Sorangium cellulosumSo0157-2)的基因組測序結果表明,該菌株擁有14.78 Mb 的環狀染色體,是目前已知基因組最大的原核生物[7-9]。除了已知的埃博霉素系列衍生物[10-15]之外仍未見其他化合物從該菌株中分離報道,這預示著該菌株仍具有較大的代謝潛能。對隱性基因簇進行有效的激活和改造,能夠為藥物先導結構的發現提供更多的化合物資源。由于纖維堆囊菌So0157-2 生長相對較慢、培養困難,本源菌也缺乏合適的遺傳操作體系,對其天然產物的開發存在著諸多挑戰。
近年來天然產物生物合成基因簇的異源表達策略受到了越來越廣泛的關注。異源表達是將完整的基因簇克隆到穿梭載體上然后轉移到合適的異源宿主中進行表達,是挖掘難培養或未培養微生物次級代謝產物的有效手段。相比于原始宿主,異源宿主在遺傳操作和生長速度上有較大優勢。一方面,異源表達可以用于提高次級代謝產物的產量。另一方面,異源表達可以用于鑒定已知天然產物的生物合成途徑。此外,異源表達還可以用于鑒定隱性基因簇,發現新型天然產物,特別有利于難培養或未培養微生物次級代謝產物的挖掘[16-19]。
異源表達的難點之一在于大部分天然產物生物合成基因簇都相當大(>10 kb),PCR 擴增很難得到如此長的DNA 序列。通過構建和篩選基因文庫雖然能夠獲得目的基因簇,但是工作量非常大,且不一定能獲得完整的基因簇。隨著基因編輯技術的發展和進步,可以利用直接克隆技術(direct cloning)從基因組中克隆大型基因簇,比如LLHR(linear-linear homologous recombination)、 TAR(transformation-associated recombination)、CATCH(Cas9 assisted targeting of chromosome segments)等[20]。其中LLHR是由本團隊于2012年開發的基于Red/ET 重組工程技術(recombineering)的直接克隆技術[21],并與異源表達相結合,廣泛應用于天然產物基因簇的挖掘。2018年將Red/ET重組工程技術與核酸外切酶體外處理技術相結合,開發了ExoCET(exonuclease combined with RecET recombination)克隆技術,進一步提高了BGCs 直接克隆的效率[22]。此外,Red/ET 重組工程技術還可以用于基因簇的無痕定點突變,結構域替換等等,極大促進了大型基因簇的遺傳操作[22-28]。
異源表達的另一個難點在于異源宿主的選擇。大腸桿菌和釀酒酵母都是表征良好、易于遺傳操作的模式菌株,為細菌和真菌中天然產物的表達提供了良好的異源宿主[29-31]。研究者也發現,當宿主菌與包含目標基因簇的菌株在進化上相近時,異源表達就更易成功。所以,很多鏈霉菌被開發為異源宿主菌,用于放線菌中基因簇的異源表達[32-33]。可用于黏細菌異源表達的異源宿主菌相對缺乏,目前常用的有黃色黏球菌(Myxococcus xanthus)、惡臭假單胞菌(Pseudomonas putida)以及Schlegelella brevitaleaDSM 7029(曾用名:BurkholderialesStrain DSM 7029,[Polyangium]brachysporumDSM 7029)等[16-18]。除了黃色黏球菌和S.brevitaleaDSM 7029之外,其他異源宿主產量普遍較低。黃色黏球菌也屬于黏細菌屬,自身生長周期慢、難于進行遺傳操作等劣勢也限制了其應用。S.brevitaleaDSM 7029 是一株能夠產生多種非核糖體肽、聚酮-非核糖體肽雜合化合物的革蘭氏陰性細菌,相較于黃色黏球菌具有生長快、易操作、代謝背景清晰等諸多優點,特別是在表達纖維堆囊菌來源埃博霉素中顯示了作為通用底盤菌的潛力[34-37]。因此,該菌株可作為本研究的異源宿主候選菌。
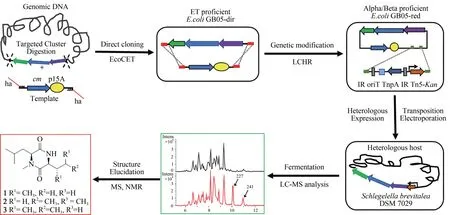
基于纖維堆囊菌So0157-2 基因組信息預測分析所顯示出的代謝潛能,本論文利用ExoCET 直接克隆技術從該菌基因組DNA 中克隆了1 個未知功能的NRPS-PKS 雜合的基因簇BGC18。通過啟動子插入,并以S.brevitaleaDSM 7029為異源宿主進行異源表達,經過液質聯用(HPLC-MS)分析,正相與反相色譜柱靶向分離純化,獲得了3個該基因簇對應的表達產物。最后,通過核磁共振(NMR)結構鑒定和Marfey 反應確定了3 個化合物分別為新天然產物Cyclo(N-Me-L-Leu-L-Val)(1)和 Cyclo (N-Me-L-Leu-L-Leu)(2), 新 化 合 物Cyclo(N-Me-L-Leu-L-Ⅰle)(3)。將化合物結構與生物合成基因簇對比分析發現化合物結構的多樣性來源于第1 個腺苷化結構域(A domain)對底物識別的寬泛性。此外,推測由于缺少硫醇化結構域(T domain)導致PKS 模塊被跳過,從而只獲得了兩個NRPS模塊指導合成的環二肽產物。該研究成功構建了基于Red/ET 重組工程技術的纖維堆囊菌So0157-2 基因簇的直接克隆、遺傳修飾和異源表達體系,不僅豐富了纖維堆囊菌So0157-2 的代謝產物庫,也為挖掘該菌株中其他新穎的天然產物用于藥物篩選評價奠定了基礎。
1 材料和方法
1.1 材料
1.1.1 菌株、質粒和引物
本研究所用的菌株和質粒見表1。寡核苷酸引物均由生工生物工程(上海)股份有限公司合成,本研究所用的寡核苷酸序列見表2。

表1 本研究所用的菌株和質粒Tab.1 Strains and plasmids used in this study

表2 本研究所用的引物Tab.2 Primers used in this study
1.1.2 培養基
LB 培養基:酵母粉0.5%,蛋白胨1%,NaCl0.1%,pH 7.0。
CYMG 培養基:胰蛋白胨0.8%,酵母粉0.4%,MgCl2·2H2O 0.4%,甘油5 mL/L。
M26 培養基:土豆淀粉0.8%,葡萄糖0.2%,蛋白胨0.2%,酵母提取物0.2%,CaCl2·2H2O 0.1%,微量元素液1 mL/L;pH 7.0。
VY/2 培 養 基 : 鮮 酵 母 0.5%, MgSO4·7H2O 0.4%,維生素B120.005%,CaCl2·2H2O 0.1%。
以上固體培養基均添加1.5%的瓊脂。
1.1.3 主要試劑和儀器
限制性DNA 內切酶、T4 DNA 聚合酶購自New England BioLabs 公司;PrimeSTAR Max DNA聚合酶、DNA Marker 購自Takara 公司;卡那霉素(kanamycin,km)、氯霉素(chloramphenicol,cm)購自上海生工生物工程有限公司;培養基組分購自北京索萊寶生物科技有限公司;分析純甲醇、無水乙醇、異丙醇購自國藥集團化學試劑有限公司;色譜級甲醇、乙腈購自Thermo Fisher 科技有限公司。
液質聯用儀型號為Thermo Fisher UltiMate3000與Bruker Amazon SL聯用;高效液相色譜儀型號為Agilent 1260;電轉儀型號為Eppendorf AG 4309;核磁共振波普儀型號為Agilent 500 MHz DD2;HPLC 制備所用色譜柱型號為Agilent ZORBAX SB-C18,9.4 mm×250 mm,5 μm;液質分析所用色譜柱為Thermo Scientific Acclaim RSLC 120 C18,2.1 mm×100 mm,2.2 μm。
1.2 BGC18 基因簇的直接克隆與異源表達
1.2.1S.cellulosumSo0157-2基因組提取
將-80 ℃保藏的S. cellulosumSo0157-2 接種到VY/2 平板上,30 ℃恒溫培養,待長出菌膜,轉接到表面濕潤的M26平板上。刮取M26平板培養5~7 d的菌落置于50 mL離心管中,水洗兩次,然后根據菌量加入適量的無菌水,渦旋混勻。吸取1.8 mL菌液分裝到2 mL EP 管中,12 000 r/min 離心1 min,棄上清。加入450 μL Tris-HCl(10 mmol/L,pH 8.0),吹打混勻。加入30 μL 20 mg/mL 蛋白酶K,顛倒混勻。加入40 μL 10%SDS(sodium laurylsulfonate)后,輕輕混勻。50 ℃水浴1~2 h,中間間斷顛倒直至溶液變澄清。加入500 μL 苯酚-氯仿-異戊醇(25∶24∶1),快速混勻,至溶液呈乳濁狀,13 800 r/min 離心15 min。用去尖的移液吸頭吸取300 μL 上清置于新的 2 mL EP 管中。加入 35 μL 3 mol/L NaAc(pH 7.5),混勻后,加入1.2 mL 無水乙醇,混勻。準備新的2 mL EP 管并加入1 mL 70%乙醇,用黃色吸頭將懸浮的DNA 挑至該EP管中。10 000 r/min 離心1 min。棄上清,倒置于吸水紙上并用吸水紙將管壁上的水吸掉。室溫干燥15~20 min。加入200 μL 雙蒸水(double-distilled H2O,ddH2O),放置4°C冰箱備用。
1.2.2S.cellulosumSo0157-2基因組酶切產物制備
將基因組DNA 利用限制性內切酶DraⅠ和HindⅢ酶切,釋放目標基因簇片段。取上述制備的基因組 DNA 200 μL,加入 40 μL 10×Cutsmart buffer、 12 μL 限 制 性 內 切 酶DraⅠ 和Hind Ⅲ 、1.5 μL RNase A,用ddH2O 補齊至 400 μL,37 ℃反應3 h。取10 μL 酶切產物跑瓊脂糖凝膠電泳進行檢測。檢測之后用等體積的苯酚-氯仿-異戊醇(25∶24∶1)抽提酶切產物除去蛋白,然后進行乙醇沉淀。
1.2.3 直接克隆載體的制備
以 BGC18-HAF 和 BGC18-HAR 為 PCR 引 物 ,以質粒p15A-cm-tetR-tetO-hyg-ccdB 為PCR 模板,進行PCR 擴增。取2 μL PCR 產物進行電泳檢測,確認正確后將剩余PCR產物切膠回收目的片段。
1.2.4 目的基因簇BGC18的直接克隆
直接克隆載體和酶切基因組產物在體外用T4 DNA Polymerase 退火:取 200 ng 克隆載體、2 μL 10×NEB Buffer 2.1、0.13 μL T4 DNA Polymerase 混勻后,輕輕加入12 μL 基因組酶切產物,再用ddH2O將酶切體系補足到20 μL。PCR反應程序為:25 ℃,60 min;75 ℃,20 min;50 ℃,30 min;4 ℃保溫。反應完成之后將產物室溫除鹽40 min。將上述除鹽后的產物電轉化到經L-Ara 誘導的感受態細胞E.coliGB05-dir/pSC101-BAD-ETgA 中。從LB 轉化平板上挑取單菌落,小量提取質粒,進行酶切分析。
1.2.5 目的基因簇BGC18的遺傳修飾
分別對質粒p15A-cm-BGC18 進行轉座元件和啟動子的插入。利用帶有同源臂的引物對ⅠR-Pkm-C18-ⅠR-HAF1/HAR1對質粒pR6K-oriT-TnpA-ⅠR-km進行擴增,得到oriT-ⅠR-PkmPCR產物,PCR產物通過切膠回收純化;隨后將回收的產物與質粒p15A-cm-BGC18 共同轉入E. coliGB05-red 感受態細胞中,使用合適的抗生素(km/cm)篩選重組子;重組質粒通過限制性內切酶ApaL Ⅰ進行酶切鑒定及測序鑒定。
1.2.6 目的基因簇BGC18異源表達
S.brevitaleaDSM 7029已作為異源宿主表達了多個黏細菌來源的基因簇,所以本研究中選擇野生型的S.brevitaleaDSM 7029 作為首選異源宿主。首 先 將 質 粒 p15A-oriT-TnpA-ⅠR-Pkm-BGC18 ( 約1 μg)電轉入野生型S.brevitaleaDSM 7029 中[24],通過含卡那霉素的CYMG 平板篩選重組子。分別利用detect-C18 in 7029-F1/R1,detect-C18 in 7029-F2/R2,detect-C18 in 7029-F3/R3,detect-C18 in 7029-F4/R4,detect-C18 in 7029-F5/R5五對引物對重組子進行菌落PCR鑒定。
1.2.7 菌株的發酵提取分離與LC-MS檢測
將正確的重組子接種于含有50 mL CYMG 培養基(km 3μg/mL)的300 mL 錐形瓶中,30 °C,180 r/min 培養過夜制備種子液。轉接50 μL 種子液于相同的培養基相同培養條件下培養2 d,然后每瓶加入1 mL經前處理的XAD16大孔樹脂,繼續恒溫搖床培養2 d。
將菌體和大孔樹脂通過100目篩進行分離,并用雙蒸水將樹脂洗滌3 次(盡量去除菌體)。將樹脂倒入新的干燥的錐形瓶中,加入50 mL 的甲醇,30°C,180 r/min浸泡1 h。通過濾紙過濾將樹脂和甲醇分離,并將甲醇組分減壓濃縮蒸干得到粗提物。加入1 mL 色譜甲醇或乙腈溶解粗提物,然后12 000 r/min,離心 10 min,取上清過 0.22 μm 微孔濾膜并轉移至HPLC 進樣管中,待HPLC-MS 進行質譜檢測。
液質檢測條件如下:液質分析色譜柱;流動相,A相為水+0.1%甲酸,B相為乙腈+0.1%甲酸;流速0.3 mL/min;進樣 3 μL;檢測波長 190~400 nm;洗脫程序0~3 min,5% B;3~18 min,5%~95%B;18~22 min,95% B;22~25 min,5% B。質譜檢測條件:電噴霧離子源,正離子模式,二級質譜AutoMS2,檢測范圍m/z70~2200。
1.2.8 氨基酸絕對構型的確定
采用Marfey 法將化合物1~3 分別進行酸水解, 水解產物分別與 L-FDAA (1-fluoro-2-4-dinitrophenyl-5-L-alanine amide) 或 D-FDAA 反應[35]。采用同樣的方法制備標準品N-Me-L-Leu 與L/D-FDAA 的衍生產物,L/D-Val、L/D-Leu、L/D-Ⅰle、L/D-allo-Ⅰle 與 L-FDAA 的衍生物,隨后進行LC-MS 分析。N-Me-L-Leu、L/D-Val 與 L/D-FDAA的衍生產物的分析條件與1.2.7液質檢測條件一致,檢測波長 330 nm。L/D-Leu、L/D-Ⅰle、L/D-allo-Ⅰle的衍生產物洗脫程序為0~45 min,5%~50% B。對應衍生物的參照分子量為[M+H]+m/z398(N-Me-L-Leu)、370(L/D-Val)、384(L/D-Leu,L/D-Ⅰle,L/D-allo-Ⅰle)。
2 結果和分析
2.1 S.cellulosum So0157-2生物信息學分析
通過antiSMASH 分析,S.cellulosumSo0157-2基因組(NCBⅠ數據庫登錄號:CP003969.1)共包含35 個BGCs(表3),編碼聚酮(PKS)、非核糖體 肽 (NRPS)、 PKS-NRPS 雜 合 以 及 萜 類(terpene)等多種結構類型化合物。除了已知的epothilone[8]及另外兩個萜類生物合成基因簇geosmin[40]和 eremophilene[41]之外,其余基因簇與目前已知的生物合成基因簇都存在著較大的不同,相似度較低,這預示著該菌株仍具有較大的代謝潛能。PKS-NRPS雜合的化合物通常具有新穎的結構以及廣泛的生物活性[42],因此優先選取該類型基因簇進行激活。BGC18 預測為PKS-NRPS雜合基因簇,長度約為26.7 kb(圖1)。核心基因(SCE1572_24725)包含3 個模塊共有10 個結構域(C1-A1-T1,C2-A2-MT-T2,KS-AT-TE)(圖 1)。其中A1(adenylation)被預測可能識別纈氨酸/丙氨酸/甘氨酸/亮氨酸/異亮氨酸(Val/Ala/Gly/Leu/Ⅰle),A2被預測可能識別亮氨酸,然后被N-甲基化形成N-甲基亮氨酸(N-Me-Leu),AT(acyltransferase)則可能識別丙二酰輔酶A(Malonyl-CoA),但是缺少PKS 所必需的硫醇化(thiolation,T)結構域,這些底物能否通過NRPS和PKS的延伸單元被依次加載、縮合,形成的終產物最后被硫酯酶(TE)結構域釋放是一個值得研究的問題。
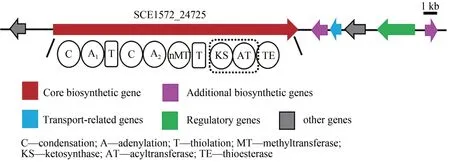
圖1 BGC18基因簇結構Fig.1 Organization of the biosynthetic gene cluster BGC18

表3 antiSMASH 預測So0157-2基因組編碼的生物合成基因簇Tab.3 Biosynthetic gene clusters in the genome of so0157-2 predicted by antiSMASH
2.2 BGC18 的直接克隆、改造、異源表達
利用DraⅠ和Hind Ⅲ酶切基因組,釋放出27 kb 的完整BGC18,將酶切后的基因組回收備用。然后PCR擴增1.79 kb的直接克隆載體p15A-cm,得到的片段兩端各帶有72 bp 的同源臂。參照ExoCET 的方法[22],對基因簇進行克隆(圖 2)。復蘇后的菌體涂布含氯霉素的LB 篩選平板,過夜培養后挑取24 個轉化子,用MscⅠ酶切鑒定(圖3),將其中4 個所有酶切條帶均正確的質粒,對它們的同源臂部分進行測序,測序正確的命名為p15A-cm-BGC18。為了讓質粒p15A-cm-BGC18能在異源宿主中成功表達,需要插入轉座元件oriT-tnpA-ⅠR 將基因簇通過轉座的方式整合至異源宿主的基因組上。此外,來源于黏細菌的啟動子在DSM 7029中可能無法正常工作,所以將BGC18的結構基因的啟動子替換成異源宿主中可以工作的組成型啟動子Tn5-kan(Pkm)。用帶有50 bp 同源臂的引物對pR6K-oriT-TnpA-ⅠR-km 進行擴增,得到oriT-TnpA-ⅠR-km 片段,將這個片段與p15A-cm-BGC18 發生線環重組(LCHR),挑選7 個轉化子進行酶切分析和同源臂部分測序,成功獲得重組質粒p15A-oriT-ⅠR-Pkm-BGC18(圖3)。
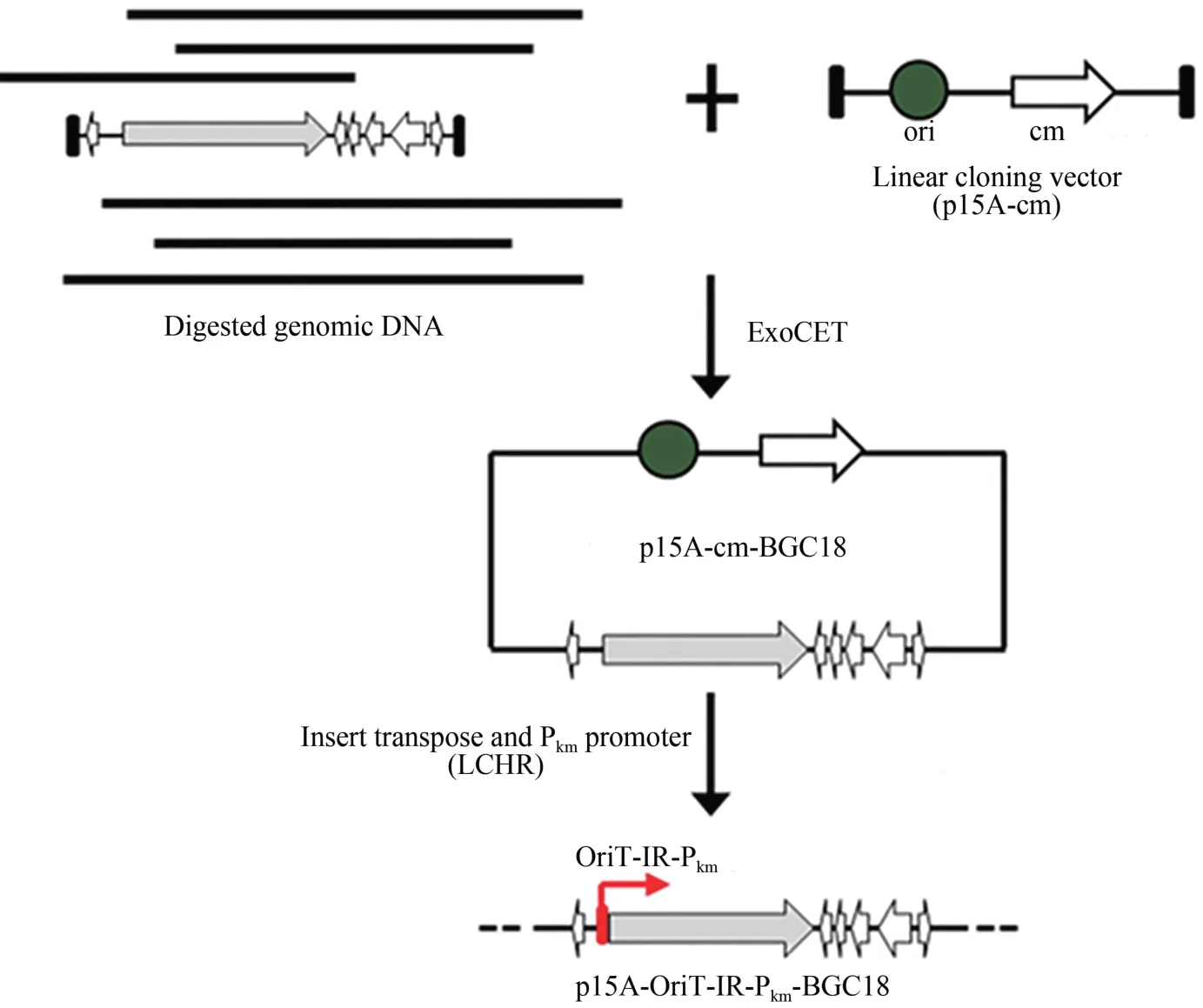
圖2 基因簇BGC18的直接克隆與遺傳修飾Fig.2 Direct cloning and modification of BGC18

圖3 重組質粒 p15A-cm-BGC18(a)和p15A-OriT-ⅠR-Pkm-BGC18(b)分別以MscⅠ和 ApaLⅠ酶切鑒定(紅色方框代表酶切條帶正確)Fig.3 a:Restriction analysis of the recombinant plasmids p15A-cm-BGC18 by MscⅠ(a)and p15A-OriT-ⅠR-Pkm-BGC18 by ApaLⅠ(b)(Red box indicates right recombinant plasmids)
將質粒 p15A-oriT-ⅠR-Pkm-BGC18 電轉入野生型的S. brevitaleaDSM 7029 中,從含卡那霉素的CYMG 平板上挑取重組子進行菌落PCR 鑒定,挑選3 個正確的重組子(DSM7029:Pkm-BGC18)進行發酵檢測,并以野生型DSM 7029 作為陰性對照。利用HPLC-MS 對發酵結果進行分析。HPLCMS結果顯示,所有帶有BGC18的突變體均產生了兩個顯著的化合物峰m/z227[M+H]+、241[M+H]+,且這些峰在陰性對照中未發現,推測是BGC18 在DSM 7029中表達的產物(圖4)。
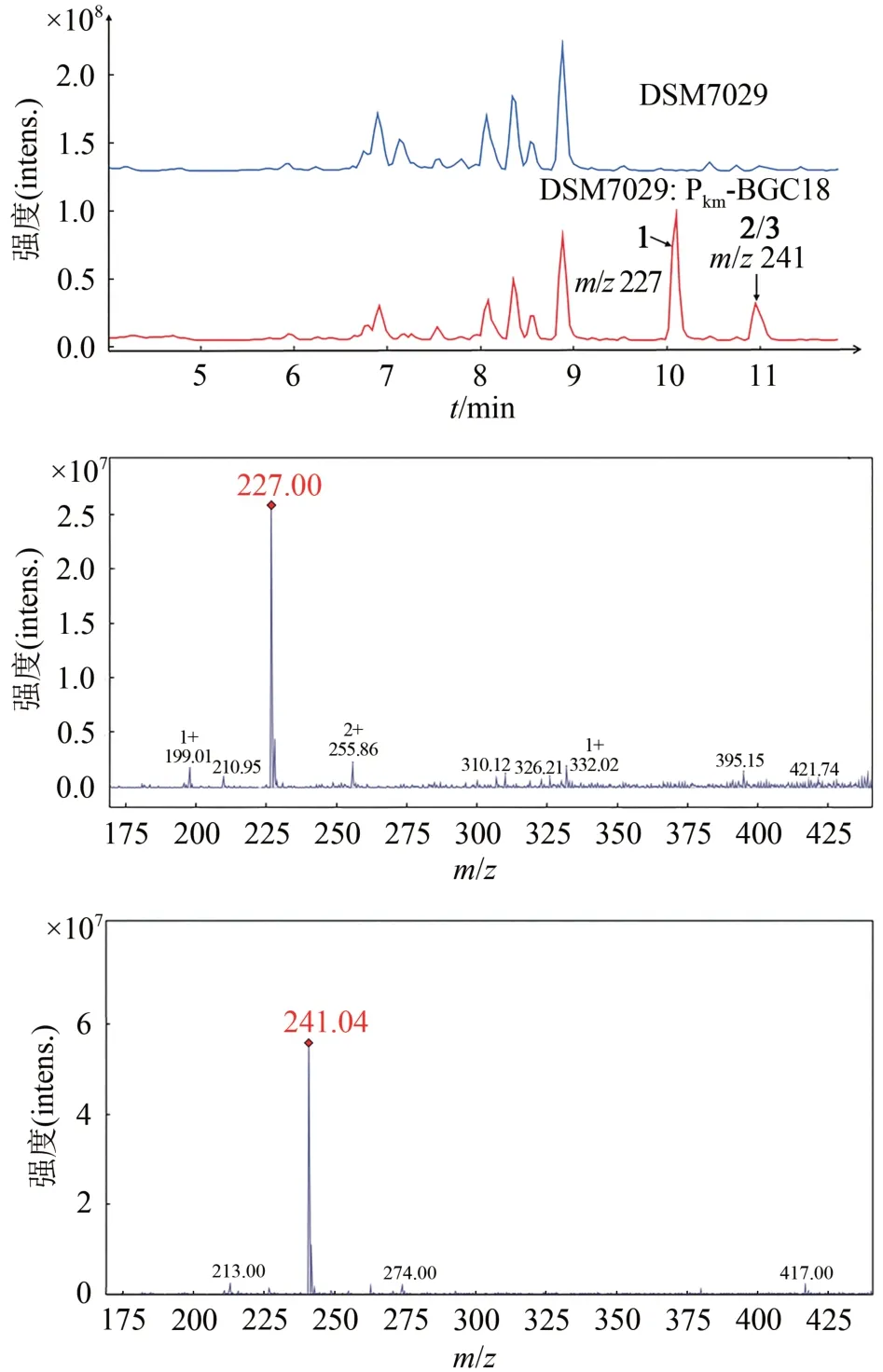
圖4 BGC18在S.brevitalea DSM 7029中的異源表達產物LC-MS分析(BPC+:m/z 200~300)Fig.4 LC-MS analysis for the heterologous products of BGC18 expressed in S.brevitalea DSM 7029
2.3 產物的分離純化
將突變菌株DSM7029:Pkm-BGC18采用CYMG培養基批量發酵10 L,大孔樹脂XAD-16 吸附目標化合物,然后用甲醇提取發酵粗提物。發酵粗提物首先經過正相硅膠柱色譜分離,干法上樣,以CH2Cl2-MeOH為流動相,梯度洗脫(100∶1、50∶1、30∶1、20∶1、10∶1),得到 5 個分組分 Fr1~Fr5。液質檢測將含有目標化合物的組分Fr3 繼續通過反相中壓液相色譜制備,水和甲醇為流動相,梯度洗脫。最終通過HPLC 制備,30%乙腈水溶液恒梯度洗脫得到化合物1(33 mg),40%乙腈水溶液恒梯度洗脫得到化合物2(7 mg)和化合物3(4 mg)。
2.4 化合物1-3 結構鑒定
化合物1 為白色固體,陽離子質譜ESⅠMS 在m/z227.0 處給出[M+H]+分子離子峰,結合化合物的一維1H 譜、13C 譜(表4)可以得到化合物分子式為C12H12O2N2。分析13C NMR,DEPT 譜發現,化合物 1 具有 2 個酰胺羰基(δC167.6,165.1);4個次甲基(δC60.1,59.2,32.6,25.1);1個亞甲基 (δC42.7);5 個甲基 (δC32.1,23.1,21.8,19.2,18.0)其中1 個與氮相連;進一步通過HMBC二維核磁數據確定化合物1的結構與已知有機 合 成 中 間 體 Cyclo (N-Me-L-Leu-L-Val) 相同[43-44](圖5),但是其核磁數據未見報道,因此對其核磁數據H和C譜進行了解析與指認(表4)。
化合物2 和3 均為白色固體,陽離子質譜ESⅠMS 在m/z241.0 處給出[M+H]+分子離子峰,提示化合物分子式為C13H24O2N2比1 多一個CH2。與化合物1 的氫譜數據比較發現(表4),化合物2中的兩個氨基酸均為亮氨酸(Leu)。進一步查閱文獻發現化合物2 為已知有機合成中間體Cyclo(N-Me-L-Leu-L-Leu)(圖 5)[45]。化合物 3 與化合物2 的氫譜數據非常類似,除了一個二重峰(d)的甲基變成了三重峰(t)的甲基(δH0.84)以及一個與氮相連的CH 信號由dt 峰變為dd 峰(δH3.61),這就表明化合物3中的氨基酸為Ⅰle,為新化合物(圖5)。采用Marfey 法對氨基酸的絕對構型進行了確定,4 種氨基酸(N-Me-Leu、Val、Leu、Ⅰle)均為L構型(表5)。

表5 化合物1~3氨基酸與marfey試劑衍生產物的保留時間Tab.5 Retention time of amino acids derivatized with Marfey's reagent
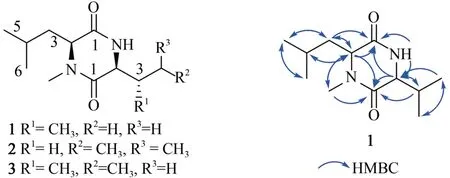
圖5 化合物1~3的結構式及化合物1的HMBC相關信號Fig.5 Structures of 1~3 and HMBC correlations of 1
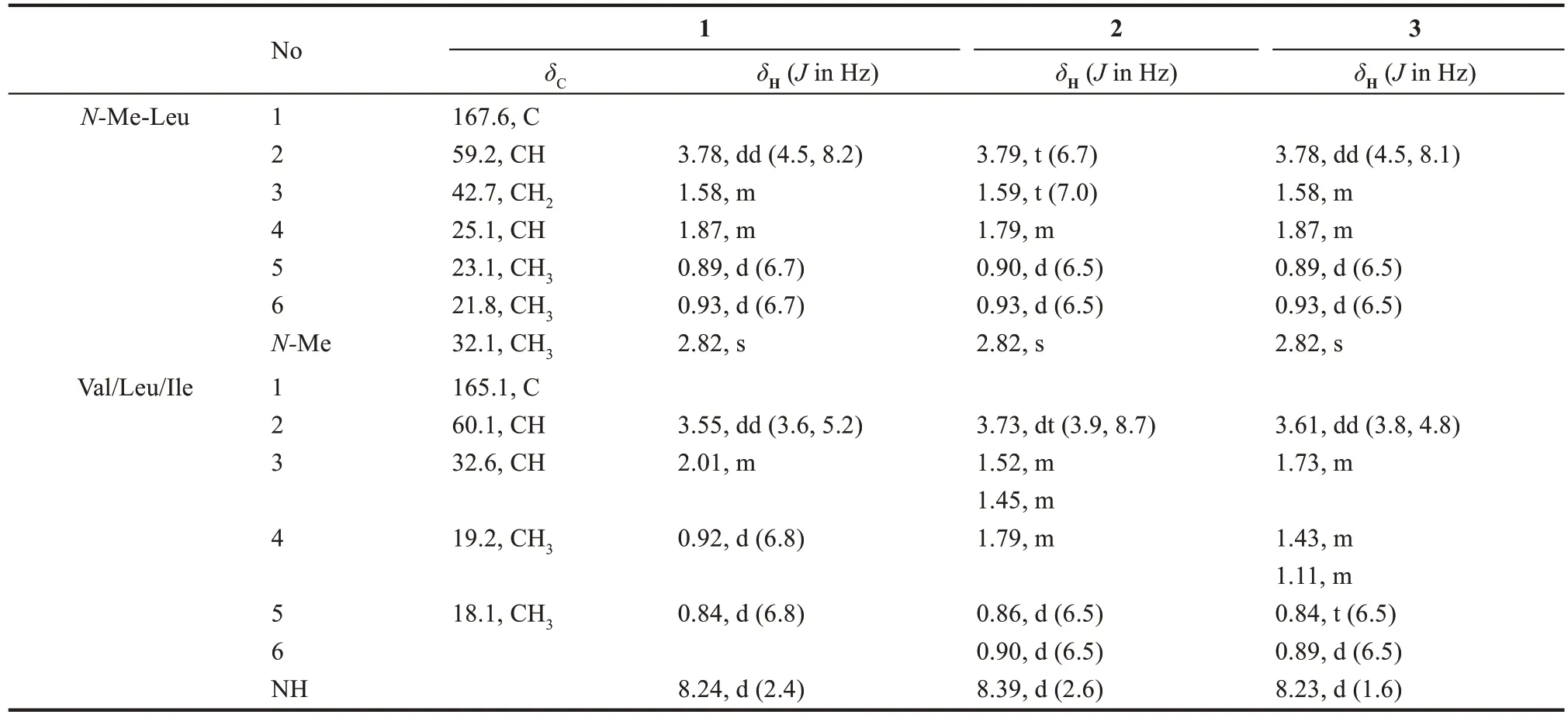
表4 化合物1~3的NMR核磁數據Tab.4 1H(500 MHz)and13C(125 MHz)data of 1~3 in DMSO-d6
2.5 化合物1~3 的生物合成途徑分析
根據化合物的結構及其生物合成基因簇的生信分析,對化合物1~3 的生物合成途徑進行了推測 (圖 6)。A1結構域可識別 L 型的 Val/Leu/Ⅰle。A2結構域可識別的L-Leu,然后經過N-甲基轉移酶甲基化修飾后形成N-Me-Leu。兩部分經過縮合與TE 介導的環化,最終形成化合物1~3 的完整結構。盡管該基因簇含有PKS 模塊,推測可能因為缺少PKS 所必需的T 結構域導致PKS 模塊被跳過,從而只獲得了NRPS 指導合成的環二肽產物1~3。
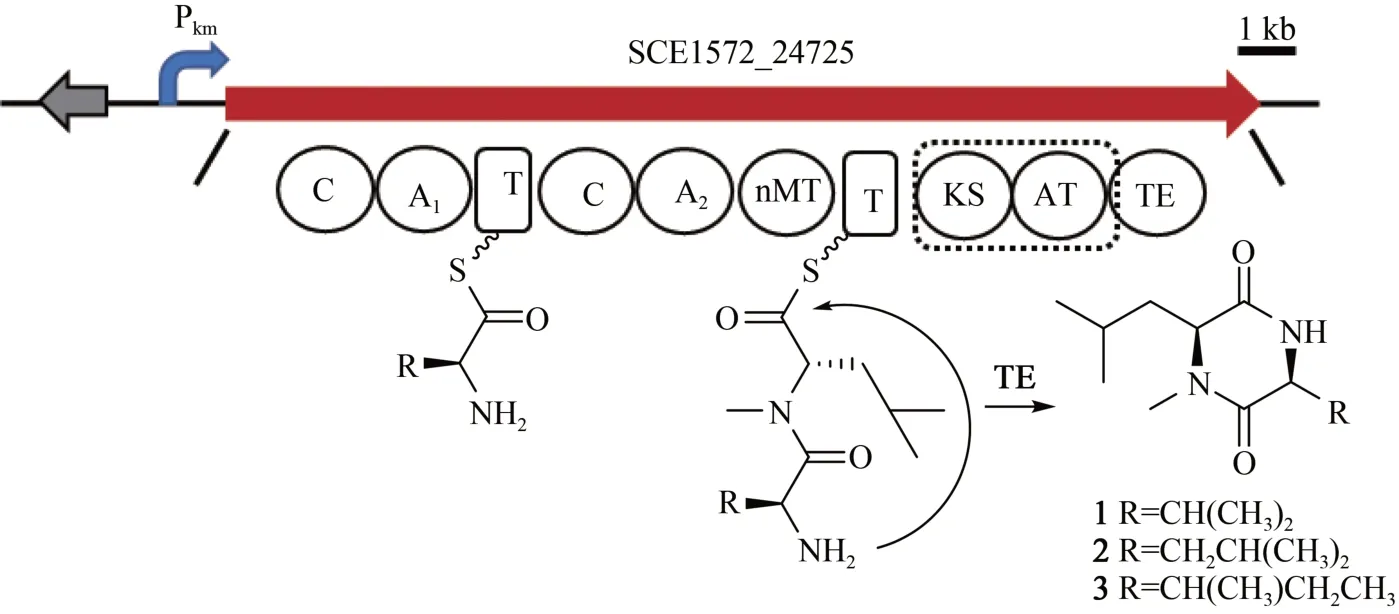
圖6 化合物1~3生物合成途徑推測Fig.6 Proposed biosynthetic pathway of 1~3
2.6 化合物1~3 的抗菌活性測試
本研究采用96孔板二倍稀釋法[35]測定了化合物1~3 對下列指示菌株(E. coliATCC 35218、P.aeruginosaATCC 27853、Staphylococcus aureusATCC 29213、Bacillus subtilisATCC 6633、Helicobacter pyloriG27、H.pylori159、Enterococcus faecalisATCC 19434、Mycobacterium smegmatisATCC 607、Candida albicansSC5314)的抗菌活性,結果顯示化合物1~3 對所測菌株均無抑制作用(MⅠC>32 μg/mL)。
3 結 論
基因組信息分析表明,纖維堆囊菌So0157-2基因組中含有豐富的未知功能的基因簇,特別是含有大量通常具有良好生物活性的PKS、NRPS 或兩者雜合的基因簇,預示著該菌株仍具有產生新穎天然產物的潛力。BGC18 即為該菌基因組中預測的一個NRPS-PKS 雜合的基因簇,大小約為26.7 kb。該基因簇中NRPS 模塊的核心基因預測含有兩個A 結構域,其中A2結構域被預測具有底物的專一性,而A1結構域對底物的識別具有寬泛性,因此該基因簇可能合成結構多樣的二酮哌嗪類化合物。此外,該基因簇PKS模塊缺少T結構域,這些底物能否通過NRPS和PKS的延伸單元被依次加載、縮合,形成的終產物最后被TE 結構域釋放值得深入研究。然而,由于該菌株較難培養且自身未建立遺傳操作體系,因此將該生物合成基因簇轉移到合適的異源宿主中,利用異源表達策略是激活該生物合成基因簇挖掘其次級代謝產物的一個有效途徑。異源表達成功的關鍵主要涉及基因簇的克隆與遺傳修飾以及異源宿主的合理選擇。本課題組已經建立了以Red/ET DNA 同源重組技術為核心的生物合成基因簇直接克隆與遺傳修飾技術平臺,為天然產物的挖掘提供了技術支撐[21-28]。基因簇在異源表達時,存在著密碼子偏好性的影響。選擇異源宿主時,首先考慮與原始生產菌在進化地位上親緣關系相近的菌。本文中所選用的異源宿主S. brevitaleaDSM 7029 與纖維對囊菌So0157-2 均為變形菌門,GC 含量相似,分別為68%和72%[8,39]。前期,本課題組將纖維堆囊菌來源的埃博霉素成功地在該異源宿主S. brevitaleaDSM 7029 中進行了表達,說明兩株菌的密碼子有一定的兼容性[36]。此外,通過啟動子工程改造以及額外補充稀有密碼子的tRNA 或者進行密碼子優化等也可以提高異源表達的概率[36-37]。
因此,本研究成功構建了纖維堆囊菌So0157-2中基因簇的直接克隆與遺傳修飾體系,并將一個NRPS-PKS 雜合的基因簇BGC18 轉入異源宿主S.brevitaleaDSM 7029中實現了該基因簇的功能性表達,成功獲得了3個對應的代謝產物。通過正相硅膠柱色譜和HPLC 分離純化,以及MS、NMR 解析了化合物的結構。SciFinder 數據庫檢索證實化合物1 和2 僅作為有機合成中間體被報道,為新天然產物,而化合物3為新化合物。BGC18為NRPSPKS 雜合基因簇,從結構上看,化合物1~3 為二酮哌嗪類化合物,其所含氨基酸與生物信息學預測一致,但是并未見PKS 單元。仔細分析PKS 相關基因發現該基因簇缺少硫醇化結構域,推測導致PKS不能有效組裝。化合物1~3結構上差別主要為第1 個氨基酸的不同(1 Val, 2 Leu, 3 Ⅰle),這是由于第1 個腺苷化結構域(A domain)對底物識別的非特異性所導致的。由A 結構域對底物識別的寬泛性導致的結構多樣性也在我們前期分離獲得的多個脂肽類化合物得到證實[46-47]。基于Red/ET 重組工程技術的纖維堆囊菌So0157-2 隱性基因簇的直接克隆、修飾和異源表達體系的建立,不僅有助于進一步了解該菌的生物合成潛力,而且能夠發現新穎的天然產物用于藥物篩選評價。
致謝:本工作得到國家重點研發計劃(2019YFA0905 700);國家自然科學基金(32070060,31670098);山東省自然科學基金(ZR2020QH345,ZR2019JQ11)的支持。

