miR-196a/LRIG3在結直腸癌組織中的表達及對HCT116細胞增殖、侵襲的影響
任 松,劉雯菲,尚錦秀
全球每年有超過60萬人死于結直腸癌(CRC),CRC的高病死率與腫瘤轉移特別是肝轉移密切相關。據報道,近25%的CRC患者初診時存在轉移,其中約50%最終會發生轉移[1]。為改善CRC患者的總體生存期,迫切需要在轉移性CRC中尋找新的生物學標志物并及時給予干預措施。微小RNA(miRNA)通過與信使RNA(mRNA)的3-URT區結合,誘導mRNA降解或抑制轉錄后翻譯,其表達改變或功能障礙在腫瘤發生和轉移過程中發揮關鍵作用[2]。miR-4775是CRC轉移的危險因素,通過激活轉化生長因子-β1(TGF-β1)/Smad7信號級聯反應促進CRC細胞的侵襲和轉移[3]。值得注意的是,CRC組織中miR-196a水平顯著高于鄰近正常結直腸黏膜,與CRC患者淋巴結轉移和不良預后有關[4]。同時,miR-196a可以促進結腸癌細胞的增殖、遷移和侵襲[5]。上述研究表明,miR-196a參與了CRC的病理過程,但其在CRC中的調控機制還有待進一步闡明。富含亮氨酸重復序列和免疫球蛋白樣結構域3(LRIG3)的染色體位于12q13.2區域,該區域是許多腫瘤最常見的基因缺失位點。研究表明,LRIG3基因在多種惡性腫瘤中低表達,但在CRC中的研究較少[6]。本研究通過檢測miR-196a在CRC組織中的表達,評估其對HCT116細胞增殖和侵襲的影響。
1 材料與方法
1.1主要試劑與儀器 HCT116細胞(中國科學院典型培養物保藏委員會細胞庫);RPMI-1640培養基和胎牛血清(浙江天杭生物科技有限公司);Lipofectamine2000轉染試劑盒、miR-196a inhibitor和miRNA陰性對照(miR-NC)(上海吉凱生物公司);Trizol試劑盒(美國Qiagen公司);mRNA逆轉錄試劑盒和熒光定量PCR試劑盒(美國Promega公司);四噻唑藍(MTT,美國Amresco公司);細胞蛋白抽提試劑盒(碧云天生物技術研究所);LRIG3、E-鈣黏蛋白(E-cadherin)、N-鈣黏蛋白(N-cadherin)和β-actin抗體(美國Santa Cruz公司);HRP標記山羊抗小鼠IgG二抗(武漢艾美捷科技有限公司)。
1.2組織來源 選取2019年1月—2020年12月在我院結直腸外科手術切除的原發性CRC患者42例,取癌組織和癌旁正常組織標本。
1.3實時熒光定量RT-PCR檢測組織中miR-196a和LRIG3 mRNA的表達 取CRC組織,研碎后加入Trizol提取總RNA,將提取的總RNA逆轉錄為cDNA后在CFX-96 PCR擴增儀中擴增,反應體系20 μl,反應條件為預變性95 ℃ 30 s、95 ℃ 5 s,擴增60 ℃ 44 s、40個循環,以U6作為內參,采用2-ΔΔCt法計算miR-196a和LRIG3 mRNA的相對表達量。
1.4細胞培養及轉染 用含10%胎牛血清的RPMI-1640培養基培養HCT116細胞,選取對數生長期細胞進行轉染。實驗分為空白對照組、miR-196a inhibitor組和miR-NC組。空白對照組在鋪板后48 h收獲細胞,miR-196a inhibitor組和miR-NC組分別按Lipofectamine2000說明書將miR-196a inhibitor和miR-NC轉染到HCT116細胞,48 h后行相關檢測。
1.5MTT法檢測HCT116細胞增殖率 按照“1.4”方法轉染后接種于96孔板中,44 h后加入MTT(50 μl/孔)繼續培養4 h,加入二甲基亞砜(200 μl/孔)振蕩,測定吸光度(OD)值,計算細胞增殖率。細胞增殖率=(miR-196a inhibitor組OD值-miR-NC組OD值)/空白對照組。
1.6Transwell法檢測HCT116細胞侵襲能力 按照“1.4”方法轉染后接種于Transwell小室中,下室加入含10%胎牛血清的RPMI-1640培養基,48 h后取出小室,去除上室內細胞,4%甲醛固定10 min后用結晶紫染液染色30 min,沖洗干凈后在顯微鏡下計數紫色染色的穿膜細胞。
1.7Western blot法檢測HCT116細胞中LRIG3、E-cadherin和N-cadherin蛋白表達 按照“1.4”方法轉染后接種于6孔板中,48 h后收獲細胞,加入細胞蛋白抽提液提取蛋白,采用BIO-RAD系統進行十二烷基硫酸鈉聚丙烯酰胺凝膠電泳,切膠、轉膜、封膜后將膜與LRIG3(1︰300)、E-cadherin(1︰200)、N-cadherin(1︰200)和β-actin抗體(1︰500)進行孵育,4 ℃過夜,用HRP標記山羊抗小鼠IgG二抗(1︰5000)在室溫下孵育30 min,顯色,采集圖像分析。
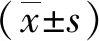
2 結果
2.1miR-196a和LRIG3 mRNA在CRC組織中的表達及相關性 癌組織miR-196a mRNA的相對表達量高于癌旁正常組織[(1.05±0.27)vs(0.64±0.09)](P<0.05);癌組織LRIG3 mRNA的相對表達量低于癌旁正常組織[(0.88±0.13)vs(1.37±0.20)](P<0.05)。癌組織中miR-196a和LRIG3 mRNA水平與TNM分期、腫瘤分化程度、腫瘤浸潤深度和腫瘤轉移相關(P<0.05,P<0.01)。見表1。Pearson相關分析顯示,miR-196a和LRIG3 mRNA在CRC組織中的表達呈負相關(r=-0.442,P=0.013)。見圖1。

表1 miR-196a和LRIG3 mRNA在不同臨床病理特征結直腸癌組織中的表達

圖1 42例結直腸癌組織中miR-196a和LRIG3 mRNA表達的相關性
2.2miR-196a靶向結合LRIG3 mRNA情況 為預測miR-196a的潛在靶點,本研究通過生物信息學網站(www.Targetscan.org)尋找miR-196a的潛在作用靶點,發現miR-196a與LRIG3有潛在的結合位點。見圖2。

圖2 Targetscan軟件預測miR-196a與LRIG3 mRNA的互補配對系列
2.3miR-196a對HCT116細胞增殖和侵襲的影響 與空白對照組比較,miR-196a inhibitor組HCT116細胞增殖率和侵襲細胞數降低;與miR-196a inhibitor組比較,miR-NC組HCT116細胞增殖率和侵襲細胞數增加(P<0.05)。見表2、圖3~4。

表2 miR-196a對HCT116細胞增殖和侵襲的影響

圖3 miR-196a對HCT116細胞增殖的影響(MTT染色×100)A.空白對照組,B.miR-196a inhibitor組,C.miR-NC組

圖4 miR-196a對HCT116細胞侵襲的影響(結晶紫染色×100)A.空白對照組,B.miR-196a inhibitor組,C.miR-NC組
2.4miR-196a對HCT116細胞中LRIG3、E-cadherin和N-cadherin蛋白表達的影響 與空白對照組比較,miR-196a inhibitor組HCT116細胞中LRIG3和N-cadherin蛋白表達增加,E-cadherin蛋白表達降低(P<0.05);與miR-196a inhibitor組比較,miR-NC組HCT116細胞中LRIG3和N-cadherin蛋白表達降低,E-cadherin蛋白表達增加(P<0.05)。見表3、圖5。

表3 miR-196a對HCT116細胞中LRIG3、E-cadherin和N-cadherin蛋白表達的影響

圖5 miR-196a對HCT116細胞中LRIG3、E-cadherin和N-cadherin蛋白表達的影響A.空白對照組,B.miR-196a inhibitor組,C.miR-NC組;E-cadherin為E-鈣黏蛋白,N-cadherin為N-鈣黏蛋白
3 討論
研究顯示,超過50%的miRNA位于腫瘤相關基因組區域或易碎部位,對癌癥的發生和發展發揮重要調控作用[7]。miR-196a最初被鑒定為一種直接靶向膜聯蛋白A1,是可促進食管癌細胞增殖和抑制細胞凋亡的致癌miRNA[8]。進一步研究發現,miR-196a在口腔癌、宮頸癌、非小細胞肺癌等多種癌癥組織中均有異常表達,其表達水平與癌癥進展相關[9]。一項臨床研究表明,miR-196a在CRC細胞中表達上調,并且通過增強CRC細胞的侵襲及對鉑衍生物的敏感性而發揮促癌作用,同時其過表達加大了體內CRC的肺轉移風險[10]。上皮間質轉化(EMT)是一個可逆過程,在包括CRC在內的多種癌癥轉移過程中起重要作用。在此過程中,細胞會促進E-cadherin蛋白表達并抑制間質蛋白表達,使細胞間失去黏附性,獲得遷移和侵襲能力[11]。但miR-196a在CRC轉移過程中的明確調控機制尚不清楚。本研究結果顯示,miR-196a在CRC組織中表達上調,且與TNM分期、腫瘤分化程度、腫瘤浸潤深度和腫瘤轉移相關,同時通過基因轉染技術降低miR-196a表達后,靶向LRIG3調控EMT過程,最終抑制HCT116細胞增殖和侵襲。表明miR-196a參與了CRC的發生發展過程。
miRNA的關鍵作用是通過與靶基因3-URT的互補,對mRNA分解和(或)抑制翻譯來調節靶基因表達[12]。本研究顯示,miR-196a與LRIG3有潛在的結合位點。有研究通過雙熒光素酶實驗發現,miR-196a顯著降低野生型LRIG3質粒熒光素酶活性,具有直接靶向作用[13]。同時,miR-196a過表達后可顯著降低宮頸癌Hela細胞中LRIG3蛋白表達,并當miR-196a抑制劑組細胞再次轉染si-LRIG3時,發現LRIG3阻斷了miR-196a對宮頸癌細胞的促進作用[14]。本研究結果也顯示,CRC組織中miR-196a和LRIG3 mRNA表達呈負相關。這些研究進一步證實了LRIG3是miR-196a的作用靶點。LRIG3在多種腫瘤中低表達,并與神經膠質瘤、膀胱癌和宮頸癌轉移有關[15]。更重要的是,靶向LRIG3小分子抑制劑已顯示出較好的抗腫瘤活性[16]。
綜上,CRC組織中miR-196a表達升高,LRIG3表達降低,miR-196a表達下調導致其靶標LRIG3表達上調,進而抑制HCT116細胞增殖和侵襲。

