栽培基質EC和pH測定值的影響因素分析
夏國棟,羅石磊,頡建民,郁繼華
(甘肅農業大學園藝學院,甘肅 蘭州 730070)
電導率(electrical conductivity,EC)指溶液導電的能力,也稱為土壤電導率,是測定土壤水溶性鹽的指標,其單位通常用mS/cm和μS/cm表示.EC過高或過低都會阻礙作物的生長,不同植物根據需肥特性與生長階段的不同,適宜的EC值不同.一般情況下,在同一區域EC值越高,鹽分就越高[1].灌溉水中有很多可溶性鹽,高濃度的可溶性鹽類會使植物受到損傷或造成植株根系的死亡.EC值過高,可能會形成反滲透壓,將根系中的水分置換出來,使根尖變褐或者干枯[2].基質濕度的波動會使可溶性鹽含量過高的問題進一步惡化,造成植株根系損傷嚴重,無法吸收水分和營養,導致植株出現萎蔫、黃化、組織壞死或植株矮小等癥狀[3].EC值過高也會增大由綿腐病菌引起的根腐病的發生機率[4].pH是衡量酸堿強弱的指標,主要由氫離子和氫氧根離子在溶液中的濃度決定.土壤pH值在6.5以下為酸性土壤,6.5~7.5之間的為中性土壤,7.5以上為堿性土壤.固體基質栽培是一種常見的無土栽培方式,栽培管理簡單,容易操作.基質中的水分、養分、氧氣、溫度、EC和pH等對作物的生長至關重要.基質EC和pH的大小能反應基質中的鹽離子濃度和酸堿度的高低.設施蔬菜栽培的環境相對密閉,其可溶性鹽含量和酸堿度受灌溉影響較大,容易引起基質表層鹽分積累和酸堿度的升高.目前,EC和pH值的測定方法有很多,但沒有統一的標準,尤其是基質的EC和pH值的測定,大都借鑒土壤測定的方法,無統一的測定標準.
本研究選用石英砂和含有機物較多的草炭、腐殖酸煤、椰糠、草炭為試材,通過測定不同干燥處理、不同浸提比、不同粒徑、不同震蕩時間和不同水質下的EC和pH,研究影響基質EC和pH的因素為測定栽培基質EC和pH值提供科學依據.
1 材料與方法
1.1 材料與儀器
試驗選取石英砂、草炭、腐殖酸煤、椰糠和發酵牛糞等5種基質,參照高峰等[5]黃瓜育苗基質配比,按體積比復配配方D,并以無機物石英砂做配方A,含有機物較多的草炭和腐殖酸煤做配方B和配方C,詳情見表1.
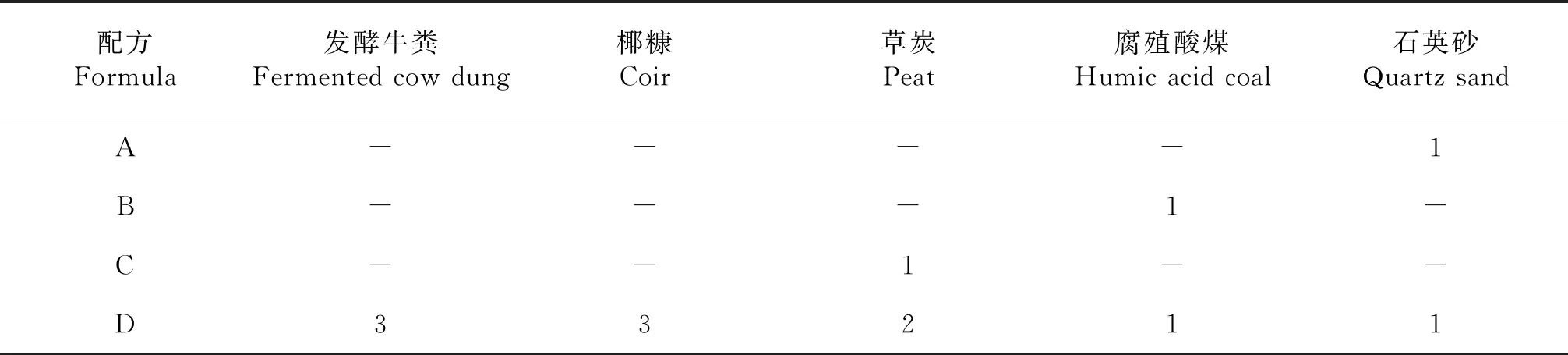
表1 不同基質配方
pH測定采用HI8314型pH計;EC測定采用DDS-307A型電導率儀(上海儀電科學儀器股份有限公司).
1.2 不同干燥處理下栽培基質EC和pH的測定
設鮮樣(不作任何處理樣)、風干樣(于陰涼通風處風干至恒質量)、烘干樣(于110 ℃烘箱內烘干至恒質量)3`種處理.將3種方法處理的樣品各稱取10 g,按照m基質∶m超純水=1∶5的比例,加入50 mL超純水,在搖床上振蕩30 min,過濾后得到浸提液,每個處理重復9次,測定EC和pH值.
1.3 不同質量比浸提下栽培基質EC和pH的測定
稱取風干樣10 g,按照m基質∶m超純水=1∶5和1∶10兩種不同比例混合,在搖床上振蕩30 min,過濾后得到浸提液,每處理重復9次,測定EC和pH值.
1.4 不同粒徑大小下栽培基質EC和pH的測定值
本試驗參照高峰等[5]的方法(m基質∶m超純水=1∶5浸提法).將風干樣分別用0.5、1和2 mm的篩子過篩,篩出粒徑≤0.5 mm、0.5~1 mm和1~2 mm的栽培基質,稱取上述3種不同粒徑大小的基質各10 g,按照m基質∶m超純水=1∶5配制浸提液60 mL,在搖床上振蕩30 min后,過濾得到濾液,每處理重復9次,測定其EC和pH值.
1.5 不同振蕩時間下栽培基質EC和pH的測定值
稱取風干樣10 g,按照m基質∶m超純水=1∶5配制浸提液60 mL,分別在搖床上振蕩10、20、30 min,過濾后得到澄清液,每個處理重復9次,最后測定其EC和pH值.
1.6 不同水質浸提下栽培基質EC和pH的測定
稱取風干樣10 g,按照m基質∶m超純水=1∶5分別加入自來水和超純水,配制浸提液60 mL,在搖床上振蕩30 min,過濾后得到澄清液,每個處理重復9次,測定EC和pH值.
1.7 數據分析
試驗數據采用Excel 2010處理,用SPSS 19.0軟件進行統計分析,用Duncan法進行顯著性分析.
2 結果與分析
2.1 不同干燥處理對栽培基質EC和pH測定值的影響
由表2可知,除配方A栽培基質的烘干樣、風干樣和鮮樣所測EC值之間無差異外,其余3種配比栽培基質的風干樣品和鮮樣品的EC值之間均差異顯著,配方B、C、D所測風干樣品的EC值均大于鮮樣的EC值,分別比鮮樣的EC值高27.67%、16.00%、14.31%;烘干樣品和風干樣品的EC值均差異顯著,配方B、C、D所測烘干樣品的EC值均大于風干樣品的EC值,分別比風干樣品的EC值高16.93%、17.46%和5.43%.配方A 3種樣品所測pH值無差異,配方B、C、D烘干樣和鮮樣所測pH值差異顯著.
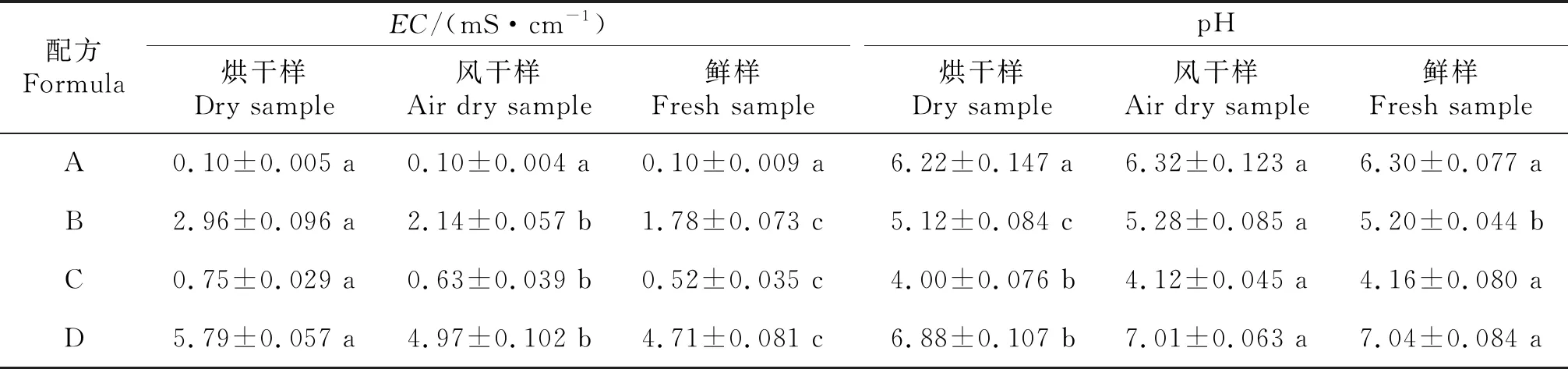
表2 不同干燥處理對栽培基質EC和pH測定值的影響
2.2 不同質量比浸提對栽培基質EC和pH測定值的影響
由表3可知,各配方按照浸提液質量比1∶5和1∶10所測EC值差異顯著,質量比為1∶5所測得EC值顯著高于1∶10,分別高出90.00%、36.44%、44.44%和23.13%.各配方按不同質量比浸提所測pH值之間無差異.

表3 不同質量比浸提對栽培基質EC和pH測定值的影響
2.3 不同粒徑大小對栽培基質EC和pH測定值的影響
由表4可知,由于配方B腐殖酸煤為粉末狀,無法過篩.配方A在不同粒徑下所測EC值無差異,配方C和配方D均在粒徑≤ 0.5 mm時所測得EC值最大,在粒徑1~2 mm測得EC值最小.配方A和配方D所測pH值不同粒徑間差異不顯著,配方C在粒徑 0.5~1 mm和1~2 mm間無差異,與粒徑≤ 0.5 mm差異顯著.

表4 不同粒徑大小對栽培基質EC和pH測定值的影響
2.4 不同振蕩時間對栽培基質EC和pH測定值的影響
由表5可知,配方A在振蕩10、20、30 min所測的EC值無差異.配方B和配方C在振蕩10 min和振蕩30 min所測EC值差異顯著;配方D在振蕩不同時間所測EC值差異顯著.
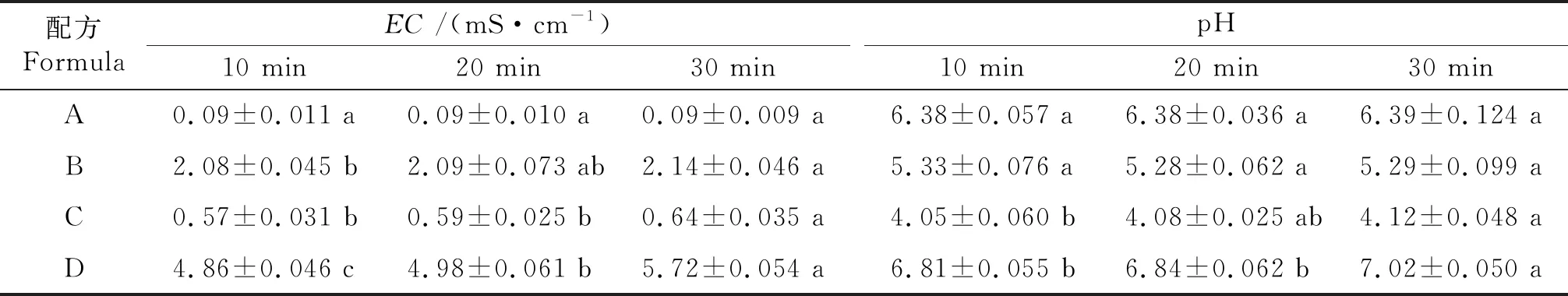
表5 不同振蕩時間對栽培基質EC和 pH測定值的影響
配方A和B在振蕩10、20、30 min所測的pH值無差異.配方C在振蕩10 min和20 min所測pH值差異不顯著,振蕩20 min和振蕩30 min所測pH值差異不顯著,但振蕩10 min和振蕩30 min所測pH值差異顯著.配方D在振蕩10 min和20 min所測pH值無差異,但振蕩10 min和振蕩30 min所測pH值差異顯著.
2.5 不同水質浸提液對栽培基質EC和pH測定值的影響
試驗所用自來水的EC值為413 μS/cm,pH值為7.83;超純水的EC值為0.28 μS/cm,pH值為7.08.分別按照m基質∶m自來水=1∶5和m基質∶m超純水=1∶5加入自來水和超純水,在搖床上振蕩,過濾得到濾液,測定其EC和pH值,結果見6.所有配方使用自來水所測EC值均顯著高于超純水所測EC值,分別高80.77%、30.07%、37.36%和11.88%.所有配方使用自來水所測pH值顯著高于超純水所測EC值,分別高9.35%、8.49%、13.45%和4.37%.
3 討論
3.1 不同前處理方式的影響
孟盈等[6]認為烘干樣可能會導致其吸濕水和膜狀水全部散失,改變某些離子的價態;汪飛等[7]認為樣品中的有機質,尤其是腐殖酸,在烘干過程中會不斷分解,使得測得含水量比實際含水量大,土樣中有機質含量越多,其誤差會越大.

表6 不同浸提水水質對EC和pH測定值的影響
本試驗中不同前處理方法對測定EC值差異顯著,Pierre等[8]和Kissel等[9]的研究結果表明可能是由于浸出液鹽離子含量較未浸出土壤溶液多、樣品含水量對EC值的影響導致.本試驗中烘干樣品所測EC值均大于風干樣,可能是由于烘干過程中有機質,尤其是腐殖酸的分解釋放其結合的金屬鹽離子導致[6].雖然鮮樣較風干樣的實際稱取質量較小,但由于土壤水懸浮效應的影響,各處理間pH值并無顯著差異,這與Rueter等[10]的研究結果一致.
3.2 不同樣品質量比的影響
本試驗中,按照m基質∶m超純水=1∶5和m基質∶m超純水=1∶10分別測EC值,測得m基質∶m超純水=1∶10EC值均小于m基質∶m超純水=1∶5測定值,而不同比例所測pH值.沒有顯著差異,這與Davis等[11]研究結果不同.Keaton[11]和Thomas等[11]認為這可能是由于隨著土壤/溶液比率增加,H+從土壤表面解離減少和Al水解減少共同作用的結果.
3.3 樣品粒徑大小的影響
本試驗中,無論石英砂的粒徑多大,對EC值和pH值沒有任何影響,這可能是由于石英砂本身是一種堅硬、耐磨、化學性能穩定的硅酸鹽礦物,不溶于水,也不含可溶性礦物質;而其他配方粒徑小的處理所測EC值和pH值均高于粒徑大的處理,與陳菲[14]等所得結果一致.Puri[15]和Hester等[16]認為較小的粒徑有利于可溶性鹽的溶解進而增加pH值,使用1~2 mm粒徑較好.
3.4 不同振蕩時間的影響
由于石英砂不溶于水,不含可溶性礦物質,因此振蕩時間的不同對其EC值和pH值沒有影響;而其他配方由于其含有可溶性鹽,振蕩30 min的EC值和pH值顯著高于振蕩10 min的數值.因此,30 min的振蕩時間更接近實際EC值和pH值.高峰等[5]在篩選黃瓜栽培基質配方時同樣選擇振蕩時間為30 min,與Puri等人[15]的研究結果一致.
3.5 鹽離子效應的影響
李慧敏等[19]認為由于自來水中含有微量氯化鈉、次氯化鈉和鈣離子、鎂離子、鉀離子及一些硫酸鹽等微量的礦物質,使用自來水來制備待測液,會給溶液中帶來額外的鹽離子,影響EC值和pH值的測定,而使用超純水不會給溶液中帶來額外的鹽離子,能更加真實地反應基質的EC值和pH值.但Rayment等[18]認為由于pH計以溶液中H+濃度給出數值,所以在pH較高的樣品中使用帶有鹽離子的溶液而非超純水進行測定能更加準確地反映其真實的pH值.中性和酸性基質自身H+較多,相較于帶入雜質的自來水,超純水的測定結果更為準確,但在堿性基質使用超純水和自來水測定的pH值較接近,這可能是由于鹽效應[19-21]導致堿性環境中樣品自身H+和Al3+釋放,而超純水由于缺少鹽離子的效應導致H+釋放受抑不能準確地反映真實pH值.本試驗中,由于自來水中的鹽離子多于超純水,導致所測EC和pH值差異顯著.
4 結論
在測定基質EC和pH值時,應先將待測基質風干后,使用篩子篩出粒徑為1~2 mm的基質,按照m基質∶m超純水=1∶5的比例配制浸提液60 mL,在搖床上振蕩30 min,過濾得到濾液,再測定其EC和pH值.

