雞血蓮黃酮通過調節AMPK/Sirt1/NF-κB信號通路改善小鼠非酒精性脂肪肝的實驗研究
楊 嫻,阮金蘭
(1.石家莊四藥有限公司藥物研究院,河北 石家莊 050000;2.武昌理工學院生命科學學院,湖北 武漢 430223)
非酒精性脂肪肝病(non-alcoholic fatty liver disease,NAFLD)是一種在無酒精濫用、病毒性肝炎、藥物因素和自身免疫性肝炎等原因的情況下,肝臟的脂肪變性疾病[1]。據報道,預計在未來10年之內,NAFLD患者的數量將急劇增加,并將于2030年成為肝移植最常見的指征[2]。NAFLD包括廣泛的肝臟病理改變,從單純性脂肪肝到非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)、肝纖維化和肝硬化,甚至部分患者可發展為肝癌[3]。臨床和非臨床研究表明,NAFLD患者和動物模型的活性氧(reactive oxygen species,ROS)和炎性細胞因子水平均升高[4-5]。氧化應激和炎癥反應在NAFLD從單純性脂肪變性到晚期脂肪變性過程中發揮關鍵作用。ROS能夠誘發肝臟炎癥反應進而刺激Kupffer細胞合成和釋放TGF-β、IL-6和TNF-α等炎癥因子,這些炎癥因子刺激肝星狀細胞轉化為肌成纖維樣細胞,誘發肝臟纖維化和肝細胞壞死的發生,從而加重NAFLD[6-7]。
雞血蓮是金星蕨科,新月蕨屬,披針新月蕨[Abacopteris penangiana (Hook.) Ching]的根莖,它作為我國土家族與苗族的傳統藥物,歷史悠久。雞血蓮含有豐富的黃酮成分,尤其是黃烷-4-醇苷類化合物,其中7-羥基-4-甲氧基-6,8-二甲基花青素是雞血蓮黃酮的主要成分。前期藥理學研究表明雞血蓮黃酮具有明確的抗炎和抗氧化活性[8-11]。有研究表明,具有抗氧化和抗炎作用的中草藥有助于NAFLD疾病進展的控制[12-13]。本研究利用高脂飲食誘導小鼠NAFLD模型,觀察雞血蓮黃酮對NAFLD小鼠的作用,并探討其作用機制。
1 材料與方法
1.1 實驗動物 40只6~8周齡SPF級雄性昆明小鼠,體質量18~22 g,購自華中科技大學實驗動物中心,動物許可證號:SCXK(鄂)2010-0009。經醫學實驗動物管理委員會批準,在溫度(25±5)℃,濕度(65±5)%,12 h光照/12 h黑暗循環的飼養條件下飼養,允許其自由飲水與飲食,同時密切觀察實驗動物的存活狀況。
1.2 藥物與試劑 雞血蓮采收自湖北省恩施自治州,九江市森林植物標本館譚策名研究員鑒定其為金星蕨科新月蕨屬植物披針新月蕨[Abacopteris penangiana (Hook.) Ching]的根莖。取雞血蓮2 kg經粉碎后,用80%(V/V)乙醇回流提取1 h。提取液經減壓,濃縮,干燥,得到雞血蓮總提取物。將總提取物以3 mg/mL的濃度加到HPD500大孔樹脂柱中,先用上樣量5倍的水進行沖洗,然后用5倍量的70%(V/V)乙醇進行沖洗,收集洗脫液,濃縮、干燥、得黃酮提取物187 g。以Triphyllin A作為對照品,采用紫外分光光度法,在波長276 nm處,測定雞血蓮黃酮中黃酮的含量。
Triphyllin A(華中科技學同濟醫學院藥學院,湖北省天然藥物化學與資源評價重點實驗室提供,純度>98%);HPD 500大孔樹脂(Bon Adsorher Technology Company);膽固醇(TC)試劑盒(批號:A111-2-1)、甘油三酯(TG)試劑盒(批號:A110-2-1)、天門冬氨酸轉氨酶(AST)試劑盒(批號:C010-2-1)、丙氨酸轉氨酶(ALT)試劑盒(批號:C009-3-1)、丙二醛(MDA)試劑盒(批號:A003-1-2)、過氧化氫酶(CAT)試劑盒(批號:A007-1-1)、超氧化物歧化酶(SOD)試劑盒(批號:A001-1-2)和谷胱甘肽過氧化物酶(GSH-Px)試劑盒(批號:A005-1-2)(南京建成生物工程有限公司);腫瘤壞死因子α(TNF-a)ELISA試劑盒(批號:ECM102a.96)、白介素-6(IL-6)ELISA試劑盒(批號:ECMC004(H).96)、白介素-1β(IL-1β)ELISA試劑盒(批號:ECMC0013.96)(欣博盛生物科技有限公司);NF-κB抗體(批號:8242)、AMPK抗體(批號:2532)、Sirt1抗體(批號:8469)(Cell Signaling Technology)。
高脂飲食配方:正常飼料47%,豬油20%,蛋黃20%,蔗糖10%,膽固醇2%,膽酸鹽1%[10]。
1.3 主要儀器 XD-101型倒置顯微鏡(南京江南光電集團股份有限公司);酶標儀(三元科技有限公司);UV1910型紫外可見分光光度計(上海凌光技術有限公司);RE-2000B型旋轉蒸發儀(鞏義市英峪高科儀器廠);Gel Doc XR+型凝膠電泳儀和凝膠成像系統(Bio Rad公司)。
1.4 造模與分組 40只小鼠適應性飼養1周后,隨機分為正常組、模型組、雞血蓮黃酮高劑量組、雞血蓮黃酮低劑量組,每組10只。正常組飼喂常規飼料,其余各組采用高脂飲食誘導小鼠NAFLD模型[10],飼喂高脂飼料連續4周后,各組隨機選取2只動物采用脊椎脫臼法處死,取出肝臟,觀察肝臟病理學變化。高脂飲食期間,觀察高脂喂養小鼠的體征變化,其中觀察到毛色發黃伴有油膩感,體質量增加,連續血脂、肝功能檢測異常,結合肝臟HE染色出現明顯大小不一的脂肪空泡,判斷模型復制成功。
1.5 實驗給藥 造模成功后,劑量設計參考文獻[8],雞血蓮黃酮高、低劑量組小鼠分別灌胃給予200、100 mg/kg雞血蓮黃酮提取物;正常組和模型組灌胃給予等體積的生理鹽水,連續4周。給藥期間,正常組繼續飼喂常規飼料,其余各組飼喂高脂飼料。
1.6 觀察指標
1.6.1 體質量、腹部脂肪質量、肝臟質量及肝指數的測定 末次給藥后,各組小鼠禁食12 h,稱定各組小鼠體質量,摘眼球取血,斷頸處死,分離腹部脂肪,稱質量;剝離完整肝臟,用生理鹽水將肝臟沖洗干凈,濾紙吸干表面水分,精密稱定質量,計算肝臟指數。肝臟指數=肝臟質量(g)/體質量(g)×100%。
1.6.2 小鼠血清AST、ALT及血脂水平的檢測 小鼠摘眼球取血,血液放置于1.5 mL離心管中,冰上靜置30 min后,3 500 g離心15 min,吸取上清,參照試劑盒說明測定TC、TG、AST和ALT的含量。
1.6.3 氧化應激相關指標的檢測 取相同部位的肝組織0.5 g,將肝臟剪碎后,按照1∶9(m/V)的比例放入4 ℃預冷的生理鹽水中,制備10%肝組織勻漿。勻漿液在4 ℃3 500 g下離心15 min,吸取上清,參照試劑盒說明測定MDA、SOD、CAT和GSH-Px的含量。
1.6.4 肝臟組織學觀察及免疫組化染色 取相同部位的肝組織,4%多聚甲醛固定24 h,先后經酒精脫水,透明,浸蠟,石蠟包埋等步驟,隨后以4 μm厚度切片,切片以常規方法進行蘇木精-伊紅(HE)染色,封片,200倍光學顯微鏡下觀測肝臟組織形態改變情況。
此外,用脫蠟切片進行免疫組化分析。將上述石蠟包埋的組織切成小薄片,在37 ℃恒溫烘箱中烘干,脫蠟,3% H2O2室溫浸泡,5%山羊血清封閉切片,磷酸鹽緩沖液(PBS)沖洗,加NF-κB(1∶200)4 ℃冰箱中保存孵育過夜,然后加入HRP標記的第二抗體并于37 ℃恒溫箱中溫育30 min。PBS沖洗后加入顯色劑,將顯色后的薄片用蒸餾水沖洗,蘇木精染色切片,酒精脫水,置于200倍顯微鏡下觀察。
1.6.5 肝臟炎癥因子檢測 肝臟上清液采用“1.6.3”方法制備,ELISA試劑盒檢測TNF-α、IL-1β和IL-6的含量,具體步驟參照試劑盒說明書。
1.6.6 小鼠肝臟組織中Sirt1和AMPK蛋白的檢測 Western blotting法檢測肝臟組織中Sirt1和AMPK蛋白的表達。肝組織經研磨后用BCA試劑盒測定蛋白含量,50 μg蛋白用10%SDS-PAGE處理后,恒壓100 V,1.5 h轉膜。PVDF膜與一抗Sirt1(1∶500),AMPK(1∶500);β-actin(1∶500)4 ℃孵育過夜。經TBST洗滌后,PVDF膜與二抗在室溫下孵育1 h。按電化學發光試劑盒說明書步驟,配備顯影液,顯影。
1.7 統計學方法 采用統計學軟件SPSS 25.0進行數據處理,計量資料以“均數±標準差”()表示,組間數據比較采用單因素方差分析,兩兩比較采用LSD檢驗,P<0.05為差異有統計學意義。
2 結 果
2.1 雞血蓮黃酮中黃酮的含量 線性回歸方程:A=3.963 7C+0.005 7,R=0.999 8,C=0.012 5~0.400 0 mg/mL。說明濃度在0.012 5~0.400 0 mg/mL的范圍內,化合物Triphyllin A濃度與吸光度之間呈現良好的線性關系。最終測得,雞血蓮黃酮中黃酮的含量為69.4%。
2.2 各組小鼠體質量、腹部脂肪質量、肝臟質量和肝臟指數比較 模型組小鼠的體質量、腹部脂肪質量、肝臟質量和肝臟指數均高于正常組(P<0.05);雞血蓮黃酮高、低劑量組小鼠的體質量、腹部脂肪質量、肝臟質量和肝臟指數均低于模型組(P<0.05);雞血蓮黃酮低劑量組小鼠的體質量、腹部脂肪質量、肝臟質量和肝臟指數均高于雞血蓮黃酮高劑量組(P<0.05)。(見表1)
表1 各組小鼠體質量、腹部脂肪質量、肝臟質量和肝臟指數比較()
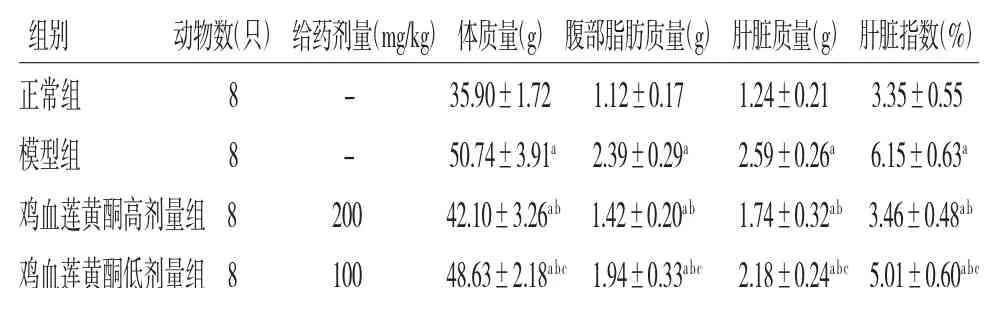
表1 各組小鼠體質量、腹部脂肪質量、肝臟質量和肝臟指數比較()
注:與正常組比較,aP<0.05;與模型組比較,bP<0.05;與雞血蓮黃酮高劑量組比較,cP<0.05
2.3 各組小鼠血清AST、ALT、TC、TG水平比較 模型組小鼠血清TC、TG、ALT和AST高于正常組(P<0.05),說明高脂飲食誘導小鼠肝功能異常及體內脂代謝紊亂,提示造模成功;雞血蓮黃酮高、低劑量組小鼠血清TC、TG、ALT和AST低于模型組(P<0.05);雞血蓮黃酮低劑量組小鼠血清TC、TG、ALT和AST均高于雞血蓮黃酮高劑量組(P<0.05)。結果表明雞血蓮黃酮能夠調節高脂飲食誘導的小鼠肝功能異常及脂代謝紊亂。(見表2)
表2 各組小鼠血清TC,TG,AST 和ALT 比較()

表2 各組小鼠血清TC,TG,AST 和ALT 比較()
注:與正常組比較,aP<0.05;與模型組比較,bP<0.05;與雞血蓮黃酮高劑量組比較,cP<0.05
2.4 各組小鼠氧化應激指標比較 模型組小鼠肝臟中MDA含量高于正常組(P<0.05),SOD、CAT及GSH-px含量低于正常組(P<0.05),提示NAFLD小鼠肝臟內存在氧化應激;雞血蓮黃酮高劑量組中MDA含量低于模型組(P<0.05),SOD及GSH-px含量高于模型組(P<0.05);雞血蓮黃酮低劑量組中MDA含量低于模型組(P<0.05),SOD、GSH-px含量高于模型組(P<0.05),而CAT含量與模型組比較,差異無統計學意義(P>0.05);雞血蓮黃酮低劑量組中MDA含量高于雞血蓮黃酮高劑量組(P<0.05),SOD、CAT及GSH-px含量均低于雞血蓮黃酮高劑量組(P<0.05)。結果表明雞血蓮黃酮能夠改善NAFLD小鼠肝臟氧化應激狀態。(見表3)
表3 各組小鼠肝組織中MDA、SOD、CAT 及GSH-px 含量比較()
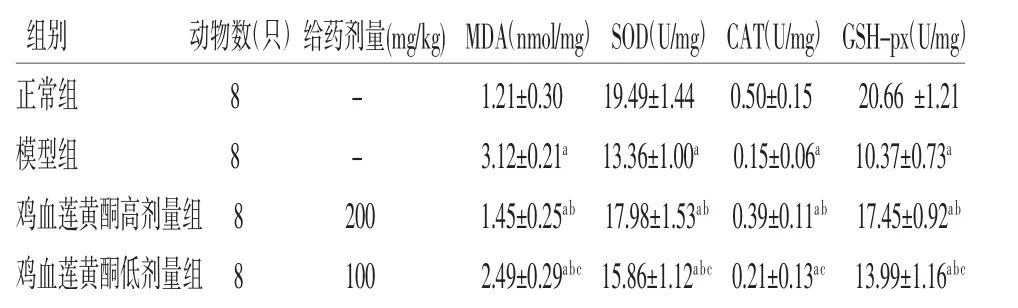
表3 各組小鼠肝組織中MDA、SOD、CAT 及GSH-px 含量比較()
注:與正常組比較,aP<0.05;與模型組比較,bP<0.05;與雞血蓮黃酮高劑量組比較,cP<0.05
2.5 各組小鼠肝臟組織及病理學變化 正常組小鼠肝臟紅潤,肝組織結構正常,肝細胞結構清晰完整,細胞內無明顯脂滴沉積;模型組小鼠肝臟外觀明顯發黃,肝臟組織內充滿大量大小不一的脂肪空泡,肝細胞結構紊亂、膨脹,大量炎細胞浸潤,提示造模成功;雞血蓮黃酮高、低劑量組小鼠肝組織與正常組比較,仍可見輕至中度肝細胞脂肪變性,但與模型組比較,脂肪變性程度減輕,胞內脂滴數量明顯減少,同時細胞體積縮小,炎性細胞的浸潤程度降低。結果表明雞血蓮黃酮能夠抑制高脂飲食誘導的小鼠肝組織脂肪變性和炎癥病變。(見圖1~2)

圖1 各組小鼠肝組織形態圖

圖2 各組小鼠肝組織病理切片圖(HE,×200)
2.6 各組小鼠炎癥指標比較 模型組小鼠肝臟中TNF-α、IL-1β和IL-6含量高于正常組(P<0.05),提示NAFLD小鼠肝臟存在炎癥反應;雞血蓮黃酮高、低劑量組小鼠肝臟TNF-α、IL-1β和IL-6含量低于模型組(P<0.05);雞血蓮黃酮低劑量組小鼠肝臟TNF-α、IL-1β和IL-6含量均高于雞血蓮黃酮高劑量組(P<0.05)。結果表明雞血蓮黃酮能夠降低NAFLD小鼠肝臟炎癥因子水平。(見表4)
表4 各組小鼠肝組織中TNF-α、IL-1β 和IL-6 含量比較(,μg/mL)

表4 各組小鼠肝組織中TNF-α、IL-1β 和IL-6 含量比較(,μg/mL)
注:與正常組比較,aP<0.05;與模型組比較,bP<0.05;與雞血蓮黃酮高劑量組比較,cP<0.05
2.7 各組小鼠肝臟NF-κB表達比較 與正常組比較,模型組呈深棕色,提示NF-κB的表達量增加;雞血蓮黃酮高、低劑量組小鼠肝組織與模型組比較,棕色變淺,提示NF-κB的表達量下降。結果表明雞血蓮黃酮能夠抑制高脂飲食誘導的NF-κB表達量增加。(見圖3)
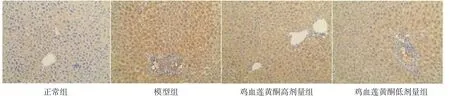
圖3 各組小鼠肝臟NF-κB 表達情況
2.8 各組小鼠Sirf1和AMPK蛋白表達比較 模型組小鼠肝臟中Sirt1和AMPK表達量低于正常組(P<0.05);雞血蓮黃酮高劑量組小鼠肝臟中Sirt1和AMPK表達量高于模型組(P<0.05)。結果表明雞血蓮黃酮能夠部分逆轉高脂飲食誘導的小鼠肝臟中Sirt1和AMPK表達障礙。(見圖4、表5)

圖4 各組小鼠Sirf1 和AMPK 蛋白表達的比較
表5 各組小鼠Sirf1 和AMPK 蛋白表達比較()

表5 各組小鼠Sirf1 和AMPK 蛋白表達比較()
注:與正常組比較,aP<0.05;與模型組比較,bP<0.05
3 討 論
NAFLD是一種臨床常見的慢性肝病,它的發生往往與肥胖、高血壓、2型糖尿病及血脂異常等因素有關。血漿中的脂質含量與NAFLD的嚴重程度密切相關。NAFLD患者體內脂代謝紊亂,一般表現為血漿中的TG、TC、AST、ALT水平較高[14]。高脂飲食可誘導小鼠體內高脂血癥及肝臟脂代謝紊亂,引起肝細胞脂肪變性,肝臟結構與功能受損。在本研究中,與正常組比較,模型組小鼠TC、TG、AST、ALT水平增加,說明高脂飼料可成功誘導小鼠脂代謝紊亂。肝臟的病理切片觀察發現,模型組小鼠肝臟組織中出現彌漫性肝細胞大泡性脂肪病變和炎性細胞,說明NAFLD造模成功,且該模型屬于非酒精性脂肪性肝炎(NASH)。
氧化應激對NAFLD的發展具有促進作用。高脂、高熱量的膳食不僅能夠引起機體脂代謝異常,還能激活細胞內還原型酰胺嘌呤二核苷酸磷酸氧化途徑,生成過量ROS,肝臟抗氧化酶活性下降,MDA含量增加,導致胰導素抵抗(IR)、炎癥和纖維化,從而導致NAFLD進一步惡化[15]。本研究中,高脂飲食誘導的模型組小鼠肝臟組織中MDA的含量增加,SOD、GSH-px、CAT的含量降低,表明NAFLD小鼠肝臟發生了氧化應激事件。雞血蓮黃酮能夠增加抗氧化酶的含量,同時降低MDA的含量,進而起到減緩NAFLD的作用。
過度炎癥反應是NAFLD的典型病理改變之一。研究表明,炎癥因子如TNF-α、IL-1β、IL-6參與了NAFLD繼發肝損傷[16-17]。在本研究中,HE染色結果顯示,高脂飲食誘導了小鼠肝臟大量的炎細胞浸潤,肝組織中TNF-α、IL-1β、IL-6水平增加,肝臟組織存在炎癥反應。雞血蓮黃酮給藥后可有效抑制炎性細胞浸潤,減少TNF-α、IL-1β、IL-6的含量。提示雞血蓮黃酮能夠抑制炎癥反應,從而起到抑制NAFLD的作用。
AMPK是導致NAFLD的發生和調節肝臟脂質代謝的重要因子。最近的研究報道,藥物可通過AMPK通路增強抗氧化酶活性以減輕氧化應激[3]。AMPK通路的激活可增加Sirt1的活性。研究資料證實,Sirt1的激活能夠增加肝內線粒體的生成,并促進肝內超氧化物歧化酶的表達,從而提高NASH抗氧化應激能力[18]。本研究發現,模型組小鼠肝臟組織中AMPK、Sirt1的表達下降,而雞血蓮黃酮給藥后能夠增加AMPK、Sirt1的表達。轉錄因子NF-κB存在于多種細胞中,包括脂肪細胞和巨噬細胞,它是一種關鍵的氧化還原敏感的促炎性轉錄因子,在炎癥反應中調節多種基因的表達,肝損傷能夠導致NF-κB的上調[19]。本研究發現,模型組小鼠肝臟組織中,NF-κB的表達量升高,而雞血蓮黃酮給藥后,NF-κB的表達下降。以上結果提示雞血蓮黃酮能夠通過調節AMPK/Sirt1/NF-κB通路,調節高脂飲食誘導的脂代謝紊亂,減緩由此引發的氧化應激及炎癥反應。
本研究從動物水平證實雞血蓮黃酮具有緩解NAFLD的潛力,為雞血蓮用于NAFLD治療藥物的開發,提供了實驗依據。

