低產(chǎn)乙醇本土有孢漢遜酵母的篩選及釀造特性
馮文倩,王倩,2,劉延琳,2,宋育陽,2,姜嬌,2,伍新宇,秦義,2*
1(西北農(nóng)林科技大學(xué) 葡萄酒學(xué)院,陜西 楊凌,712100) 2(西北農(nóng)林科技大學(xué)合陽葡萄試驗(yàn)示范站,陜西 合陽,715300) 3(新疆農(nóng)業(yè)科學(xué)院園藝作物研究所,新疆 烏魯木齊,830043)
由于全球氣候變暖,葡萄成熟時(shí)的含糖量越來越高,導(dǎo)致葡萄酒酒度不斷升高[1]。在過去30年的時(shí)間里,全球葡萄酒的酒精度平均上升了約2%(乙醇體積分?jǐn)?shù),下同)[2-3]。在我國西北部分葡萄酒產(chǎn)區(qū),特別是近10年來,葡萄完全成熟時(shí)的含糖量甚至超過270 g/L,從而導(dǎo)致葡萄酒最終酒精度超過15%。較高的酒精度不利于酒體平衡,也影響葡萄酒的香氣和風(fēng)味[4]。利用葡萄栽培技術(shù)、葡萄酒物理脫醇技術(shù)和微生物技術(shù)等,可以在一定程度上降低葡萄酒的酒精度[5-6],這其中,選育具有低產(chǎn)乙醇的酵母菌株將是最簡單和經(jīng)濟(jì)的方法。有研究顯示,假絲酵母屬(Candida)、有孢漢遜酵母屬(Hanseniaspora)、有孢圓酵母屬(Torulaspora)、美奇酵母屬(Metschnikowia)、畢赤酵母屬(Pichia)、Starmerella和Lachancea等酵母屬的部分菌株具有低產(chǎn)乙醇的特性,可以使葡萄酒的酒精度降低0.3%~3.8%[7-11]。
Hanseniaspora主要包括葡萄汁有孢漢遜酵母(Hanseniasporauvarum),仙人掌有孢漢遜酵母(Hanseniasporaopuntiae)、季也蒙有孢漢遜酵母(Hanseniasporaguilliermondii)、葡萄園有孢漢遜酵母(Hanseniasporavineae)等。有研究表明H.uvarum的純種或混合發(fā)酵可以降低酒精含量,同時(shí)產(chǎn)生較低的揮發(fā)酸和更高的甘油、有機(jī)酸、醛類、醇類等次級代謝產(chǎn)物[12]。ROSSOUW等[10]利用H.opuntiae和H.uvarum發(fā)酵Pinotage,酒精度分別降低了0.6%和0.8%。GOBBI等[13]使用H.uvarum單獨(dú)發(fā)酵Verdicchio和Trebbiano,可使乙醇產(chǎn)量降低32.9%。ZHU等[14]篩選到2株乙醇產(chǎn)量及產(chǎn)率均低于釀酒酵母的H.uvarum06/4菌株,其乙醇產(chǎn)量減少了10%。但同時(shí),大部分有孢漢遜酵母在葡萄酒生境下的生長能力較弱,因?yàn)檩^高的葡萄含糖量、酒精度的增加、發(fā)酵溫度的變化、SO2的添加等都可能會(huì)抑制有孢漢遜酵母的生長。
我國葡萄酒產(chǎn)區(qū)分布廣、生態(tài)多樣,蘊(yùn)藏著豐富的有待開發(fā)的非釀酒酵母資源,而有孢漢遜酵母屬酵母是葡萄表皮和葡萄酒發(fā)酵早期主要的“土著”酵母屬,因此本研究以有孢漢遜酵母屬酵母為研究對象。為了獲得低產(chǎn)乙醇且釀造特性較好的本土有孢漢遜酵母菌株,本研究以從寧夏、甘肅、陜西和新疆分離獲得的53株有孢漢遜酵母為材料,首先利用模擬葡萄汁發(fā)酵,篩選出乙醇產(chǎn)率較低和生長速率較快的有孢漢遜酵母,并對其糖、乙醇、SO2、低pH、溫度耐受性、嗜殺性和產(chǎn)H2S特性等葡萄酒釀造學(xué)特性進(jìn)行分析。
1 材料與方法
1.1 材料與試劑
1.1.1 菌株
53株本土有孢漢遜酵母(分離自寧夏、甘肅、陜西和新疆)和1株釀酒酵母(分離自寧夏),均保藏于西北農(nóng)林科技大學(xué)葡萄酒學(xué)院,如表1所示。

表1 本研究使用的本土酵母菌株Table 1 Indigenous yeast strains used in this study
1.1.2 培養(yǎng)基
YEPD培養(yǎng)基(g/L):葡萄糖20,蛋白胨20,酵母浸粉10,121 ℃高壓滅菌20 min。
YEPD-MB培養(yǎng)基(g/L):葡萄糖 20,蛋白胨20,酵母浸粉10,瓊脂20,亞甲基藍(lán)0.03,0.2 mol/L 磷酸檸檬酸緩沖溶液調(diào)pH值至4.6,121 ℃高壓滅菌20 min。
Triple M模擬汁[15]:葡萄糖100 g/L,果糖100 g/L,4 mL/L ergo stock(Tween-80 12.5 mL,95%乙醇 37.5 mL,麥角固醇 0.125 g);L-(+)酒石酸 6 g/L,L-(-)蘋果酸 3 g/L,檸檬酸0.5 g/L;YNB 1.7 g/L,酸水解酪蛋白2 g/L,肌醇0.006 g/L,CaCl20.2 g/L,L-脯氨酸1 g/L,DL-色氨酸0.1 g/L,精氨酸0.8 g/L,(NH4)3PO41 g/L。KOH溶液調(diào)pH值至3.25,0.22 μm濾膜過濾除菌。
WL營養(yǎng)瓊脂,青島高科技工業(yè)園海博生物技術(shù)有限公司;BIGGY瓊脂,北京陸橋技術(shù)有限責(zé)任公司。
1.2 儀器與設(shè)備
ZHWY—2102C恒溫培養(yǎng)振蕩器,上海智城分析儀器制造有限公司;AUX320分析天平,日本SHIMADZU公司;SX-500立式壓力蒸汽滅菌器,中國Techcomp公司;ELX800全自動(dòng)酶標(biāo)儀,美國Bio Tek公司;BK1301生物顯微鏡,重慶光電儀器有限公司;Spectra Max M2多功能微孔板檢測儀,美國Molecular Devices公司。
1.3 實(shí)驗(yàn)方法
1.3.1 酵母培養(yǎng)
將保藏的酵母菌液劃線于WL營養(yǎng)瓊脂培養(yǎng)基,28 ℃下培養(yǎng)3~5 d。在WL營養(yǎng)瓊脂培養(yǎng)基上挑取單菌落接種于YEPD液體培養(yǎng)基中,于28 ℃、150 r/min的條件下培養(yǎng)24 h制備酵母種子液。
1.3.2 低產(chǎn)乙醇有孢漢遜酵母的篩選
將53株有孢漢遜酵母及對照菌株釀酒酵母NX11424的活化菌液以2%的接種量接種于50 mL 模擬汁中,28 ℃、150 r/min擴(kuò)大培養(yǎng)24 h,然后再將擴(kuò)大培養(yǎng)的菌液以1×106CFU/mL的接種量接種到裝有150 mL模擬葡萄汁的250 mL發(fā)酵瓶中發(fā)酵,發(fā)酵瓶用封口膜密封,25 ℃靜置發(fā)酵,每個(gè)菌株設(shè)置3組平行。發(fā)酵過程中,每隔8 h對釀酒酵母取樣測定殘?zhí)呛虲O2失重,每24 h測定有孢漢遜酵母的CO2失重。當(dāng)糖含量<4 g/L或連續(xù)72 h CO2失重不再變化時(shí)視為發(fā)酵結(jié)束。發(fā)酵結(jié)束后,通過比較各菌株的CO2失重速率、乙醇產(chǎn)量、乙醇產(chǎn)率、乙醇產(chǎn)率的變化率等指標(biāo),篩選獲得低產(chǎn)乙醇的有孢漢遜酵母。
1.3.3 低產(chǎn)乙醇有孢漢遜酵母的發(fā)酵驗(yàn)證
為進(jìn)一步確定所篩選有孢漢遜酵母的低產(chǎn)乙醇特性,將其和對照菌株NX11424再次進(jìn)行模擬發(fā)酵。
將待測有孢漢遜酵母及對照菌株釀酒酵母NX11424的活化菌液,以2%的接種量接種于50 mL模擬汁中,28 ℃、150 r/min擴(kuò)大培養(yǎng)24 h,然后再將擴(kuò)大培養(yǎng)的菌液以1×106CFU/mL的接種量接種到裝有150 mL模擬葡萄汁的250 mL發(fā)酵瓶中發(fā)酵,發(fā)酵瓶用封口膜密封,25 ℃靜置發(fā)酵,每個(gè)菌株設(shè)置3組平行。利用移液槍在超凈工作臺(tái)進(jìn)行無菌取樣,每次取樣體積均等且控制在1 mL。通過測定發(fā)酵液的還原糖含量監(jiān)控發(fā)酵過程(釀酒酵母:每24 h測定1次;有孢漢遜酵母:發(fā)酵前期,每48 h測定1次,發(fā)酵后期,每72 h測定1次)。發(fā)酵結(jié)束后,測定各菌株的理化指標(biāo)。
1.3.4 優(yōu)選有孢漢遜酵母的系統(tǒng)發(fā)育樹構(gòu)建
采用通用引物NL1(5′-GCATATCAATAAGCGGAGGAAAAG-3′)和NL4(5′-GGTCCGTGTTTCAAGACGG-3′)進(jìn)行26S rDNA D1/D2區(qū)的擴(kuò)增。PCR擴(kuò)增液送至上海生工生物工程股份有限公司進(jìn)行測序。將測序結(jié)果在NCBI數(shù)據(jù)庫中用BLAST軟件與已知序列進(jìn)行同源比對分析。根據(jù)同源序列搜索結(jié)果,用Clustal X軟件對優(yōu)選菌株和相關(guān)模式菌株的多個(gè)序列進(jìn)行匹配分析(Alignment),利用MEGA 7.0構(gòu)建系統(tǒng)發(fā)育樹,并進(jìn)行1 000次Bootstrap檢驗(yàn)。
1.3.5 四株有孢漢遜酵母菌株的工藝學(xué)性狀
1.3.5.1 糖耐受性
在YEPD液體培養(yǎng)基中加入葡萄糖,使其葡萄糖質(zhì)量濃度分別為100、150、200、250、300、350 和400 g/L,經(jīng)過濾除菌后,將酵母種子液以1×106CFU/mL的接種量接種于培養(yǎng)基中,28 ℃條件下培養(yǎng)48 h,使用酶標(biāo)儀測定各菌株的OD600。
1.3.5.2 酒精耐受性
在滅菌之后的YEPD液體培養(yǎng)基中加入無水乙醇調(diào)整乙醇體積分?jǐn)?shù)為2%、4%、6%、8%、10%,將酵母種子液以1×106CFU/mL的接種量接種于培養(yǎng)基中,28 ℃條件下培養(yǎng)48 h,使用酶標(biāo)儀測定各菌株的OD600。
1.3.5.3 SO2耐受性
在滅菌之后的YEPD液體培養(yǎng)基中加入H2SO3調(diào)整SO2質(zhì)量濃度為60、120、180、240、300、360和420 mg/L,將酵母種子液以1×106CFU/mL的接種量接種于培養(yǎng)基中,28 ℃條件下培養(yǎng)48 h,使用酶標(biāo)儀測定各菌株的OD600。
1.3.5.4 溫度耐受性
將酵母種子液以1×106CFU/mL的接種量接種于已滅菌的YEPD液體培養(yǎng)基中,分別置于溫度為10、15、20、25、30、35和40 ℃的培養(yǎng)箱中,28 ℃條件下培養(yǎng)48 h,使用酶標(biāo)儀測定各菌株的OD600。
1.3.5.5 低pH耐受性
用磷酸-檸檬酸緩沖液調(diào)節(jié)YEPD液體培養(yǎng)基的pH值分別為2.8、3.2、3.6、4.0,滅菌后接種酵母種子液,接種量為1×106CFU/mL,28 ℃條件下培養(yǎng)48 h,使用酶標(biāo)儀測定各菌株的OD600。
1.3.5.6 酵母嗜殺性測定
將釀酒酵母NX11424細(xì)胞計(jì)數(shù)后用無菌水稀釋至107CFU/mL后涂布于YEPD-MB培養(yǎng)基,然后取5 μL非釀酒酵母菌液點(diǎn)樣在涂有釀酒酵母的YEPD-MB培養(yǎng)基上,28 ℃恒溫培養(yǎng)2 d。若非釀酒酵母菌株為嗜殺菌株,其菌落周圍會(huì)形成藍(lán)色死菌帶和透明抑菌圈[16]。
1.3.5.7 酵母產(chǎn)H2S特性檢驗(yàn)
將5 μL非釀酒酵母菌液點(diǎn)樣于BIGGY培養(yǎng)基上,28 ℃恒溫培養(yǎng)3~5 d,觀察菌落顏色。一般H2S產(chǎn)量由低到高對應(yīng)菌落顏色分別為白色(不產(chǎn))、黃棕色(低產(chǎn))、褐色(中產(chǎn))和黑色(高產(chǎn))[17]。
1.3.6 理化指標(biāo)測定
利用酶標(biāo)儀測定樣品在600 nm波長下的OD值;采用DNS法[18]測定殘?zhí)堑暮俊0凑誐egazyme乙醇試劑盒(K-ETOH)和BioSystems甘油試劑盒分別檢測乙醇和甘油。參照GB/T 15038—2006《葡萄酒、果酒通用分析方法》[19]測定總酸和揮發(fā)酸。
1.4 數(shù)據(jù)處理與指標(biāo)計(jì)算
1.4.1 數(shù)據(jù)處理
利用Excel 2016進(jìn)行發(fā)酵數(shù)據(jù)統(tǒng)計(jì)。采用SPSS 20.0進(jìn)行單因素方差分析(ANOVA)和Duncan多范圍檢驗(yàn)以確定數(shù)據(jù)之間的顯著差異(P<0.05)。利用Origin Pro 2018作圖。
1.4.2 指標(biāo)計(jì)算
乙醇產(chǎn)量/(g·L-1)=φ(乙醇)×10×0.789
(1)
式中:0.789為乙醇密度,g/mL[13]。
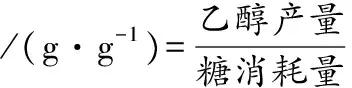
(2)
(3)
式中:A,供試有孢漢遜酵母發(fā)酵結(jié)束時(shí)的乙醇產(chǎn)率;B,當(dāng)釀酒酵母與供試有孢漢遜酵母消耗相同糖時(shí),釀酒酵母的乙醇產(chǎn)率。
2 結(jié)果與分析
2.1 低產(chǎn)乙醇有孢漢遜酵母菌株的篩選
對53株本土有孢漢遜酵母進(jìn)行模擬葡萄汁發(fā)酵,以乙醇產(chǎn)率作為主要評價(jià)指標(biāo),以S.cerevisiaeNX11424為對照菌株,評估了有孢漢遜酵母菌株的產(chǎn)乙醇能力(表2)。有孢漢遜酵母的CO2最大失重速率明顯低于S.cerevisiaeNX11424,其中,葡萄汁有孢漢遜酵母(H.uvarum)HuD-2-2的發(fā)酵速率較快,CO2最大失重速率達(dá)到0.48 g/(L·h)。有孢漢遜酵母的乙醇產(chǎn)率介于0.185~0.494 g/g,而S.cerevisiaeNX11424的乙醇產(chǎn)率為0.404 g/g。53株有孢漢遜酵母中,有28株酵母的乙醇產(chǎn)率低于S.cerevisiaeNX11424,降低幅度為3.78%~39.52%。
綜合分析CO2最大失重速率、糖利用率、乙醇產(chǎn)率及乙醇產(chǎn)率的變化率等指標(biāo),初步篩選出4株低產(chǎn)乙醇且發(fā)酵速率較快的菌株,分別為H.opuntiaeHoA-1-3、HoC-4-2和H.uvarumHuB-2-2、HuC-3-2,其進(jìn)化關(guān)系如圖1所示。H.opuntiaeHoA-1-3、HoC-4-2和H.uvarumHuB-2-2、HuC-3-2的糖利用率分別為86.94%、90.13%和98.77%、87.69%,乙醇產(chǎn)率分別降低了26.03%、22.33%和23.77%、32.05%。
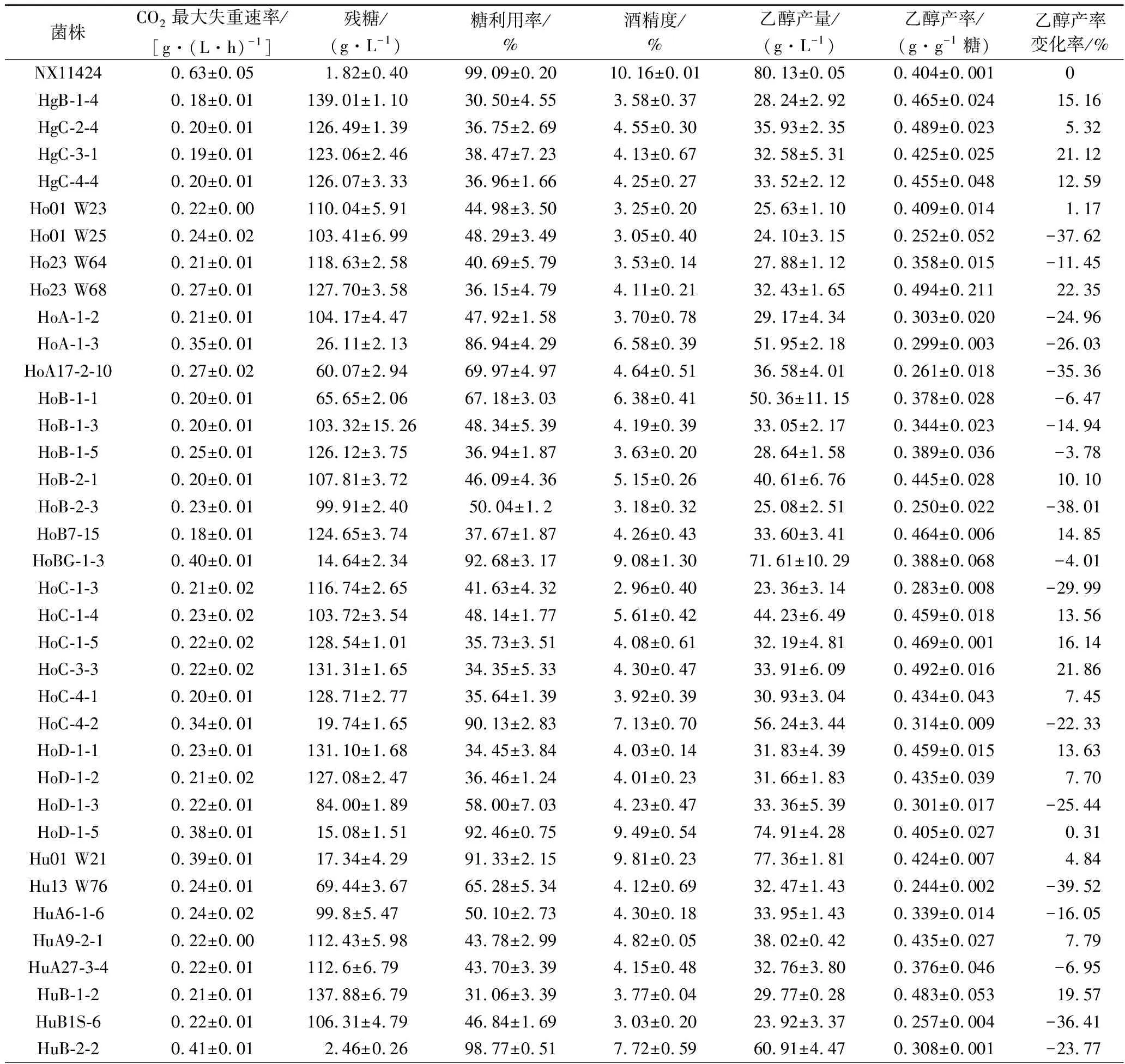
表2 菌株的發(fā)酵相關(guān)參數(shù)Table 2 Fermentation parameters of the strains
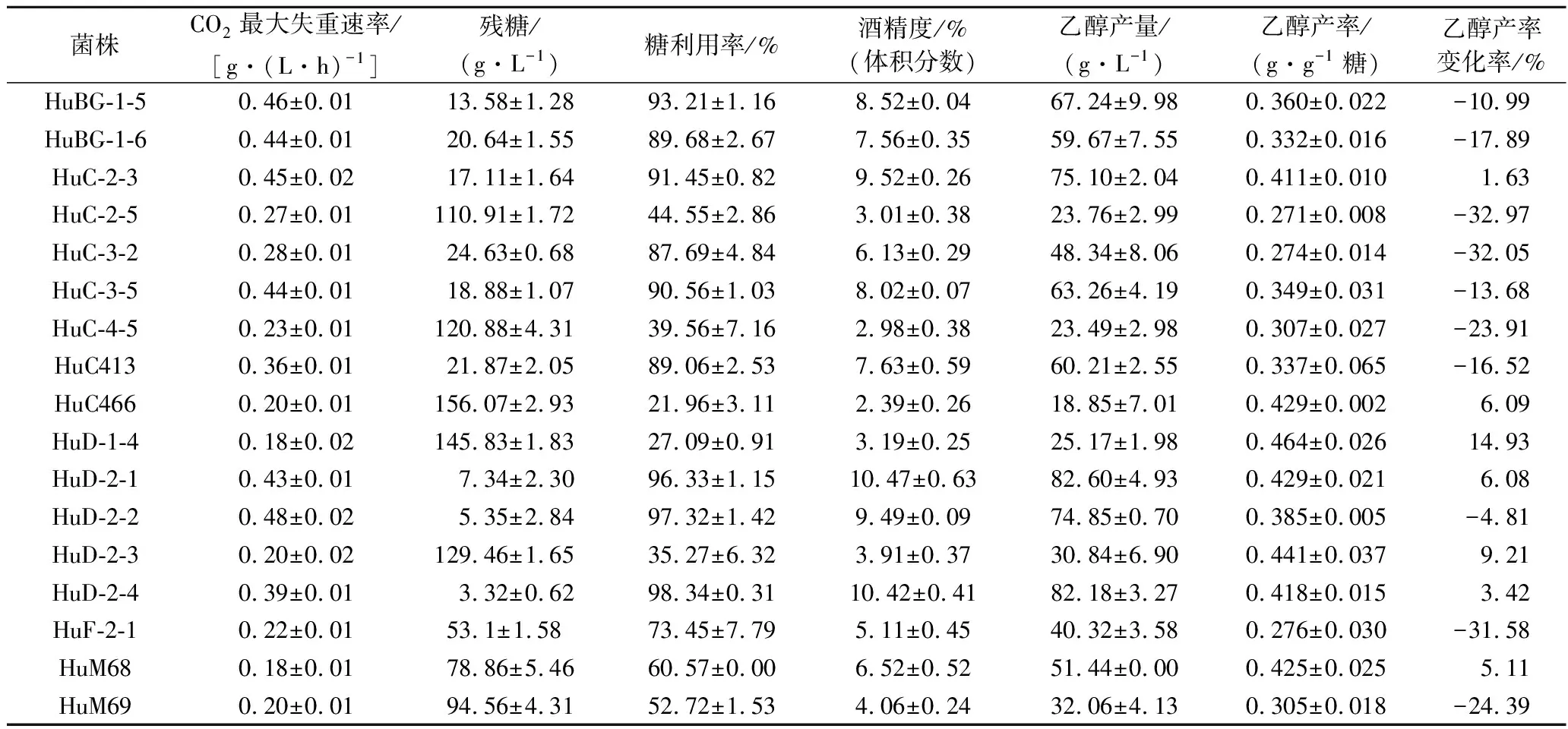
續(xù)表1
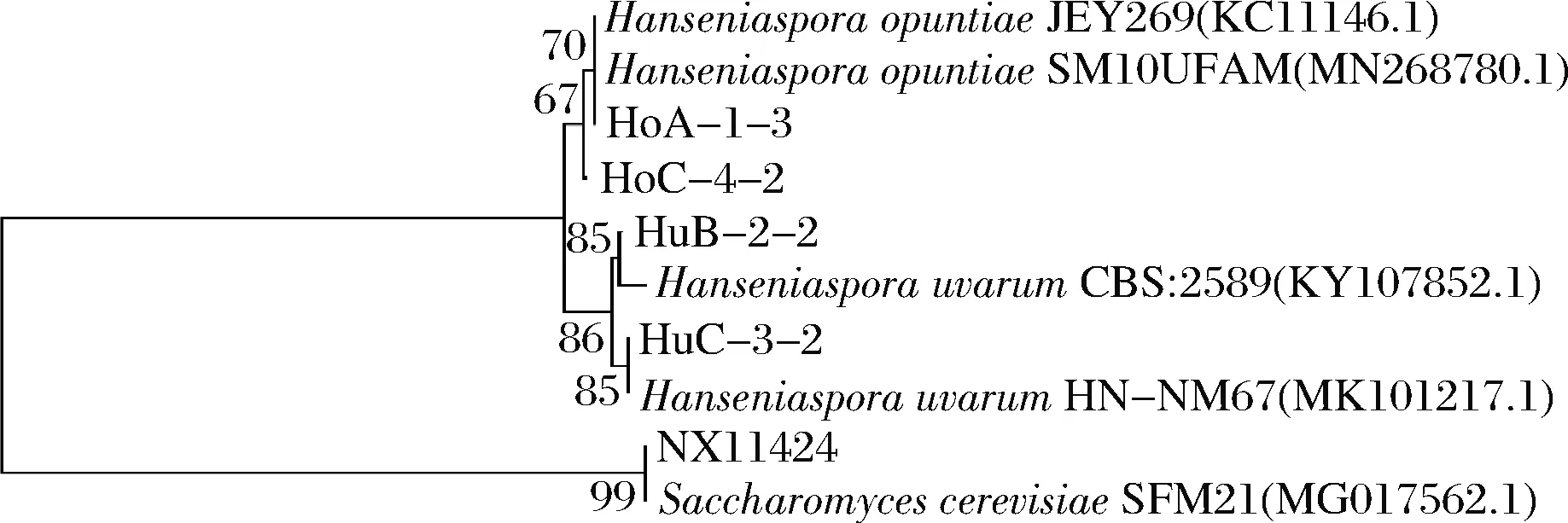
圖1 四株有孢漢遜酵母的系統(tǒng)進(jìn)化樹Fig.1 Phylogenetic tree of four Hanseniaspora strains
2.2 低產(chǎn)乙醇有孢漢遜酵母的進(jìn)一步發(fā)酵驗(yàn)證
為了進(jìn)一步驗(yàn)證篩選獲得的4株有孢漢遜酵母菌株的乙醇合成能力,再次進(jìn)行模擬葡萄汁發(fā)酵。
2.2.1 四株有孢漢遜酵母菌株的發(fā)酵動(dòng)力學(xué)特征
當(dāng)發(fā)酵進(jìn)行到12 d時(shí),4株有孢漢遜酵母逐漸適應(yīng)了模擬葡萄汁環(huán)境,發(fā)酵速度均明顯加快,其中H.uvarumHuC-3-2的糖消耗速率最快,并于第21天完成發(fā)酵;H.opuntiaeHoC-4-2和H.uvarumHuB-2-2的發(fā)酵趨勢基本一致,發(fā)酵能力稍弱于H.uvarumHuC-3-2;H.opuntiaeHoA-1-3的發(fā)酵能力最弱,在30 d內(nèi)不能完成發(fā)酵(圖2-a和圖2-b)。盡管H.opuntiaeHoC-4-2、H.uvarumHuB-2-2和H.uvarumHuC-3-2均可以單獨(dú)完成葡萄模擬汁發(fā)酵,但在真實(shí)葡萄酒發(fā)酵過程中,通常需要將有孢漢遜酵母和釀酒酵母進(jìn)行混合接種發(fā)酵。
4株有孢漢遜酵母的乙醇產(chǎn)量明顯低于NX11424,其中H.opuntiaeHoA-1-3的乙醇產(chǎn)生速率最慢,其他3株有孢漢遜酵母產(chǎn)乙醇速率的趨勢相似(圖2-c)。發(fā)酵結(jié)束后,H.opuntiaeHoA-1-3、H.opuntiaeHoC-4-2、H.uvarumHuB-2-2和H.uvarumHuC-3-2的酒精度分別為6.41%、8.47%、9.38%和8.48%。
2.2.2 四株有孢漢遜酵母菌株的代謝物
除H.opuntiaeHoA-1-3外,其他菌株的殘?zhí)呛烤? g/L以下。5株酵母菌株的酒精度和乙醇產(chǎn)率分別為6.41%~10.41%(體積分?jǐn)?shù))和0.317~0.417 g/g。與S.cerevisiaeNX11424相比,H.opuntiaeHoA-1-3、HoC-4-2和H.uvarumHuB-2-2、HuC-3-2的乙醇產(chǎn)率分別降低了23.87%、19.25%和10.74%、18.74%(表3)。
H.opuntiaeHoC-4-2、H.uvarumHuB-2-2和H.uvarumHuC-3-2的甘油產(chǎn)量均高于菌株S.cerevisiaeNX11424,分別增加了2.3%、4.7%和5.9%。此外,4株有孢漢遜酵母的揮發(fā)酸均高于S.cerevisiaeNX11424,揮發(fā)酸含量增加了12.3%~38.6%。甘油和揮發(fā)酸產(chǎn)量的增加,說明發(fā)酵底物碳源有更多的碳流向了甘油和乙酸的合成,這可能是4株有孢漢遜酵母乙醇產(chǎn)率降低的重要原因。
此外,模擬葡萄汁的總酸含量為9.0 g/L(以酒石酸計(jì)),發(fā)酵結(jié)束后,4株有孢漢遜酵母的降酸幅度(23.22%~27.78%)均高于S.cerevisiaeNX11424(20.67%)。因此,本研究篩選的4株有孢漢遜酵母在葡萄酒降酸方面也具有一定的應(yīng)用潛力。
2.3 四株有孢漢遜酵母菌株的釀造特性
2.3.1 糖耐受性
較高糖質(zhì)量濃度的葡萄汁會(huì)抑制酵母菌的生長,從而延長發(fā)酵時(shí)間[20],而且高滲透壓也會(huì)影響酒精發(fā)酵的代謝產(chǎn)物,如乙酸合成量的增加等[21]。H.opuntiaeHoA-1-3、HoC-4-2和H.uvarumHuB-2-2、HuC-3-2均能夠耐受400 g/L的初始葡萄糖質(zhì)量濃度,但當(dāng)初始糖質(zhì)量濃度>300 g/L時(shí),4株酵母的生長量呈現(xiàn)下降趨勢(圖3)。其中,H.opuntiaeHoA-1-3和H.uvarumHuB-2-2在初始糖質(zhì)量濃度為250 g/L時(shí)表現(xiàn)出生長抑制,H.uvarumHuC-3-2和H.opuntiaeHoC-4-2分別在初始糖質(zhì)量濃度為300和350 g/L時(shí)表現(xiàn)出生長抑制。綜合看來,H.opuntiaeHoA-1-3和HoC-4-2對高糖具有較好的耐受性,這對于高糖葡萄汁發(fā)酵的順利進(jìn)行具有重要意義。
2.3.2 酒精耐受性
酒精耐受性是酵母菌株重要的葡萄酒工藝學(xué)性狀。H.opuntiaeHoA-1-3、HoC-4-2和H.uvarumHuB-2-2、HuC-3-2的生長受到高酒精含量的顯著抑制(圖4)。H.opuntiaeHoA-1-3和H.opuntiaeHoC-4-2可以耐受6%(體積分?jǐn)?shù))的酒精度,而H.uvarumHuB-2-2和H.uvarumHuC-3-2僅能耐受4%的酒精度。當(dāng)酒精度>6%時(shí),4株有孢漢遜酵母盡管仍可以生長,但是生長趨勢極其微弱。在這部分的試驗(yàn)中出現(xiàn)了一個(gè)有意思的現(xiàn)象,即4株有孢漢遜酵母在YEPD培養(yǎng)基中酒精耐受性較弱,但是在模擬葡萄汁中卻能產(chǎn)生8%以上的酒精,這可能是由于4株有孢漢遜酵母在10余天的模擬葡萄汁發(fā)酵過程中經(jīng)歷了一個(gè)酒精度逐漸升高的適應(yīng)性馴化,這也間接反應(yīng)出這4株有孢漢遜酵母可能比較容易使用適應(yīng)性馴化或者理化誘變等方法進(jìn)行育種。
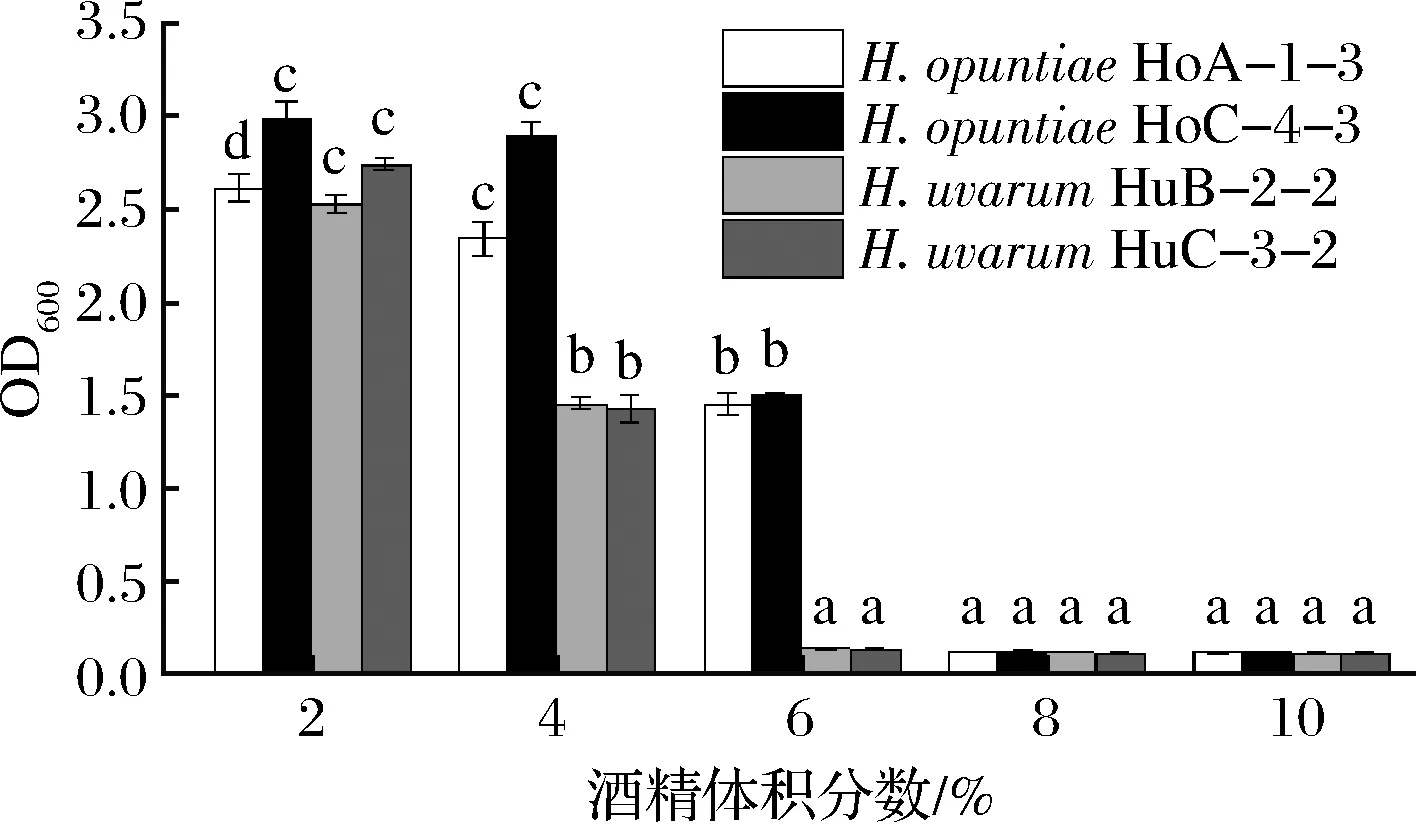
圖4 有孢漢遜酵母菌株的酒精耐受性Fig.4 Ethanol tolerance of the Hanseniaspora strains
對這4株有孢漢遜酵母開展以提高發(fā)酵速度為目標(biāo)的常壓室溫等離子體誘變育種,初步證實(shí)了上述猜想,1次誘變即可獲得大量的發(fā)酵速度加快的正向突變菌株。
2.3.3 SO2耐受性
如圖5所示,4株有孢漢遜酵母菌株在SO2質(zhì)量濃度<300 mg/L時(shí)均能很好地生長,且在不同質(zhì)量濃度下的生長沒有明顯差異。當(dāng)SO2質(zhì)量濃度達(dá)到360 mg/L時(shí),H.opuntiaeHoA-1-3、H.opuntiaeHoC-4-2和H.uvarumHuB-2-2的生長幾乎被完全抑制,但H.uvarumHuC-3-2在SO2質(zhì)量濃度達(dá)到420 mg/L時(shí),生長才受到完全抑制。在葡萄原料衛(wèi)生狀況良好的情況下,釀造干型葡萄酒添加的SO2通常不超過60 mg/L。因此,從生產(chǎn)應(yīng)用的角度來看,SO2不是限制這些菌株應(yīng)用的因素。
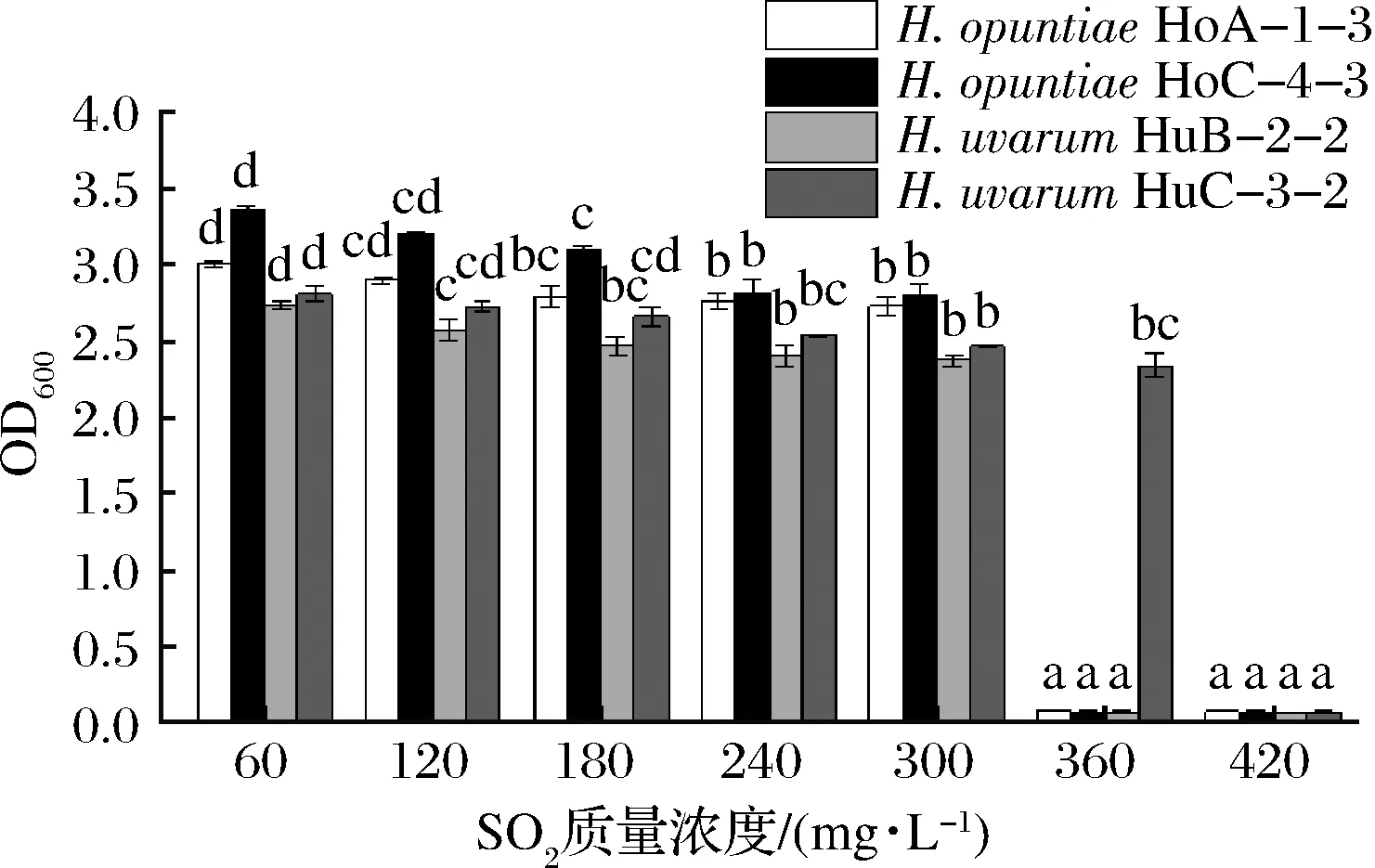
圖5 有孢漢遜酵母菌株的SO2耐受性Fig.5 SO2 tolerance of the Hanseniaspora strains
2.3.4 溫度耐受性
發(fā)酵溫度是決定葡萄酒質(zhì)量的重要因素,酵母生長的最適溫度不同,低溫和高溫都會(huì)影響酵母菌的生長繁殖和發(fā)酵速率[22]。在葡萄酒釀造過程中,高溫菌株將提高發(fā)酵臨界溫度,降低發(fā)酵停滯的風(fēng)險(xiǎn),而漢遜酵母屬是耐高溫酵母屬之一[23]。由圖6可知,H.opuntiaeHoA-1-3、H.opuntiaeHoC-4-2和H.uvarumHuB-2-2都能在40 ℃高溫條件下正常生長,H.uvarumHuC-3-2的生長較弱。有研究表明部分非釀酒酵母比釀酒酵母能更好地在10~15 ℃的低溫條件下發(fā)酵,發(fā)酵前的冷浸漬也有利于有孢漢遜酵母的生長[24-25],而本研究的4株有孢漢遜酵母菌株均能在10 ℃的低溫下生長,且當(dāng)培養(yǎng)溫度為20 ℃時(shí),菌株的生長量均達(dá)到最大值。
2.3.5 低pH耐受性
葡萄汁的pH值通常在3.0~4.0[20],因此葡萄酒釀造用酵母菌需要具有較強(qiáng)的耐酸性能。H.opuntiaeHoA-1-3、HoC-4-2和H.uvarumHuB-2-2、HuC-3-2在pH 2.8~4.0均能很好的生長,尤其是H.uvarumHuC-3-2在不同pH值條件下的生長量均高于其他菌株(圖7),因此,從pH值耐受性角度看,本研究的4株有孢漢遜酵母菌均可滿足葡萄酒生產(chǎn)要求。
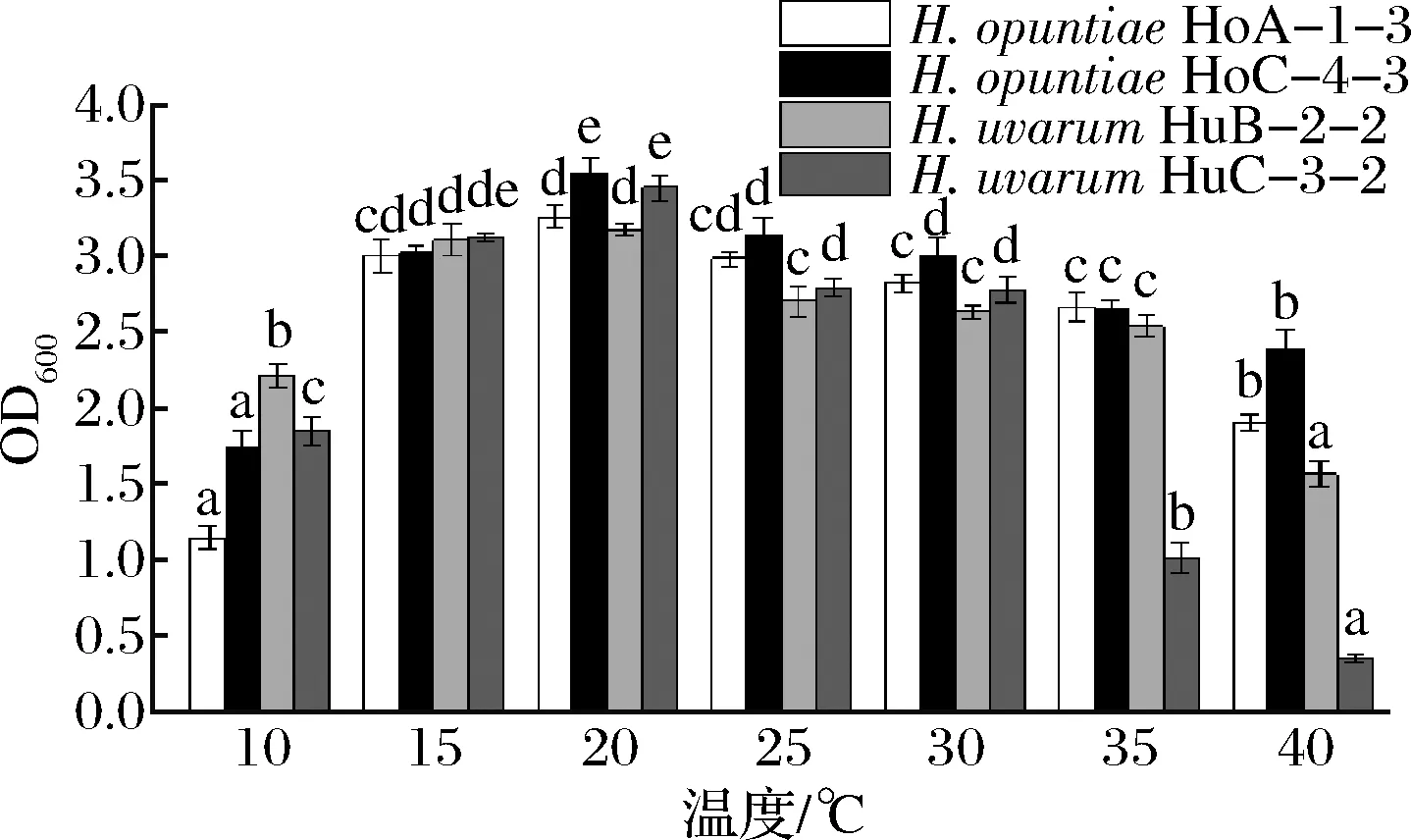
圖6 有孢漢遜酵母菌株的溫度耐受性Fig.6 Temperature tolerance of the Hanseniaspora strains
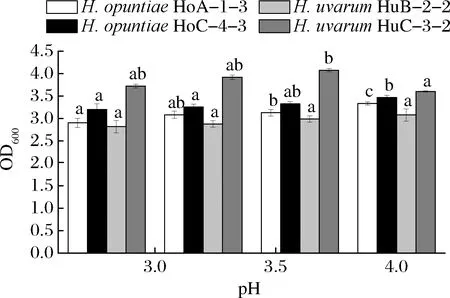
圖7 有孢漢遜酵母菌株的pH耐受性Fig.7 pH tolerance of the Hanseniaspora strains
2.3.6 嗜殺特性
嗜殺酵母在其生長繁殖過程中會(huì)分泌嗜殺毒素,但對自身產(chǎn)生的毒素具有免疫功能[26]。4株有孢漢遜酵母周圍均未出現(xiàn)藍(lán)色抑菌圈,說明這4株有孢漢遜酵母對S.cerevisiaeNX11424均無嗜殺作用(圖8)。對S.cerevisiae沒有嗜殺活性,將有利于這4株有孢漢遜酵母和S.cerevisiae進(jìn)行混合發(fā)酵。

圖8 有孢漢遜酵母菌株的嗜殺性Fig.8 Killing activity of the Hanseniaspora strains
2.3.7 產(chǎn)H2S特性
H2S具有較強(qiáng)的揮發(fā)性,較低的嗅覺閾值(50~80 μg/L),過高會(huì)使葡萄酒具有臭雞蛋氣味,影響葡萄酒的香氣質(zhì)量,破壞葡萄酒的風(fēng)味[18]。5株酵母菌株在BIGGY培養(yǎng)基上的顯色如圖9所示,S.cerevisiaeNX11424和H.uvarumHuB-2-2屬于中產(chǎn)H2S菌株,H.opuntiaeHoA-1-3、H.opuntiaeHoC-4-2和H.uvarumHuC-3-2均為不產(chǎn)H2S菌株。

圖9 酵母菌株的產(chǎn)H2S特性Fig.9 H2S production capacity of the yeast strains
3 結(jié)論
本研究以寧夏、甘肅、陜西和新疆葡萄酒產(chǎn)區(qū)分離的53株有孢漢遜酵母為研究對象,利用模擬葡萄汁發(fā)酵篩選獲得H.opuntiaeHoA-1-3、H.opuntiaeHoC-4-2、H.uvarumHuB-2-2和H.uvarumHuC-3-2等4株具有低產(chǎn)乙醇性狀的有孢漢遜酵母屬酵母,其乙醇產(chǎn)率分別降低23.87%、19.25%、10.74%和18.74%。4株有孢漢遜酵母均能耐受400 g/L的糖、300 mg/L的SO2、pH 2.8、10 ℃低溫和40 ℃高溫,均無嗜殺活性;除H.uvarumHuB-2-2外,其他3株有孢漢遜酵母均不產(chǎn)H2S。整體而言,本研究篩選獲得的H.opuntiaeHoC-4-2和H.uvarumHuC-3-2在低產(chǎn)乙醇的同時(shí),還具有較好的生長特性、耐受能力、發(fā)酵性能等釀造學(xué)特性,具有一定的應(yīng)用價(jià)值。
為了將其應(yīng)用于真實(shí)的葡萄酒釀造,在后續(xù)的研究工作中,一方面需要進(jìn)一步研究4株有孢漢遜酵母與釀酒酵母的混合發(fā)酵技術(shù),以及其對葡萄酒感官質(zhì)量的影響;另外,可以這4株有孢漢遜酵母為出發(fā)菌株,通過物理化學(xué)誘變或者適應(yīng)性進(jìn)化等育種手段,選育具有更優(yōu)秀釀造學(xué)特征的低產(chǎn)乙醇酵母菌株,從而實(shí)現(xiàn)在生產(chǎn)中的推廣應(yīng)用。

