轉錄組測序揭示激素介導的信號通路參與甜菜低溫應答
龍佳麗,鄒 奕,邳 植,吳則東
(1黑龍江大學生命科學學院,哈爾濱 150080;2黑龍江大學現代農業與生態環境學院,哈爾濱 150080)
0 引言
低溫是植物生長發育過程中經常遇到的非生物脅迫,是限制作物產量和地理分布的主要環境因素之一[1]。低溫脅迫可引起植物膜通透性改變,破壞酶系統,引起代謝異常,減少能量供應,抑制光合作用,促進有毒物質的積累[1]。在嚴重的情況下,低溫脅迫甚至可能導致植物死亡[1]。甜菜是世界上最重要的產糖作物之一,約占全球產糖量的30%[2-3]。在中國集中栽種在內蒙古、新疆、黑龍江等地[4]。甜菜種子萌發起始溫度為4~5℃,最適溫度為25℃[5]。當甜菜種子或幼苗在早期發育階段暴露于冷凍溫度時,種子的發芽率、植株的存活率以及成熟植株的蔗糖產量均會受到低溫的嚴重限制[6]。甜菜幼苗凍害初期主要表現為葉片直硬,進而呈水漬狀。溫度回升后,葉片萎蔫、退綠褐化,甚至變黑死亡。因此,研究低溫在甜菜生長發育中的調節以提高甜菜低溫耐受性是非常有必要的。
植物激素作為一種信號分子,參與調節許多生長發育代謝進程,并在抵抗非生物脅迫中起著重要作用[7-8]。在低溫脅迫下,生長素在調節植物生長和發育中起著至關重要的作用[9]。在擬南芥中,冷應激同時影響生長素的運輸和信號傳遞過程,長期冷應激分別導致Aux/IAA和ARF蛋白家族的協調下調和上調[9]。脫落酸(ABA)常被稱為脅迫反應激素,在根形態建成和非生物脅迫防御中起著關鍵作用[10-11]。當植物受到環境脅迫時,植物體內ABA水平升高,進而激活ABA介導的抗性途徑,從而促進氣孔關閉,增強植物抗旱能力[12]。在水稻中,過表達ABA受體基因OsPYL10可以顯著增強秈稻的耐旱性與耐寒性[13]。在赤霉素(GA)信號途徑中,赤霉素受體蛋白GID1與GAs相互作用,降解DELLA蛋白,促進GA反應。而DELLA蛋白SLR1的編碼基因OsSLR1在低溫條件下被顯著上調,以抑制GA反應[14]。此外,油菜素內酯(BR)也是植物生長發育所必需的激素,通過激活細胞表面受體(BRI1和BAK1)激酶活性,并導致一種抑制BRI1的新蛋白BKI1的分離,進而誘導BZR1和BZR2 2個關鍵轉錄因子去磷酸化來調節基因表達[15]。然而,這些植物激素在甜菜中如何參與低溫應答仍未可知。
隨著轉錄組測序技術的發展,人們對植物耐低溫的分子機制進行的轉錄組分析結果已成功的應用于水稻[16]、玉米[17]、小麥[18]等植物的研究。為了進一步探究甜菜對低溫應答的分子機制,本研究對低溫處理后甜菜葉片轉錄組變化進行測定。利用比較轉錄組學分析策略探索甜菜低溫應答的分子機制,研究植物激素調控的信號通路是否參與甜菜低溫脅迫防御。
1 材料與方法
1.1 試驗材料及處理方法
本研究選用KWS9442作為材料,于2019年4月份在黑龍江大學呼蘭校區將種子播種于方形花盆(12 cm×12 cm×10 cm)。發芽后,于溫度(25±2)℃,光照強度為140 μmol/(m2s),光周期14 h/10 h培養箱中培養4周。隨后,將幼苗轉移到4℃光照培養箱中進行低溫處理,光照條件保持不變。分別剪取低溫處理0、3、6、12、24、36、48 h后甜菜葉片,液氮速凍后-80℃冰箱保存。每個處理共設3次重復。使用TRIzol Reagent提取葉片總RNA。所有RNA樣品用于qRT-PCR分析,0 h和24 h RNA樣品還用于RNA-seq。
1.2 文庫構建和RNA-seq
對RNA濃度、純度及完整性進行檢測后,參照Illumina Truseq RNA sample prep Kit標準流程進行文庫構建。隨后,對文庫進行定量和質量檢測。最后,使用Illumina高通量測序平臺對cDNA文庫進行測序。
1.3 RNA-seq數據分析
對raw reads中低質量、接頭污染以及未知堿基N含量過高的reads進行過濾后獲得clean reads,計算GC含量、Q20和Q30。使用HISAT2將clean reads比對到甜菜參考基因組RefBeet-1.2.2,并計算比對率。檢測轉錄組測序飽和度評估測序數據量是否滿足后續分析。采用Stringtie軟件計算每個基因在樣本中的FPKM值,根據樣本所有基因的FPKM值計算組內及組間的Pearson相關性系數。通過比對NR、Swiss-Prot、Pfam、STRING、GO和KEGG數據庫進行功能注釋。
1.4 顯著地差異表達基因的篩選
采用DESeq方法篩選對照組與低溫處理組之間的DEGs。首先,對原始的基因表達量進行標準化處理。隨后,通過統計學模型進行假設檢驗概率(P-value)的計算,并進行多重假設檢驗校正獲得FDR值。以低溫處理組與對照組的表達量變化倍數大于2倍且錯誤發現率FDR值小于0.05為閾值篩選DEGs。
1.5 功能注釋與富集分析
為研究DEGs的生物功能和參與代謝途徑,將所有DEGs映射到GO和KEGG數據庫,對DEGs進行GO富集分析和KEGG代謝通路分析。
1.6 qRT-PCR驗證
2個BvDREBs和12個參與脫落酸和生長素信號通路的DEGs被挑選,檢測其在低溫應答過程表達模式。qRT-PCR引物設計及定量方法參照Pi等[19]的方法,引物序列詳見表1。采用PrimeScript RT reagent Kit with gDNA Eraser(TaKaRa,中國大連)將RNA逆轉錄為cDNA。以GAPDH為內參基因,使用TB Green premix Ex Taq(TaKaRa,中國大連)試劑進行熒光定量PCR。每個樣品3次重復,按2-ΔΔCT相對定量法計算相對表達量。
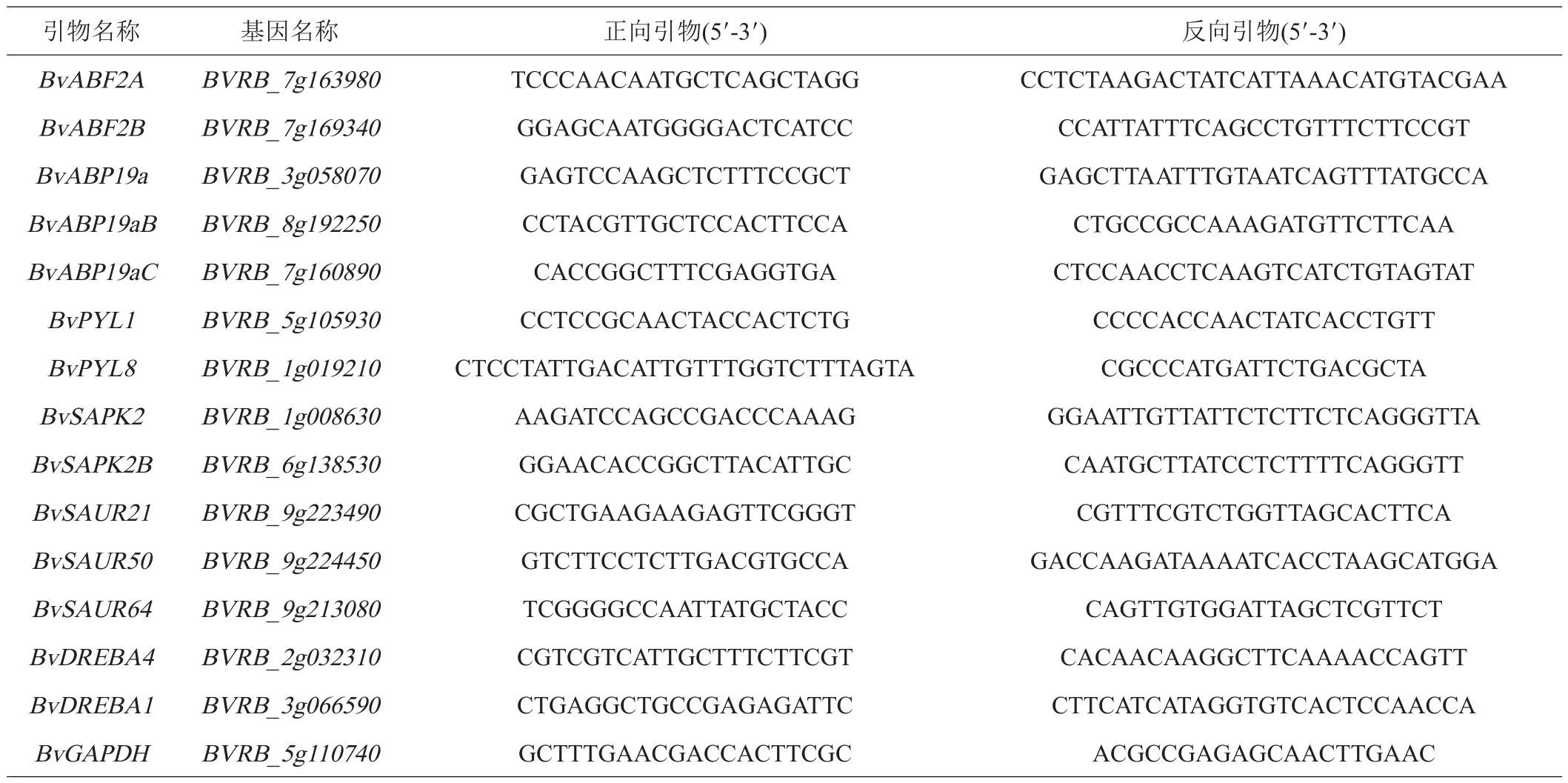
表1 本研究用于qRT-PCR的引物
1.7 數據處理
使用IBM SPSS Statistics 26進行數據處理。
2 結果與分析
2.1 低溫脅迫下BvDREBs表達模式分析
前期研究表明甜菜‘KWS9442’是低溫抗性較強的品種[20]。對生長4周的甜菜幼苗進行4℃低溫處理24 h后,甜菜表型并無萎蔫、葉斑、黃化等明顯變化。為確定甜菜對低溫的響應過程,選擇植物低溫應答中已知的關鍵轉錄因子BvDREBs作為標記基因。BvDREBA1和BvDREBA4的表達水平在低溫過程中均表現出先上升后下降的趨勢(圖1)。BvDREBA1在低溫處理24 h后表現出顯著上調,上調倍數超過300倍。BvDREBA4基因表達水平在低溫處理24 h后達到峰值,上調倍數約為10倍。低溫處理36 h后,這些基因表達水平均隨著低溫持續逐步下調。BvDREBs受低溫誘導24 h后表達水平達到峰值,說明此時甜菜低溫應答被激活。

圖1 低溫脅迫過程中BvDREBs表達模式
2.2 轉錄組數據質控分析
轉錄組測序共獲得269609790原始讀數,去除低質量、接頭污染以及未知堿基N含量過高的reads后獲得269237926過濾讀數(表2)。GC含量在43.60%~44.28%之間,Q20含量均在98.2%以上,Q30的值均在94.8%以上,測序錯誤率均在0.03%以下。利用HISAT2軟件,將clean reads比對到甜菜參考基因組RefBeet-1.2.2上,比對率91.747%~92.098%(表2)。為評估不同測序量的條件下各基因的表達檢測是否準確,對每個樣品進行了飽和度分析。結果顯示,各樣品中高(FPKM>15)、中(0.6<FPKM<15)、低表達基因(FPKM<0.6)飽和曲線均達到平臺期,說明本次測序的深度足夠。
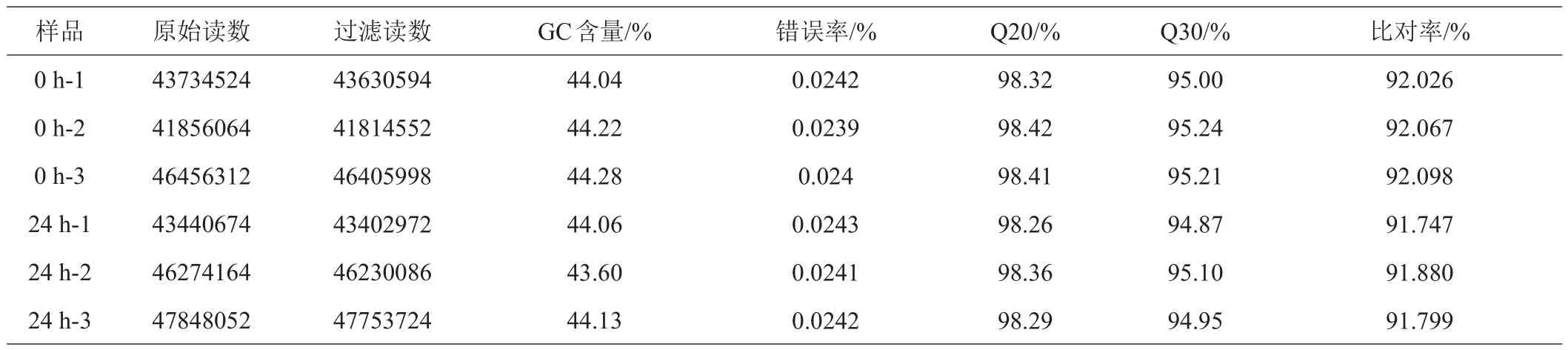
表2 測序讀數比對到參考基因組的基本統計
為評估樣品之間的重現性,計算了各樣品的Pearson相關系數。結果顯示,對照組3個重復間的相關系數在0.939~0.945之間,低溫處理組3個重復間相關系數在0.915~0.936之間,說明本次試驗結果具有較好的重現性。此外,對照組與處理組樣品間相關系數在0.814~0.874之間。組間相關系數低于組內相關系數,暗示24 h低溫處理引起部分蛋白發生變化。綜合以上質控分析結果,測序數據質量滿足后續基因表達分析要求。
2.3 功能注釋與篩選DEGs
經過比對參考基因組共鑒定基因27964個,分別檢索NR、Swiss-Prot、Pfam、STRING、GO和KEGG數據庫對基因功能進行注釋。共有26720個基因功能被成功注釋,占全部基因的95.5%。為篩選甜菜中低溫應答基因,使用DESeq軟件以基因變化倍數大于2倍且FDR小于0.05為閾值篩選DEGs。共獲得3061個DEGs,其中上調表達1363個、下調表達1698個(圖2)。
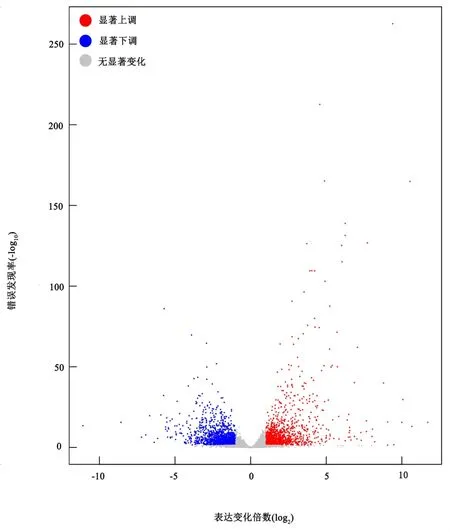
圖2 對照組與低溫處理組間DEGs火山圖
2.4 顯著地差異表達基因的功能注釋及富集
對鑒定到的DEGs進行GO富集分析發現,共有49個GO term被顯著富集,包括生物學過程22個GO term、分子功能13個GO term、細胞組分14個GO term。根據GO term富集顯著程度(FDR值)及有向無環圖中的上下級關系,挑選出12個與低溫應答相關的GO term(圖3A)。在生物過程方面,激素響應(GO:0009725)、含氧化合物響應(GO:1901700)、酸性化合物響應(GO:0001101)、激素介導的信號通路(GO:0009755)等方面被顯著富集。其中,激素響應(GO:0009725)最顯著,FDR值為3.73×108。同時,激素介導的信號通路(GO:0009755)也被顯著富集,FDR值為0.00014。在分子功能方面,DNA結合轉錄因子活性(GO:0003700)和蛋白激酶活性(GO:0004672)等信號轉導相關GO terms被顯著富集。細胞組分方面富集結果反映出這些DEGs編碼蛋白主要分布于核小體(GO:0000786)、細胞周邊(GO:0071944)、細胞膜系統(GO:0016021和(GO:0031225)。說明激素調控的信號通路在低溫應答中具有重要作用。

圖3 甜菜低溫處理DEGs的GO富集分析
對參與激素響應(GO:0009725)和激素介導的信號通路(GO:0009755)的DEGs進一步分類(圖3B~C)發現,激素反應(GO:0009725)總共包含233個DEGs,117個上調表達,116個下調表達。這些DEGs所響應的激素種類包括生長素(auxin)、ABA、乙烯(ETH)、水楊酸(SA)、BR、GA、茉莉酸(JA)、細胞分裂素(CTK)。其中,ABA和auxin響應基因最多,分別為65個和59個基因,占28%和25%。激素介導的信號通路(GO:0009755)共涉及125個DEGs,包括59個上調表達基因和66個下調表達基因。這些基因可分為8類,與激素響應(GO:0009725)結果相似。其中,參與auxin和ABA介導的信號通路的基因最多,分別為51個和27個,占41%和22%。
2.5 DEGs的KEGG功能注釋及富集
利用KEGG數據庫對DEGs參與的代謝通路進行功能注釋,這些DEGs涉及293個代謝通路。其中,植物激素信號轉導、MAPK信號通路、淀粉和糖代謝等8條通路被顯著富集。與GO富集結果一致,植物激素信號轉導(ko04075)富集程度最為顯著,FDR值為0.00017。該通路中DEGs主要參與auxin、ABA、ETH、GA、BR、CTK、JA 和 SA 信號通路(圖4)。其中,PP2C、PYL、ABF和SAPK2均受低溫處理影響轉錄水平發生顯著變化,它們編碼的蛋白相互作用參與ABA信號轉導。Auxin信號通路中,編碼auxin響應蛋白SAUR和IAA的基因也受低溫處理影響。此外,低溫脅迫還會導致編碼DELLA、JAZ、BZR等其他激素信號通路關鍵蛋白的基因發生顯著變化。
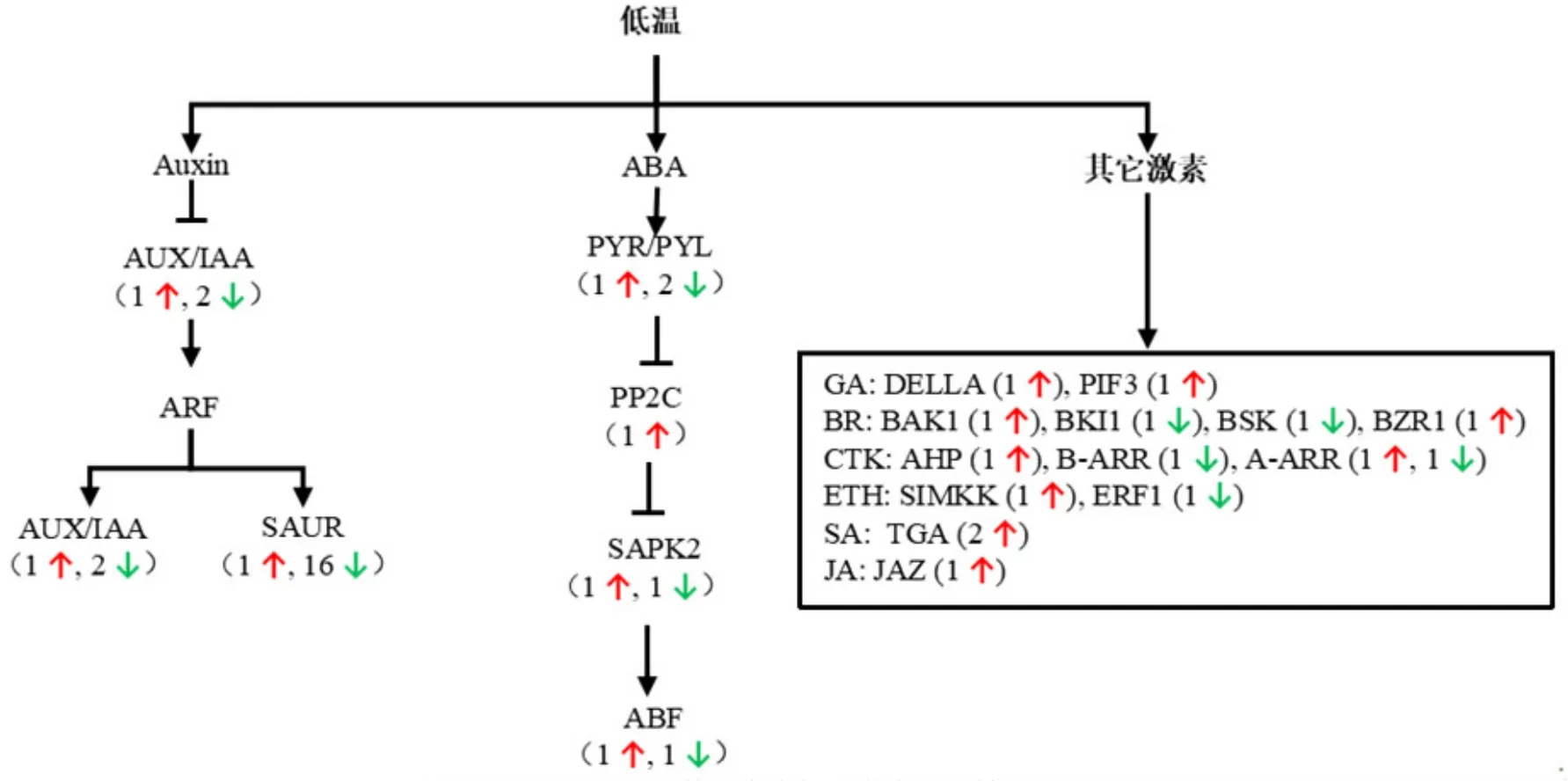
圖4 參與植物激素信號通路的低溫應答DEGs
2.6 熒光定量PCR分析DEGs
為驗證轉錄組測序結果的準確性,挑選2個BvDREBs和12個auxin和ABA響應DEGs比對qRTPCR和RNA-seq定量結果。由圖5和圖6可知,2種方法檢測到的基因表達模式結果基本一致。RNA-seq同樣檢測到BvDREBA1和BvDREBA4在低溫處理24 h后表達量顯著上調,變化倍數分別為159倍和19倍。在auxin介導的信號通路中,分別挑選了3個SAUR和ABP19a進行基因表達模式的測定。這些基因的表達趨勢與轉錄組測序結果相符。BvSAUR21、BvSAUR50和BvSAUR64均在低溫處理3 h內表現出顯著下調,變化倍數4.8~7.2倍,且在低溫處理48 h基因表達水平進一步降低。3個BvABP19a基因則受到低溫誘導表達,基因水平在處理24 h后達到最大值,上調倍數超過20倍。在ABA響應通路中,編碼ABA受體蛋白的PYL1和PYL8基因表達均受低溫處理顯著抑制,并且隨著低溫持續基因表達水平逐漸降低。然而,位于PYL下游的基因則對低溫處理表現出不同的響應。BVRB_1g008630和BVRB_6g138530均編碼蛋白激酶SAPK2,在低溫處理后12 h內基因水平分別顯著下調8倍和上調2.9倍。相似地,BVRB_7g163980和BVRB_7g169340均編碼轉錄因子ABF2,低溫處理24 h后基因水平分別下調11.6倍和上調2.6倍。

圖5 qRT-PCR和RNA-seq檢測低溫脅迫過程中BvDREBs表達模式
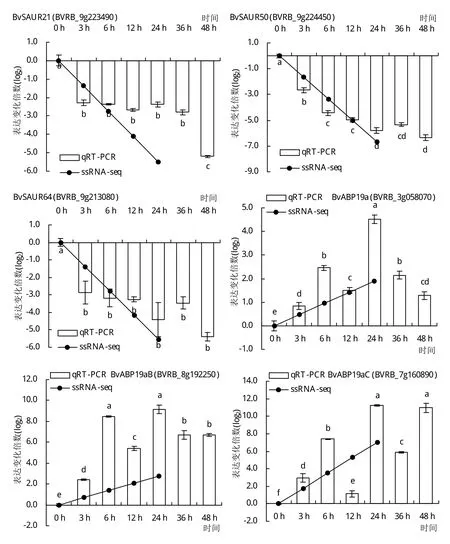
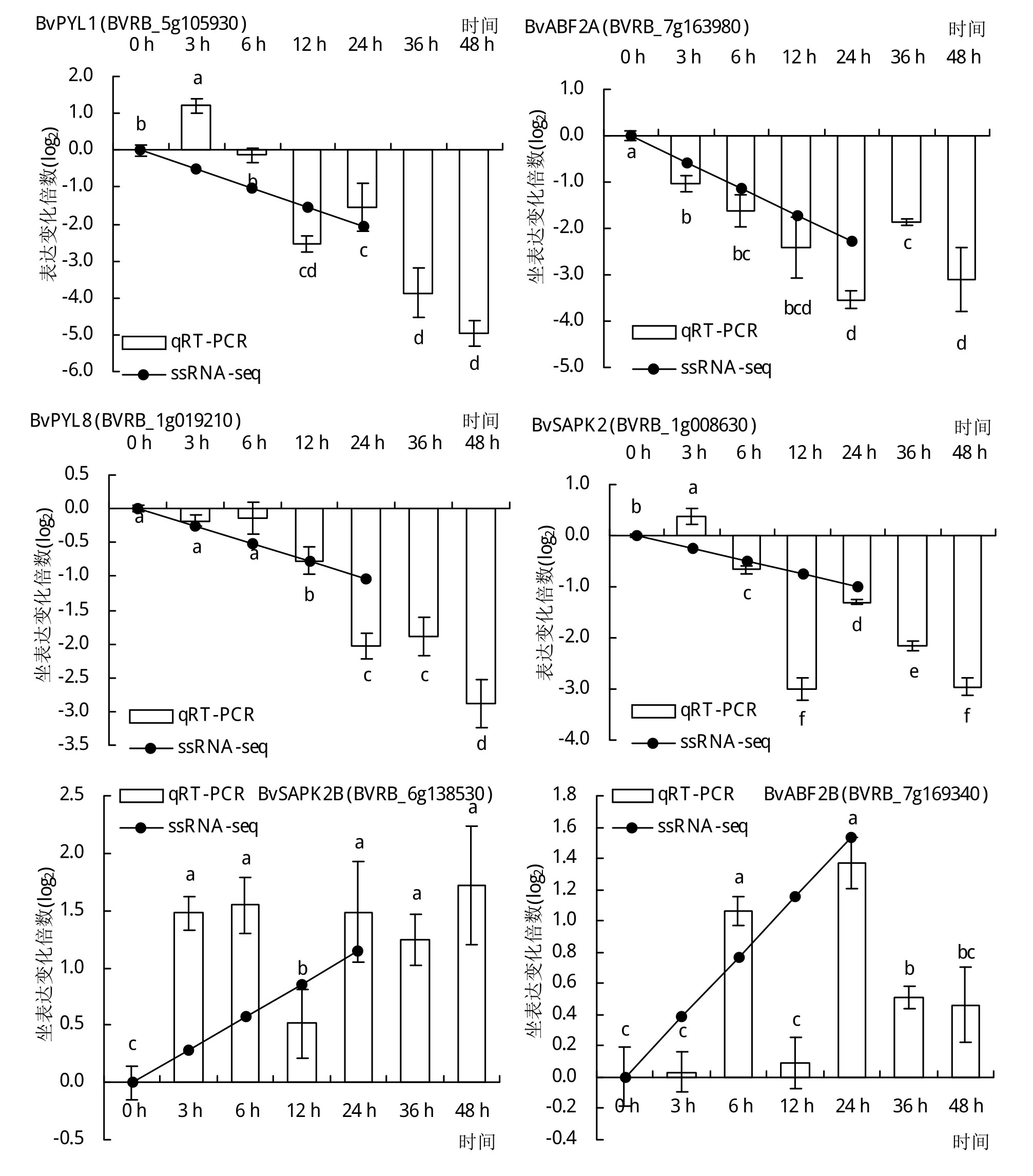
圖6 qRT-PCR和RNA-seq分析低溫脅迫下參與auxin和ABA信號通路的DEGs表達模式
3 討論
CBF/DREB途徑是植物低溫應答中保守的主效途徑[21]。AtDREBs受低溫誘導后,數小時內表達量就會達到頂峰,并隨著低溫持續表達水平逐漸下調。通過對cbf突變體研究表明,AtDREBs參與Ca2+、激素信號、碳代謝等途徑基因的激活與抑制[22]。本研究結果表明,BvDREBs基因表達模式與擬南芥AtDREBs表達模式相似。低溫誘導24 h后表達量達到峰值,表明此時甜菜低溫應答被激活。進一步利用RNA-seq分析甜菜KWS9442品種在低溫處理前后的基因表達變化,從分子水平探究基因在調控甜菜低溫應答具有的重要作用。基于DEGs表達變化、GO富集和KEGG功能富集發現,auxin和ABA等激素介導的信號通路是甜菜響應低溫的重要方式。
Auxin主要在幼芽、幼葉、莖尖等具分生能力的組織中合成,作為植物必需的激素廣泛參與調控細胞分裂與大小、向光性、向地性等生長和發育過程[23]。ABP是一種能夠在酸性條件下結合auxin的糖蛋白,被認為是細胞質膜上的auxin受體,調控細胞伸長與分裂。過表達AtABP1或者外源施加ABP1純化蛋白和C-末端多肽均能激活auxin信號通路,增加葉片細胞大小[24]。相反,RNAi突變體細胞大小則顯著低于野生型[25]。在擬南芥中異源過表達OsABP57后,突變體在干旱脅迫和鹽脅迫條件下鮮重和根長均顯著高于野生型[26]。而在水稻中原位過表達OsABP57可以顯著促進水稻不定根形成,有助于水稻適應澇害引起的根系缺氧[27]。本研究低溫處理3 h后,分別有3個和2個BvABP19a基因水平發生顯著上調和下調。這暗示低溫環境能夠影響甜菜auxin信號通路,從而調控植株生長。此外,筆者檢測到16個BvSAUR基因表達受到低溫顯著抑制。SAUR作為最大的auxin早期應答基因家族,可以與PP2Cs相互作用并抑制其磷酸酶活性,從而激活促進細胞延伸,促進葉片的擴張和開放,增強下胚軸的伸長[28]。過表達AtSAUR19、AtSAUR41等多個SAURs基因均能夠促進細胞延伸生長,使細胞大小出現顯著變化[29-30]。一些研究還表明SAURs還與非生物脅迫防御相關。過表達AtSAUR19基因會延緩氣孔關閉,加速葉片失水[29]。擬南芥中異源轉化TaSAUR78后,突變體對鹽脅迫和干旱脅迫表現出更強的抗性,葉片中活性氧積累較野生型更低[31]。本研究共發現16個BvSAUR在低溫處理后顯著下調,其中BvSAUR50、BvSAUR64、BvSAUR21等變化倍數超過40倍。此外,BvPID、BvBG、BvIAA等多個參與auxin信號通路的基因表達也在低溫處理后受到抑制。這些基因的顯著下調暗示低溫條件下auxin信號通路可能調控甜菜生長以適應低溫環境。
ABA常被稱為脅迫反應激素,在根形態建成和非生物脅迫防御中起著關鍵作用[10-11]。通過對小麥[32]、水稻[33]、玉米[34]、葡萄[11]等的研究發現,低溫脅迫下外源ABA可以改變作物內源激素水平,使內源ABA含量增加,從而提高植物的抗寒性。這與低溫脅迫下外源ABA能夠提高甜菜抗氧化防護系統,從而增強甜菜抗逆性的研究結果一致[10]。PYR、PYL和RCAR家族成員被認為是ABA的主要受體,與ABA結合后構象發生變化[35]。隨后,識別PP2Cs并抑制其去磷酸化活性,導致蛋白激酶SAPK2被磷酸化[36]。磷酸化的SAPK2激酶活性被激活,催化轉錄因子ABFs發生磷酸化修飾,激活ABFs轉錄活性,促進啟動子區中含有ABRE元件的基因表達[37]。在水稻中,共有10個ABA信號通路基因在低溫處理后表現出顯著變化。其中,除1個PYR/PYL同源基因下調表達外,5個PP2C、2個SnRK2以及2個ABF同源基因均上調表達[38]。在胡蘿卜中,ABF1基因同樣受低溫誘導,表達水平在低溫處理24 h時達到峰值,上調5.47倍[39]。而在牛皮杜鵑中,12個PP2Cs基因在低溫處理后表現出相反的表達模式。同時,5個SnRK2s基因在低溫處理后顯著上調,1個表現出下調模式[40]。與這些結果相似,BvPYL、BvSAPK2、BvPP2C、BvABF基因表達水平均受到低溫顯著影響,說明ABA信號通路是甜菜響應低溫脅迫的主要信號通路之一。同時,本研究也發現這些基因對低溫響應并不一致。如在2個低溫應答的BvSAPK2中,BVRB_1g008630在低溫處理后基因表達受到顯著抑制,而BVRB_6g138530基因表達水平則顯著升高。相似地,2個BvABF2基因分別在低溫處理后表現出相反的表達模式。根據這些結果推測甜菜中可能存在由不同同源基因構成的多個ABA信號通路,甜菜通過激活與抑制不同ABA信號通路激活低溫脅迫防御。這些不同ABA信號通路在甜菜生長發育與低溫脅迫防御中具體調控哪些生物過程仍值得進一步研究。
4 結論
本研究對低溫處理前后甜菜轉錄組變化進行分析,鑒定到3061個低溫應答的DEGs。對這些DEGs功能富集發現,激素介導的信號通路在甜菜低溫應答中具有重要作用。其中,auxin和ABA信號通路與低溫脅迫密切相關。在auxin信號通路中DEGs主要為BvABP19a和BvSAUR,而在ABA信號通路中BvPYL、BvSAPK2、BvABF響應低溫脅迫。這些基因對甜菜低溫脅迫防御的調控作用值得進一步研究。本研究結果將為進一步解析甜菜響應低溫脅迫的分子機制提供重要信息。

