原發性肝癌中西醫結合介入診療專家共識(試行第一版)
2019年肝癌中西醫臨床協作專家委員會
原發性肝癌是世界常見的惡性腫瘤之一。2018年,全球肝癌新發841 080例(中國占48.4%),死亡781 631例(中國占57.3%),嚴重危害人民的健康[1-2]。其病理類型主要是肝細胞癌(91.5%)、膽管細胞癌(5.5%)、肝細胞與膽管細胞混合型肝癌(3%),三者在發病機制、分子特征、生物學行為、病理組織學形態、臨床表現、治療方法及預后等方面差異較大。本共識所講的“肝癌”特指肝細胞癌。中醫古籍中雖無“原發性肝癌”或“肝癌”的病名,但肝癌可歸屬于中醫學中“肥氣”、“積聚”、“肝積”、“癖黃”、“鼓脹”、“癥瘕”、“痞氣”、“脅痛”等范疇[3]。目前,肝癌的根治性方法有3種:肝移植、手術切除和消融治療,3種治療方法的5年生存率分別為66%、53%和52%[4]。微創消融手術是在CT、MRI或者超聲的引導下,以熱消融為主,通過加熱、冷凍或不可逆電穿孔技術毀損腫瘤病灶的治療方法。肝癌中西醫結合診療是將傳統的中醫藥知識和方法與西醫微創治療的方法結合起來,在提高臨床療效的基礎上,闡明機制并獲得新認識的方法。
本共識由介入、中醫、腫瘤內科、外科、放療科、藥學、醫保、護理等多個學科的全國40余名專家,針對我國肝癌治療現狀,充分發揮中醫診療優勢和肝癌微創介入診療技術特點,同時經過對相關領域內文獻深入而廣泛的研究,結合臨床實際情況,數易其稿最終達成。
1 適用范圍
本共識以成人肝癌患者為對象,依托2019年重大疑難疾病中西醫臨床協作能力建設項目制定。從臨床診療的實際出發,詳細介紹了西醫篩查和診斷、消融和介入治療、中醫病機、辨證分型及治法等,力求突出“微創介入消融+中醫整體調治”的中西醫協作治療肝癌的特色。肝癌中西醫臨床協作專家委員會最終形成原發性肝癌中西醫結合介入診療專家共識,推薦給臨床和科研中的廣大中、西醫肝癌工作者。
2 發病因素與病因病機
肝癌的產生是多因素、多步驟的復雜過程,流行病學和基礎研究顯示,HBV和HCV感染、黃曲霉素、飲水污染、酒精濫用、肝硬化以及亞硝胺類物質等都與肝癌的發病有關。在我國,HBV感染是導致肝癌發生的主要因素,而黃曲霉素和飲水污染可能是最重要的促癌因素。腫瘤的發生常常是由于機體防御功能不足所致,如《醫宗必讀·積聚》指出:“積之成也,正氣不足,而后邪氣距之”說明機體正氣虛損,邪氣乘襲,結聚于肝,肝氣郁結,氣機受阻,血行不暢,痰瘀毒互結,形成痞塊,乃至肝癌[5]。中醫學認為,肝癌病是由于正氣虛損,邪氣乘襲,蘊結于肝,肝氣郁結,氣機受阻,血行不暢,痰瘀互結,形成痞塊。其與感受濕熱邪毒、長期飲食不節、嗜酒過度以及七情內傷等因素引起機體陰陽失衡有關。
消融或介入治療是肝癌患者常用的治療手段。研究顯示,肝癌患者經介入治療后40%以上發生惡心嘔吐、發熱、胸脅脹痛、脅肋部刺痛等4個癥狀,而口苦、納呆、脈弦、神疲乏力、口唇紫暗、脘腹脹滿的發生率在30%以上[6]。介入治療后肝癌病機發生變化,且有一定規律可循。中醫認為,消融或介入治療會影響機體氣機運行,易致氣機逆亂,而誘發惡心嘔吐及肝區脹痛、刺痛等癥,肝主疏泄,肝氣不暢,郁而化火,加之肝癌患者多脾虛內有痰濕,痰濕從火化,濕熱蘊結,出現口苦、發熱、神疲乏力、納呆等癥。舌脈象表現苔黃膩、脈弦等。因此,從中醫角度來看,消融或介入治療后的不良反應可屬于肝郁氣滯、濕熱內蘊的表現。
3 肝癌的篩查和診斷
3.1 肝癌的篩查
我國肝癌高危人群包括:HBV和/或HCV慢性感染、長期酗酒、非乙醇性脂肪性肝炎、食入黃曲霉毒素污染食物、肝內寄生蟲、各種原因引起的肝硬化、有肝癌家族史,尤其是年齡>40歲的男性患者。血清AFP和腹部超聲是早期篩查的主要手段,建議高危人群篩查間隔為3~6個月[7]。
3.2 肝癌的常規篩查措施
3.2.1 血清AFP及肝癌與膽管癌相關檢查輔助指標
肝癌診斷最常用的標志物是AFP,但有30%~40%的肝癌患者AFP水平正常;甲胎蛋白異質體(AFP-L3)和血漿游離微小核糖核酸有助于提高診斷率。此外,異常凝血酶原、肝細胞癌Ki-67(+)對亞臨床肝癌有早期診斷價值,糖類抗原(CA19-9)對早期膽管細胞癌有輔助診斷價值。
3.2.2 肝癌的影像學檢查
影像學檢查主要包括超聲、CT。影像學診斷主要依據“快進快出”的特點:動脈期強化,門靜脈期和/或平衡期腫瘤強化低于肝實質。此外,數字減影血管造影(digital subtraction angiography,DSA)可以明確顯示肝腫瘤數目、大小、血供及門脈血管有無侵犯[8];正電子發射計算機斷層成像(positron emission tomography/CT,PET/CT)和單光子發射計算機斷層掃描儀(SPECT-CT)可評價淋巴結轉移及遠處器官轉移、靶向藥物療效、指導放療生物靶區和穿刺活檢部位及腫瘤的惡性程度和預后[9-11]。
3.3 肝癌的病理學診斷
肝占位病灶或肝外轉移灶穿刺活檢或手術切除組織標本,經病理組織學和/或細胞學檢查,可明確診斷為肝癌,有助于明確病灶性質、病因、肝癌分子分型、指導治療和判斷預后[12]。
3.4 肝癌的西醫臨床診斷標準[13]
綜合肝癌高危因素、影像學特征及血清學分子標記物,對肝癌做出臨床診斷。肝癌診斷路徑見圖1。
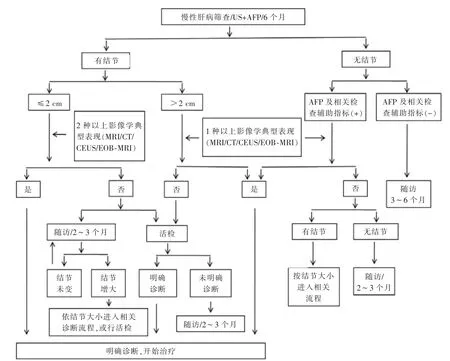
圖1 肝癌診斷路徑
3.5 肝癌消融或介入治療階段中醫證候分型
根據肝癌患者臨床表現,在消融或介入治療背景下,結合《腫瘤中醫診療指南》《惡性腫瘤中醫診療指南》《中藥新藥臨床研究指導原則(試行)》以及國內中醫腫瘤專家意見[3,5,14-16],微創消融或介入治療可視為一種致病因素,經治療后肝癌的病機發生了變化,消融或栓塞治療會影響機體氣機運行,易致氣機逆亂,誘發惡心嘔吐及肝區脹痛、刺痛等癥狀,而肝主疏泄,肝氣不暢,郁而化火,加之肝癌患者多脾虛內有痰濕,痰濕從火化,導致口苦、發熱、神疲乏力、納呆等濕熱蘊結征象加重。從中醫角度來看,微創消融或介入治療后中醫病機更傾向于氣滯血瘀證、濕熱內蘊證。故可將肝癌微創治療階段分為圍消融或介入治療階段(一般指微創手術開始至手術結束后4周內)及消融或介入治療后鞏固階段,具體證候分型如下。
3.5.1 圍消融或介入治療階段
(1)肝郁脾虛型
主癥:胃脘或脅肋脹痛明顯,口苦或干,情緒抑郁或急躁易怒,善太息,倦怠乏力,便溏不爽。
次癥:食少納呆,腸鳴矢氣,腹痛即泄、泄后痛減。舌苔白或膩,脈弦或細。
上述具備主癥3項(胃脘或脅肋脹痛必備),或主癥2項(胃脘或脅肋脹痛必備)加次癥/舌脈征2項即可診斷。
(2)氣滯血瘀型
主癥:胸脅脹滿走竄疼痛明顯,脅肋部刺痛、痛處不移,胸悶,情志抑郁或易怒,善太息,脘腹脹滿,面色晦暗。
次癥:納呆食少,脘悶噯氣,時有嘔惡,脅下痞塊,口唇紫暗或爪甲紫暗,形體消瘦,大便溏結不調。
舌質紫暗,有瘀斑、瘀點,苔薄白;脈弦或澀。
上述具備主癥3項(胸脅脹滿走竄疼痛必備),或主癥2項(胸脅脹滿走竄疼痛必備)加次癥/舌脈征2項即可診斷。
(3)濕熱蘊結型
主癥:脅肋脹痛灼熱,發熱汗出,惡心嘔吐,心煩易怒,口苦,納呆食少,神疲乏力,黃疸。
次癥:口干咽燥,煩渴不欲飲,大便粘膩,小便黃赤。
舌紅苔白膩或黃膩,脈弦滑或滑數。
上述具備主癥3項(脅肋脹痛灼熱必備),或主癥2項(脅肋脹痛灼熱必備)加次癥/舌脈征2項即可診斷,舌苔征象為必備。
(4)肝腎陰虛型
主癥:脅肋部隱痛,腰膝酸軟,五心煩熱或低熱,盜汗,口干咽燥,脅下痞塊。
次癥:形體消瘦,耳鳴,健忘,失眠多夢,頭暈,目眩。
舌紅少苔,或光剝有裂紋,脈沉細或細數或細澀。
上述具備主癥3項(脅肋部隱痛必備),或主癥2項(脅肋部隱痛必備)加次癥2項以及典型舌象(必備)即可診斷。
3.5.2 消融或介入治療后鞏固階段
早中期肝癌證型一般以肝郁脾虛、氣滯血瘀、濕熱內蘊、肝腎陰虛證型為主。消融或介入治療后,在鞏固階段的病機較圍消融或介入治療階段發生了變化,其濕熱內蘊及氣滯血瘀證型比例減少,而肝郁脾虛、肝腎陰虛型患者比例增加,且各證型的癥狀程度減輕。但是,對于晚期肝癌患者經消融或介入治療后未有效控制,病情進展,其證型以脾虛濕困、正虛毒結為主,具體證型如下。
(1)肝郁脾虛型
主癥:胃脘或脅肋脹痛,口干或口苦,食少納呆,倦怠乏力,便溏不爽。
次癥:情緒抑郁或急躁易怒,善太息,腸鳴矢氣,腹痛即泄、泄后痛減。
舌苔白或膩,脈弦或細。
上述具備主癥3項(胃脘或脅肋脹痛必備),或主癥2項(胃脘或脅肋脹痛必備)加次癥/舌脈征2項即可診斷。
(2)氣滯血瘀型
主癥:胸脅脹滿走竄疼痛,脅肋部刺痛、痛處不移,胸悶,情志抑郁或易怒,善太息,面色晦暗。
次癥:納呆食少,脘悶噯氣,時有嘔惡,脅下痞塊,口唇紫暗或爪甲紫暗,形體消瘦,大便溏結不調。
舌質紫暗,有瘀斑、瘀點,苔薄白;脈弦或澀。
上述具備主癥3項(胸脅脹滿走竄疼痛必備),或主癥2項(胸脅脹滿走竄疼痛必備)加次癥/舌脈征2項即可診斷。
(3)濕熱蘊結型
主癥:脅肋脹痛灼熱,發熱汗出,惡心嘔吐,偶心煩易怒,口苦。
次癥:納呆食少,神疲乏力,口干咽燥,煩渴不欲飲,大便粘膩,小便黃赤。
舌紅苔白膩或黃膩,脈弦滑或滑數。
上述具備主癥3項(脅肋脹痛灼熱必備),或主癥2項(脅肋脹痛灼熱必備)加次癥/舌脈征2項即可診斷,舌苔征象為必備。
(4)肝腎陰虛型
主癥:脅肋部隱痛,腰膝酸軟,五心煩熱或低熱,盜汗,口干咽燥。
次癥:形體消瘦,耳鳴,健忘,失眠多夢,頭暈,目眩。
舌紅少苔,或光剝有裂紋,脈沉細或細數或細澀。
上述具備主癥3項(脅肋部隱痛必備),或主癥2項(脅肋部隱痛必備)加次癥2項以及典型舌象(必備)即可診斷。
(5)脾虛濕困型
主癥:腹大脹滿,神疲乏力,頭身困重,肢體浮腫。
次癥:惡心欲嘔,口粘不欲飲,小便短少,大便溏稀或泄瀉。
舌淡,邊見齒痕,苔厚膩,脈細弦或滑或濡。
上述具備主癥3項(腹大脹滿必備),或主癥2項(腹大脹滿必備)加次癥2項以及典型舌象(必備)即可診斷。
(6)正虛毒結型
主癥:病勢進展迅速,腹脹或腹痛拒按,積塊膨隆,形體贏瘦。
次癥:頭暈耳鳴,低熱,或高熱煩渴,或牙宣鼻衄,大便干結,小便短赤。
舌紅少津,苔薄黃,脈弦數。
上述具備主癥3項(腹脹或腹痛必備),或主癥2項(腹脹或腹痛必備)加次癥2項以及典型舌象(必備)即可診斷。
4 肝癌的分期
肝癌的分期主要根據腫瘤的數目、大小、血管侵犯情況、肝外轉移、Child-Pugh分級(表1)、美國東部腫瘤研究協作組(ECOG)體力狀況(PS)評分(表2),目前國際上以巴塞羅那肝癌分期(BCLC)最為常用[17],BCLC分為5期(表3)。肝癌的分期及治療路徑見圖2。
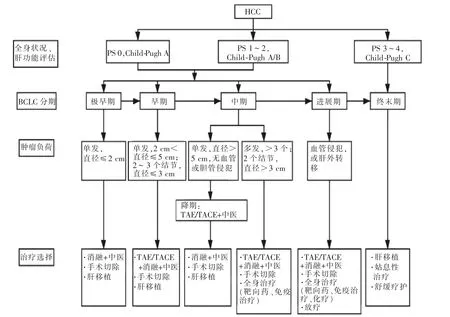
圖2 肝癌分期及治療路徑

表1 Child-Pugh分級

表2 PS評分標準
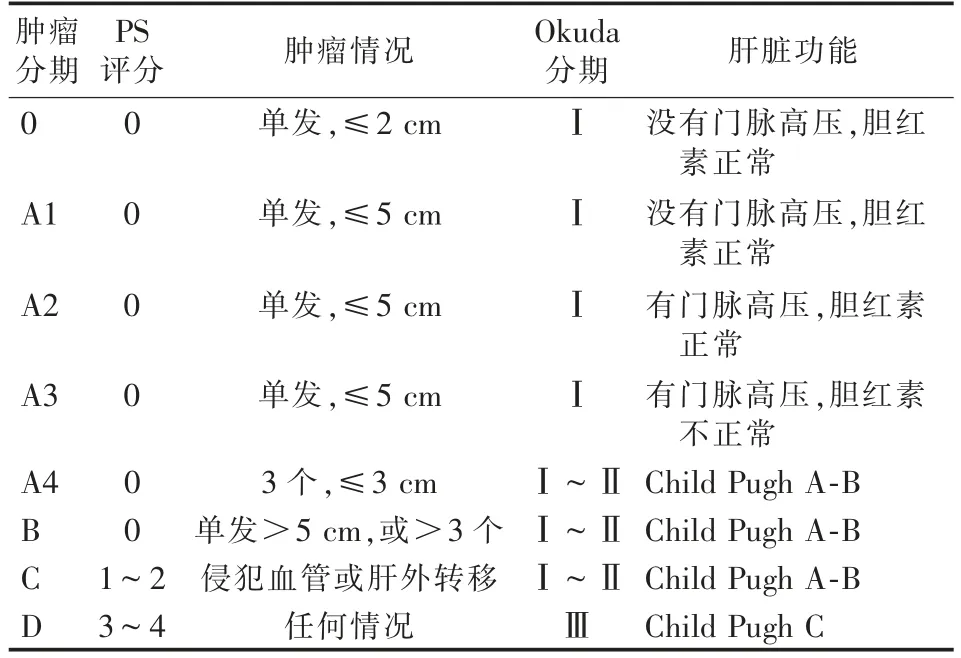
表3 BCLC分期標準
5 肝癌的消融治療
5.1 消融治療原則及目標
5.1.1 消融治療原則:①徹底性是指完全毀損腫瘤、消融邊緣充分,盡可能實現解剖性消融;②安全性是指最大限度地保留正常肝組織,降低病死率和并發癥。
5.1.2 消融治療目標:完全應答(CR)+延長患者生命+患者高質量生活。
5.2 物理消融及分類
物理消融是指通過加熱、冷凍或不可逆電穿孔技術毀損腫瘤病灶的治療方法,以熱消融為主[7,18]。影像引導技術包括超聲、CT和MRI;治療途徑包括影像引導下經皮、腹腔鏡和開腹3種,其中經皮消融創傷最小[9]。肝癌消融治療分類如下。
5.2.1 射頻消融:通過電極周圍組織中離子振蕩產熱使局部組織壞死,是較成熟的局部消融手段。
5.2.2 微波消融:通過極性分子在微波電磁場內的運動使局部組織壞死,具有速度快、消融范圍大、熱沉降效應小等優勢。
5.2.3 冷凍消融:通過低溫冷凍滅活腫瘤,無需鎮痛處理,能緩解腫瘤引起的疼痛。冷凍治療具有減輕腫瘤負荷、釋放腫瘤抗原,激活機體免疫功能等優點。
5.2.4 聚焦超聲消融:利用超聲波方向性、組織穿透性和可聚焦的特性,將超聲波自體外聚焦于體內病灶靶區,在其焦點區域形成高能密度區,產生不可逆性凝固性壞死。
5.2.5 不可逆電穿孔技術:其基于電極產生高壓直流電微秒脈沖,改變細胞跨膜電勢,在細胞膜上形成不可逆的孔隙,誘導細胞凋亡從而導致腫瘤死亡。主要用于鄰近重要空腔臟器、脈管系統及神經系統腫瘤消融。
5.3 消融治療適應證
5.3.1 以根治性為目的適應證:單發腫瘤最大直徑≤5 cm,或者腫瘤數目≤3個,最大直徑≤3 cm;沒有脈管癌栓和鄰近器官侵犯;肝功能Child-Pugh A或B級;患者體力狀況評分0~2;血小板≥50×109/L[7]。
5.3.2 以姑息性減瘤為目的適應證:單發腫瘤最大直徑>5 cm;或者腫瘤數目>3個,最大直徑>3 cm;或伴有脈管侵犯:亞肝段、肝段、肝葉門靜脈及膽管,單支肝靜脈癌栓;肝功能Child-Pugh A或B級;肝癌伴寡轉移;患者體力狀況評分0~2;血小板≥50×109/L[19-20]。
5.4 消融治療禁忌證
禁忌證:①Child-Pugh C級;②不可糾正的凝血功能障礙;③頑固性大量腹腔積液,惡液質;④彌漫型肝癌;⑤治療前1個月內有過食管(胃底)靜脈曲張破裂出血;⑥活動性感染,尤其是膽管系統急性炎癥等;⑦意識障礙,或不能配合治療;⑧其他臟器衰竭[21]。
5.5 消融術前準備
5.5.1 完善相關檢查及臨床評估:血常規、血生化、凝血功能、肝腎功能、腫瘤標志物、T淋巴細胞亞群、心電圖、胸部X線片和腹部影像學檢查,必要時行心肺功能檢查。
5.5.2 腫瘤評估:影像學評價腫瘤情況,選擇引導方式和消融設備。
5.5.3 知情同意:告知手術過程、風險及可能預后,獲得充分的知情同意。
5.6 消融治療方式
肝癌消融治療可以影像引導下經皮、腹腔鏡或開腹進行。
5.6.1 經皮局部消融治療
消融治療程序:①術前禁食12 h,禁飲4 h;②制定麻醉方案,全屏靜脈麻醉;鎮靜、鎮痛聯合局部麻醉;全身麻醉;③影像引導下,選擇合適消融方式,進行精準消融;④影像評價是否達到消融效果,如未達到預期效果,可行補救消融治療。
不同類型肝癌消融治療模式:①肝癌合并脾功能亢進(血小板<50×109/L,Child-Pugh A/B):消融術前可先行脾動脈部分栓塞,或口服升血小板藥物,必要時輸血小板,血小板≥50×109/L行消融治療;②常規部位早期肝癌:TAE/TACE序貫消融治療[7],也可單獨行消融治療;③肝癌高風險部位:高風險部位指腫瘤鄰近重要臟器≤5 mm,TAE/TACE序貫消融治療,對腫瘤鄰近高風險部位實施消融保護措施,術中影像學評估,判斷消融范圍,如腫瘤不能與重要空腔臟器分離開或已侵犯空腔臟器,應手術切除治療;④大肝癌(10 cm>直徑>5 cm)及巨塊型肝癌(直徑≥10 cm):TAE/TACE序貫消融治療,目的是腫瘤降期;精準引導消融,減少腫瘤內血供,降低消融治療出血的風險;大腫瘤可實施單次或分次消融治療,肝功能Child-Pugh A分次消融時盡量縮短間隔時間[20];⑤肝癌伴肝段或肝葉門靜脈癌栓:TAE/TACE序貫相應解剖性肝段或肝葉消融,目的是栓塞門靜脈癌栓使之縮小壞死;碘化油標記門靜脈癌栓精準引導布針消融,建議先消融門靜脈癌栓,再消融腫瘤主體,然后消融癌栓分布區域肝段或肝葉組織;若行肝段消融治療,肝功能應為Child-Pugh A/B;若行肝葉消融治療,肝功能應為Child-Pugh A;若癌栓位于肝外門靜脈,無法行消融治療,可在TAE/TACE基礎上聯合門靜脈癌栓放療序貫肝內腫瘤消融[22];⑥肝癌伴單支肝靜脈癌栓:行TAE/TACE+肝靜脈癌栓、瘤體消融及癌栓分布區域消融;⑦肝癌伴肝段膽管癌栓:行TAE/TACE+膽管癌栓、瘤體及膽管癌栓分布區域消融;⑧肝癌伴梗阻性黃疸:先行經皮肝穿膽道引流術或經內鏡逆行胰膽管造影術引流降期至TBIL≤50μmol/L,肝功能Child-Pugh A或B,患者體力狀況評分0~2,行TAE/TACE;符合消融治療適應證后,視腫瘤情況制定消融治療方案;⑨合并肝外寡轉移的肝癌:肝內病灶可行TAE/TACE序貫消融治療,肝外轉移病灶根據具體情況選擇局部治療方法,包括消融治療、放療、放射性粒子植入、骨水泥治療等;⑩肝癌伴慢性腎功能衰竭:注意保護腎功能,必要時在腎透析的基礎上配合肝癌栓塞或/和消融治療,也可直接消融。消融結束前,行增強CT/MRI或超聲造影掃描肝臟,根治性消融邊界達到0.5~1.0 cm,同時初步判斷有無并發癥的發生。
5.6.2 經腹腔鏡局部消融:適用于肝包膜下腫瘤,或者鄰近膽囊和胃腸,外生性腫瘤等[23]。
5.6.3 開腹消融:上述2種消融方法難以實行或手術探查發現腫瘤無法切除者。
5.6.4 術后對癥支持治療:術后常規不用禁食,鄰近空腔臟器腫瘤消融,根據具體情況調整禁食、禁水時間。監測生命體征24 h,臥床12 h以上,監測血常規和肝腎功能。同時,根據患者臨床表現,結合具體情況,進行中醫辨證施治,予中醫藥綜合治療,預防術后并發癥。
5.7 并發癥的預防和處理[6]
肝癌消融治療并發癥的分類及分級可分為輕度和重度。輕度并發癥包括:A級,無需治療且無不良后果;B級,需少許治療且無不良后果(包括僅需一夜的觀察)。重度并發癥包括:C級,需要治療但住院時間延長<48 h;D級,需要系統治療,提高醫護級別,住院時間延長>48 h;E級,導致長久的后遺癥;F級,死亡。
5.7.1 消融后綜合征:消融后綜合征以發熱和疼痛為主要表現,西醫常規行退熱、止痛等對癥治療。
5.7.2 氣胸:少量氣胸,可自行吸收;中大量氣胸,可行閉式引流;張力性氣胸需負壓引流或外科手術。
5.7.3 腸瘺:禁食、水,胃腸減壓,及時行外科手術治療。
5.7.4 血紅蛋白尿:術后盡早行堿化尿液、補液、擴張血管。
5.7.5 感染:大腫瘤發生肝膿腫應及時行膿腫引流,應用敏感抗生素,配合中藥湯劑治療,減輕患者發熱等不適癥狀,增加抗生素療效。
5.7.6 消化道出血:明確出血原因,針對病因積極治療;肝動脈損傷引起的膽系出血需行肝動脈栓塞止血及膽囊引流。
5.7.7 腹腔或/和胸腔出血:動脈活動性出血,需行動脈導管栓塞止血,必要時行外科手術治療;非活動性出血,監測生命體征、血常規,給予止血藥治療。
5.7.8 腫瘤種植:避免多次穿刺,變換穿刺位點時要消融針道。
5.7.9 肝功能衰竭:嚴格掌握適應證,禁用何首烏、黃藥子、雷公藤等損傷肝功能的藥物。
5.8 消融治療效果評價
消融術后即刻或24 h內行三期CT/MRI或行超聲造影,以評價消融療效。
5.8.1 完全消融(complete response,CR):肝臟三期CT/MRI或超聲造影,腫瘤消融病灶動脈期未見強化,瘤周0.5~1.0 cm消融邊界。
5.8.2 不完全消融(incomplete response,ICR):肝臟三期CT/MRI或超聲造影發現,腫瘤病灶內局部動脈期有強化,提示腫瘤殘留。
6 肝癌的TAE/TACE治療
TAE/TACE目前是肝癌非手術治療最常用方法之一[24]。
6.1 適應證
①對BCLC A期、B期、C期(肝段肝葉門靜脈癌栓,Child-Pugh A/B,體力狀況評分0~2)可行TAE/TACE序貫消融或手術切除;②對多發肝內轉移(腫瘤病灶個數≥5)、肝腫瘤破裂出血或肝動脈-門脈靜分流造成門靜脈高壓消化道出血可行TAE/TACE;③對門靜脈癌栓累及主干,且側支血管形成,Child-Pugh A,可TAE/TACE聯合門脈癌栓適形放療;④腫瘤占全肝體積≥70%,若Child-Pugh A、B,可分次行TAE/TACE減瘤、減癥、降期治療。
6.2 禁忌證
①肝功能Child-Pugh C;②無法糾正的嚴重凝血功能障礙;③門靜脈主干完全被癌栓占據,且無側支血管形成;④合并活動性肝炎或嚴重感染者;⑤惡液質或多器官功能衰竭者;⑥腫瘤占全肝體積≥70%,且Child-Pugh C。
6.3 操作程序[25]
6.3.1 肝動脈造影:通常采用Seldinger方法,經皮穿刺股動脈或橈動脈插管,導管置于腹腔干或肝總動脈行DSA造影。
6.3.2 根據肝動脈插管栓塞、消融術前碘化油標記腫瘤精準引導消融治療:通常分為①TAE:白細胞計數<3.0×109/L、血小板計數<60×109/L、血紅蛋白<90 g/L的患者,微導管超選擇腫瘤供血動脈,先用碘化油標記腫瘤,碘化油注入量以顯示腫瘤輪廓為宜,再用顆粒栓塞劑栓塞腫瘤的供血動脈。②TACE:白細胞計數≥3.0×109/L、血小板計數≥60×109/L、血紅蛋白≥90 g/L的患者,微導管超選擇腫瘤供血動脈,化療藥物與碘化油混合在一起或分別注入,碘化油標記腫瘤,顆粒栓塞劑栓塞腫瘤供血動脈。
6.4 化療藥物選擇
常用化療藥物包括表阿霉素、絲裂霉素C、順鉑、奧沙利鉑、5-氟尿嘧啶(5-Fu)、雷替曲塞、羥基喜樹鹼(HCPT)等。化療藥物劑量根據患者的體表面積計算,一般為系統化療劑量的1/2或2/3。
6.5 栓塞劑選擇
6.5.1 碘化油:與化療藥物混合,可作為化療藥物的載體,在腫瘤內緩慢釋放,延長化療藥的作用時間。
6.5.2 顆粒性栓塞劑:包括明膠海綿顆粒、聚乙烯醇顆粒和標準粒徑微球,也可使用載藥微球。
6.6 TAE/TACE并發癥及處理
常見不良反應會持續1~7 d,對癥治療后多數可以恢復。
6.6.1 栓塞后綜合征:動脈栓塞后引起腫瘤組織缺血、壞死,引起發熱、疼痛,予退熱、止痛對癥治療。
6.6.2 惡心、嘔吐:與化療藥物有關,給予抑酸、保護胃黏膜、止吐治療。
6.6.3 穿刺部位出血、白細胞下降、一過性肝功能異常、異位栓塞、腎功能損傷以及排尿困難等其他不良反應,可予相應對癥治療。
7 肝癌消融或介入治療患者中醫辨證治療
肝癌消融或介入治療患者中醫辨證治療應采取辨病與辨證相結合的原則,根據不同的西醫治療背景、患者身體狀況及臨床表現,選擇不同的中醫治療方式,中醫藥可發揮增強體質、促進康復、協同增效、減輕不良反應、鞏固療效等作用[26-27]。
在圍消融或介入治療階段,中醫藥治療可以減輕消融或介入治療的不良反應,提高患者耐受性、生活質量及患者的治療依從性,保證治療計劃進行,增強消融或介入治療效果。
在消融或介入治療后的鞏固階段,中醫藥治療,一方面可以提升患者身體機能,改善體質,提高生活質量;另一方面,有可能延長消融或介入治療后的疾病緩解期,進而延長患者的生存期。
7.1 中藥湯劑治療
7.1.1 圍消融或介入治療階段
(1)肝郁脾虛型
治法:調肝理脾
中藥湯劑:六君子湯合大柴胡湯加減。
藥物組成:黨參、白術、茯苓、甘草、陳皮、半夏、柴胡、枳實、黃芩、白芍、酒大黃、生黃芪等。
(2)氣滯血瘀型
治法:行氣活血
方藥:柴胡疏肝散合金鈴子散加減。
藥物組成:陳皮、柴胡、川芎、香附、枳殼、白芍、川楝子、元胡、茯苓、當歸、郁金等。
(3)濕熱蘊結型
治法:清熱利濕
方藥:茵陳蒿湯加減。
藥物組成:茵陳蒿、梔子、黃芩、豬苓、茯苓、車前子、金錢草、生薏米、白豆蔻、竹葉、柴胡等。
(4)肝腎陰虛型
治法:養陰清熱,軟堅散結。
中藥湯劑:滋水清肝飲加減。
藥物組成:茯苓、白芍、當歸、生地黃、枸杞子、丹皮、山藥、山茱萸、柴胡、鱉甲、炒梔子等。
7.1.2 消融或介入治療后的鞏固治療
經消融或介入治療后,鞏固階段的證型與之前圍消融或介入治療階段不同,其濕熱內蘊及氣滯血瘀證型比例減少,肝郁脾虛、肝腎陰虛型患者比例增加,且各證型的癥狀程度減輕。臨床研究發現,消融或介入治療后的鞏固治療階段,肝郁脾虛型患者占絕大多數[27]。因此,該階段中藥湯劑治療可參考圍消融或介入治療階段用藥。
此外,對于消融或介入治療無效或不能耐受消融或介入治療的晚期患者,中醫藥治療可以改善患者不適癥狀,提高生活質量,延長生存期,其治療如下。
(1)脾虛濕困型
治法:健脾溫陽,利濕消腫
中藥湯劑:實脾飲合五苓散加減。
藥物組成:白術、厚樸、木瓜、木香、草果、檳榔、茯苓、干姜、制附子、炙甘草、生黃芪、桂枝、香附、豬苓、澤瀉、龍葵、半枝蓮、鱉甲等。
(2)正虛毒結型
治法:扶正祛邪、解毒散結
中藥湯劑:鱉甲煎丸加減。
藥物組成:鱉甲膠、阿膠、蜂房、土鱉蟲(炒)、柴胡、黃芩、半夏、黃芪、黨參、干姜、厚樸、桂枝、白芍、丹皮、酒大黃、元胡、凌霄花、澤蘭、瞿麥等。
7.1.3 中醫扶正方(基礎方)
臨床實踐發現,部分患者行消融或介入治療后無明顯不適癥狀,中藥可防治消融或介入治療后并發癥[26]。因此,給予患者中藥治療,以防止并發癥的出現,具體方藥組成如下:生黃芪30 g,太子參20 g,茯苓15 g,生白術15 g,醋柴胡12 g,制鱉甲20 g,女貞子15 g,木香10 g,黃芩10 g,姜半夏10 g,赤芍12 g,炙甘草10 g,枳殼12 g。
7.2 消融或介入術后相關不良反應的治療
7.2.1 中醫藥防治消融或介入術后發熱
發熱是肝癌消融或介入術后常見的不良反應之一。中醫辨證多屬肝脾不和,郁熱內生。治宜疏肝清熱,健脾和營。推薦方劑:小柴胡湯加減。
低熱:多屬陰虛火旺,可加青蒿、地骨皮、丹皮、生地、鱉甲等滋陰清熱。高熱:熱在氣分,可加生石膏、滑石、寒水石;熱在營血,則加水牛角、羚羊角,也可用清開靈、雙黃連注射劑、牛黃清熱散等。
7.2.2 中醫藥防治介入栓塞征
TACE術后80%以上患者出現肝區疼痛、惡心、嘔吐等不良反應,稱為栓塞后綜合征。中醫辨證多為肝郁脾虛,中藥治療以調肝理脾為法。推薦方劑大柴胡湯合香砂六君子湯加減。
若辨證屬脾胃虛寒證者,推薦理中湯加減(人參、白術、干姜、甘草)以溫中散寒,補氣健脾。
7.2.3 中醫藥防治化療相關骨髓抑制
肝動脈灌注化療術或栓塞化療后,因為化療藥物引起骨髓抑制,導致白細胞、血小板等減少。中醫辨證多屬脾腎虧虛,氣血不足。治宜健脾益腎,補氣養血。推薦方劑應用郁仁存教授經驗用藥處方“生血湯”隨證加減(黃芪30 g、黃精15 g、枸杞子15 g、雞血藤15 g、菟絲子15 g、山茱萸10 g等)。
7.3 常用中成藥及中藥注射液
現代藥理學研究表明,部分中藥能夠抑制腫瘤細胞生長及殺滅腫瘤細胞,還具有增強體質、促進康復、協同增效、減輕不良反應、鞏固療效等作用,近年來中成藥廣泛應用于肝癌的輔助治療,并取得了較好的療效。常用中成藥及其功能見表4。

表4 常用中成藥及其功能
7.4 中醫非藥物療法
中醫非藥物療法主要包括針刺、艾灸、耳穴壓丸、穴位貼敷等,在減輕消融或介入術后疼痛、胃腸道不良反應、骨髓抑制等方面具有一定優勢。
針刺:用于減輕消融或介入治療引起的疼痛、胃腸道不良反應等,疼痛取穴常選足三里、三陰交、合谷、行間、血海、陰陵泉、肝俞;胃腸道不良反應取穴常選足三里、太沖、合谷、內關、三陰交、中脘。
灸法:用于預防或輔助治療圍消融或介入治療期間出現的惡心嘔吐及骨髓抑制等,艾條灸取穴常選大椎、膈俞、足三里、涌泉、氣海、關元。
耳穴壓丸:用于預防或輔助治療圍消融或介入治療期間出現的疼痛、惡心嘔吐等不良反應,耳穴取穴常選神門、皮質下、交感、肝、脾、胃。
穴位貼敷:用于預防或輔助治療圍消融或介入治療期間出現的疼痛、惡心嘔吐等不良反應。術后疼痛可用大黃、黃芩、黃連、黃柏、薄荷制成藥膏直接敷于腹部疼痛最明顯處(阿是穴)。惡心、嘔吐者選用生姜、半夏、菖蒲制成藥膏分別敷于雙側合谷、內關、足三里穴位處。
8 分子靶向藥物治療[28]
一線藥物:索拉非尼、樂伐替尼;二線藥物:瑞格芬尼。
適應證:肝功能Child A或B級,無法行根治性治療的肝癌患者;肝癌根治術后的高危復發、腫瘤破裂、病理證實有淋巴結轉移。常見不良反應:腹瀉、體質量下降、手足綜合征、皮疹、心肌缺血及高血壓等。
9 肝癌消融或介入治療全過程健康管理與調護
9.1 隨訪
術后前3個月,每月復查CT/MRI或超聲造影、肝功能和腫瘤標志物,如連續3個月無新發和轉移,以后每3個月復查1次。
9.2 中醫辨證施護
9.2.1 肝郁脾虛證
(1)調整情緒:此型患者對待事物較為敏感,護理人員態度要和藹,工作要耐心細致,與患者交談,加以疏導和鼓勵,培養樂觀情緒;對于精神抑郁較嚴重者,可用喜悅療法:即應用恰當的言行、事物,使患者情志怡悅,心情舒暢,以達到氣機調暢,營衛調和,經脈通利之功。
(2)飲食以素食為主,少量多餐。宜食用蘿卜、菠菜、蕃茄、芹菜、山藥、冬瓜、柑橘、金橘等,慎食香燥之品。
9.2.2 氣滯血瘀型
(1)調整情緒:積極疏導、鼓勵患者,使患者心情愉快,氣機舒暢。
(2)宜食高熱量、易消化食物,避免食用厚膩之品。
9.2.3 濕熱蘊結證
(1)節制飲食,注意飲食規律,食量適中,冷熱軟硬適宜,勿偏嗜五味,匆貪食肥甘、厚膩、生冷、燥熱之品。
(2)宜多食具有健脾利濕作用的食品,如茯苓、玉米須、赤小豆、薏米、山藥、黑豆、冬瓜。忌用苦寒傷脾、豁痰破氣之品。慎用辛辣之品。
9.2.4 肝腎陰虛證
(1)宜食清涼多津食品,忌食辛辣之品。
(2)多休息,勿勞累。
9.2.5 脾虛濕困證
(1)作息時間規律,節制飲食。
(2)宜多食具有健脾利濕作用的食品,如茯苓、玉米須、赤小豆、薏米、山藥、黑豆、冬瓜。忌用苦寒傷脾、豁痰破氣之品。慎用辛辣、肥甘厚膩及生冷之品。
9.2.6 正虛毒結證
(1)積極疏導、鼓勵患者,舒暢心情。
(2)宜食高熱量、高蛋白、易消化食物,避免食用辛辣、厚膩、生冷之品。
肝癌中西醫協作治療原則:肝癌高發人群應定期篩查,早期發現、早期診斷,可早期采用微創消融或TAE/TACE序貫消融治療,也可采取切除及肝移植治療;對中晚期肝癌微創治療聯合中醫扶正、辨證施治、全過程健康管理及調護,才能使肝癌防治有新的突破。
10 展望
建立肝癌早期篩查、早期診斷、早期治療模式,項目以中西醫結合腫瘤微創診療中心一、十、百、千、萬工程(一個項目中心、十個省級區域中心、一百個地市級中心、輻射一千個區縣級醫院、培養萬名醫護技管人員)的模式在全國推廣實施,并進行多中心的病例數據庫注冊登記,以大數據形式支撐并完善專家共識,提供高級別的理論依據,并為國家在腫瘤診療項目政策制訂提供依據。
在此項目已制訂的多影像引導腫瘤微創手術室全國團體標準、腫瘤微創治療技術管理規范的基礎上,以項目為依托,以全國培訓班的形式開展中西醫結合肝癌微創治療規范化培訓,為中西醫結合腫瘤微創診療中心一、十、百、千、萬工程培養人才隊伍;在全國推進中西醫結合腫瘤微創學科體系建設,制訂出不同層級規模腫瘤微創中心認證標準,對中心開展醫療服務認證工作,形成計劃(plan)、執行(do)、檢查(check)、處理(act),即PDCA可持續改進的管理模式,以醫療服務認證推進中西醫結合腫瘤微創診療同質化醫療進程。
[參與本共識討論專家 編寫工作組組長:鄭加生,楊國旺。編寫工作組成員(按姓氏漢語拼音排序):樊慶勝(首都醫科大學附屬北京中醫醫院腫瘤科)、高 寵(首都醫科大學附屬北京中醫醫院腫瘤科)、蔣益蘭(湖南省中醫藥研究院附屬醫院腫瘤科)、龍 江(首都醫科大學附屬北京佑安醫院肝病與腫瘤微創介入治療中心)、馬 良(首都醫科大學附屬北京佑安醫院肝病與腫瘤微創介入治療中心)、念家云(首都醫科大學附屬北京中醫醫院腫瘤科)、吳玉華(湖南省中醫藥研究院附屬醫院)、張永宏(首都醫科大學附屬北京佑安醫院肝病與腫瘤微創介入治療中心)、楊國旺(首都醫科大學附屬北京中醫醫院腫瘤科)、鄭加生(首都醫科大學附屬北京佑安醫院肝病與腫瘤微創介入治療中心)。
征求意見專家(按姓氏漢語拼音排序):陳 震(復旦大學附屬腫瘤醫院中西醫結合科)、崔云峰(天津醫大南開醫院肝膽胰外科)、郭 勇(浙江中醫藥大學附屬第一醫院腫瘤科)、金 龍(首都醫科大學附屬北京友誼醫院介入科)、李 平(安徽醫科大學第一附屬醫院中西醫結合腫瘤中心)、李 肖(中國醫學科學院北京協和醫學院腫瘤醫院介入科)、李曉光(北京醫院腫瘤微創治療中心)、李 威(首都醫科大學附屬北京地壇醫院腫瘤介入科)、劉 平(上海中醫藥大學附屬曙光醫院肝硬化科)、胡義揚(上海中醫藥大學附屬曙光醫院肝病研究所)、呂志平(南方醫科大學中醫藥學院)、潘 杰(中國醫學科學院北京協和醫院放射科)、施軍平(杭州師范大學附屬醫院肝病科)、吳萬垠(廣東省中醫院腫瘤科)、王華明(解放軍總醫院第五醫學中心介入科)、王維虎(北京大學腫瘤醫院放射治療科)、王曉東(北京大學腫瘤醫院介入科)、王沛陵(首都醫科大學附屬北京佑安醫院醫保辦)、武 清(上海中醫藥大學附屬龍華醫院腫瘤科)、肖越勇(解放軍總醫院第一醫學中心放射科)、薛文翰(甘肅省腫瘤醫院中西醫結合科)、楊武威(解放軍總醫院第五醫學中心腫瘤微創科)、楊正強(中國醫學科學院北京協和醫學院腫瘤醫院介入科)、于友濤(解放軍總醫院第四醫學中心介入科)、張洪亮(新疆自治區中醫醫院腫瘤科)、張洪義(首都醫科大學附屬北京天壇醫院普外科)、朱 旭(北京大學腫瘤醫院介入科)、邢秀亞(首都醫科大學附屬北京佑安醫院肝病與腫瘤微創介入治療中心護理部)、周志凌(珠海市人民醫院藥學部)。
執筆:龍 江、高 寵。]

