超重力法制備高分散性鎂鋁水滑石及其對鈾酰離子的吸附性能①
尹朝旺,顏文斌
(吉首大學 化學化工學院,湖南 吉首 416000)
作為一種清潔能源,核能已成為緩解世界能源短缺的替代方案。在核能開發和利用過程中,大量含鈾廢水不可避免地通過核燃料循環活動釋放到環境中,如果對廢水不加處理,必將對生態環境和人類健康產生嚴重危害。吸附法由于效率高、成本低以及操作簡單,被認為是最具發展潛力的含鈾廢水處理方法。
鎂鋁水滑石(Mg-Al-LDHs)是由鎂和鋁2種金屬的氫氧化物組成的化合物,具有層狀結構。焙燒后,層間陰離子被去除,成為層狀雙氧化物(LDO)。LDO能夠重新吸收陰離子恢復原有的層狀結構[1-2]。因其獨特的結構記憶效應和特殊的層間結構,LDHs和LDO具有優異的離子交換或吸附性能,在選擇性吸附與分離、催化以及環境保護等領域具有廣泛應用潛力[3-6]。但采用傳統的水熱合成法和共沉淀法制備鎂鋁水滑石,在正常重力下,反應原料微觀混合不均,以及樣品表面存在大量非架橋羥基,在干燥過程中相鄰顆粒間能通過氫鍵作用結合在一起,導致產物分散性差、粒徑分布不均勻[7]。粒徑分布及顆粒分散性嚴重影響鎂鋁水滑石的性能,因此,制備粒徑均勻、高分散性的鎂鋁水滑石成為一個研究熱點[8-11]。本文選用超重力旋轉床作為反應器,能極大地強化反應物料的傳質和反應過程,避免常規條件下反應原料微觀混合不均等缺點,使反應物料在反應過程中從微觀上混合均勻,從而制備出粒徑分布均勻的超細鎂鋁水滑石,同時通過非均相共沸蒸餾在微細鎂鋁水滑石干燥過程中有效防止粉體團聚。將鎂鋁水滑石應用于含鈾廢水的處理,考察了其對鈾酰離子的吸附性能。
1 實 驗
1.1 主要試劑及原料
主要試劑包括硝酸鎂(Mg(NO3)2·6H2O)、硝酸鋁(Al(NO3)3·9H2O)、尿素(CO(NH2)2)、異丁醇(C4H10O)、無水乙醇(C2H6O)、硝酸(HNO3)、氫氧化鈉(NaOH)、無 水 乙 酸 鈉(CH3COONa)、氯 乙 酸(C2H3ClO2)、偶氮胂Ⅲ(C22H18As2N4O14S2),購自天津市天力化學試劑有限公司,均為分析純。硝酸鈾酰(UO2(NO3)2·6H2O),來自湖北楚盛威化工股份有限公司。實驗用蒸餾水自制。
1.2 超重力床實驗裝置
超重力旋轉床示意圖如圖1所示。反應過程中物料在高速旋轉通道中受到相等于重力幾百倍的離心力作用,極大地強化了反應物料的傳質和反應過程,使反應物料從微觀上混合均勻[12-14]。

圖1 超重力旋轉床示意
1.3 超重力法制備鎂鋁水滑石
按n(Mg2+)∶n(Al3+)=2.5∶1、n[CO(NH2)2]∶n(Mg2++Al3+)=10∶1,稱取一定量CO(NH2)2,使用去離子水溶解后,加入到儲料槽1中;稱取一定量Mg(NO3)2·6H2O溶液和Al(NO3)3·9H2O溶液加入到儲料槽2中。開啟超重力床,逐步調節轉速到1 000 r/min,開啟循環泵,準確控制流量計,使2種混合溶液在系統中循環,定時記錄pH值,反應一段時間后,待pH值趨于穩定,卸下料漿。流程如圖2所示。所得料漿加入晶化釜中,在150℃下晶化8 h,然后過濾,在濾餅中加入輔助分散劑異丁醇,放入超聲波反應器中,超聲5 min,使物料混合均勻,然后放入烘箱中100℃下共沸蒸餾干燥,充分研磨后得到鎂鋁水滑石粉體(Mg-Al-LDHs)。
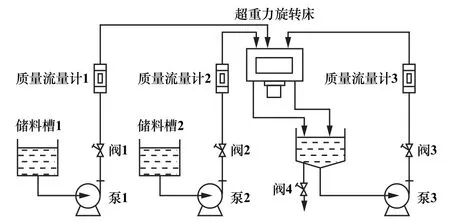
圖2 實驗流程
1.4 分析與測試
利用JEM-6300Ⅵ型掃描電子顯微鏡對樣品Mg-Al-LDHs進行TEM表征。利用D/Max-RB型X射線衍射儀對Mg-Al-LDHs進行XRD表征。利用BT-9300H型激光粒度分布儀分析Mg-Al-LDHs粒徑分布。利用X-Max型元素含量分析儀分析Mg-Al-LDHs樣品和吸附UO22+后的U-Mg-Al-LDHs樣品元素組成及含量。
1.5 鎂鋁水滑石對鈾酰離子的吸附實驗
鈾標準液、緩沖液、偶氮胂Ⅲ顯色劑配制及U(Ⅵ)的檢測方法見文獻[15]。
在錐形瓶中加入30 mL鈾標準溶液,使用NaOH溶液或HNO3溶液調節溶液pH值,加入Mg-Al-LDHs樣品0.01 g,將上述錐形瓶放入恒溫水浴振蕩反應器中,設定溫度為50℃進行吸附反應,120 min后取溶液上層清液,用微孔濾膜過濾后,利用紫外可見光分光光度計測定鈾酰離子濃度。
去除率和吸附量分別根據下式計算:

式中Y為UO22+去除率,%;C0、Ct分別為UO22+初始質量濃度、t時刻質量濃度,mg/L;qt為t時刻Mg-Al-LDHs對UO22+的吸附量,mg/g;V為含鈾廢水溶液體積,L;m為Mg-Al-LDHs質量,mg。
2 結果與討論
2.1 樣品SEM和XRD的表征
圖3為Mg-Al-LDHs樣品XRD圖譜。由圖3可見,Mg-Al-LDHs樣品XRD特征衍射峰無雜峰,峰形較窄且尖銳,表明產物純度高。Mg-Al-LDHs樣品XRD特征衍射峰的形狀和出峰角度與Mg0.667Al0.333(OH)2-(CO3)0.167(H2O)0.5(JCPDS card№89-0460)的相關參數相匹配,屬于典型的碳酸根插層型水滑石層狀結構[16]。圖4為Mg-Al-LDHs的SEM照片。由圖4可見,產物晶體完整,粒徑分布均勻,為六方片狀微細鎂鋁水滑石,尺寸為1~2.5μm。以上表征結果說明,采用超重力法可以制備出粒徑分布均勻的片狀微細鎂鋁水滑石。

圖3 樣品XRD圖譜

圖4 樣品SEM照片
2.2 超重力旋轉床法與傳統水熱合成法制備樣品比較
在相同物料配比和晶化溫度下,對比超重力旋轉床法與傳統水熱合成法制備鎂鋁水滑石樣品的粒徑分布,結果見圖5。由圖5可以看出,超重力旋轉床法制備的鎂鋁水滑石樣品粒徑分布窄,產物尺寸1~2.5μm,而傳統水熱合成法制備的樣品粒徑分布較寬,尺寸0.03~10μm。
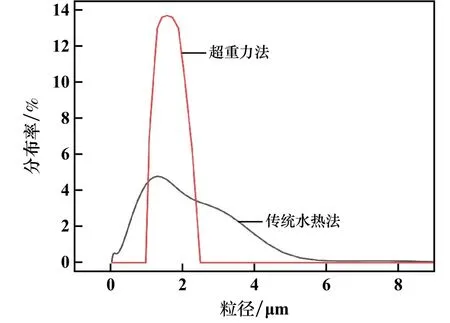
圖5 不同反應器制備Mg-Al-LDHs樣品粒度分布圖
制備粒徑分布均勻微細粉體的前提條件為:①反應成核區置于高度強化的微觀混合區;②必須將反應成核區和產物晶體的生長區分開。在普通反應器中,反應物料在微觀水平上完全混合均勻所需時間超過5 ms,并且產物成核需要的特征時間在1 ms左右。這樣在反應開始時,反應物料在微觀水平上沒有混合均勻,并且產生晶核;反應物料濃度不均勻將導致產物晶核尺寸不同,導致產物粒度分布不均勻。在超重力床中,物料傳質系數比常用反應釜提升10~1 000倍,傳質過程得到極大強化,物料微觀混合均勻所需時間大大縮短(0.4 ms到0.04 ms甚至更小),反應物料的濃度在很短時間內就達到非常均勻,產物成核在高度強化的微觀環境中進行,這樣生成的產物晶核大小均一,產品粒度分布范圍很窄[17]。
2.3 鎂鋁水滑石微細顆粒的團聚機理
具有高表面活性的細顆粒容易形成一些弱連接并聚結在一起,從而形成較大尺寸的團聚體,這種團聚一般是軟團聚,在后面的制備過程中可以通過研磨等方式進行分散。但鎂鋁水滑石表面存在大量非架橋羥基,顆粒表面的羥基和水分子之間能夠通過形成氫鍵產生橋聯作用,或者顆粒的表面羥基之間進行縮聚反應直接脫水,這樣就會造成在干燥過程中微細顆粒孔道發生收縮,產生致密且難以消除的硬團聚。因此,在干燥過程中嚴格控制羥基間的脫水縮聚反應以及顆粒表面的羥基和水分子之間通過氫鍵產生的橋聯作用,是防止最初生成的小粒子逐漸成為大粒子的關鍵步驟。
2.4 非均相共沸蒸餾干燥過程對團聚狀態的控制
在非均相共沸蒸餾干燥過程中,使用烷氧基取代顆粒表面上的非橋連羥基,以及使用醇取代顆粒表面上的配位水分子,可以消除共沸蒸餾干燥過程中由羥基引起的化學鍵合,從而控制生產粉體時產生硬團聚現象。本研究以異丁醇為溶劑,通過共沸蒸餾法最大限度地脫除Mg-Al-LDHs顆粒表面上的水分子,并利用—OC4H9基團取代顆粒表面上的非橋連羥基,從而有效防止Mg-Al-LDHs粉體的團聚。圖6為不同干燥法制備的鎂鋁水滑石樣品的SEM照片。由圖6可知,經過異丁醇共沸蒸餾干燥法所得鎂鋁水滑石樣品分散性好,顆粒間沒有團聚;而直接干燥法制備的鎂鋁水滑石樣品顆粒之間團聚嚴重。

圖6 不同干燥方法制備鎂鋁水滑石樣品的SEM照片
2.5 不同條件下Mg-Al-LDHs對鈾酰離子的吸附性能
2.5.1 UO22+初始濃度對Mg-Al-LDHs吸附性能的影響
在含鈾溶液30 mL、吸附溫度50℃、吸附時間120 min、pH=6、吸附劑投加量0.01 g條件下,研究了UO22+初始濃度對Mg-Al-LDHs吸附鈾酰離子的影響,結果見圖7。由圖7可見,隨著UO22+初始濃度增加,Mg-Al-LDHs對UO22+的吸附量逐漸增加,去除率逐漸降低。由此可見,UO22+初始濃度對Mg-Al-LDHs吸附性能影響很大。作者到有關鈾礦冶企業進行調研,發現工廠待處理的含鈾廢水中UO22+濃度約為35 mg/L,因此,選擇UO22+初始濃度35 mg/L的模擬廢水作為研究對象。
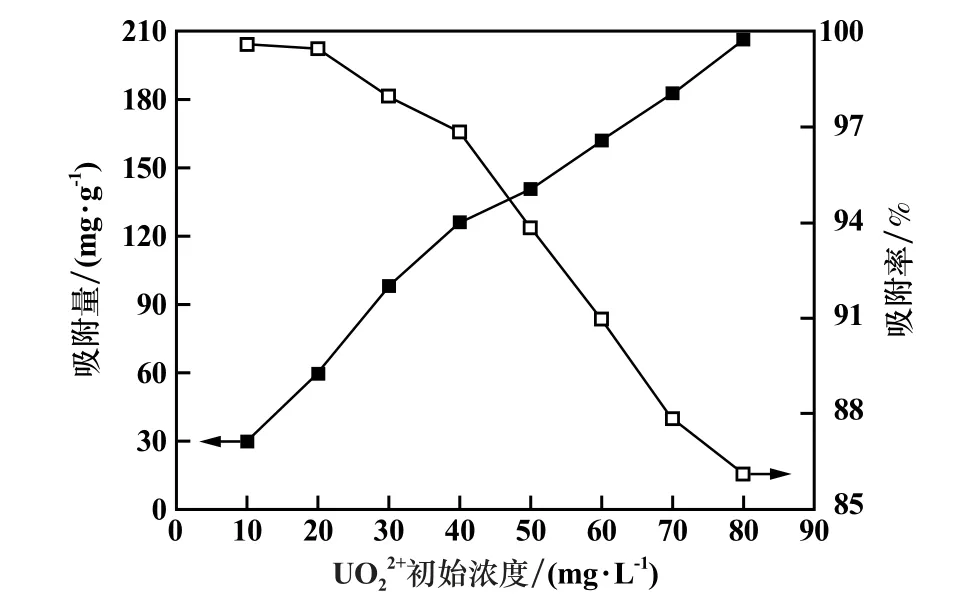
圖7 UO22+初始濃度對Mg-Al-LDHs吸附性能的影響
2.5.2 吸附時間對Mg-Al-LDHs吸附性能的影響
UO22+初始濃度35 mg/L,其他條件不變,吸附時間對Mg-Al-LDHs吸附性能的影響見圖8。由圖8可見,吸附時間30 min時,Mg-Al-LDHs對UO22+的吸附率為74.98%,吸附量為82.02 mg/g。在吸附時間為120 min時,Mg-Al-LDHs對UO22+的吸附率達到93.91%,吸附量達到118.57 mg/g。吸附時間大于120 min后,吸附率、吸附量均變化不大,因此選擇吸附時間120 min。

圖8 吸附時間對Mg-Al-LDHs吸附性能的影響
2.5.3 吸附劑投加量對Mg-Al-LDHs吸附性能的影響
吸附時間120 min,其他條件不變,吸附劑投加量對Mg-Al-LDHs吸附性能的影響見圖9。隨吸附劑投加量增加,Mg-Al-LDHs對UO22+的吸附率增大,而吸附量隨吸附劑投加量增加而減少。綜合考慮,選擇吸附劑投加量為0.01 g。
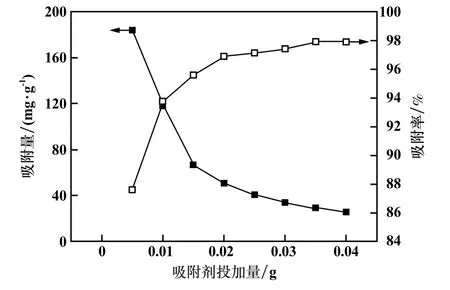
圖9 吸附劑投加量對Mg-Al-LDHs吸附性能的影響
2.5.4 pH值對Mg-Al-LDHs吸附性能的影響
吸附劑投加量0.01 g,其他條件不變,廢水pH值對Mg-Al-LDHs吸附性能的影響見圖10。當pH=6時,Mg-Al-LDHs對UO22+的吸附效果最佳,吸附率為93.91%,吸附量為118.57 mg/g。pH<6.0時,隨著pH值增加,吸附率與吸附量均不斷增大;pH>6.0時,吸附率與吸附量則降低。這是由于吸附介質的pH值在很大程度上影響了離子種類以及官能團的電離,當溶液為強酸性時,溶液中的H+因帶正電荷,會與UO22+爭奪吸附劑的活性位點,H+首先與吸附劑表面的活性位點相結合,UO22+受到斥力作用,很難靠近活性位點,導致吸附率與吸附量均較低;pH>6.0時,隨著溶液堿性增強,溶液中OH-濃度不斷增加,OH-與UO22+可以形成一些較低吸附親和力的離子,其中包括[UO2OH]+、[(UO2)3(OH)4]2+、[(UO2)2OH]3+、[(UO2)3OH]5+、[(UO2)4OH]7+、[UO2(OH)4]2-、[(UO2)3(OH)7]-等,使得Mg-Al-LDHs對UO22+的吸附量減小。因此,選擇pH=6。

圖10 pH值對Mg-Al-LDHs吸附鈾酰離子性能的影響
2.5.5 吸附溫度對Mg-Al-LDHs吸附性能的影響
廢水pH=6,其他條件不變,吸附溫度對Mg-Al-LDHs吸附性能的影響見圖11。吸附溫度從30℃升高到50℃時,Mg-Al-LDHs對UO22+的吸附量和吸附率均升高;再進一步升高吸附溫度,Mg-Al-LDHs對UO22+的吸附量和吸附率均變化不大。因此,選擇吸附溫度50℃。

圖11 吸附溫度對Mg-Al-LDHs吸附鈾酰離子性能的影響
2.6 吸附前后樣品的EDS表征
圖12為Mg-Al-LDHs吸附鈾酰離子前后的EDS分析圖譜。由圖12可見,在Mg-Al-LDHs材料中,O元素的原子分數為72.04%,Mg元素的原子分數為18.25%,Al元素的原子分數為9.70%。在Mg-Al-LDHs吸附鈾酰離子后,鈾元素的原子分數達到12.20%,證實了Mg-Al-LDHs對UO22+的吸附作用。

圖12 Mg-Al-LDHs吸附鈾離子前后的EDS圖譜
3 結 論
1)采用超重力旋轉床可以制備出晶體完整、粒徑分布均勻的片狀微細鎂鋁水滑石,粒徑尺寸為1~2.5μm。
2)通過非均相共沸蒸餾可在微細鎂鋁水滑石干燥過程中有效防止粉體團聚,制備高分散性的粉體。
3)考察了Mg-Al-LDHs對UO22+的吸附性能,在吸附溫度50℃、UO22+初始濃度35 mg/L、吸附時間120 min、pH=6、吸附劑投加量0.01 g(廢水體積30 mL)條件下,Mg-Al-LDHs對UO22+的吸附量為118.57 mg/g,表明Mg-Al-LDHs對UO22+具有良好的吸附性能,是處理含鈾廢水的一種潛在吸附劑。

