山黧豆β-腈基丙氨酸合成酶基因LsCAS的原核表達及蛋白聚合狀態分析
賈海燕,李辰浩,宋瑤瑤,劉鳳娟,焦成瑾,徐全樂
(1 隴東學院 生命科學與技術學院,甘肅慶陽 745000;2 西北農林科技大學 生命科學學院,陜西楊陵 712100; 3 天水師范學院 生物工程與技術學院,甘肅天水 741000)
β-N-草酰-L-α,β-二氨基丙酸(β-N-oxalyl-L-α,β-diaminopropionic acid,β-ODAP)在山黧豆(Lathyrussativus)中首次獲得分離和鑒定[1],并被發現廣泛存在于三七(Panaxnotoginseng)、西洋參(Panaxquinquefolium)和人參(Panaxginseng)等物種[2-3]。研究表明,β-ODAP是傳統中藥材三七止血的活性成分,被命名為三七素(dencichine)[2],并在神經保護、糖尿病及腎病防治等過程中發揮重要作用[3-8]。因而,β-ODAP生物合成的調控是山黧豆、三七等作物品質形成機理研究的重要內容。
β-ODAP的生物合成在山黧豆種子萌發期和成熟期形成2個顯著高峰[9]。對萌發期種子的代謝組學和轉錄組學分析表明,β-ODAP的生物合成與硫代謝等基礎代謝途徑密切關聯[10-12]。其中,β-腈基丙氨酸合成酶(β-cyanoalanine synthase,β-CAS)負責催化異噁唑-5-酮與半胱氨酸(Cys)反應生成β-異噁唑-5-酮-丙氨酸[β-(isoxazolin-5-on-2-yl)alanine,BIA]。BIA進一步通過兩步反應生成β-ODAP[13-14]。
在擬南芥和大豆等物種中的研究表明,β-CAS隸屬于磷酸吡哆醛(pyridoxal phosphate,PLP)依賴的β基取代的丙氨酸合成酶家族(β-substituted alanine synthase,Bsas),可形成二聚體,分子量范圍為50~70 kD[15-16]。在山黧豆中,將LsCAS的PLP附著關鍵位點Lys突變后導致突變體酶活喪失[14,17],說明LsCAS也是PLP依賴性蛋白酶。該蛋白可通過與絲氨酸乙酰基轉移酶(serine acetyltransferase,SAT)互作起到β-ODAP生物合成調控分子開關的作用[14]。
植物硫代謝途徑調控的一個典型特征是2個CS同源二聚體與2個SAT同源三聚體共同形成半胱氨酸調控復合物十聚體(cysteine regulatory complex,CRC),并通過聚合/解聚狀態調節CS 與SAT酶活[18-20]。為進一步研究LsCAS功能及聚合狀態,本研究克隆了LsCAS基因的CDS序列,構建了pGEX2T-LsCAS原核表達載體,通過蛋白純化和Western-blot分析進行了LsCAS功能驗證,并利用分子排阻初步解析山黧豆LsCAS蛋白的聚合狀態,深入了解LsCAS的功能。
1 材料與方法
1.1 試驗材料
試驗所用山黧豆(Lathyrussativus)種子為西北農林科技大學生命學院實驗室保存。種子在含腐殖土、蛭石、珍珠巖(1∶1∶1)的混和基質中于23 ℃萌發6 d,取其根部提取RNA。GST親和柱購自碧云天生物技術公司,GST標簽抗體購自美國Affinity公司,大豆CS 抗體為美國農業部Hari Krishnan教授惠贈,牛凝血酶購自上海翊圣生物科技有限公司,10 kD超濾管等購自Millipore。
1.2 試驗方法
1.2.1LsCAS基因克隆采用Invitrogen公司的總 RNA 提取試劑盒(Trizol法)提取山黧豆6 d齡幼苗的根部RNA,利用TaKaRa公司的反轉錄試劑盒(PrimeScriptTMⅡ1st Strand cDNA Synthesis Kit)進行反轉錄合成cDNA。采用50 μL反應體系進行PCR擴增,其中5×PrimeSTAR 緩沖液 10 μL,dNTP 混合液(2.5 mmol/L)4 μL,模板2 μL,PrimeSTAR HS DNA 聚合酶(2.5 U/μL)0.5 μL;上下游引物(10 μmol/L)各1.5 μL。PCR程序為:98 ℃ 1 min;98 ℃ 10 s,57 ℃ 5 s,72 ℃ 1 min 15 s,30個循環;最后72 ℃ 延伸5 min。引物序列為F(ATCACCTTCCTCAAGCGAACCTC)和R(CTC-GGAACTCGTGGAAGAAAT)。PCR產物經1%瓊脂糖凝膠電泳檢測后,送北京擎科生物科技有限公司測序。
1.2.2 原核表達載體構建利用EcoR I和BamH Ⅰ對pGEX2T載體進行雙酶切,經1%瓊脂糖凝膠電泳檢測后采用天根DNA純化試劑盒(Tiangen)進行切膠回收,利用T4DNA連接酶(TaKaRa)和帶有EcoR Ⅰ和BamH Ⅰ酶切位點的LsCAS片段連接。重組產物轉化到DH5α后,經菌落PCR、雙酶切和測序鑒定。
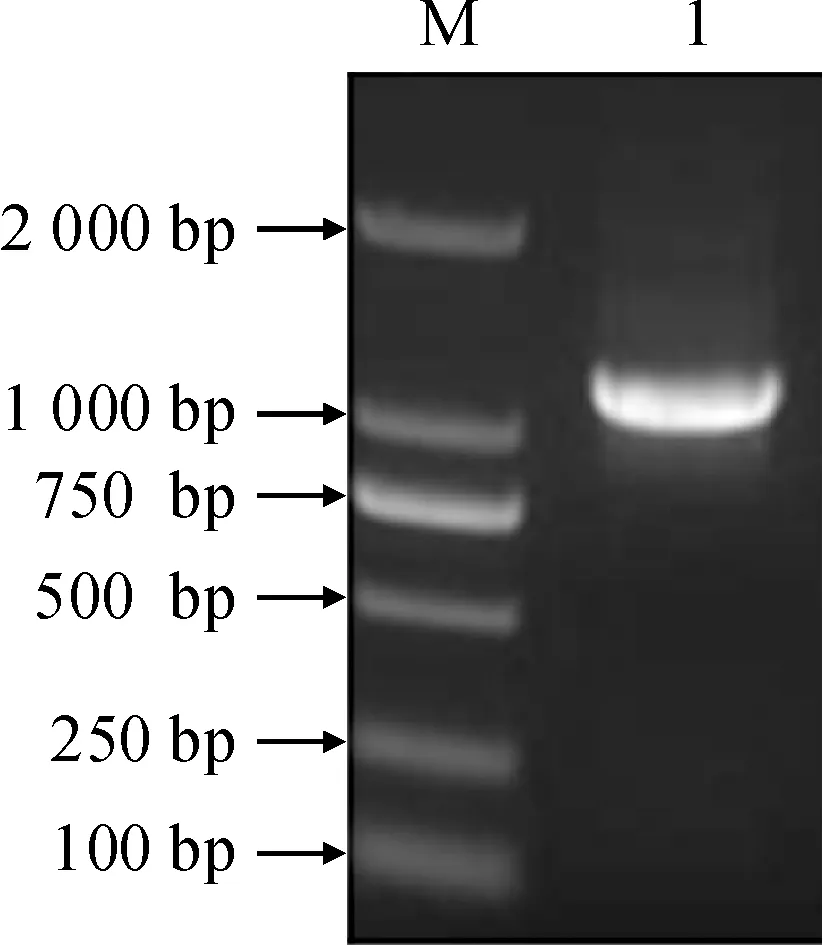
M. DL2000;1. RT-PCR圖1 LsCAS基因的RT-PCR擴增結果Fig.1 RT-PCR amplification result of LsCAS
1.2.3 LsCAS蛋白純化將pGEX2T-LsCAS重組質粒利用KCM法轉化入感受態BL21(DE3)中。挑取單克隆于5 mL含Amp的LB液體培養基中,37 ℃、180 r/min培養12 h后;取2 mL菌液轉接于200 mL含有Amp的LB液體培養基中培養至OD600為0.4~0.6,加入終濃度為0.2 mmol/L IPTG,25 ℃培養10~12 h。收集菌體后用PBS緩沖液重懸,超聲破碎后收集上清液。使用碧云天GST親和柱(BeyoGoldTMGST-tag Purification Resin)進行親和層析,用PBS緩沖液平衡GST親和柱并洗去未結合雜蛋白,用含有10 mmol/L GSH的GST洗脫緩沖液洗脫目的蛋白。通過SDS-PAGE對純化蛋白進行鑒定。
1.2.4 Western-blot分析上述純化蛋白使用12.5%的SDS-PAGE分離后,轉移到NC 膜上,用GST標簽抗體和大豆CS 抗體分別進行驗證。
1.2.5 分子排阻將純化的LsCAS用牛凝血酶切割GST標簽,用10 kD超濾管濃縮至蛋白終濃度為3 mg/mL。取1 mL樣品,使用AKTA蛋白純化系統,Superdex 200 Increase 10/300 GL凝膠柱分析純化的LsCAS分子量。檢測條件為:柱溫室溫,流速0.5 mL/min,流動相0.1 mol/L Tris-HCl緩沖液(pH 7.5,含200 mmol/L NaCl),檢測波長為280 nm和412 nm。
2 結果與分析
2.1 山黧豆LsCAS基因CDS序列克隆
利用RT-PCR從山黧豆萌發6 d的幼苗根部RNA中進行LsCAS基因CDS序列的特異性擴增。結果表明,PCR擴增產物在1 000 bp左右,與預期相符,且條帶單一(圖1)。PCR產物的測序結果與轉錄組數據序列完全一致,表明所獲序列為β-腈基丙氨酸合成酶基因。LsCAS基因的CDS序列為1 035 bp,編碼344個氨基酸。編碼的蛋白質具有典型的CBS-like 蛋白功能結構域(Cystathionine beta-synthase,CBS)和半胱氨酸合成酶(CS),表明LsCAS基因克隆成功。
2.2 LsCAS表達載體構建
采用酶切連接法構建LsCAS基因的原核表達載體。經菌液PCR驗證后(圖2,A),挑取陽性克隆進行質粒提取及EcoR Ⅰ和BamH Ⅰ雙酶切驗證(圖2,B)。瓊脂糖凝膠電泳檢測結果表明,重組質粒的電泳遷移率略小于pGEX2T空載體;重組質粒經雙酶切后在5 kb和1 kb左右呈2條條帶,其電泳遷移率分別與pGEX2T空載體和LsCAS基因擴增產物大小相當。這表明重組載體構建成功。經測序證實后,將其命名為pGEX2T-LsCAS。
2.3 LsCAS蛋白純化
利用IPTG進行重組質粒誘導表達后,采用GST親和層析法對LsCAS融合蛋白進行純化。SDS-PAGE檢測表明,所獲融合蛋白條帶單一,大小在64 kD左右,符合預期大小。進一步利用GST標簽抗體和大豆CS抗體進行Western-blot分析,在誘導后的菌體蛋白和純化后的重組蛋白中均能檢測到特征條帶,說明所獲融合蛋白為山黧豆LsCAS蛋白(圖3)。

A. 菌液PCR驗證:1-8. 菌落PCR; B. BamH Ⅰ和EcoR Ⅰ雙酶切驗證:1. pGEX2T;2. pGEX2T-CAS;3. pGEX2T-CAS酶切產物;4. pGEX2T酶切產物;5. LsCAS基因PCR產物;M. DNA marker圖2 重組質粒驗證A. Colony PCR: 1-8. Colony PCR of randomly selected colonies; B. Double enzyme digestion by BamH Ⅰ and EcoR Ⅰ: 1. Plasmid pGEX2T; 2. Plasmid pGEX2T-LsCAS; 3. Enzyme digested fragments of pGEX2T-LsCAS; 4. Enzyme digested fragments of pGEX2T; 5. Cloned LsCAS gene via RT-PCR; M. DNA markerFig.2 Identification of recombinant plasmid
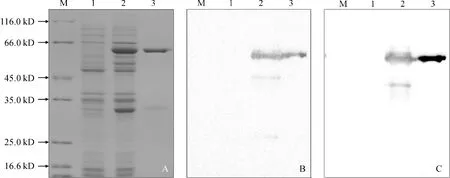
A. SDS-PAGE;B. 利用大豆CS抗體檢測;C. 利用GST標簽抗體進行檢測;M.蛋白質分子量標準;1.IPTG誘導前總蛋白質;2.IPTG誘導后總蛋白質;3.純化后的LsCAS蛋白圖3 LsCAS蛋白純化的 SDS-PAGE及Western-blot檢測A. SDA-PAGE; B. CS antibody; C. GST antibody; M. Regular range protein marker; 1. Total protein before IPTG induction; 2. Total protein after IPTG induction; 3. The purified LsCASFig.3 SDA-PAGE and Western-blot analysis of purified LsCAS
2.4 分子排阻分析
使用Superdex 200 Increase 10/300 GL凝膠柱判斷LsCAS在離體條件下的分子量。結果表明(圖4),純化的LsCAS在412 nm下具有特征吸收峰。由于412 nm是磷酸吡哆醛PLP的特征吸收波長[21],說明LsCAS屬于PLP依賴的蛋白酶家族。在280 nm檢測波長下,LsCAS在洗脫體積為14.56 mL處有最大吸收值。根據標準蛋白分子的排阻體積進行計算,對應的分子量為145 kD左右。由于LsCAS蛋白單體分子量為36 kD,說明LsCAS在離體條件下可能以四聚體方式存在。

圖4 分子排阻驗證LsCAS分子量及聚合方式Fig.4 Molecular weight analysis of LsCAS via size-exclusion chromatography
3 討 論
在山黧豆中,LsCAS是β-ODAP生物合成途徑的關鍵酶,負責催化異噁唑-5-酮與Cys合成關鍵中間化合物BIA[13-14]。研究表明,β-CAS隸屬于磷酸吡哆醛PLP依賴的半胱氨酸合成酶CS家族[16,21]。因而,PLP附著的關鍵位點Lys(K)對CS功能的行使至關重要[21]。例如,擬南芥AtOASSK46A突變體表現為Cys合成酶活性喪失[22]。在山黧豆中,將PLP附著關鍵位點的Lys突變后,進行E.coliNK3功能互補分析和酶活檢測均表明,LsCS及LsCAS突變體酶活喪失[14, 17]。本研究在分子排阻試驗中,檢測到LsCAS蛋白在412 nm波長下具有PLP的特征吸收峰,進一步證實了上述結論。
擬南芥、大豆等作物中的研究表明,植物硫代謝途徑調控的一個典型特征是2個CS同源二聚體與2個SAT同源三聚體共同形成半胱氨酸調控復合物CRC,并通過復合物的聚合/解聚狀態調節CS與SAT酶活[18-20]。當形成CRC復合物時,會降低CS的活性而升高SAT活性[23]。山黧豆LsCAS在發揮功能時,可通過與LsSAT2互作起到β-ODAP生物合成調控分子開關的作用[14],這暗示LsCAS與LsSAT2可能通過CRC復合物的形成調控二者酶活。將LsCAS與LsSAT2采用梯度摩爾比例混合后,在降低LsCAS酶活的同時確實會增加LsSAT2活性[14]。本研究利用分子排阻法證實,LsCAS可能以四聚體方式存在,說明LsCAS可能以兩個二聚體方式參與CRC復合物的形成。
CRC的聚合與解聚狀態由細胞內的硫含量決定[24]。在硫充足情況下,山黧豆LsCAS 和LsSAT2形成CRC調控復合物,增強了SAT活性;充足的硫供應保證了Cys的合成,進而在游離LsCAS作用下合成BIA及β-ODAP。在低硫情況下,OAS的積累促使CRC解聚,降低了SAT活性;低水平的Cys限制了以其為底物的BIA及β-ODAP合成。但積累的OAS可在CS催化下和異噁唑-5-酮以較低效率合成BIA[14]。
綜上所述,本研究克隆了山黧豆LsCAS基因的CDS序列,通過原核表達獲得了山黧豆LsCAS蛋白并利用Western-blot進行了驗證。在此基礎上,利用分子排阻試驗證實了LsCAS為PLP依賴性蛋白酶,可能以四聚體方式發揮作用。在擬南芥中,AtCYS-C1編碼的AtCAS蛋白定位于線粒體,主要參與氰基代謝和根毛發育[25-26]。那么,山黧豆LsCAS是否和擬南芥AtCAS具有相同的作用方式、其功能是否存在差異,有待進一步研究。

