RGMa通過Rho激酶調控EAE小鼠IL-27的表達和神經功能*
牟春地,燕偉平,余 剛,秦新月 ,馮金洲△
(1.重慶市綦江區人民醫院神經內科 401420;2.重慶醫科大學附屬第一醫院神經內科 400016;3.山東省廣饒縣人民醫院神經內科,山東東營 257300)
多發性硬化(multiple sclerosis,MS)是一種中樞神經系統自身免疫性疾病,特征性病理改變包括白質脫髓鞘、炎性細胞浸潤、軸突破壞等。MS病程反復發作,是30歲以下年輕人最常見的致殘性神經系統疾病,常導致永久性軀體功能殘疾[1]。實驗性自身免疫性腦脊髓炎(experimental autoimmune encephalomyelitis,EAE)模型是研究MS炎性反應與免疫等病理生理過程常用的經典動物模型。
最近研究表明排斥性導向分子a(repulsive guidance molecule a,RGMa)在MS的病理過程具有重要作用。采用RGMa特異性抗體抑制RGMa的表達能夠促進小鼠的軸突和髓鞘再生,減少小膠質細胞激活面積,促進神經功能恢復[2-3],但具體作用機制仍未完全明確。白細胞介素-27(IL-27)是近年來新發現的IL-12家族成員,在自身免疫疾病和宿主抗感染過程中起重要作用[4]。筆者團隊前期研究發現IL-27表達在EAE小鼠顯著升高,而且抑制IL-27的表達能夠顯著緩解EAE小鼠的神經功能損傷程度[5]。本研究旨在通過EAE小鼠模型,利用特異性RNA干擾分子抑制RGMa的表達,探討RGMa對EAE小鼠神經功能的影響及通過Rho激酶調控IL-27的相關分子機制,為MS的臨床治療提供新的思路和理論依據。
1 材料與方法
1.1 材料
1.1.1實驗動物
雌性C57BL/6小鼠(8~10周)購自重慶醫科大學實驗動物中心,飼養于重慶醫科大學附屬第一醫院動物實驗中心空氣層流飼養室(不限食物與水的攝入)。所有小鼠在相同環境下喂養,飼養環境溫度18~28 ℃,相對濕度40%~80%,每天喂養正常鼠糧。飼養及實驗過程符合《實驗室動物飼養和使用條例》。
1.1.2主要試劑
RGMa RNAi重組腺病毒rAd5-shRNA-RGMa及空載體重組腺病毒rAd5-HK(中國武漢晶賽生物工程技術有限公司),Rho激酶特異性抑制劑Y-27632、完全福氏佐劑(美國FCA公司)、MOG31-55多肽(美國Sigma公司),RGMa多克隆抗體(美國Santa Cruz公司),Rho激酶多克隆抗體(美國CST公司),IL-27 ELISA試劑盒(美國R&D公司),卡介苗(中國生物制品研究所),百日咳菌液由重慶市渝中區疾病預防與控制中心贈送。
1.2 方法
1.2.1EAE模型建立及干預
MOG31-55多肽用PBS(0.01 mol/mL,pH7.2)稀釋至3.0 mg/mL后,與等體積CFA混合成乳濁液,于小鼠四肢皮下注射免疫(0.2 mL/只)。免疫當天記做第0天,分別于免疫后0 h和48 h腹腔注射百日咳菌液(15 μg/kg)[6],每天觀察小鼠體重、癥狀及神經功能評分,評估EAE建模情況。由神經功能評分確定造模是否成功,評分大于0分記為造模成功(參見1.2.3部分),至免疫后第10天神經功能評分仍為0分的小鼠視為建模失敗不再納入研究。
1.2.2分組
正常對照組常規飼養,無任何干預處理;造模小鼠在免疫后12 d分為EAE模型組、空載體對照組、rAd5-shRNA-RGMa組(RGMa RNAi組)、Rho激酶抑制劑組和PBS組,每組10只。EAE模型組僅造模,無其他特殊處理,RGMa RNAi組和空載體對照組分別于造模后12 d[7]給予側腦室內立體定位注射重組腺病毒rAd5-shRNA-RGMa及空載體重組腺病毒rAd5-HK,轉染滴度(2.51×1010pfu/mL,6 μL)參照筆者前期實驗結果[8]。Rho激酶抑制劑組造模后給予Rho激酶特異性抑制劑Y-27632(按體重10 mg/kg[9]),PBS組給予相同體積的PBS。除觀察神經功能評分的小鼠,其余在免疫后第18天麻醉處死后取脊髓組織。
1.2.3神經功能評分
EAE模型組、RGMa RNAi組及空載體對照組(5 只/組)在免疫當天及免疫后每天進行神經功能評分,連續觀察21 d。采用通用的5分評分法:0分,正常,無發病;1分,動物尾無力;2分,雙后肢無力;3分,雙后肢麻痹;4分,雙后肢加前肢癱瘓;5分,瀕死狀態或死亡。癥狀介于兩級之間則分別記作0.5、1.5、2.5、3.5、4.5分。評分越高代表神經功能損傷程度越重。首次觀察到評分大于0.5分記做起病,根據EAE小鼠神經功能先加重后逐漸恢復的自然病程,評分最高時記做神經功能損傷最高峰。
1.2.4Western blot檢測脊髓RGMa和Rho激酶表達水平
正常對照組及免疫后18 d的各組小鼠腹腔麻醉,斷頭迅速取新鮮脊髓組織,提取全蛋白20 μg上樣進行十二烷基硫酸鈉-聚丙烯酰氨凝膠電泳(SDS-PAGE),恒壓(濃縮膠80 V,分離膠100 V)分離蛋白,轉膜,5%脫脂奶粉封閉,4 ℃孵一抗過夜,第2天復溫、TBST漂洗、孵二抗、TBST漂洗后凝膠成像儀成像,結果用Quantity One軟件進行圖像條帶灰度值分析,以目的蛋白條帶灰度值/β-actin條帶灰度值表示目的蛋白相對表達水平。
1.2.5ELISA檢測各組小鼠血清IL-27的表達
正常對照組、EAE模型組、空載體對照組、RGMa RNAi組、Rho激酶抑制劑和PBS組免疫后第18天收集小鼠靜脈血,按照ELISA試劑盒說明書,最終所得孔板使用酶標儀在450 nm波長處測得各標本孔吸光度(A)值,根據標準品濃度與A值繪制標準曲線,通過各樣本A值計算出樣本對應濃度(pg/mL),每組實驗重復3次取平均值。
1.2.6蘇木素-伊紅(HE)染色
4 μm石蠟切片通過梯度二甲苯和乙醇依次脫蠟至水,蘇木素染色3~8 min,自來水沖洗,1%的鹽酸乙醇分化,0.6%氨水返藍,流水沖洗后入伊紅染液中染色1~3 min,再依次梯度乙醇及二甲苯脫水透明,封片后顯微鏡鏡檢,圖像采集分析。炎性細胞浸潤程度分級依據文獻[10]。
1.3 統計學處理
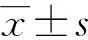
2 結 果
2.1 各組神經功能評分比較
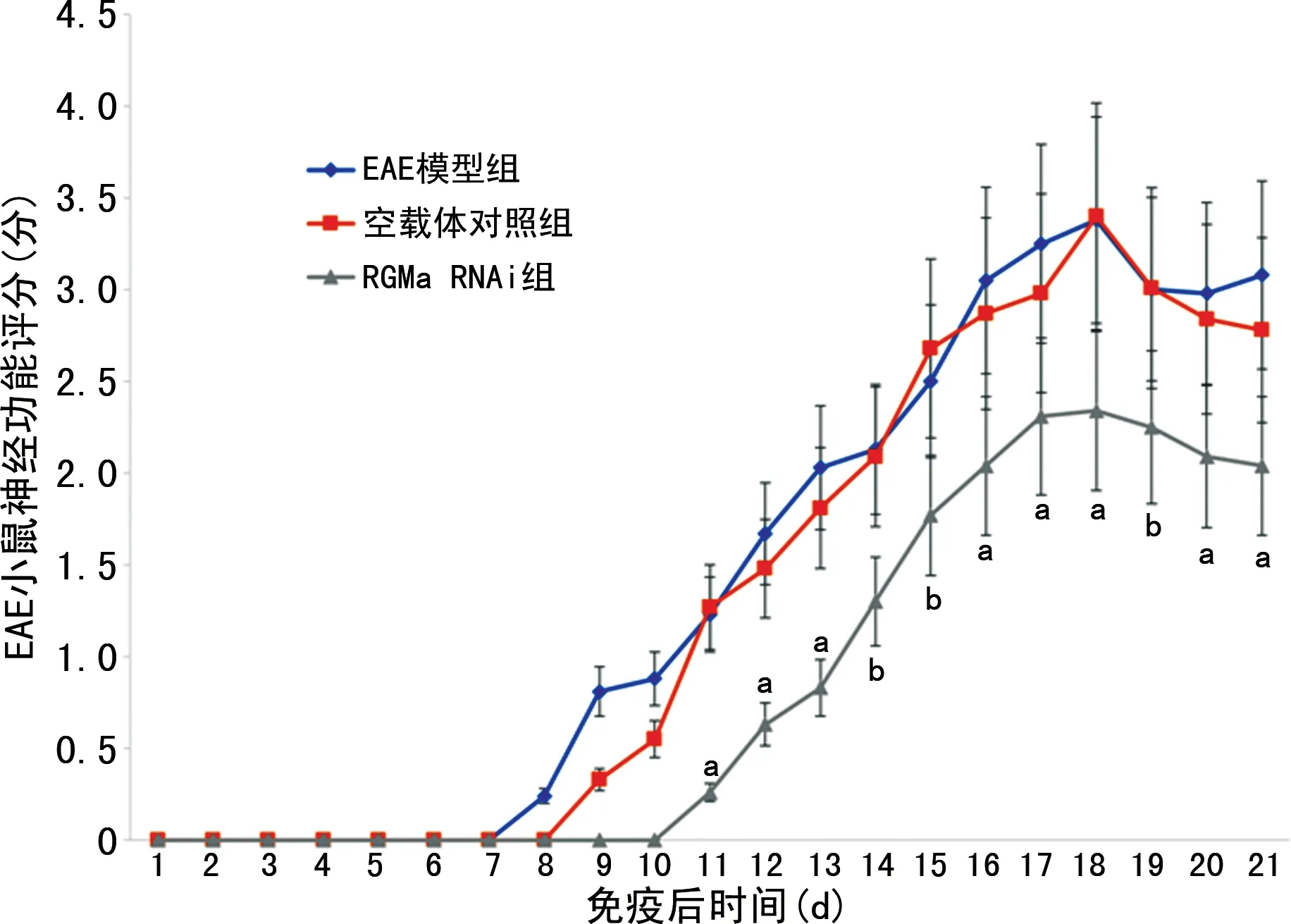
對EAE模型組、RGMa RNAi組及空載體對照組進行神經功能評分。EAE模型組小鼠自于免疫后第8天起病,神經功能損傷逐漸加重,約免疫后第18天神經功能損傷達最高峰。空載體對照組于免疫后免疫后第9天起病,免疫后第18天達病情最高峰,與EAE模型組相似。而RGMa RNAi組于免疫后第12天起病,免疫后第18天病情達最高峰。與前兩組比較起病時間明顯推遲,神經功能評分明顯降低,神經功能損傷明顯減輕,見圖1;同時HE染色結果也顯示RGMa RNAi組脊髓前角炎性細胞浸潤程度較空載體對照組明顯減輕(炎性指數0.72±0.25vs.3.37±0.81,P=0.002),見圖2。
a:P<0.01,b:P<0.05, 與EAE模型組比較。
A.HE染色;B.炎性指數;a:P<0.01,與空載體對照組比較。
2.2 Western blot示EAE小鼠RGMa表達水平
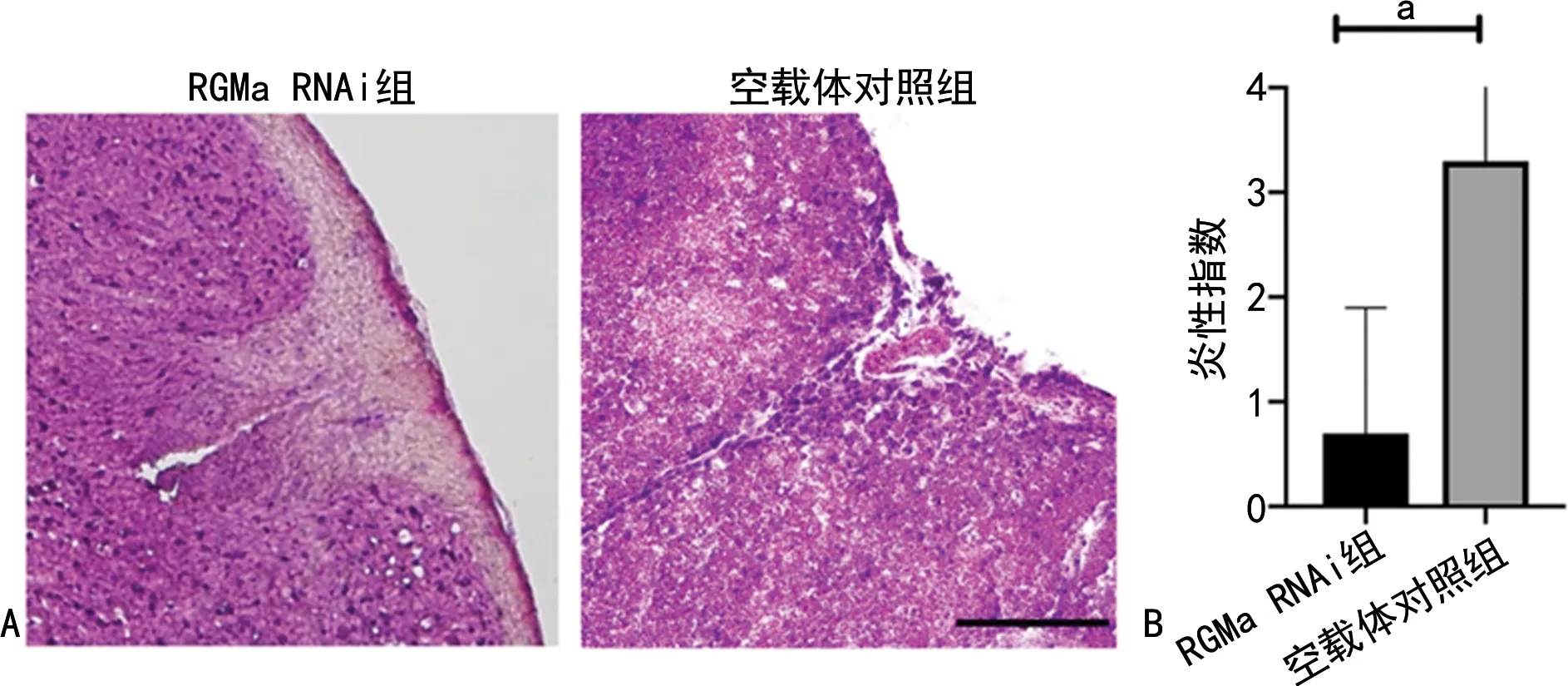
與EAE模型組(0.58±0.09)比較,RGMa RNAi組(0.07±0.01)RGMa相對表達水平明顯降低(P<0.001),見圖3A。
2.3 各組小鼠Rho激酶表達水平比較
與正常對照組(18.23±2.60)小鼠比較,EAE模型組(66.74±8.35)Rho激酶相對表達水平顯著升高(P=0.038),空載體對照組(73.02±12.47)Rho激酶表達與EAE模型組比較無明顯差異,而RGMa RNAi組(42.98±5.69)Rho激酶相對表達水平較EAE模型組明顯降低(P=0.027),見圖3B。
A:RGMa;B:Rho激酶。
2.4 各組小鼠IL-27表達比較
EAE模型組(368.98±30.85)免疫后第18天IL-27表達水平與正常對照組(1 145.36±134.45)比較顯著升高(P<0.001)。與EAE模型組比較。空載體對照組(1 200.90±163.27,P=0.100)IL-27表達水平亦較高,但差異無統計學意義(P=0.010),而RGMa RNAi組(658.46±83.41,P=0.004)及Rho激酶抑制劑組(804.45±133.90,P=0.022)IL-27的表達較EAE模型組顯著降低;與PBS組(1 060.73±104.54)比較,Rho激酶抑制劑組IL-27表達顯著降低(P=0.022),見圖4。
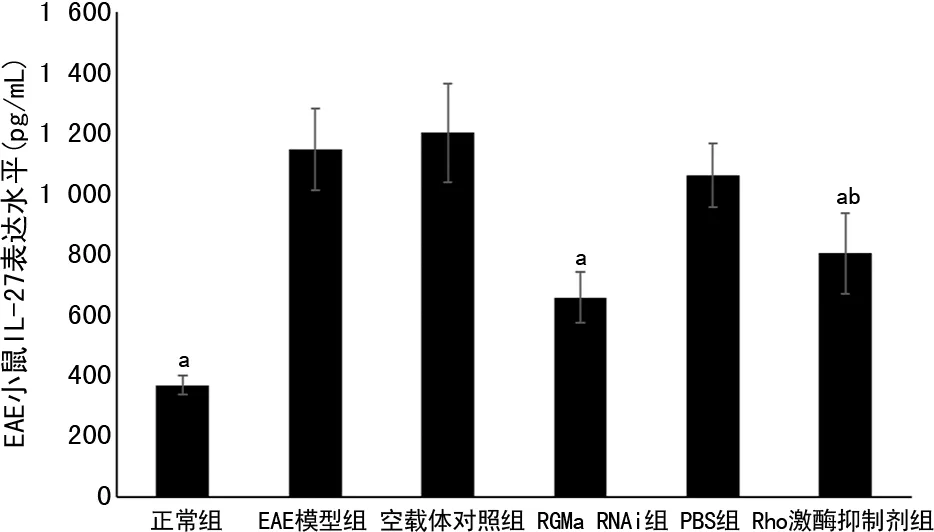
a:P<0.01,與EAE模型組比較;b:P<0.05,與PBS組比較。
3 討 論
MS是以脫髓鞘、慢性炎性反應、軸突破壞為特征的中樞神經系統自身免疫性疾病,MOG誘導的EAE小鼠模型是研究MS等中樞神經系統免疫介導的脫髓鞘病的經典動物模型。RGMa屬糖基磷脂酰肌醇(glycosylphosphatidylinositol,GPI)錨定蛋白家族,是近年來新發現的軸突再生抑制因子,目前發現其主要作為軸突再生抑制因子抑制神經損傷后的神經再生,筆者團隊前期利用腺病毒介導的RGMa RNAi干預缺血再灌注大鼠模型,發現特異性抑制RGMa的表達可顯著促進缺血再灌注大鼠的軸突出芽,改善神經功能損傷程度和炎性細胞浸潤水平[8],本研究同樣利用RGMa RNAi特異性抑制EAE小鼠的RGMa表達,發現抑制RGMa可顯著改善EAE小鼠的神經功能損傷程度。MURAMATSU等[4]發現抑制RGMa可通過抑制T細胞反應抑制MOG誘導的EAE小鼠的炎性反應,促進其神經功能恢復[3],這表明RGMa可作用于MS免疫調節而發揮致病作用,但具體作用機制仍不明確。本研究說明RGMa可通過調節EAE小鼠的Rho激酶表達調控IL-27的表達,這可能是RGMa參與MS病理過程的重要分子機制,同時也進一步揭示了RGMa免疫調控作用的具體方式,但RGMa這一作用是通過免疫細胞還是非免疫細胞介導,尚需進一步深入探討。
Rho激酶作為RGMa及其受體neogenin的下游信號分子,主要抑制軸突外向性生長,介導RGMa的軸突抑制作用[11]。研究發現抑制Rho激酶激活可顯著促進MS、脊髓損傷等疾病中的神經功能恢復,提高突觸可塑性[12-13]。本實驗特異性抑制RGMa的表達后發現其下游Rho激酶表達水平亦明顯降低,而EAE小鼠神經功能亦明顯恢復,表明RGMa對EAE小鼠的神經抑制作用可能是通過Rho激酶介導的,后期尚需Rho激酶水平的進一步干預研究以驗證其在這一通路中的具體分子機制。此外Rho激酶是否具有免疫調節作用尚不明確,本實驗同時顯示RGMa可以通過Rho激酶活性調控IL-27的表達水平,有助于深入明確Rho激酶的生物學功能和信號通路。
IL-12細胞因子家族包括IL-12、IL-23、IL-27等[14],IL-12、IL-23等作為前炎性細胞因子在中樞神經系統的致炎性作用已被廣泛證實。而IL-27盡管目前研究雖少有報道,但已顯示出其在免疫反應調控中具有獨特作用:IL-27可誘導Th1細胞的分化,抑制Th2細胞和Th17細胞的發育,具有促炎與抗炎的雙重特征[15]。研究發現MS患者的IL-27表達水平明顯升高,星形膠質細胞、小膠質細胞及巨噬細胞等均可分泌IL-27,與T淋巴細胞表面的IL-27受體結合介導MS的病理損傷。但同時亦有研究發現IL-27可刺激T細胞分泌IL-10從而抑制EAE的炎性損傷[16]。目前認為上述看似相反的結論在于研究角度是以IL-27作為病理性前炎性細胞因子亦或繼發性宿主反應而產生的保護行為而致[14],也間接反映了深入研究IL-27的生物學功能的必要性。本課題組前期利用IL-27受體抑制劑干預EAE小鼠能明顯緩解中樞神經系統的炎性損傷程度和神經功能損傷[5],同時結合本研究進一步說明RGMa很可能通過對IL-27的調控介導EAE小鼠的神經功能損傷,也提示在后續工作中尚需進一步開展針對IL-27的特異性干預措施以深入驗證。
綜上所述,本研究發現特異性抑制RGMa可促進EAE小鼠的神經功能恢復,這一作用可能是通過Rho激酶調控IL-27的表達而實現的。這一結論的發現有利于深入揭示RGMa參與中樞神經系統免疫介導的脫髓鞘病病理損傷的分子機制,同時為以MS為代表的中樞神經系統免疫介導的脫髓鞘病的臨床治療提供新的思路。

