超聲波-乙醇法提取藜麥黃酮類物質及其對金黃色葡萄球菌的抑制作用
孫永杰,方小磊,張興華,胡楠楠,尤麗新
(長春科技學院,吉林長春130600)
藜麥(Chenopodium quinoa Willd.)發源于安第斯山區,是一種營養豐富的食物。藜麥中黃酮類物質特別豐富,其中主要包括黃酮醇、槲皮素、山奈酚等[1]。由于其黃酮類物質含量的豐富性,越來越多的研究人員開始對其提取過程、工藝優化及其產品應用展開一系列研究。如張永花[2]以引種的山西藜麥為研究對象,對黎麥種子總黃酮進行了提取。但現有研究普遍存在黃酮類物質得率不高的問題。
金黃色葡萄球菌(Staphylococcus aureus)產生的毒性劇烈,對食品行業造成巨大威脅[3]。面對這樣的現狀,許多的研究人員開始轉向對金黃色葡萄球菌天然抑菌劑的研究,陳國妮[4]在對馬齒莧黃酮類化合物抑菌機理研究時發現,黃酮類化合物以促使細菌細胞膜裂解的方式,使細菌失去活性,產生抑菌效果。譚才鄧等[5]對金黃色葡萄球菌抑菌試驗的抑菌圈法進行比較研究時得出,通過對紙片法、打孔法、牛津杯法等定性試驗方法進行比較,打孔法所得到的抑菌圈在清晰程度、重復性等方面具有明顯優勢,應該作為定性試驗的優先選擇方案。
本試驗旨在改進藜麥黃酮類物質提取工藝的條件及參數以達到更高的黃酮類物質得率,并研究其提取物對金黃色葡萄球菌的抑制效果,以期為藜麥黃酮類物質的得率提升、天然活性抑菌劑的開發提供更多理論依據。
1 材料與方法
1.1 試驗材料
金黃色葡萄球菌ATCC6538(Staphylococcus aureus):招遠拓普生物工程有限公司。藜麥:吉林省通榆市藜麥種植基地。
無水乙醇:無錫東能化工科技有限公司;氫氧化鈉:滄州峰林化工產品有限公司;亞硝酸鈉:天津市致遠化學試劑有限公司;硝酸鋁:天津市永大化學試劑有限公司;蘆丁標準品(純度98%):上海金穗生物科技有限公司;蛋白胨:天津市龍騰化學試劑有限公司;牛肉膏:北京陸橋技術有限責任公司;氯化鈉:濰坊玉鼎化工有限公司;氯化鉀、磷酸二氫鉀:上海華正化學試劑廠;瓊脂、磷酸二氫鉀:武漢豐竹林化學科技有限公司;磷酸二氫鉀:濰坊市晨陽化工有限公司;硝酸鉀:北京奧博星生物技術有限責任公司;牛肉粉:天津市華東試劑廠。以上試劑均為分析純。
1.2 試驗設備
DGG-914OA電熱恒溫鼓風干燥箱:鄭州辰星儀器設備有限公司;DFY-1000C高速粉碎機:大德藥機有限公司;SKY2103-1高速氣流粉碎機:上海人和科學儀器有限公司;LANYI-650E超聲波細胞粉碎機:上海蘭儀實業有限公司;T6新世紀紫外可見光分光光度計:山東晨拓科學儀器有限公司;PHS-25精密數顯酸度計:上海雙旭電子有限公司;SPX-400生化培養箱:山東博科生物產業有限公司。
1.3 試驗方法
1.3.1 藜麥黃酮類物質的提取
1.3.1.1 藜麥種子預處理
用電子天平稱取若干份的藜麥種子各150g,在電熱鼓風干燥箱65℃的溫度條件下進行脫水干燥,期間多次觀察檢查,以確保脫水程度。干燥完成之后,置于常溫干燥箱中。待其溫度下降之后,用高速粉碎機將烘干的藜麥種子進行粉碎,控制粉碎程度。過80目篩,再進行高速氣流粉碎[6-7]。將粉末按照編號組別收集完全,確保每組100g的粉末量,完成后立即放進硅膠干燥室備用。
1.3.1.2 超聲波輔助提取與分離
將干燥室的藜麥粉末取出,用78%乙醇溶液,按1∶52(g/mL)的料液比,對粉末進行浸泡。將混懸液連同燒杯放入超聲波細胞粉碎機,在230 W的功率條件下提取28 min。達標之后,打開抽氣泵裝置,將混懸液緩緩倒入進行分離,視分離出液體的澄清度適當調整分離次數,最終得到澄清的藜麥黃酮類物質提取液,在510 nm的波長下測定吸光度。
1.3.2 單因素試驗
以料液比、超聲波功率、乙醇濃度、超聲波浸提時間作為主要影響因素,對各個因素選取5個不同水平[料液比 1∶44、1∶48、1∶52、1∶56、1∶60(g/mL),超聲波功率 200、215、230、245、260 W,乙醇濃度 70%、74%、78%、82%、86%,超聲波浸提時間 20、24、28、32、36 min]進行單因素試驗。
1.3.3 正交試驗
根據單因素試驗的結果,以藜麥黃酮類物質的得率作為參考指標,對料液比、超聲波功率、乙醇濃度、超聲波浸提時間4個因素進行考察,進行L9(34)正交試驗,以確定其最佳的工藝條件。因素水平見表1。
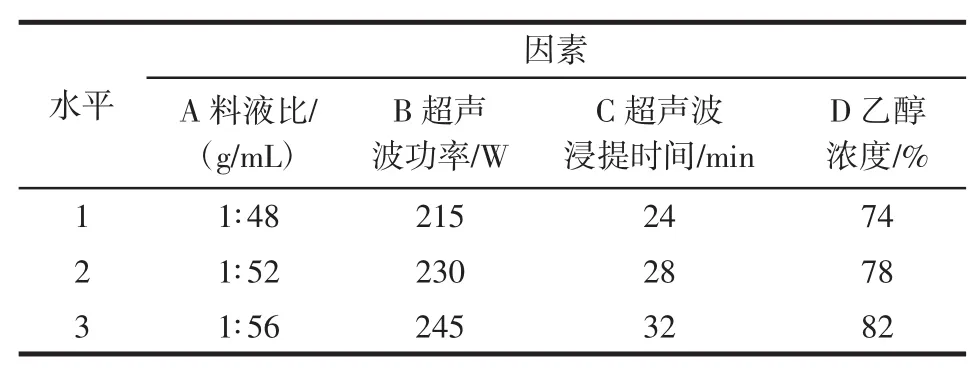
表1 正交試驗水平Table 1 Orthogonal test leve
1.3.4 標準蘆丁曲線繪制
準備已清洗干燥的30 mL試管6支,分別對6支試管進行編號,按順序在各支試管中加入0.1 mg/mL的蘆丁標準溶液 0、2.0、4.0、6.0、8.0、10.0 mL,再分別加78%的乙醇溶液至10 mL。在各支試管中分別加入等量的5%亞硝酸溶液0.6 mL,等待6 min,再分別加入0.6 mL的10%硝酸鋁溶液,靜置6 min,加入1.0 mol/L的氫氧化鈉溶液8 mL,立即混勻,最后在各試管中加入78%的乙醇溶液0.8 mL,靜置15 min,在510 nm的波長條件下,用紫外可見分光光度計測定其吸光度,繪制標準蘆丁曲線[8]。根據下面公式測定藜麥黃酮類物質得率。
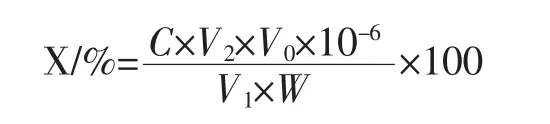
式中:C為樣液濃度,μg/mL;V0為樣液定容后的體積,mL;V1為測定吸光度用樣液的體積,mL;V2為測定時稀釋體積,mL;W為稱取樣品質量,g。
1.3.5 抑菌試驗
1.3.5.1 菌種活化
在凈化工作臺無菌條件下,打開金黃色葡萄球菌凍干菌種管,加入10mL在高壓蒸汽滅菌鍋121℃、20min條件下滅菌的營養肉湯,用滅菌吸管反復吹打,使其分散均勻。用移液槍從中吸取10 μL,加入另一支5 mL營養肉湯培養基的試管并混勻,37℃培養18 h。培養結束后,用接種環取少量劃線于營養瓊脂培養基平板,在37℃培養18 h。用接種環挑取平板上生長良好的典型菌落,劃線于另一支營養瓊脂培養基斜面,37℃培養18 h后,得到其三代培養物。
1.3.5.2 菌液制備
選擇培養后菌落生長形態良好的金黃色葡萄球菌第三代培養物斜面,在凈化工作臺無菌條件下,用10 mL的移液槍加入配制好的磷酸鹽緩沖液(phosphate buffer saline,PBS)5 mL,浸沒斜面以上,用接種環將斜面的金黃色葡萄球菌菌苔刮下,充分振蕩。用滅菌吸管將混懸液吸出,移入另一只滅菌潔凈試管,用電動混合器混合均勻。將初步制成的菌懸液比照0.5麥氏濁度,用PBS緩沖液進行10倍梯度稀釋,以保證菌濃度在1×106cfu/mL左右。
1.3.5.3 藜麥黃酮提取液的準備
將初步提取得到的藜麥黃酮提取液通過60℃減壓濃縮方式,分別濃縮 480、32、38、44 mg/100 mL 4組不同濃度,前一組用于微量二倍稀釋法測最小抑菌濃度(minimum inhibitory concentration,MIC)值,后3組作為打孔法抑菌圈測定的3組不同濃度的提取液。濃縮完成后,分組收集于不同的三角瓶中,每組標上編號,用封口膜封口,放入4℃冰箱保存備用。
1.3.5.4 打孔法測量抑菌圈直徑
將高壓滅菌的培養基移入60℃水浴鍋中冷卻,擦拭酒精棉,移入超凈臺。平板中加入100 μL濃度為1×106cfu/mL的菌液,各加入15 mL左右的培養基,輕微振蕩平板,以保證培養基與菌液充分混合,使金黃色葡萄球菌均勻地分散在培養基中。混勻后,使其自然冷卻凝固,待其凝固完全后備用。用100 μL槍頭在平板中垂直打孔,每板打孔3個,分為1組。打完孔后,向每孔注入0.5 mL準備好的藜麥黃酮提取液[9-10]。同時設置一組未加藜麥黃酮提取液的平板作為陽性對照組,37℃培養18 h。培養完成后,觀察抑菌圈,用游標卡尺測量其抑菌圈的直徑并記錄。
1.3.5.5 微量二倍稀釋法
在超凈臺無菌條件下,用移液槍在96孔板前5排均加入100 μL的肉湯,吸取制備好的藜麥黃酮提取液100μL加入第一排第一孔,再從中吸出一半加入第二孔,進行二倍稀釋,依次由前一孔移出100μL到后一孔,最后一孔吸出100μL舍去,即每孔對應的藜麥黃酮提取液濃度分別為 240.000、120.000、60.000、30.000、15.000、7.500、3.750、1.875、0.938、0.469、0.234、0.117 mg/100 mL,最后分別加入1×106cfu/mL濃度的菌液10 μL,重復兩排,所有操作同上。設第4排為陰性對照組,即除無菌液加入之外其他余操作同上,設第5排為陽性對照組,操作同上,第12列為每排的空白對照。于600 nm波長下測出各孔初始吸光度,全部完成之后,37℃條件下培養18 h。培養結束后,以同樣的方式測出600 nm波長下各孔吸光度,前后的吸光度差值作為判定標準,ΔA>0.2視作有菌生長,最小無菌生長孔對應的藜麥黃酮提取液濃度則為其對金黃色葡萄球菌的最小抑菌濃度即MIC值。
2 結果與分析
2.1 標準蘆丁曲線測定
標準曲線見圖1。
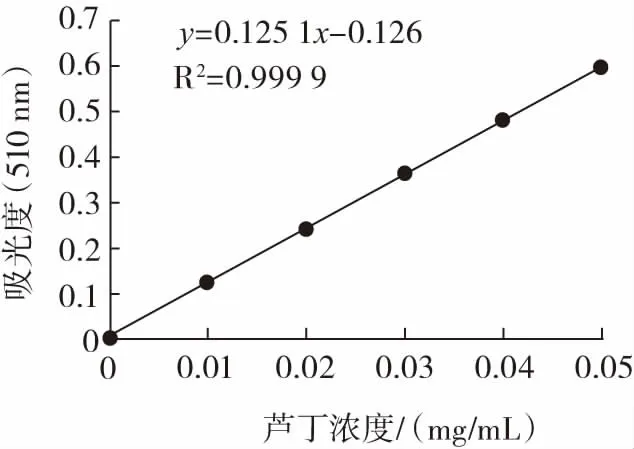
圖1 標準蘆丁曲線Fig.1 Standard rutin curve
由圖1可得,y=0.125 1x-0.126的擬合公式,其擬合系數R2已達到0.999 9,說明繪制而成的標準蘆丁曲線具有較高的線性相關性。
2.2 單因素試驗結果
2.2.1 料液比對藜麥黃酮類物質得率的影響
料液比對藜麥黃酮類物質得率的影響見圖2。
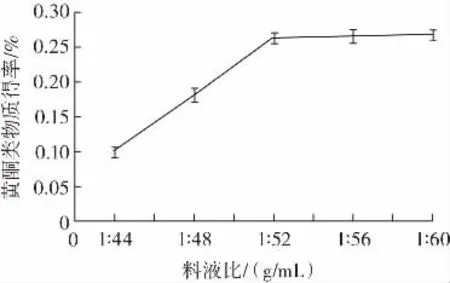
圖2 料液比對藜麥黃酮類物質得率的影響Fig.2 Effect of solid-liquid ratio on the yield of quinoa flavonoids
由圖2可知,黃酮類物質得率和料液比呈現出正向關系,而在料液比到達1∶52(g/mL)之后,正向關系不再顯著,即使料液比中提取液的比例再增加,其對黃酮類物質得率的提升作用并不明顯。這可能是因為,試驗選擇的提取液為乙醇溶液,當藜麥黃酮類物質在提取液中的擴散達到平衡時,再增加提取液的加入量也無法對黃酮類物質的溶出產生明顯的促進作用。因此基于經濟節約的選擇,最終選擇料液比1∶52(g/mL)進行正交試驗。
2.2.2 超聲波功率對藜麥黃酮類物質得率的影響
超聲波功率對藜麥黃酮類物質得率的影響見圖3。
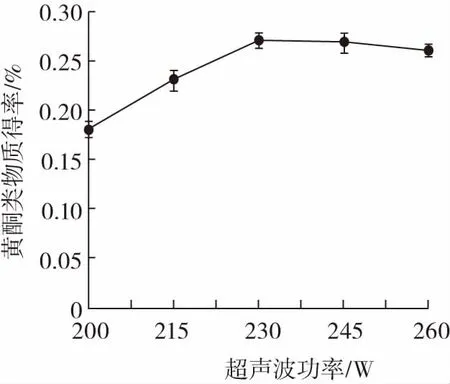
圖3 超聲波功率對藜麥黃酮類物質得率的影響Fig.3 Effect of ultrasonic power on the yield of quinoa flavonoids
由圖3可知,功率從200 W到230 W的變化階段,黃酮類物質得率明顯升高,但功率到達230 W之后,黃酮類物質得率和超聲波功率卻開始出現負向關系。這可能是因為超聲功率增大,其空化閾值也隨之升高,空化不易產生,且已空化的氣泡無充分時間發生爆裂,空化強度減弱。綜合考慮,最終選擇超聲波功率230 W進行正交試驗。
2.2.3 超聲波浸提時間對藜麥黃酮類物質得率的影響
超聲波浸提時間對藜麥黃酮類物質得率的影響見圖4。
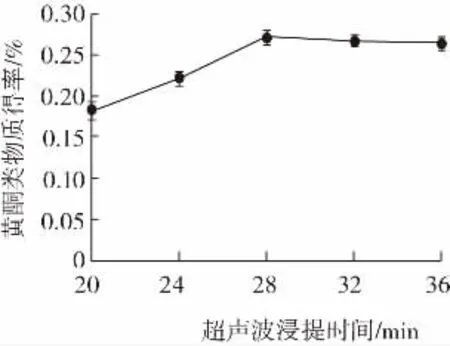
圖4 超聲波浸提時間對藜麥黃酮類物質得率的影響Fig.4 Effect of ultrasonic extraction time on the yield of quinoa flavonoids
由圖4可知,超聲波浸提時間與黃酮類物質得率呈現正向關系,而到達28 min之后,即使提取時間再延長,黃酮類物質得率不再上升,甚至后期略微有所下降。這可能是因為提取時間延長使得藜麥中的其他一些醇溶性物質溶出,如酚類、生物堿等,這些物質會競爭性的和乙醇溶液結合,而使黃酮類物質的結合位點減少。所以最終選擇以超聲波提取時間28 min進行正交試驗。
2.2.4 乙醇濃度對藜麥黃酮類物質得率的影響
乙醇濃度對藜麥黃酮類物質得率的影響見圖5。
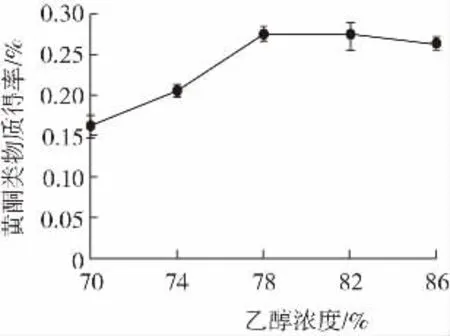
圖5 乙醇濃度對藜麥黃酮類物質得率的影響Fig.5 Effect of ethanol concentration on yield of flavonoids in quinoa
由圖5可知,在乙醇濃度到達78%之前,兩者呈現正向關系,而在78%后,乙醇濃度與黃酮類物質得率開始出現負向關系,呈現下降趨勢。這可能是因為乙醇濃度過高使得藜麥中除了黃酮類物質以外的其他醇溶性生物活性物質大量溶出,使得黃酮類物質在提取液干物質中占比減少。綜合考慮,以78%乙醇濃度進行正交試驗。
2.3 正交試驗結果分析
對4個因素,料液比、超聲波功率、乙醇濃度、超聲波浸提時間進行分析,每個因素分別選取3個水平進行L9(34)正交試驗,以藜麥黃酮類物質的得率為參考依據,確定各因素的最佳參數條件,從而實現工藝優化,獲得更高的得率。正交試驗結果見表2。
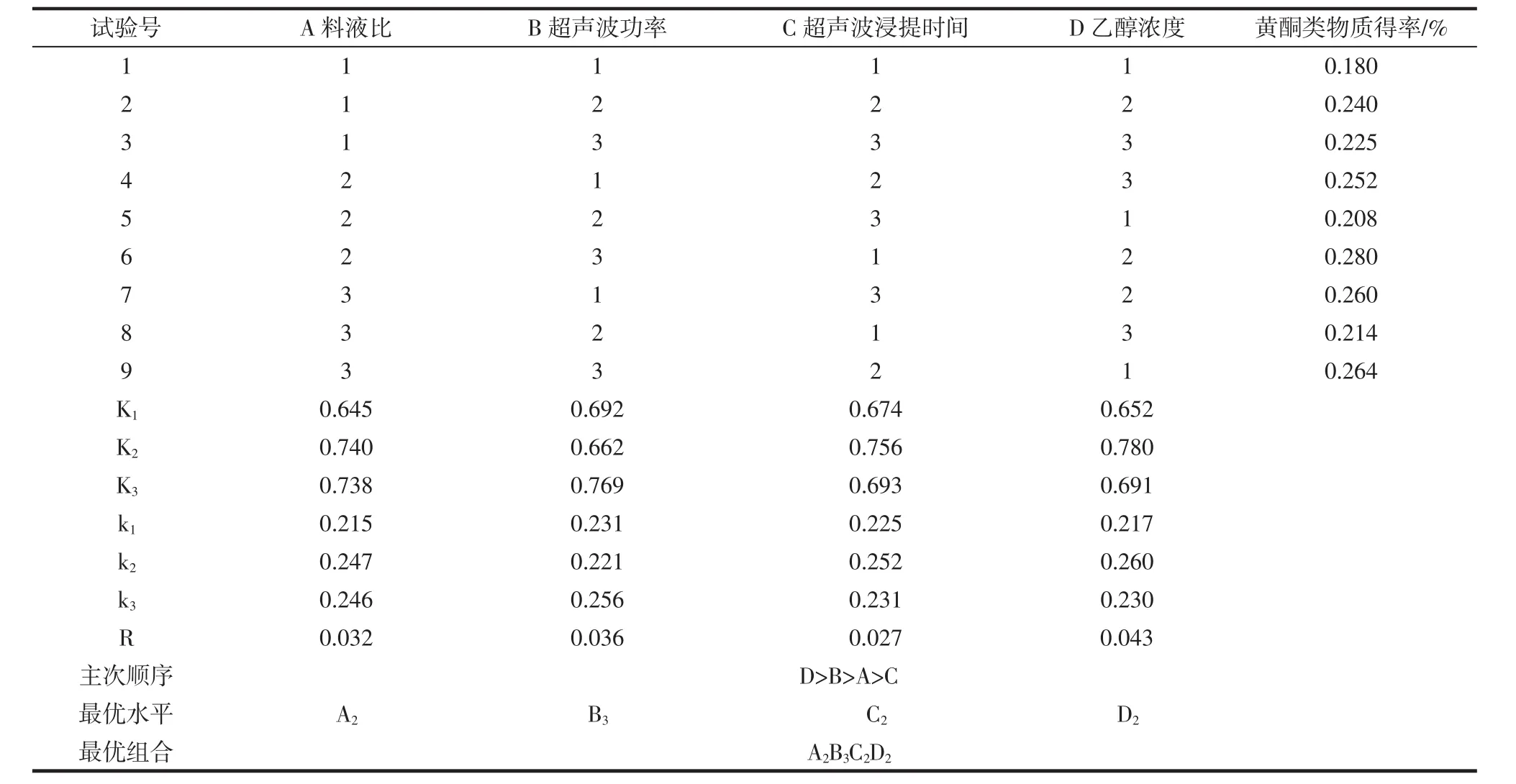
表2 正交試驗結果Table 2 Orthogonal test results
由表2,將各個因素的極差值大小進行對比,乙醇濃度對黃酮類物質得率影響最強,而超聲波浸提時間對黃酮類物質得率的影響最弱,影響性排序為D>B>A>C。通過正交試驗結果,最優組合為A2B3C2D2,然而該組合并未在9組正交試驗范圍內,所以需要對該組合進行進一步的驗證試驗。
2.4 驗證試驗
對由正交試驗得出的最優組合A2B3C2D2進行驗證試驗,見表3。

表3 驗證試驗Table 3 Verification test
根據驗證試驗結果,比較A2B3C2D2、A2B3C1D2兩種組合,以黃酮類物質得率為判定依據,最終選擇A2B3C1D2組合,即料液比為 1∶52(g/mL),超聲波功率245 W,乙醇濃度78%,超聲波浸提時間24 min,在該參數條件下,黃酮類物質得率達到了0.280%。
2.5 藜麥黃酮類物質對金黃色葡萄球菌抑菌效果評價
2.5.1 抑菌圈測量結果
藜麥黃酮類物質抑菌圈直徑測定見表4。
由表4可知,藜麥黃酮類物質具有明顯的抑制作用,并且兩者呈現正向關系,抑菌作用隨著黃酮類物質濃度的增大而顯著增強。
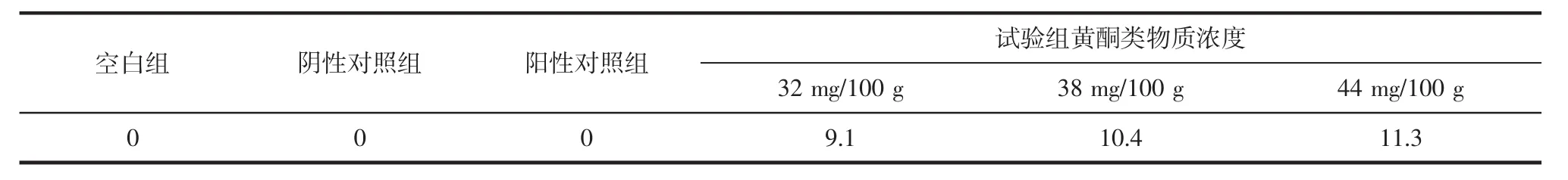
表4 藜麥黃酮類物質抑菌圈直徑測定Table 4 Determination of bacteriostatic zone diameter of quinoa flavonoids mm
2.5.2 二倍稀釋法測得MIC值
96U型孔板每孔吸光度前后差值見表5。
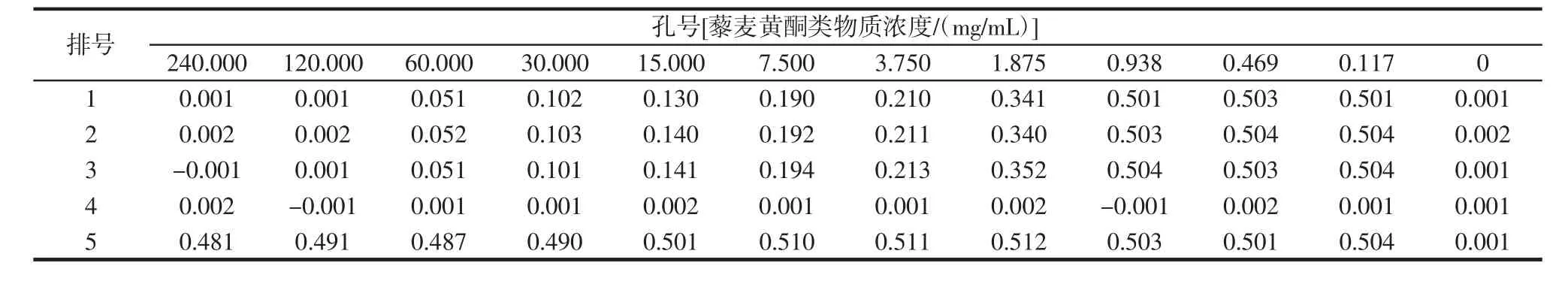
表5 96U型孔板每孔吸光度前后差值Table 5 Absorbance difference before and after each hole of 96U orifice plate
由表5可知,第6孔即藜麥黃酮類物質濃度在7.500 mg/mL時,ΔA值剛好<0.2,濃度升高其ΔA值減小,濃度降低其ΔA值增大,綜上所述,藜麥黃酮類物質的提取液對金黃色葡萄球菌的最小抑菌濃度MIC值為7.500 mg/mL。藜麥黃酮類物質的提取液采用60℃減壓濃縮方式進行制備,其中的乙醇溶液基本揮發完全,因此由乙醇產生的抑菌效應可以忽略不計。
3 結論
在料液比為 1∶52(g/mL),超聲波功率 245 W,乙醇濃度78%、超聲波浸提時間24min的工藝條件下,藜麥黃酮類物質的得率最高,達到了0.280%。通過打孔法對抑菌圈進行測定,藜麥黃酮類物質乙醇提取液與抑菌效果呈現出正向作用,抑菌效果隨著黃酮類物質濃度的遞增表現出明顯的增強態勢,在藜麥黃酮類物質濃度達到44 mg/100 g時,其抑菌圈直徑可達11.3 mm。通過二倍稀釋法測金黃色葡萄球菌的MIC值,得出藜麥黃酮類物質的乙醇提取液對金黃色葡萄球菌的最小抑菌濃度MIC值為7.500 mg/mL。

