電針對肥胖胰島素抵抗大鼠胰島素敏感性及脂肪組織脂聯素、抵抗素基因表達的影響?
王雅媛, 梁鳳霞△, 盧 威, 宋燕娟, 任加鳳, 周鈺點, 黃湘茜, 楊姝瑞
(1.湖北中醫藥大學針灸骨傷學院,武漢 430061;2.針灸治未病湖北省協同創新中心, 武漢 430061)
肥胖是由于長期的能量攝入與消耗不平衡導致過多脂肪堆積的結果。白色脂肪組織(white adipose tissue,WAT)作為能量存儲器官,在維持代謝穩態方面起著至關重要的作用[1]。當機體處于肥胖狀態時,WAT會產生過多的非酯化脂肪酸、炎癥前因子、脂肪因子等,誘導胰島素抵抗(insulin resistance,IR)發生[2],提示脂肪因子的分泌失調可能是促使肥胖IR發生的驅動力之一。這些因子以自分泌、旁分泌以及內分泌機制影響機體新陳代謝和炎癥反應。如脂聯素(adiponectin,ADPN)被認為是與肥胖表型相關的重要基因,與體質量指數和其他肥胖指標呈負相關,同時ADPN還是胰島素的增敏劑,可提高機體的胰島素敏感性[3,4]。抵抗素(Resistin)的作用則與之相反,它可降低胰島素的作用,促使IR發生。研究顯示,血清Resistin含量升高會提升肥胖、IR及2型糖尿病的發生風險[5],它被視為代謝綜合征的潛在危險因素[6],可見二者在肥胖和IR的發展進程中極為重要[7]。
值得注意的是,肥胖引起的IR是2型糖尿病、心血管疾病和非酒精性脂肪肝的共同危險因素[8,9]。但IR狀態并非是不可逆的,當肥胖患者體質量減輕時,血清胰島素(Insulin,INS)含量下降,胰島素敏感性隨之升高,也降低了代謝綜合征的發生幾率[10]。因此及時改善IR狀態,既可減少肥胖帶來的疾病負擔,還能提升人們的健康水平和生活質量。目前針對肥胖的藥物治療應用廣泛,但其產生的副作用往往不可忽視且價格昂貴,影響臨床使用。而針灸因其安全有效越來越廣泛地應用于肥胖IR及相關性代謝性疾病的防治中[11,12]。故本實驗以胰島素敏感性及白色脂肪組織ADPN、Resistin的基因表達為切入點,觀察電針改善肥胖IR的可能作用機制,為其臨床應用提供更多的實驗依據。本研究經湖北中醫藥大學實驗動物倫理委員會批準。
1 材料與方法
1.1 動物
SPF級Wistar健康雄性8周齡大鼠40只,體質量(180±20) g,購于武漢春玉紅有限公司。飼養于湖北中醫藥大學實驗動物中心SPF級動物房,實驗動物許可證號SCXK(鄂)2015-0018,溫度(22±2) ℃,相對濕度(50±10)%,12 h明暗周期、自由進食飲水。
1.2 模型的制備與評價
1.2.1 肥胖胰島素抵抗大鼠模型制備 所有大鼠采用耳標進行標號,標準飲食(總熱量3.8 kcal/g)適應性喂養1周后,隨機選取10只為正常組,繼續標準飲食喂養,余下30只大鼠采用高脂飲食(high-fat diet,HFD)(總熱量5.4 kcal/g)喂養。喂飼8周后,最終有23只大鼠符合肥胖胰島素抵抗(obesity with insulin resistance,OIR)模型標準,從中隨機選出20只分為模型組、電針組各10只。所有飼料由武漢春玉紅有限公司提供,高脂飼料配方參考文獻制作[13]。
1.2.2 評價標準 (1)肥胖標準:HFD喂養大鼠體質量高于標準飲食喂養大鼠體質量平均值的20% 以上[14];(2)IR標準:在正常組及HFD喂養大鼠中各隨機挑選3只,行尾部動靜脈高胰島素:正葡萄糖鉗夾術檢測,計算葡萄糖輸注速率(glucose Infusion Rate,GIR)。IR標準為HFD大鼠的GIR值低于正常組大鼠GIR平均值20%以上[15]。
1.3 主要試劑及儀器
大鼠抵抗素酶聯免疫吸附測定試劑盒(CSB-E06885r),美國CUSBIO公司;大鼠脂聯素酶聯免疫吸附測定試劑盒、大鼠胰島素酶聯免疫吸附測定試劑盒(E-EL-R0329c、E-EL-R2466c),武漢伊萊瑞特公司;RNA提取試劑盒 ( 北京Takara公司);RNA逆轉錄試劑盒、熒光定量試劑盒(740900、QRT-201),上海Toyobo公司;胰島素,天津諾和諾德公司;葡萄糖溶液,湖南科倫制藥有限公司;鹽酸利多卡因,山東魯抗辰欣公司;靜脈留置針(26 G),丹麥古氏公司;雙通道微量注射泵(WZ-50C6),上海軟隆科技發展有限公司;血糖儀(580),江蘇魚躍公司;精密電子秤(SF-400A),上海志榮電子科技公司;針灸針(0.25×25 mm),北京中研太和醫療器械有限公司;韓式電針儀(2000HANS),北京華威科技有限公司;微型高速離心機(C2500-R-230V),美國Labnet公司;電熱恒溫培養箱(ICV-450),日本ASONE公司;FlexStation 3多功能酶標儀(Flexstation3),美國Molecular Devices公司;實時熒光定量PCR儀(CFX96),美國Bio-Rad公司。
1.4 干預方法
OIR模型大鼠造模成功后,正常組繼續給予標準飲食喂養,余下組別繼續給予HFD喂養,共飼喂8周。此外,電針組還給予電針同步干預。
電針干預:抓取大鼠穿上自制鼠衣,暴露腹部及下肢部皮膚,待大鼠平靜后,選取“關元”“中脘”、同側“足三里”和“豐隆”進行針刺,穴位的定位及針刺深度依據《實驗針灸學》[16]。將“中脘”和“關元”連接一組電針,同側“足三里”及“豐隆”穴連接一組電針(兩穴左右兩側交替使用),連接韓式電針儀,頻率2 Hz,強度1 mA,連續波,刺激強度根據局部肌肉收縮情況決定,每次留針20 min,隔日干預1次,每周3次,連續8周。以上電針參數皆參考文獻[17]及課題組前期多次實驗后決定。正常組和模型組大鼠在電針干預期間同樣抓取固定但不干預。
1.5 標本取材
新鮮組織在取材前禁食不禁水12 h,采用10%水合氯醛(3 mL/kg)腹腔注射麻醉,待大鼠麻醉完全后心尖取血獲取血液樣本,將血液樣本迅速轉入4 ℃冰箱保存。取血后處死,快速剪取腹部WAT分裝至EP管中,并迅速放入液氮中速凍,再轉至-80 ℃冰箱中保存備用。
灌注取材前準備同上。待大鼠麻醉完全后,打開胸腔暴露心臟,用12號灌胃針插入大鼠左心室到達主動脈,用血管夾夾住灌注生理鹽水,直至大鼠雙肺雙眼快速變白后停止輸注生理鹽水,轉接4%多聚甲醛直至鼠尾變硬停止灌注。剪取腹部周圍的WAT放置于裝有4%多聚甲醛的標本瓶中。
1.6 檢測指標
1.6.1 體質量、Lee’s指數檢測 在干預前0周、干預后2、4、6、8周的最后1 d的同一時間段(上午8∶30)檢測各組大鼠體質量和肛鼻長。Lee’s指數=(體質量×1000)1/3/肛鼻長。
1.6.2 GIR檢測 干預8周后每組隨機選取3只大鼠行鉗夾術(提前禁食8 h)。首先用自制鼠套固定大鼠并暴露鼠尾,在尾部皮下環形注射2%的利多卡因進行麻醉,待麻醉完全后分別挑出動脈及靜脈,插入靜脈留置針(規格:26 G),動脈所插留置針頭連接裝有50 μ/mL的肝素注射器,靜脈所插留置針頭的一個通道連接胰島素注射液(濃度50 mU/mL),另一通道連接30%葡萄糖溶液,并將這2個通道連接微量注射泵的2個通道,插管完成后靜置30 min(緩解插管導致的應激反應)。然后取動脈血測定基礎血糖值,緊接著以0.25 μ/kg·h的恒定速度輸入胰島素溶液,5 min后再次測量血糖值,若血糖值≤基礎血糖的0.5 mmol/L開始泵入葡萄糖注射液,每隔5 min檢測1次血糖,通過不斷調整GIR,使血糖保持在基礎血糖±0.5 mmol/L范圍以內,若連續3次所測值均在上述范圍內則血糖趨于穩態,計算達到穩態后60~120 min的GIR的平均值。
1.6.3 空腹血糖、餐后血糖、腹腔糖耐量(introperitoneal glucose tolerance test,IPGTT)及腹腔胰島素耐量(introperitoneal insulin tolerance test,IPITT)檢測 所有血糖值均由專人用快速血糖儀檢測。在干預前后的同一時間段(上午8∶30),分別檢測空腹血糖(禁食不禁水12 h)及餐后血糖(不禁食不禁水)。IPGTT在干預后的第6周檢測,先測得空腹血糖即為0 min血糖值,然后根據大鼠體質量腹腔注射50%葡萄糖(劑量2 g/Kg),在注射后的第30、60、90、120小時測量血糖并記錄。IPITT則是根據大鼠體質量腹腔注射胰島素(劑量:1U/Kg),其余檢測步驟同IPGTT。并采用近似梯形法[18]計算IPGTT和IPITT的曲線下面積(area under the curve,AUC) :AUC=30 min×[1/2×( BG0 +BG120) + 1×( BG30 + BG60 + BG90)]。
1.6.4 血清INS、ADPN、Resistin含量檢測 各組大鼠處死前心尖取血獲取血液樣本。按試劑盒說明書操作,采用 ELISA 法測血清INS、ADPN、Resistin含量。
1.6.5 WAT中ADPN、Resistin的mRNA水平檢測 采用RT-PCR法檢測,剪取100 mg WAT提取總RNA,其中2 μl作為RNA濃度測定,純度OD260/OD280值在1.9~2.2時濃度為可取值。依次配制熱變性體系、逆轉錄體系,在PCR 儀中進行逆轉錄獲取cDNA,保存在-20 ℃冰箱中。按照擴增體系配方進行DNA擴增,每組樣本3個復孔,并以β-Actin 作為內參引物,通過2-ΔΔCt法計算 ADPN、Resistin mRNA的相對表達水平。引物由武漢巴菲爾公司設計合成,序列如下。

表1 PCR引物序列
1.6.6 WAT形態學觀察 采用HE染色,將取材備用的WAT固定并切取平整,經過脫水、透明、包埋、切片、烤片、脫蠟、水化、蘇木素染色、脫水、透明、封片后,于200倍視野的電鏡下觀察并拍照,數出視野中的脂肪細胞個數,然后在同一視野中挑選10個相對較大的脂肪細胞,測量其直徑并取平均值。
1.7 統計學方法
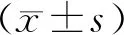
2 結果
2.1 各組大鼠體質量、Lee’s指數比較
圖1A與1B示,在干預前0周,模型組及電針組的體質量、Lee’s指數均顯著高于正常組(P<0.01) ,模型組與電針組比較差異無統計學意義(P>0.05) ,表明二者具有同質性,可進行統計學比較。在干預期間,各組大鼠的體質量均逐步增加,從第6周開始電針組大鼠體質量顯著低于模型組(P<0.01),Lee’s指數在第8周顯著低于模型組(P<0.01)。

注:與同時段正常組比較:*P<0.01;與同時段模型組比較:#P<0.05,##P<0.01
2.2 各組大鼠GIR 、空腹血糖、餐后血糖、血清INS含量比較
圖 2A示,HFD喂養大鼠的GIR水平顯著低于標準飲食喂養的正常組大鼠(P<0. 01),說明OIR大鼠全身胰島素敏感性降低。治療后,電針組GIR數值較模型組升高(P<0. 01),且較干預前也升高(P<0. 05),說明電針可改善OIR大鼠全身胰島素敏感性。圖2B示,各組大鼠干預前后的空腹血糖比較差異無統計學意義(P>0. 05)。圖2C和2D示,干預前模型組及電針組大鼠餐后血糖含量均較正常組升高(P<0. 05),干預后模型組大鼠餐后血糖、血清INS含量(圖2D)仍顯著高于正常組(P<0. 01),而與模型組比較,電針組還可以降低餐后血糖值(P<0. 05)以及血清INS含量(P<0.01)。
注:與同時段正常組比較:*P<0.05,**P<0.01;與同時段模型組比較:#P<0.05,##p<0.01;與干預前比較:△P<0.05
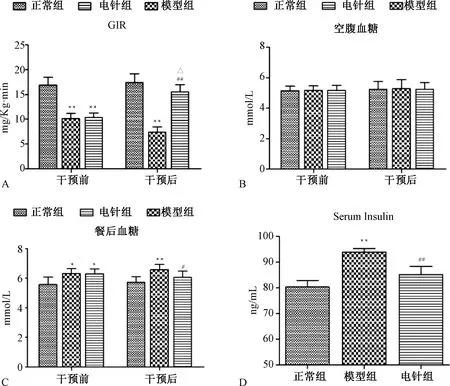
2.3 各組大鼠IPGTT、IPITT比較
圖3A與3C示,各組大鼠腹腔注射葡萄糖30 min后,血糖水平迅速升高達到峰值,然后逐漸降低。模型組大鼠IPGTT水平在第30~120分鐘血糖均顯著高于正常組(P<0. 01),且IPGTT-AUC也較正常組顯著增加(P<0. 01);而經過電針干預后,第30~120分鐘 IPGTT水平、IPGTT-AUC低于模型組(P<0. 05)。圖3B與3D示,各組大鼠腹腔注射胰島素后血糖逐漸下降,在第60分鐘達到最低值隨后開始回升。與正常組比較,模型組大鼠IPITT水平在第30~120分鐘血糖值均顯著升高(P<0. 01),且IPGTT-AUC也表現出升高趨勢(P<0. 01);與模型組比較,電針組可降低第30~120分鐘血糖水平(P<0.05)以及IPITT-AUC(P<0. 01),提示電針能夠調節OIR大鼠的IPGTT和IPITT水平,增強外周胰島素敏感性。
注:與同時段正常組比較:**P<0.01;與同時段模型組比較:#P<0.05,##P<0.01
2.4 各組大鼠血清ADPN、Resistin含量比較
圖4A與4B示,與正常組比較,模型組血清ADPN水平出現明顯下降(P<0.01) ,而Resistin水平顯著上升(P<0.01)。與模型組比較,電針干預后大鼠的血清ADPN水平出現回升(P<0.01) ,Resistin水平下降顯著(P<0.01)。

注:與正常組比較,**P<0.01;與模型組相比,#P<0.05,##P<0.01
2.5 各組大鼠WAT中ADPN、Resistin mRNA相對表達水平比較
圖4C示,模型組大鼠WAT中ADPN mRNA較正常組減少(P<0.01),Resistin mRNA增多(P<0.01);與模型組比較,電針組可以上調ADPN的基因表達(P<0.01),下調Resistin表達(P<0.05),表明電針刺激可以有效調節WAT中ADPN、Resistin的基因表達。
2.6 各組大鼠WAT形態學比較
圖5示,正常組大鼠白色脂肪細胞大小均勻,呈蜂窩狀圓形,結構較完整。與正常組比較,模型組細胞個數減少(P<0.01),細胞直徑顯著增加(P<0.01);電針治療后,其細胞個數顯著增加(P<0.01),細胞直徑減小(P<0.05),提示電針具有減小肥大脂肪細胞體積的作用。
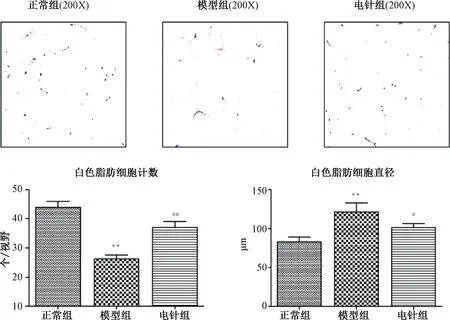
注:與正常組比較:**P<0.01;與模型組比較:#P<0.05,##P<0.01
3 討論
IR是肥胖發展成2型糖尿病的關鍵病理基礎[19],早期干預肥胖IR狀態,可有效預防2型糖尿病等疾病的發生發展,防患于未然。在本實驗中筆者發現,與模型組比較電針干預后OIR大鼠體質量、Lee’s指數顯著降低,提示電針可有效減輕體質量,改善肥胖表型。且大鼠餐后血糖、IPITT、IPGTT水平也低于模型組,GIR顯著升高,說明電針刺激還能增強OIR大鼠的胰島素敏感性。脂肪組織是胰島素的重要靶器官,與肥胖IR狀態密切相關。其中WAT可通過將具有生物活性的脂肪因子釋放到血液中,調節各種代謝過程,包括新陳代謝和葡萄糖穩態[20]。如Resistin是調節葡萄糖穩態的重要脂肪因子,研究發現肥胖小鼠循環Resistin含量明顯升高,且與胰島素、血糖水平呈正相關[21]。這可能與Resistin降低胰島素受體及受體底物-1 (Insulin receptor substrate, IRS-1)的磷酸化水平,從而減弱磷脂酰肌醇-3激酶 (phosphatidylinositol-3-kinase, PI3K)的激活,誘使IR發生有關[22]。且Resistin還可導致胰島素信號抑制劑細胞因子信號傳導抑制劑3(suppressor of cytokine signaling 3, SOCS-3)的基因表達增加[23]。
ADPN則是由WAT產生的有益脂肪因子,它可調節胰島素靶組織中碳水化合物和脂肪代謝[24],包括減少肝臟中葡萄糖的合成,增加肌肉中葡萄糖的攝取及脂肪酸的氧化[25]。其作用的發揮與ADPN受體(adiponectin receptor,AdipoR)密不可分。如AdipoR2可誘導過氧化物酶體增殖物激活受體 α(peroxisome proliferators activated receptor-α,PPARα),從而增加葡萄糖攝取和脂肪酸氧化,減輕炎癥和氧化應激反應[26]。在肥胖和胰島素抵抗人體內,ADPN循環水平和分泌率顯著降低[27]。而低水平的ADPN還可激活下丘腦-垂體-性腺激素軸(hypothalamic pituitary gonadal,HPG),促使肥胖的早期發作[28]。本實驗發現,與HFD誘導的OIR模型大鼠比較,電針組可增加WAT中ADPN mRNA表達,降低Resistin mRNA水平,且血清ADPN、Resistin含量也隨之變化。提示電針對WAT中脂肪因子ADPN、Resistin的調節作用可能是有效改善肥胖IR的機制之一。
同時實驗表明,在HFD的誘導下,模型組大鼠WAT細胞直徑顯著大于正常組,這是由于WAT在能量存儲中起著至關重要的作用。當機體攝取能量過多時,體內脂肪細胞會出現增生和肥大。而肥大脂肪細胞還可導致脂肪細胞因子分泌失調,進一步加速肥胖IR的發展。已有研究表明,血漿中的脂肪細胞因子水平隨著脂肪組織與脂肪細胞體積的增加而升高[29]。在本實驗中,模型組大鼠WAT細胞直徑增加,WAT中Resistin mRNA隨之上升,與前期報道一致[29]。但ADPN水平卻表現出相反趨勢,這可能是由于脂肪細胞肥大時會釋放出更多的游離脂肪酸與巨噬細胞toll樣受體4結合,加重慢性炎癥反應,表現出高水平的循環炎癥細胞因子(如TNF-α和IL-6),而IL-6抑制ADPN的表達[29],導致WAT中ADPN基因表達減少。還有研究表明,當脂肪細胞膨脹時血流灌注不足,隨之而來的局部組織缺氧致使脂肪細胞中的纖維化和內質網應激反應,與ADPN基因的下調也具有相關性[30],可見WAT細胞大小可能是脂肪因子分泌的重要因素之一。在經過電針治療后,WAT細胞直徑較模型組明顯減小,且WAT及血清中Resistin及ADPN含量均趨向正常化也印證了這一點。
綜上所述,電針可減輕HFD誘導的OIR大鼠體質量,增強胰島素敏感性,改善IR狀態,其可能機制與電針減小肥大脂肪細胞體積,調節WAT中Resistin及ADPN的分泌水平相關。

