海洋源生物活性肽的構效關系與作用機理研究進展
黃沐晨,楊傅佳,2,陳 旭,2,蔡茜茜,2,陳 選,2,吳金鴻,張 恒,張 軍,汪少蕓,
(1.福州大學生物科學與工程學院,福建 福州 350108;2.福州大學石油化工學院,福建 福州 350108;3.上海交通大學農業與生物學院,上海 200240;4.安徽國肽生物科技有限公司,安徽 宣城 242199;5.中食都慶(山東)生物技術有限公司,山東 菏澤 274108)
海洋是地球上最大的生物資源庫。海洋生物鏈完整且再生能力強,其獨特而復雜的孕育環境和悠久的演化發展歷程,使海洋生物體內的防御體系和代謝機制具有特殊的性質[1],來自海洋生物的活性肽可分為內源性肽和外源性肽。內源性海洋生物活性肽是存在于海洋生物中的特異性功能肽,可積極發揮各種功能和生物學活性,主要包括海洋生命體中內分泌腺產生的肽類抗生素、激素等生物體代謝產物,血液或組織中存在的組織激肽以及神經遞質或神經活動調節肽等[2]。可以運用分離純化技術將內源性海洋生物活性肽直接從生命體中提取出來。外源性海洋生物活性肽是海洋源蛋白質通過水解產生的具有特定功效的肽,最主要的制備方法是酶解法[2]。根據不同酶的酶切位點可以產生多種不同功能活性的肽片段。通過微生物強大的酶系統發酵也是制備生物活性肽的有效手段,在發酵過程中,常選用枯草芽孢桿菌和真菌等從廢棄的海洋源蛋白質中制備生物活性肽釋放大量不同的二肽、三肽和其他生物活性肽[3]。化學合成法常用于已知氨基酸序列的海洋源生物活性肽,并可依據不同活性肽的構效機制對海洋源生物活性肽的氨基酸序列進行定向設計改造,從而快速獲得理想有效的肽類藥物[4]。根據生物活性肽的來源和種類,選擇相應合適的制備方法以合理有效的獲取目標活性肽尤為重要。
海洋生物是開發新型生物活性肽的良好資源,有著巨大的開發利用潛力[1]。隨著現代生物技術和化學技術的發展應用,科技工作者們已利用豐富的海洋原料及其加工副產物,挖掘出眾多結構新穎、功能特殊的生物活性肽,如抗氧化肽[5-8]、抗菌肽[9]、抗凍肽[10]、金屬離子螯合肽[11-12]、免疫肽[13]等。近年來,有關海洋源生物活性肽的研究屢見報道。因此,有必要對海洋源生物活性肽的構效關系及作用機制進行綜述,以期為海洋源生物活性肽的進一步挖掘及開發應用提供啟發。
1 抗氧化肽
1.1 氨基酸序列與抗氧化的構效關系
自由基是機體代謝的中間產物,自由基的產生和積累會導致DNA的氧化損傷、蛋白質交聯或降解、酶失活、發生脂質過氧化反應以及破壞細胞結構,造成機體免疫系統出現多種損傷和惡性病變,加速機體衰老,引發癌癥、心血管疾病、阿爾茨海默癥等慢性疾病的發展[5,8]。常見化學合成的抗氧化劑,如丁基化的羥基甲苯、叔丁基對苯二酚和丁基化的羥基茴香醚等存在毒性,危及人體健康。已有諸多研究表明,海洋加工副產物水解制備的抗氧化肽能夠有效防止氧化造成的機體損傷,已成為最重要的人工抗氧化劑取代來源。
大多數抗氧化肽是由2~20 個氨基酸組成,低分子質量的肽相比于其親本蛋白質更容易接近自由基從而抑制自由基介導的脂質過氧化。Kim等[14]發現抗氧化能力與肽的分子質量緊密相關,低分子質量組分(1~3 kDa)的鱈魚蛋白水解產物組分相比于其他高分子質量組分具有更高的抗氧化活性。同樣的,林琳等[15]發現以魷魚皮膠原蛋白為原料制備的小于2 kDa的多肽組分相比于其他分子質量更大的組分對羥自由基和超氧陰離子自由基的清除效果更好。Ranathunga等[16]發現,來源于康吉鰻的分子質量低于1 kDa的肽組分對體外脂質過氧化的防御效果優于天然抗氧化劑生育酚。
氨基酸組成及其位于肽序列中的位置對多肽抗氧化活性起著至關重要的作用。含苯環的氨基酸、酸性氨基酸和堿性氨基酸是抗氧化肽的活性位點,肽鏈的氨基酸位置決定了抗氧化肽到達細胞中自由基生成位點(如線粒體)的能力[17]。現有的研究發現抗氧化肽通常在N端含有疏水性氨基酸,增強了它們在脂質中的溶解度,使其易于進入靶器官發揮作用。顏阿娜等[18]從黑鯊魚皮中酶解制備和分離純化得到新型抗氧化肽Pro-Gly-Gly-Thr-Met(PGGTM),從圖1中其清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基機理圖可以看出,N端的脯氨酸和C端的蛋氨酸可能是清除自由基的關鍵性位點。在抗氧化肽清除自由基的過程中,脯氨酸能夠向DPPH自由基提供質子,并且兩個帶自由基的脯氨酸能夠結合,從而阻止自由基鏈式傳遞[19-21]。疏水性氨基酸如蛋氨酸能增強多肽的抗氧化活性,蛋氨酸通過消耗周圍環境的氧,被快速氧化生成甲硫氨酸亞砜,起到抗氧化作用[22]。Qian Zhongji等[23]采用體外胃腸消化法水解牡蠣得到抗氧化肽,確定了肽的氨基酸序列為LKQELEDLLEKQE(1.60 kDa),得到比生育酚活性更高的抗氧化肽。Yang Qian等[7]以黑鯊魚皮為原料獲得的新型抗氧化肽在500 μg/mL的質量濃度下對2,2’-聯氮-雙-3-乙基苯并噻唑啉-6-磺酸(2,2’-azinobis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)陽離子自由基具有81.5%的清除活性,序列為ATVY,其作用于ABTS的抗氧化作用位點為N末端的酪氨酸。Sinthusamran等[24]采用多種水解工藝酶解太平洋白對蝦頭胸部,不同的水解過程直接影響水解產物的蛋白質回收率、化學組成和抗氧化活性,得到的所有水解產物均以谷氨酸/谷氨酰胺、天冬氨酸/天冬酰胺、精氨酸和亮氨酸為主。另外,Zhao Kesheng等[25]發現Szeto Schiller(SS)肽可滲透細胞、靶向保護線粒體免受細胞氧化。SS肽的這種功能歸因于它們有獨特的結構基序,并含有芳香族和堿性氨基酸。
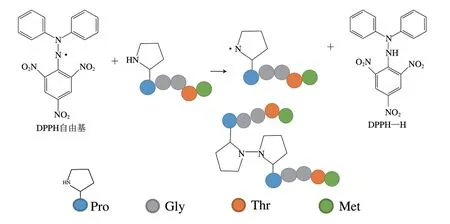
圖1 Pro-Gly-Gly-Thr-Met清除DPPH自由基機理圖[18]Fig. 1 Schematic illustration of the reaction mechanism between Pro-Gly-Gly-Thr-Met and 1,1-diphenyl-2-picrylhydrazyl radicals[18]
1.2 抗氧化機制
抗氧化肽在作用機理方面,主要從以下3 個方面抑制氧化反應[26]:1)通過抗氧化肽的肽鍵和羥基提供氫原子或電子清除自由基,以消除自由基對生物分子的破壞作用;2)通過鈍化氧化酶的活性,螯合在氧化反應中起催化作用的金屬離子,在脂質顆粒外形成保護膜等方式,封閉引起氧化的物質,阻截氧化反應的進行;3)上調內源性抗氧化劑如谷胱甘肽、超氧化物歧化酶和過氧化氫酶[27],調節細胞生理生化反應的抗氧化酶聯防御功能[28],能夠對細胞器破壞誘導慢性疾病發展起到抑制作用[29]。
抗氧化肽分子質量較小,容易穿過細胞膜被人體吸收利用,且安全性高,在吸收速率和生物學功能上具有顯著優勢。抗氧化肽可以用作食品配方中的成分,預防、控制和管理氧化應激相關疾病,還可以作為食品中的添加劑抑制食品的氧化。彭新顏等[30]發現藍點馬鮫魚皮抗氧化肽可有效抑制4 ℃冷藏過程中熟肉糜蛋白降解和脂質氧化,保持熟豬肉糜品質。在保健應用及美白醫藥方面,王奕等[31]研究證實了日本刺參膠原肽對羥自由基等有顯著的清除能力,并提高B16黑素瘤細胞的增殖水平,抑制酪氨酸酶活性進而抑制B16細胞黑素的合成。隨著生命科學的發展和生物學作用機制研究的不斷深入,抗氧化肽的構效關系將更加明確,海洋源抗氧化肽用于開發藥物或作為保健品的功能因子將成為食品和高科技產業的前沿和熱點,在醫藥領域將具有更好的發展前景和優勢。
2 抗菌肽
2.1 二級結構與抗菌的構效關系
抗菌肽又稱為肽類抗生素或抗微生物肽,是生物體內免疫防御機制經誘導產生的抵御外界微生物侵害的特殊小分子多肽。海洋源抗菌肽富含賴氨酸或精氨酸,使抗菌肽帶正電荷,含較多的疏水性氨基酸形成疏水或兩親性結構[32],其分子質量小,容易到達被感染的位置,與傳統抗生素不同,抗菌肽有廣譜抗菌效果,且不會產生耐藥性[33-34]。根據二級結構的差異可將抗菌肽分為4 類:α螺旋型、β折疊型、環形結構類以及伸展性螺旋結構類。
α螺旋型抗菌肽是水脂兩親性結構,疏水性氨基酸和帶正電荷的親水性氨基酸分布在螺旋軸的兩側,螺旋度的變化會影響其抗菌效果和穿透細菌細胞膜的能力[35]。β折疊型抗菌肽在氨基酸組成上富含半胱氨酸,可以形成分子內二硫鍵以穩定β折疊結構[35]。Qin Chuanli等[36]利用反相高效液相色譜從紫貽貝中分離出含55 個氨基酸殘基的新型抗菌肽,這種新型抗菌肽對真菌和革蘭氏陽性菌表現出卓越的抗菌活性,其分子質量為6 621.55 Da,具有一個幾丁質結構域,分子中6 個半胱氨酸殘基形成3 個分子內二硫鍵。環形結構類型在抗菌肽家族中較為少見,其環狀結構由序列中的一個單鍵維持,這類抗菌肽可能同時具有α螺旋結構、β折疊結構。環形結構類型抗菌肽能對抗細菌和真菌,通過核磁共振(nuclear magnetic resonance,NMR)技術測定發現具有反平行β片層的結構,序列11位和18位間形成二硫鍵,通過二硫鍵穩定整個結構[35]。第4種抗菌肽為伸展性螺旋結構,其缺少典型的二級結構,一般呈線型,且氨基酸序列中不含半胱氨酸。富含脯氨酸的伸展性螺旋結構類抗菌肽,其結構含有多個Pro-Arg-Pro特征序列,部分抗菌肽在特定位置的氨基酸殘基上還存在與生物功能密切相關的O-糖基化位點。
海洋源與陸生及兩棲動物來源的抗菌肽在整體結構方面不具有顯著的差別,但是,海洋源抗菌肽也存在一些如富含組氨酸的Piscidins這類特有的家族結構[37],為海洋源抗菌肽的開發應用提供了新思路。
2.2 膜損傷和非膜損傷機制
抗菌肽作為多細胞生物體內的防御物質,由于其不同于傳統抗生素的作用機制而備受關注。對現有研究進行總結,抗菌肽的廣譜抗菌作用主要分為膜損傷機制和非膜損傷機制。
膜損傷機制認為抗菌肽首先導致細胞壁結構變形,再通過靜電相互作用導致細菌細胞質膜穿孔,破壞細胞膜產生孔隙,細胞內的水溶性物質外溢而死亡。破膜型抗菌肽的作用機制假說主要有圖2所示的4 種[38]:桶板模型、環孔模型、毯式模型、聚集模型。在抗菌肽破膜模型中,當膜上抗菌肽的濃度超過閾值時便會插入細胞膜內,形成孔隙,即桶板模型。抗菌肽覆蓋在膜周圍,裂解膜形成地毯模型或插入到膜內形成環孔模型。聚集模型與去污劑作用模式相似,即結合于脂質膜表面的抗菌肽通過改變其自身結構與磷脂分子形成凝聚物,破壞膜結構,形成穿孔跨越細胞膜。Zhu Xin等[39]通過在α螺旋結構的氫鍵連接處放置不同類型的氨基酸殘基來表征其抗微生物特性和作用機理,設計了一系列的兩親性肽,發現優化的序列通過誘導細胞質膜電位損失和改變膜通透性而表現出優異的抗微生物能力。海洋魚類獨有的抗菌肽Piscidins家族的作用機理屬于典型的環孔模型機制。有研究者發現Piscidins-1相比于同源的Piscidins-3具有更強的殺菌能力,可能是由于N端2位的苯丙氨酸增強了螺旋結構的穩定性,而非極性部分17位的組氨酸則提高了破膜能力,改變了細胞膜的電導率和黏彈性,進而起到抗菌效果[40-41]。這一研究清楚地解釋了Piscidins的結構與其抗菌作用機制間的關系。
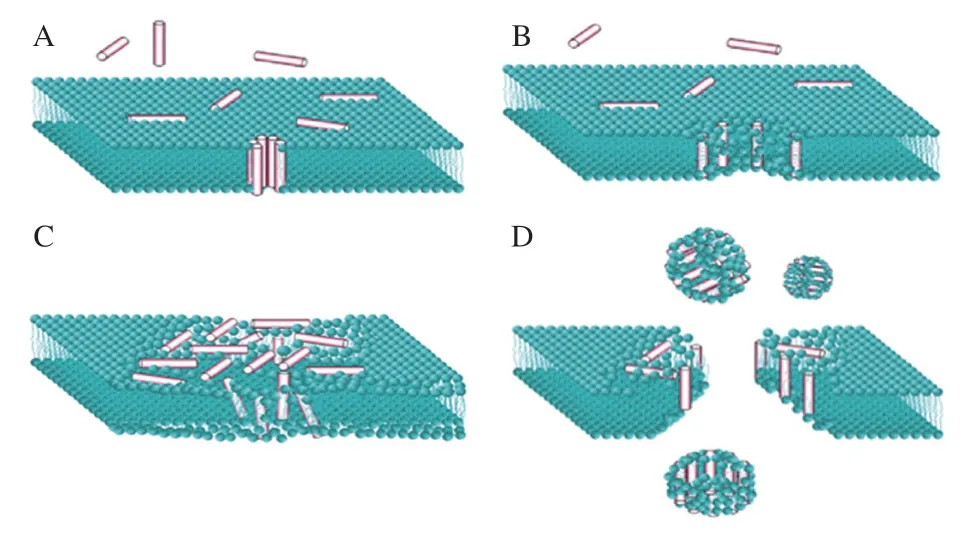
圖2 文獻中常被引用的抗菌肽作用模式圖[38]Fig. 2 Modes of action of antimicrobial peptides against microbial membrane commonly reported in the literature[38]
非膜損傷機制通常作為一種輔助性作用方式,與細胞膜損傷機制聯合作用于菌體細胞。部分抗菌肽可以穿過細胞壁膜進入細胞,作用于菌體胞內的靶點。如圖3所示,抗菌肽的非膜損傷機制主要包括:抑制細胞壁合成,改變細胞脂膜(抑制細胞膜間隔的形成),誘導菌體自溶,抑制胞內酶活力,抑制DNA、RNA、蛋白質的合成以及與DNA結合等[42]。Powers等[43]研究者使用1H-NMR法測定來源于鱟的鱟肽I的結構,發現鱟肽 I是通過I型β轉角連接的兩親性β-發夾結構,可轉移到細胞中發揮抗菌作用。

圖3 抗菌肽細胞內作用機制[42]Fig. 3 Intracellular mode of action of antimicrobial peptides[42]
抗菌肽除了在醫藥領域有望替代抗生素外,在食品行業也具有潛在的開發和利用價值[33]。宋宏霞[44]采用紫貽貝抗菌肽溶液浸泡草莓及鱸魚,監測在一定貯藏條件下有關指標的變化情況,研究結果表明抗菌肽具有保鮮防腐的作用。海洋無脊椎動物只依靠體內免疫機制抵抗入侵細菌或病原體,因此內源性抗菌肽豐富[45],但海洋抗菌肽的獲取存在提取操作繁瑣、純化成本高等問題,使其生產應用受限。提高抗菌肽的生產效率、降低成本是研究者們關注的焦點,高效經濟的生產安全、穩定的海洋源抗菌肽對其發展和應用起有力的推動作用。
3 抗凍肽
3.1 冰晶-肽鏈的構效關系
抗凍蛋白(antifreeze protein,AFP)是一類具有熱滯活性、能夠抑制冰晶生長和重結晶的蛋白質,許多極地海洋魚類能夠存活于低溫環境中正是得益于體內的AFP有效阻止血液在低溫條件下凝固成冰[46]。海洋魚源AFP根據氨基酸組成和結構不同可分為6 種[47-49](圖4):抗凍糖蛋白(antifreeze glycoprotein,AFGPs)、AFP I、AFP II、AFP III和AFP IV及高活性AFP。AFGPs是最早被提取的AFP,肽鏈由肽糖單元重復連接而成,且發現糖基團是重要的抗凍活性基團[50],AFGPs在溶液中自發形成左手螺旋構像,保證肽鏈中的親水的雙糖基一側朝向溶液,形成氫鍵與水分子結合。AFP I的分子質量為3.3~4.5 kDa,富含丙氨酸[51],在AFP中結構最為簡單,其二級結構均呈現兩親性α螺旋,即親水性氨基酸鏈與疏水性氨基酸鏈分別位于螺旋軸的兩側。AFP II結構特征表現為半胱氨酸含量較高,且約有一半能形成二硫鍵。研究證明,用巰基乙醇或者二硫蘇糖醇破壞其二硫鍵會造成熱滯活性喪失,因此,二硫鍵在AFP II分子中起著關鍵作用[52]。AFP III二級結構主要由9 個β折疊組成,其兩兩形成三明治樣結構,剩余的游離在外,另外,AFP III中的親水殘基可以形成多個氫鍵使其和冰晶之間的結合力增強[53]。AFP IV的分子質量約為12.3 kDa,谷氨酰胺含量高,二級結構富含兩親性α螺旋,α螺旋以反向排列折疊成螺旋束的形式使得疏水基團朝內,親水基團向外與冰晶結合[52]。Marshall等[54]從冬鰈魚中分離得到一種高活性的AFP,它的活性和分子質量都比其他類型的AFP更高,使冬鰈魚能夠在-1.9 ℃的極限溫度下生存。

圖4 6 種魚類AFP結構圖[55]Fig. 4 Structural illustration of six kinds of fish antifreeze proteins[55]
但是,天然海洋源AFP含量甚微,應用成本高,隨著對AFP活性結構研究的深入,科學家發現AFP的抗凍活性可來源于其一級結構多肽鏈中的某些片段[56]。海洋源抗凍肽則是利用海洋源蛋白質通過生物酶解技術,篩選出具有抗凍活性的肽段,一般具有GP-X(X為任何氨基酸殘基)三肽重復序列、GTPG-和GPP(OH)_G-等特殊結構特征,且存在特定的氨基酸序列長度[10,57-59]。例如,Wang Shaoyun等[10]將鯊魚皮膠原蛋白酶解產物進行分離純化,得到了等電點小于5.0、分子質量為906 Da的純化親水性抗凍肽SsC-AFP,其氨基酸序列為GAIGPAGPLGP。對保加利亞乳桿菌進行低溫脅迫處理,當SsC-AFP質量濃度為250 μg/mL時,菌種存活率高達90.28%。不同來源的抗凍肽無論結構或活性都存在著很大的差異,其抗凍機理、學說也不完全一致,闡明抗凍肽的作用機制對研究者來說仍然是一個巨大挑戰。
3.2 吸附-抑制與親水-互補作用機理
“吸附-抑制”學說認為AFP能夠在冰晶結合面上吸附,形成冰曲面,通過開爾文效應抑制其生長[60]。在純水體系中,冰晶垂直于晶體表面的方向生長(圖5A),當AFP/抗凍肽分子吸附于冰生長路徑的表面上(圖5B、C),需要在外施加推動力促使冰在雜質間生長。具有特定分子質量和氨基酸結構的抗凍肽積累在冰-水界面,與水分子形成氫鍵吸附于冰核表面,改變冰晶生長方向和形態,形成六棱柱型或六角雙錐體型,抑制冰晶生長及重結晶[10,57-59,61]。

圖5 溶液中冰晶的形狀[55]Fig. 5 Shapes of ice crystals in solutions[55]
汪少蕓[10,57]、Damodaran[58]等根據活性肽氨基酸序列結構進一步對抗凍肽與冰結構層相互作用的理論模型進行了分子動力學模擬構建,采用表面“親水-互補”模型對其作用機制進行分析[57],如圖6所示,該模型認為,具有特定氨基酸長度和結構的抗凍膠原肽的冰晶結合位點所形成的表面與冰結構層面通過氫鍵互補聯結,同時抗凍肽所含有的脯氨酸和丙氨酸殘基等烷基側鏈可以提供非極性環境以穩定氫鍵間的作用。抗凍肽與冰的結合阻止了冰晶的生長,表現出顯著的冰晶生長抑制活性。
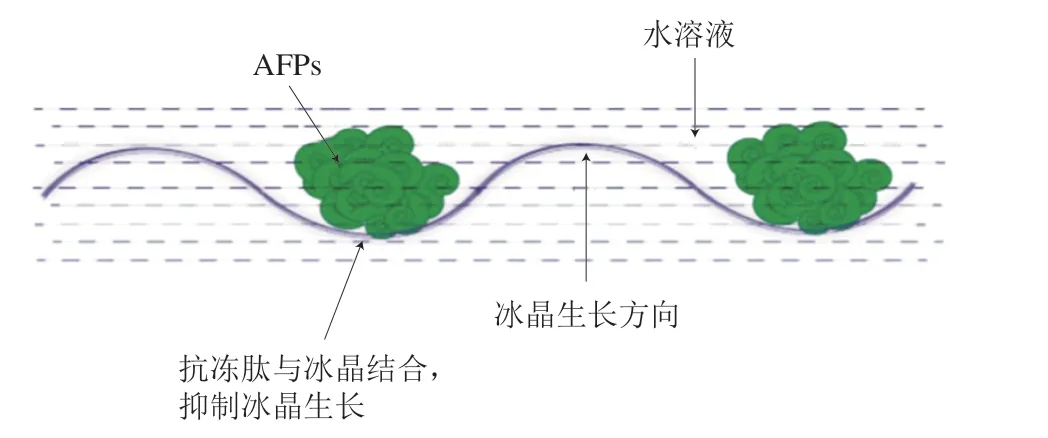
圖6 抗凍多肽與冰晶表面親水-互補作用示意圖[62]Fig. 6 Surface hydrophilic-complementary interaction between antifreeze peptides and ice molecules[62]
抗凍肽具有良好抗凍活性的同時,也具有穩定的性質,獲取手段便捷,制備量大,相較于AFP擁有更多的應用優勢[56]。抗凍肽在食品工業中的應用主要體現在減少低溫冷鏈食品的品質劣變,能夠有效降低冷凍損傷,抑制冰晶形成、生長和重結晶。通過合理地開發利用海洋生物中豐富的蛋白質資源開發抗凍肽,替代現有高鹽、高糖的食品抗凍劑或保水劑是一種新趨勢。
4 金屬離子螯合肽
4.1 肽-金屬離子螯合的構效關系
金屬元素對人體具有明顯的生理功能和營養作用,它們的需求量小,卻與機體生長代謝密切相關[63]。人體內對金屬礦物元素吸收利用率較低,其缺乏會引起多種疾病,因此膳食金屬元素補充劑的開發受到廣泛關注。肽-金屬離子螯合物可以利用機體對肽的吸收而使金屬離子在消化道中更容易被吸收,具備優于無機態金屬離子的生理生化特性。
影響金屬螯合活性的結構特征包括肽的分子大小、氨基酸組成和特定的氨基酸序列,有研究指出海洋源金屬離子螯合肽的羧基、氨基以及側鏈中含孤對電子的氮、氧、硫原子,與金屬陽離子通過化學鍵結合形成肽-金屬離子螯合物[12,64]。Bao Xiaolan等[65]研究表明,某些特定氨基酸序列,如Asn-Cys-Ser被認為具有較高的螯合活性,特定氨基酸也能顯著影響金屬離子螯合肽的螯合作用,如天冬氨酸、谷氨酸和組氨酸,這些氨基酸上的羧基可能是螯合作用的結合位點,從而顯著影響螯合反應。Zhang Lingtuo等[66]從裂殖壺菌粕蛋白水解產物中分離純化出一種鈣螯合肽,鑒定氨基酸序列為Ser-Ser-Val(SSV),分子質量為291.15 Da,具有良好的肽鈣結合能力。利用傅里葉變換紅外光譜分析發現該肽的螯合位點主要為羰基上的氧原子和氨基或亞氨基上的氮原子,SSV-Ca螯合物在酸堿條件下均表現出良好的熱穩定性和溶解性,有利于人體胃腸道對鈣的吸收和利用。Bouhallab等[67]研究發現,肽螯合金屬離子的能力還與肽和金屬離子結合的相對親和常數、穩定常數等有關。此外,蛋白的磷酸化位點會影響肽-金屬離子螯合反應,Wang Jiaxin等[68]發現酪蛋白的去磷酸化降低了酪蛋白磷酸肽與鋅離子的螯合作用。多肽分子可以通過N端氨基、C端羧基、氨基酸側鏈以及肽鏈中的羰基和亞氨基螯合金屬離子,使其具有更高的配合率和穩定性,并且相較于其他類型的金屬離子補充劑具有無毒副作用、制備成本低、操作便捷等優點[63]。
4.2 肽-金屬離子螯合物的吸收作用機制
肽-金屬離子螯合物結構穩定,肽對金屬離子的保護可以避免金屬離子受食物中的植酸和草酸的沉淀,從而提高其生物利用度[69]。
目前出現了兩種被人們較為接受的肽-金屬離子螯合物吸收機制的假說。1)完整吸收假說。即肽作為有機外殼將金屬陽離子包裹起來,肽-金屬離子螯合物以肽的形式被完整吸收進入小腸,通過肽的吸收通道,在小腸中進行轉運[70],以完整的結構進入循環系統。2)競爭吸收假說。即多肽金屬螯合物中的金屬元素通過競爭方式被吸收利用,螯合物整體進入消化道后,金屬元素受肽的包裹保護到達小腸黏膜的刷狀緣,在吸收位點處肽-金屬離子螯合物發生水解,膳食金屬礦物元素分離出來,以離子形式進入腸上皮細胞,通過金屬離子通道進入體內消化。Feng Yinuo等[71]發現酪蛋白水解物能夠防止鋅離子與磷酸鈣發生聚沉,提高小鼠腸道對鋅的吸收,推斷Zn/CaP-納米復合物一部分在細胞溶酶體中降解釋放Zn2+到細胞質中;另一部分經內吞作用進入基底外側(圖7)。Ferraretto等[72]的研究進一步說明,螯合物的作用方式可能是肽直接嵌入到細胞膜中形成特殊的Ca2+選擇性通道,作為一種鈣載體活性肽經過細胞膜內吞作用使Ca2+進入細胞溶質中。憑借機體對肽類的吸收通路機制,肽與金屬離子的螯合物具有作為一類新式金屬離子增補劑的潛質,用于提升金屬離子在機體的生物利用度和生物利用速度。

圖7 Zn/CaP納米復合物的腸吸收[71]Fig. 7 Intestinal absorption of Zn/CaP nanocomplexes[71]
目前,研究者們通過各種方式制備分離得到海洋源金屬離子螯合肽,在與各類金屬離子發生螯合作用后可以作為抑菌劑[73]、抗氧化劑[74]和人體金屬離子補充劑[75]等產品應用到工業化生產中,具有無毒副作用、生物利用率更高、制備成本更為低廉、流程更為簡便等優點,有著廣泛的商業價值潛力和研究前景。
5 免疫調節肽
5.1 肽與免疫調節的構效關系
免疫力降低是人體代謝失常的根本原因,免疫系統是抵御病原體的第一道防線,能夠在身體機能受損之前提供保護。因此,機體免疫功能的強化是疾病防控及診療的關鍵。海洋生物成為新型免疫調節肽提取的重要來源。Chalamaiah等[76]對不同酶水解產生的魚卵蛋白水解物的體內免疫調節潛力進行了評估。在45 d內,對不同濃度的魚卵蛋白水解物進行了處理。胃蛋白酶水解產物增加了脾巨噬細胞的細胞毒性和吞噬活性以及血清中免疫球蛋白A的水平。同時,胃蛋白酶和堿性蛋白酶水解物增強腸道內黏膜免疫,而胰蛋白酶水解產物增加了脾臟中CD4+、CD8+細胞數量。這些研究表明,水解產物的免疫調節作用與蛋白酶的類型有關,酶的特異性決定了生物活性肽的片段大小和序列分布。有研究報道,阿拉斯加鱈魚的蛋白水解物能夠刺激小鼠脾臟細胞的淋巴細胞增殖,與此活性相關的多肽的序列為NGMTY、NGLAP、WT[77]。免疫效應可能與氨基酸的物理化學特性相關,如正電荷數量、疏水性和鏈長。帶正電荷的肽類似于趨化因子,可以結合免疫細胞上的受體,激活免疫反應。Yang Ruiyue等[78]在鮭魚酶解產物中發現其氨基酸組成主要為Asp、Glu、Lys和Leu,得到的寡肽可以顯著提高刀豆蛋白的活性、刺激淋巴細胞增殖、促進分泌細胞因子、調節自然殺傷細胞活性等。Merly等[79]在對鯊魚軟骨酶解產物的研究中發現,產物中Ⅱ型膠原蛋白α-1鏈和糖肽可進一步誘導機體的免疫反應。Wang Yukai等[80]對牡蠣水解多肽的免疫調節作用進行了研究,經牡蠣水解多肽處理的小鼠,體內淋巴細胞數量明顯增多,同時發現自然殺傷細胞的活性也顯著提高,血清中白細胞介素2分泌水平也有所提高。蛋白質被人體攝入后經過消化道酶解作用,多以小肽的形式通過小腸絨毛上皮細胞消化吸收。根據體內外的研究證據表明,免疫調節肽被認為是一種具有潛力的調節免疫反應策略物質,能夠增強對感染因子的反應并減少組織損傷,對減輕自身免疫性疾病、炎癥發生或與免疫系統相關的其他過程有著重要作用。
5.2 肽-特定細胞免疫調節的作用機制
免疫調節肽可通過調節淋巴細胞、單核細胞和粒細胞等刺激機體的免疫功能,關于免疫活性肽的調節機制一直是研究者們關注的熱點[81]。外源性免疫調節肽可以通過直接作用于免疫系統的特定細胞發揮調節作用,其作用途徑主要通過刺激特定細胞的細胞因子的分泌,誘導免疫細胞分化或激活免疫相關的細胞通路等[82-83]。
目前,研究者對免疫調節肽與免疫系統特定細胞之間的相互作用假說猜測與抗高血壓和阿片肽系統有關[82-83]。如圖8所示,相關研究表明免疫調節肽能夠與位于免疫細胞表面的δ、μ型或κ型阿片受體相互作用,中樞阿片受體的激活可以調節周圍的免疫系統[84-85]。酪啡肽在與阿片受體相互作用時,抑制了伴刀豆球蛋白刺激的淋巴細胞DNA合成和淋巴細胞中鳥氨酸脫羧酶的活性,從而抑制了體外固有層淋巴細胞增殖,影響人體黏膜免疫系統。肽序列決定了免疫細胞的反應活性,免疫調節肽的作用可歸因于N端或C端區域的精氨酸、色氨酸或磷酸化的絲氨酸殘基,以及谷氨酰胺的存在,這些氨基酸能夠被免疫細胞表面的阿片受體識別[83]。
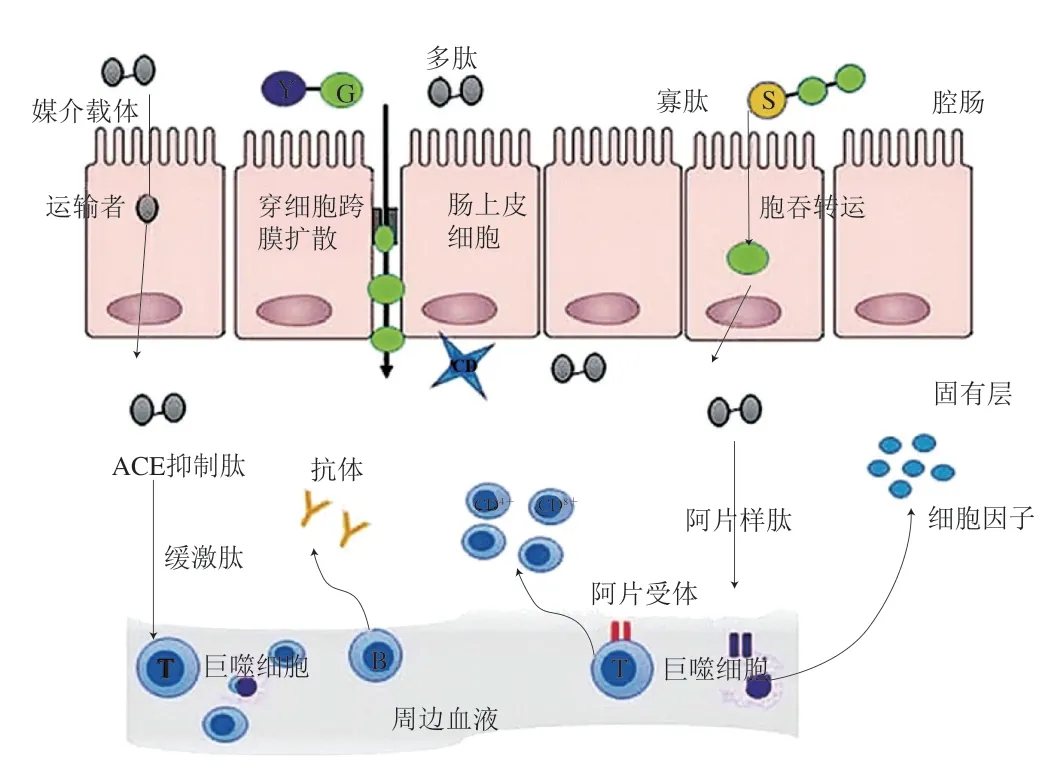
圖8 肽與免疫細胞相互作用的相關機制[84]Fig. 8 Mechanism associated with peptides and their interactions with immune cells[84]
血管緊張素轉化酶(angiotensin converting enzyme,ACE)抑制肽是高活性酪蛋白血管緊張素轉化酶抑制肽,對于高血壓有很好的治療效果。免疫調節作用也與ACE抑制肽的作用機制相關。在ACE抑制肽發揮功效時形成的緩激肽是一種免疫調節肽,因此ACE抑制肽也具有免疫調節活性。緩激肽能夠與靶細胞上的激肽受體結合,通過刺激巨噬細胞促進淋巴細胞增殖和轉移,并誘導淋巴因子激活的殺傷細胞分泌細胞因子,發揮免疫調節作用[86]。免疫調節肽的N端或C端區域內有精氨酸可以被T細胞的膜結合受體識別,這些T細胞是淋巴因子的產生者。因此,C端精氨酸的存在是ACE抑制肽的結構特點,并且與免疫調節活性相關。
目前,許多藥物在臨床上用于控制人體免疫功能,包括左旋咪唑、咪喹莫特、匹多莫德等。但大多數合成的免疫調節藥物都有一定的毒性和副作用,而天然來源的免疫調節蛋白或肽安全可靠且成本較低,現代營養學研究發現人類攝食蛋白質經消化道的酶解作用后,大多是以小肽的形式通過腸壁轉運消化吸收,海洋源免疫調節肽可從多層面廣泛地調節機體的免疫功能,對提高機體免疫力、確保機體健康具有重要的意義[87]。
6 結 語
此外,科研工作者發現海洋生物活性肽還具有抗衰老[88]、降血糖[89]、抗高血壓[90]、ACE抑制活性[91]、抗炎[92]等功效,為此研究者還在不斷地發現、分離、純化新的海洋源功能肽類物質[1]。海洋源生物活性肽分子質量小,易被人體吸收和滲透到組織中;同時其毒副作用小、穩定性高,具有食療效果等優點[93],這啟發了研究者,海洋生物酶解提取物有望向功能食品的研發方向發展,同時充分利用海洋生物加工副產物,經過活性肽提取能夠帶來巨大的收益,提升商業價值。由于海洋資源的富饒,海洋環境的特殊和多樣化,現有的活性功能肽作用機制有待深究,新型的海洋源生物活性肽也待科學家們去發現。
海洋源生物活性肽的開發仍然存在較大的局限性。酶解法是目前制備活性肽最為高效、普遍的方法,可以通過開發新型蛋白酶試劑、多種蛋白酶聯合反應、采用多技術結合對酶解法獲得海洋源生物活性肽進行深入優化,推進酶工程在海洋源生物活性肽領域的應用[9]。目前對海洋生物活性肽研究大部分仍處于實驗室階段,可以通過開發適用于產業化生產的活性肽分離設備,使得海洋生物活性肽能夠從實驗室科研水平進入產業規模化的生產。
海洋生物活性肽作為功能性食品及藥品具有廣闊的應用前景,但是在體內的研究還相對較少,在投入市場前,須對其活性進行檢測和安全性評估[9]。此外,已有研究證明蛋白或肽的構象對這些分子的生物活性起到了決定性作用,因此,更加深入的構效關系分析極其必要,可以考慮對已經獲得的海洋生物活性肽結構進行化學修飾,從而提高其活性和性能,有利于市場開發利用。

