深度學習重建算法對肝臟圖像質量及肝轉移瘤診斷的研究
許藝馨,李輝堅,王國華,王銘君,張振
1.青島大學附屬青島市市立醫院 放射科,山東 青島 266011;2.青島市第八人民醫院 放射科,山東 青島 266121;3.GE中國CT影像研究中心,上海 200240
引言
CT是檢測肝轉移瘤最常用的影像學方法,隨著現代技術的不斷革新,計算機斷層掃描技術不斷發展[1-3]。傳統的濾波反投影(Filter Back Projection,FBP)算法依賴的是噪聲與空間分辨率之間的線性關系,且算法易受統計波動的影響,投影數據不足,圖像質量會明顯降低[4-5]。與FBP相比,多模型迭代重建(Adaptive Statistical Iterative Reconstruction-Veo,ASiR-V)算法改進了噪聲模型、物體模型及物理模型,在降低噪聲、提高密度及空間分辨率方面得到極大的改善[6-9],在高對比度診斷任務中表現突出。但是,有報道指出,ASiR-V圖像的噪聲紋理看起來“平滑”“塑料感”或“不自然”[10-11],這會對低對比度病變的檢測產生不利影響。
為了解決上述算法的不足,一種新型的基于深度學習的圖像重建(Deep Learning Image Reconstruction,DLIR)算法正在蓬勃發展。這項技術是以深度神經網絡(Deep Neural Network,DNN)為基礎,以大量高劑量FBP圖像和原始數據作為訓練集,在低劑量或非理想掃描條件下的CT數據也可以進行高質量圖像重建[12]。有研究表明,DLIR能有效改善圖像質量,并且對于解剖和細小結構的顯示具有明顯優勢[2,13]。本研究旨在通過與FBP及ASiR-V相比,評價DLIR對肝臟轉移瘤患者CT圖像質量的影響,以期獲得較高的圖像質量,并為臨床診斷提供更清晰的病灶顯示和更高的診斷信心。
1 資料與方法
1.1 一般資料
將2020年5至12月在青島大學附屬青島市市立醫院就診,符合如下標準的肝臟腫瘤患者納入研究。納入標準:① CT圖像顯示清晰,無較大偽影者;② 已確診為其他部位原發腫瘤(經病理證實),且經病理或后期增強CT隨訪證實的肝轉移瘤患者;③ 體質指數在18.5~23.9 kg/m2;④ 患者均有腹部CT平掃和動態增強掃描圖像。排除標準:① 呼吸無法配合、影響圖像測量和評價者;② 嚴重圖像偽影者。最終納入研究者有32例,其中男18 例,女14 例;年齡40~82 歲,平均(55.8±12.75)歲。本研究經醫院倫理委員會批準,患者均簽署知情同意書。
1.2 儀器與方法
患者采用GE 256排Revolution CT機(GE Healthcare,Milwaukee,WI,USA)行腹部常規輻射劑量掃描,仰臥位,頭先進。雙手上舉交叉抱頭,掃描前進行呼吸訓練,吸氣后屏氣掃描,并對甲狀腺及盆腔進行防護。掃描參數:管電壓120 kV,采用智能管電流調控Smart mA模式,管電流范圍250~500 mAs,噪聲指數8.5 HU,螺距0.992,轉速0.8 s/r,層厚及層距均為5 mm。先進行平掃,然后進行增強掃描。增強采用高壓注射器注入碘對比劑(320 mgI/mL)70 mL,流速2.2 mL/s。注射對比劑后分別在30、50和120 s行動脈期、門靜脈期和平衡期掃描,掃描結束后記錄CT容積劑量指數(Computed Tomography Dose Index,CTDIvol)、劑量長度乘積(Dose Length Product,DLP)和有效劑量(Effective Dose,ED)。
1.3 圖像重建
將門靜脈期掃描原始數據分別采用0 ASiR-V(FBP)、30% ASiR-V、DLIR-L、DLIR-M、DLIR-H進行圖像重建,重建層厚1.25 mm,窗寬300 HU,窗位45 HU。將5組重建圖像傳入AW 4.7后處理工作站用于圖像測量和評價。
1.4 圖像評價
1.4.1 圖像客觀評價
5組薄層重建橫斷位圖像上,選取病灶顯示最清晰或病灶最大的層面,在層面上下連續3個層面上測量病灶實質部分及相鄰正常肝組織的CT值、右側椎旁肌肉的噪聲值(Standard Deviation,SD)值,以肌肉SD值作為圖像背景噪聲。感興趣區(Region of Interest,ROI)大小為20~40 mm2,病灶ROI的選取應盡量避開壞死、出血、鈣化等區域;肝組織ROI的選取應盡量避開肝內膽管、血管等區域。每個參數測量三次取平均值。計算健康肝臟和病灶處信噪比(Signal to Noise Ratio,SNR)和病灶處對比噪聲比(Contrast to Noise Ratio,CNR),SNR肝臟/病灶=CT肝臟/病灶/SD肌肉;CNR=(CT肝臟-CT病灶)/SD肌肉。
1.4.2 圖像主觀評價
由2名工作5年以上且經驗豐富的放射科診斷醫師采用5分制對5組重建圖像質量進行雙盲主觀評分。評價內容包括:① 圖像質量,采用5分法:5分,圖像質量優;4分,圖像質量較好;3分,圖像質量尚可;2分,圖像質量較差,影響診斷;1分,圖像質量差,無法用于診斷;② 病灶顯示(包括病灶邊緣、病灶內小囊變、小血管等),采用5分法:5分,顯示清晰;4分,顯示較好;3分,顯示欠佳;2分,顯示模糊;1分,完全不能顯示;③ 診斷信心度,5分法:5分,完全有信心診斷為轉移瘤;4分,較有信心診斷為轉移瘤;3分,提示轉移瘤可能;2分,僅提示病變,轉移瘤不能除外;1分,完全不能診斷。
1.5 統計學處理
采用SPSS 21.0統計分析軟件,計量資料以均值±標準差(±s)表示。客觀評分各參數組間差異采用Kruskal-Wallis檢驗正態性,組間多重比較采用多個獨立樣本檢驗。主觀評分使用秩和檢驗。2名放射科醫師對圖像質量主觀評分的一致性采用Kappa檢驗,以P<0.05為差異有統計學意義。
2 結果
2.1 病人情況和輻射劑量
全部病例中,經病理證實者8例,臨床資料證實者24例。其中22例為結直腸癌肝轉移,5例為胰腺癌肝轉移,3例為胃癌肝轉移,1例為乳腺癌肝轉移。門靜脈期掃描的平均CTDIvol為(16.30±2.79)mGy,DLP為(557.48±104.37)mGy.cm,ED 為(8.51±1.55)mSv。
2.2 5種重建圖像評價
在門靜脈期5組圖像中,DLIR組的SD值均低于FBP、30% ASiR-V,其中DLIR-H的SD最低(6.35±1.27),DLIR-M次之(P<0.001)。DLIR組中肝臟和病灶的SNR及病灶的CNR值均高于FBP、30% ASiR-V(P<0.001),其中DLIR-H的數據最佳,均明顯優于其他算法結果(P<0.001)。具體數值如表1所示。
表1 5組重建圖像客觀測量參數的SD、SNR、CNR值(±s)

表1 5組重建圖像客觀測量參數的SD、SNR、CNR值(±s)
重建算法 SD 肝臟SNR 病灶SNR CNR FBP 18.2±3.33 5.63±1.7 3.46±1.45 2.17±0.81 30% ASiR-V 13.62±2.7 7.59±2.44 4.68±2.05 2.91±1.13 DLIR-L 10.73±2.1 9.65±3.07 5.96±2.56 3.69±1.47 DLIR-M 8.62±1.63 12.02±3.8 7.45±3.14 4.57±1.85 DLIR-H 6.35±1.27 16.32±5.1 10.09±4.16 6.24±2.61統計值 130.526 111.575 87.572 95.558 P值 <0.001 <0.001 <0.001 <0.001
2位放射科診斷醫師的主觀評分在圖像質量的Kappa值為0.8,表現出高度的一致性。得分從FBP、30%ASiR-V到DLIR依次遞增,DLIR-M(4.98±0.21)最佳,較FBP及30% ASiR-V增加48%、29%(P<0.001)。經多重比較之后發現,各組間差異均有統計學意義。具體數值如表2所示,圖像質量如圖1所示。
表2 5組重建圖像的主觀評分(±s)

表2 5組重建圖像的主觀評分(±s)
重建算法 圖像質量 病灶顯示 診斷信心FBP 2.55±0.48 2.92±0.70 2.58±0.59 30% ASiR-V 3.55±0.47 3.27±0.82 3.39±0.49 DLIR-L 4.84±0.35 4.41±0.81 4.44±0.58 DLIR-M 4.98±0.24 4.55±0.54 4.54±0.39 DLIR-H 4.05±0.35 4.08±0.52 4.23±0.55統計值 267.723 4165.538 226.098 P值 <0.001 <0.001 <0.001
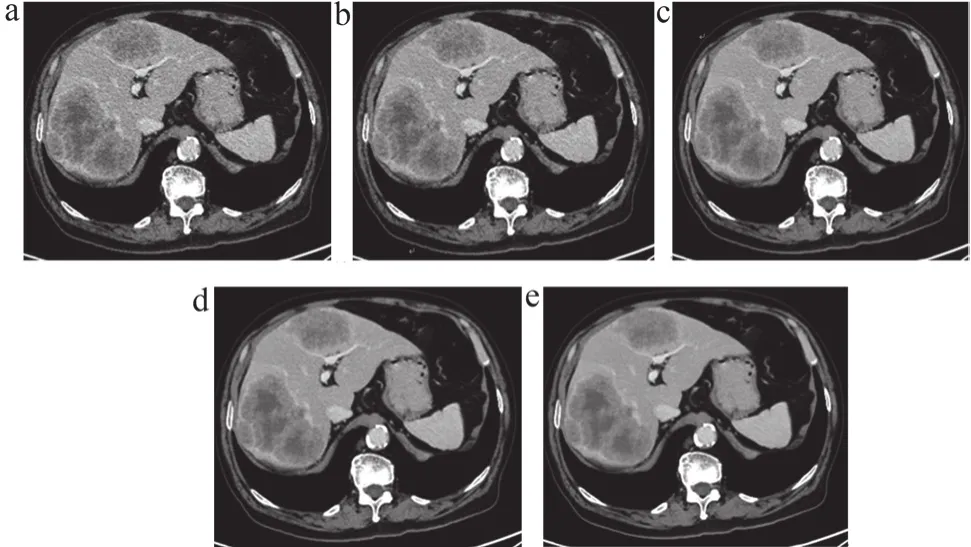
圖1 患者直腸癌術后肝臟多發轉移影像
2位放射科診斷醫師對病灶顯示的主觀評價Kappa值為0.531,表現出一般的一致性。對病灶顯示評分表現為DLIR得分高于30% ASiR-V,FBP算法的得分最低,其中DLIR-M(4.55±0.54)最佳(P<0.001)。經多重比較后發現,各組間差異均有統計學意義,其他組間差異均有統計學意義(表2)。
在診斷信心方面,2位放射科診斷醫師的主觀評分為0.703,表現出高度一致性。結果顯示,DLIR表現明顯優于ASiR-V及FBP,其中DLIR-M(4.54±0.39)最優(P<0.001)。經多重比較后發現,DLIR-M與DLIR-L之間差異沒有統計學意義,其他組間差異均有統計學意義(表2)。
3 討論
CT因其掃描速度快、圖像分辨率高等優點,在臨床上被廣泛應用來評估肝臟疾病[14]。CT增強掃描在肝轉移瘤診斷方面具有明顯優勢,但關于輻射劑量能引起惡性腫瘤的問題已經引起了人們的廣泛關注[9,15-18]。對于惡性腫瘤患者而言,減少放射劑量可能會增加疾病診斷的難度[19]。因此,研究者一直努力平衡輻射劑量與圖像質量之間的關系。這通常依賴于重建算法的技術進步[3,20]。典型的肝轉移瘤表現為“牛眼征”,清楚地顯示瘤體實性部分與內部壞死組織的對比差異是診斷的關鍵[21]。之前的研究揭示了ASiR-V的局限性,存在“蠟質”“過度平滑”等缺點,特別是在低對比度檢測任務時,為病灶的檢出及診斷帶來風險[22]。而DLIR是以高劑量高質量的FBP圖像作為訓練目標,所以即使是低對比度診斷目標,DLIR重建的圖像都應具有出色的圖像質量和真實的噪聲紋理[10,23-24]。本研究旨在對比傳統FBP和ASiR-V,研究新型DLIR重建算法對肝臟圖像質量和肝臟腫瘤診斷信心的提高。
Greffier等[25]的研究已經表明,對于像肝轉移瘤這種對比度偏低的診斷任務,DLIR算法的檢測能力高于其他算法。另外的一些研究也評估了DLIR重建技術在其他臟器中的應用。如Nj?lstad等[26]研究了在0.625 mm及2.5 mm層厚條件下,DLIR算法在肝臟實質、肝內血管結構、圖像噪聲和紋理方面的成像效果,結果顯示相較于ASiR-V及FBP,DLIR提供了最優的圖像質量。這些研究對比進一步肯定了DLIR重建算法的進步性及優越性。
本研究顯示,在肝轉移瘤圖像中,相比于FBP和ASiR-V,DLIR表現出較好的降噪能力,并且隨著DLIR重建水平的增加,降噪能力依次增加;同時也展示出了較高的CNR及SNR,其中DLIR-H表現最佳。但在2名放射科醫師主觀評分過程中,發現DLIR-H的圖像“過度平滑”,存在不熟悉的塑料圖像紋理,病灶內較小的血管及小囊變顯示不清,導致圖像對比度降低,并且與DLIR-L相比,整體圖像質量顯示欠佳,導致對疾病的診斷存在不確定性、信心不足。這是因為隨著DLIR重建強度的增加,去噪能力增強,但由于去噪算法的局限性,去噪強度過高時,會導致圖像紋理發生變化、成像的一些細小結構損失,圖像質量變得模糊,進而導致診斷信心降低。因此,盡管在客觀數據測量中DLIR-H表現最好,但DLIR-H并沒有被評為最佳算法,而DLIR-M在提供了較好的降噪能力及圖像紋理的同時也保留了病灶中小的細節,所以DLIR-M被評為最佳的圖像重建算法。這與之前的報道一致[13],表明在常規輻射劑量條件下,DLIR-M在減少圖像噪聲和提高圖像質量及診斷信心等方面表現最好。
本研究的局限性:① 樣本量小;② 僅研究了門靜脈期的圖像質量;③ 圖像客觀參數的測量及主觀評價受醫師的影響;④ 只應用于常規劑量檢查,沒有將不同算法應用于低劑量檢查中進行評估。在今后的研究中,需要進一步擴大樣本量,增加對動脈期及平衡期圖像質量的研究,邀請更多不同年資診斷醫師參與主觀評分,以確保統計的準確性和完整性,同時將低劑量檢查應用于不同的重建算法來評估圖像質量。
綜上,DLIR作為一種先進的重建方法,提高了肝臟圖像質量和肝臟腫瘤診斷信心。