上皮性卵巢癌中Bax、Gal-3及GST-π表達與順鉑化療耐藥的關系*
王小玉 唐寅 孔佑虔 朱夢一
(1.黑龍江中醫藥大學,黑龍江 哈爾濱 150040;2.黑龍江中醫藥大學附屬第一醫院,黑龍江 哈爾濱 150040)
上皮性卵巢癌因起病隱匿、早期缺乏有效篩查手段及易在盆腔內散播和轉移等原因,其病死率占女性生殖道惡性腫瘤首位[1]。該類患者約80%對鉑類為基礎的化療敏感,但多數會出現復發和鉑耐藥。因此,上皮性卵巢癌的治療效果一直無法完善,5年生存率一直徘徊在30%~40%,且90%以上患者死于原發性或繼發性化療耐藥[2]。因此,明確耐藥相關分子機制,尋找有效的耐藥逆轉劑和治療靶標,對提高上皮性卵巢癌化療敏感性、逆轉耐藥與調整治療方法具有重要意義[3]。目前針對臨床標本的報道指出,細胞凋亡相關因子Bax、半乳糖凝集素-3(Galectin-3,Gal-3)及谷胱甘肽轉移酶-π(Glutathione transferase,GST-π)等因子水平與甲狀腺癌、膀胱癌、卵巢癌等惡性腫瘤化療敏感性具有一定相關性,但體外實驗及機制研究鮮為報道[4-5]。基于此,本研究通過觀察上皮性卵巢癌中Bax、Gal-3及GST-π表達與順鉑化療耐藥的關系,探討其可能機制,并為順鉑耐藥的上皮性卵巢癌的治療提供新思路。
1 資料與方法
1.1 一般資料 選取2018年4月~2019年12月黑龍江中醫藥大學附屬第一醫院收治的94例上皮性卵巢癌患者(卵巢癌組)為研究對象,按對化療是否敏感分為化療敏感組(敏感組)58例和化療耐藥組(耐藥組)36例。納入標準:①均符合《婦產科學》第九版相關上皮性卵巢癌的診斷標準[6]。②未合并其他臟器惡性疾病。③既往無卵巢手術史。④均順利完成本次研究,無中途退出者。排除標準:①臨床資料缺損或丟失者。②術前進行放療、化療等治療者。③過敏體質者。④心、腦、肝、腎等功能嚴重不全者。另選取同期進行健康體檢的53例女性體檢者作為對照組。本研究經醫院醫學倫理委員會批準通過,受試者均簽署知情同意書。
1.2 方法
1.2.1 主要試劑 Bax鼠抗人單克隆抗體,購自福州邁新生物技術公司;Gal-3鼠抗人單克隆抗體,購自美國Santa Cruz公司;GST-π鼠抗人單克隆抗體,購自北京中山生物技術開發公司。鏈酶菌抗生物素蛋白-過氧化物酶連接(SP)免疫組化超敏試劑盒、胰蛋白酶及二氨基聯苯氨酶底物顯色試劑盒,均購自福州邁新公司。
1.2.2 檢測方法 標本經10%甲醛固定,石蠟包埋,組織連續切片,厚度為4μm;脫蠟、水化,隨后經3%雙氧水消化內源性過氧化物酶。然后根據SP免疫組化染色法對VEGF-C、CCL21及Bmi-1蛋白進行檢測,檢測過程嚴格按照說明進行。一抗陰性對照使用PBS(磷酸鹽緩沖液)進行代替。
1.2.3 結果判斷 Bax表達于細胞質,Gal-3、GST-π表達于細胞核、細胞質中。根據陽性細胞百分比、染色強度判定[7]。①陽性標準為在細胞核或細胞漿內出現棕黃色或褐色顆粒。0分為無色,1分淡黃色,棕黃色2分,棕褐色3分。總積分:上述2項評分的乘積。陽性:總積分>4分。②陽性細胞率計算:從每張切片中隨機選取5個高倍視野并計算、觀察陽性細胞數,陽性細胞率=陽性細胞數/觀察細胞數×100%。0分:無陽性細胞;1分:陽性細胞<10%;2分:10%~50%;3分:50%~75%;4分:>75%。總積分:上述2項評分的乘積。陽性:總積分>4分。
1.3 觀察指標 ①比較卵巢癌組、對照組Bax、Gal-3及GST-π表達情況。②分析卵巢上皮性癌病理特征與Bax、Gal-3及GST-π的關系。③根據美國婦科腫瘤學組(GOG)建議分型[7]:初次采用順鉑藥為基礎的化療并獲得緩解,停藥超過6個月出現復發灶者納入敏感組;將初次治療有效,但病灶完成化療相對較短的時間即6個月內復發者納入耐藥組。分析兩組Bax、Gal-3及GST-π表達情況,并分析上述因子預測上皮性卵巢癌患者順鉑化療耐藥的價值。
1.4 統計學分析 采用SPSS 22.0軟件進行統計分析,計數資料通過率(%)表示,并采用2檢驗,采用ROC曲線分析Bax、Gal-3及GST-π對順鉑化療耐藥的預測價值。檢驗水準為α=0.05,P<0.05為差異具有統計學意義。
2 結果
2.1 卵巢癌組與對照組一般資料比較 納入的94例上皮性卵巢癌患者患者,均為初次治療,術后輔以順鉑的聯合化療;患者年齡34~67歲,平均年齡(45.54±10.52)歲;臨床分期:Ⅰ期19例,Ⅱ期16例,Ⅲ期36例,Ⅳ期23例;病理類型:漿液性癌43例,黏液性癌31例,子宮內膜樣10例,透明細胞癌10例;伴淋巴結轉移者60例(盆腔淋巴結45例和腹主動脈旁淋巴結15例);病理分級G122例,G228例,G344例。對照組年齡33~66歲,平均年齡為(44.56±9.54)歲。兩組一般資料比較差異無統計學意義(P>0.05)。
2.2 兩組Bax、Gal-3及GST-π表達情況比較 卵巢癌組Bax、Gal-3及GST-π陽性表達率均高于對照組 (P<0.05)。見表1。
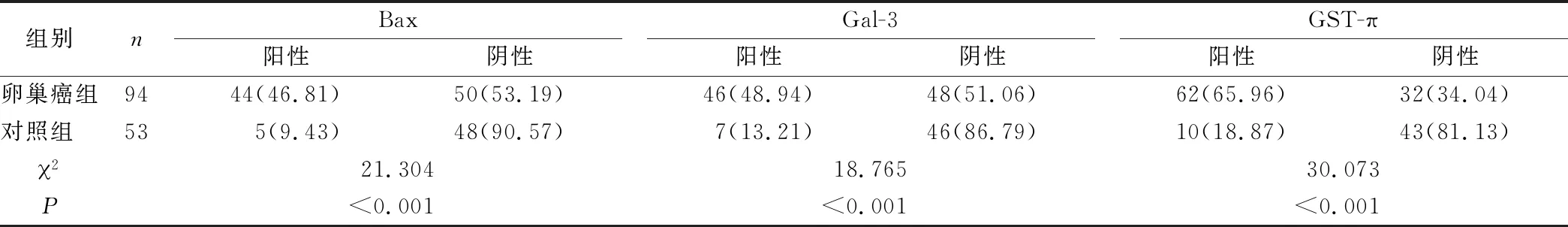
表1 卵巢癌組、對照組Bax、Gal-3及GST-π表達情況比較[n (×10-2)]Table 1 Comparison on Bax,Gal-3 and GST-π expression in ovarian cancer group and control group
2.3 Bax、Gal-3及GST-π表達與上皮性卵巢癌病理特征的關系 Bax陽性表達率與上皮性卵巢癌患者臨床分期、病理分級具有顯著相關性 (P<0.05);Gal-3陽性表達率與上皮性卵巢癌患者臨床分期、淋巴結轉移及病理分級具有顯著相關性 (P<0.05);GST-π陽性表達率僅與患者病理分級具有相關性 (P<0.05)。見表2。

表2 Bax、Gal-3及GST-π表達與上皮性卵巢癌病理特征的關系[n (×10-2)]Table 2 The relationship between the expressions of Bax,Gal-3 and GST-π and the pathological characteristics of epithelial ovarian cancer
2.4 敏感組、耐藥組Bax、Gal-3及GST-π表達情況 卵巢癌患者中敏感組Bax陽性表達率顯著高于耐藥組,Gal-3、GST-π陽性表達率顯著低于耐藥組,組間比較差異均具有統計學意義 (P<0.05)。見表3。
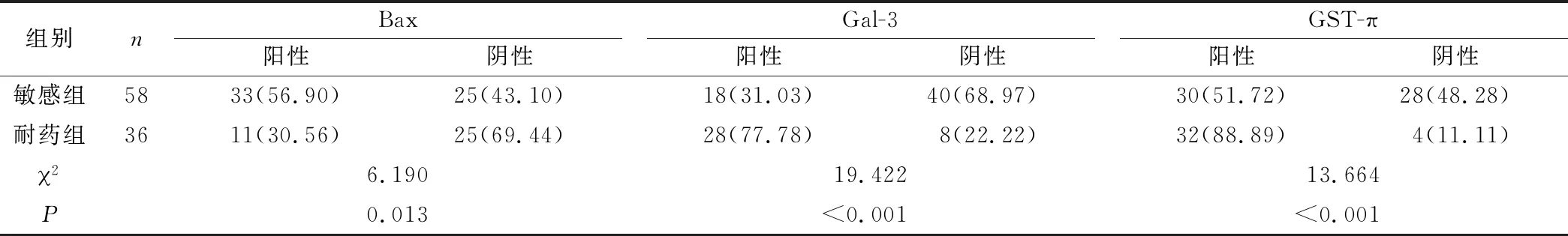
表3 敏感組、耐藥組Bax、Gal-3及GST-π表達情況[n (×10-2)]Table 3 Bax,Gal-3 and GST-π expressions in the sensitive group and drug-resistant groups
2.5 Bax、Gal-3及GST-π預測上皮性卵巢癌患者順鉑化療耐藥的價值 ROC結果顯示,Bax、Gal-3及GST-π單項檢測曲線下面積(AUC)分別為0.655、0.691、0.773,聯合檢測AUC為0.803,明顯高于單獨檢測。見表4、圖1。

表4 Bax、Gal-3及GST-π預測上皮性卵巢癌患者順鉑化療耐藥的價值Table 4 The value of Bax,Gal-3 and GST-π in predicting drug resistance of cisplatin chemotherapy in patients with epithelial ovarian cancer
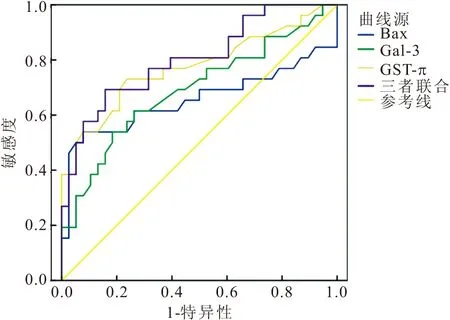
圖1 Bax、Gal-3及GST-π單項及聯合預測曲線圖Figure 1 The prediction curve of single Bax,Gal-3 and GST-π and combined detection of them
3 討論
目前臨床上治療上皮性卵巢癌的標準治療方案為腫瘤細胞減滅術結合鉑類為基礎的輔助化療。綜合治療后,多數患者會出現復發或進一步轉移擴散,晚期上皮性卵巢癌患者5年生存率不超過30%[8]。以順鉑為代表的鉑類是上皮性卵巢癌化療的一線藥物,順鉑進入細胞后,解離形成帶正電荷的水合鉑,與胞內親質子的分子結合,包括 DNA、RNA 和蛋白質,進而引發細胞程序性死亡。而對鉑類藥物耐藥是導致腫瘤未控、復發等治療失敗的重要原因之一[9]。因此尋求可逆轉卵巢癌鉑耐藥的分子靶點是綜合治療上皮性卵巢癌的重要方向與目標之一。
Bax是促凋亡類蛋白的典型代表,Mazumder[10]研究表明,Bax在乳腺癌、直腸癌等惡性腫瘤的凋亡調解中發揮著重要作用。同時國外有報道在已建立的細胞系和原發性卵巢癌細胞中發現Bax基因過度表達將增強化療藥物誘導的細胞毒作用,提示上皮性卵巢腫瘤中Bax基因與化療藥物耐藥性及預后有關[11-12]。Gal-3在人類基因組中由單個基因 LGALS3 編碼位于14號染色體,是半乳糖凝聚素家庭中唯一的嵌合型代表[13]。Gal-3主要存在于細胞質中,在多種生物行為中起重要作用,如胚胎形成、生長、細胞增值、分化、細胞周期進展、凋亡等。Krishna[14]等報道在卵巢透明細胞癌細胞中沉默Gal-3表達后,由順鉑誘導的細胞凋亡明顯增加,沉默效應消除后,誘導凋亡效應也隨之減弱。GST是一種多功能藥物代謝酶,參與細胞內解毒,可分為μ、α、θ、π及膜結合微粒5種類型,其中以GST-π與腫瘤細胞的多藥耐藥關系最為密切[15]。GST-π通過催化方式降解藥物及酶結合方式將抗癌藥物從體內排出,從而造成腫瘤細胞耐藥,GST-π高表達是導致宮頸癌對鉑類耐藥的主要原因[16]。
本研究結果顯示,Bax、Gal-3及GST-π在卵巢癌組織中的陽性表達率顯著高于正常卵巢組織,且上述因子表達與腫瘤分期、病理分級及淋巴結轉移具有一定關系,提示Bax、Gal-3及GST-π表達異常參與上皮性卵巢癌的發生、發展,可作為預測上皮性卵巢癌發生、發展過程中的重要標記物。此外,本研究發現,化療耐藥組中Bax呈低表達,Gal-3、GST-π呈高表達,提示上皮性卵巢癌組織中Bax、Gal-3及GST-π的表達與順鉑化療療效有關,Bax蛋白高表達提示化療敏感,Gal-3、GST-π高表達提示化療耐藥。這可能與Bax蛋白升高時,加速了腫瘤細胞凋亡,與化療藥物的誘導細胞凋亡發生協同作用,故而對化療敏感;而Gal-3、GST-π蛋白表達升高時,腫瘤細胞凋亡受到抑制,化療藥物很難通過誘導細胞凋亡發揮抗腫瘤作用,從而產生耐藥[17]。另外,本研究通過ROC曲線分析發現,聯合檢測Bax、Gal-3及GST-π可提高上皮性卵巢癌患者順鉑化療耐藥的預測價值,提示與單一檢測相比,聯合檢測效能更佳。
4 結論
Bax低表達、Gal-3及GST-π高表達均與上皮性卵巢癌患者順鉑化療耐藥相關,三者表達變化相互作用引起上皮性卵巢癌腫瘤多藥耐藥產生,最終導致化療失敗。因此,聯合檢測上述因子可預測患者化療敏感性,獲取較為全面的耐藥信息,為臨床化療藥物選擇及療效預測提供參考,尤其利于制定個體化的化療方案,同時針對不同的耐藥機制采用可能的耐藥逆轉治療,促使患者更大獲益。

