基于高通量測序技術分析比較南寧和孝感地區米酒曲中真菌多樣性
楊甜甜,楊少勇,侯強川,蔡文超,劉忠軍,郭 壯*
(1.湖北文理學院 湖北省食品配料工程技術研究中心,湖北 襄陽 441053;2.襄陽市釀酒生物技術與應用企校聯合創新中心,湖北 襄陽 441053;3.湖北古襄陽酒業有限公司,湖北 襄陽 441100)
米酒又稱醪糟,是以糯米為原料,經液化、糖化和發酵而成的中國傳統釀造酒之一[1],主要分布在我國湖北省、廣西壯族自治區和四川省等地區[2],其營養豐富,具有開胃提神、抗氧化和抗衰老等多種功效[3]。米酒主體香氣成分為乙酸乙酯、乳酸乙酯和β-苯乙醇,主要由微生物在米酒釀造過程中代謝生成[4]。米酒的品質與米酒曲的微生物群落息息相關,因而有“曲為酒之骨”的說法[5-6]。米酒曲的制作通常是在開放的環境內完成,因而其微生物菌群較為豐富,包含細菌、真菌和霉菌三個類群,其中霉菌分泌的酶可以加速谷物中的淀粉和蛋白質等物質的轉化,糖分在酵母菌的代謝下可進一步生成乙醇,而以乳酸菌為代表的細菌類群則對米酒滋味品質的形成具有重要作用[7-8]。
近年來,關于米酒曲中微生物多樣性的研究卓有成效。向凡舒等[9]對湖北省建始地區米酒曲微生物群落進行研究,結果發現細菌以假單胞菌屬(Pseudomonas)、片球菌屬(Pediococcus)、魏斯氏菌屬(Weissella)、芽孢桿菌屬(Bacillus)、腸桿菌屬(Enterobacter)、泛菌屬(Pantoea)、克雷伯菌屬(Klebsiella)和乳球菌屬(Lactococcus)為主;真菌以淀粉霉屬(Amylomyces)、復膜孢酵母屬(Saccharomycopsis)和威克漢姆酵母屬(Wickerhamomyces)為主;楊春敏等[10]對海南省山蘭米酒曲的微生物多樣性進行分析,結果發現真菌主要以根霉屬(Rhizopus)、假絲酵母屬(Candida)、布勒擲孢酵母屬(Bullera)、擬青霉屬(Simplicillium)、曲霉屬(Aspergillus)和赤霉屬(Gibberella)為主,其中Rhizopus是酒曲中優勢真菌屬;蔡海鶯等[11]對12種不同來源的酒曲進行篩選和分離得到46株細菌和54株真菌,真菌主要為酵母屬(Saccharomyces)、畢赤酵母屬(Pichia)及根霉屬(Rhizopus)等。這些研究均表明米酒曲中存在豐富的微生物群落。米酒曲的質量與地理和氣候等息息相關,不同地區的酒曲中微生物可能存在差異,然而對于不同地區米酒曲真菌多樣性比較的研究較少。
作為發酵食品微生物多樣性解析強有力的手段之一,Illumina MiSeq高通量測序技術具有通量高和價格相對較低的優點,已被廣泛應用于腐乳[12-13]、白酒[14]、泡菜[15]以及酸湯[16]等發酵制品的微生物類群分析中。本研究以采集自廣西壯族自治區南寧市和湖北省孝感市的米酒曲為研究對象,采用Illumina MiSeq高通量測序技術對米酒曲中真菌多樣性進行解析,以期為酒曲的復配和改善米酒品質提供數據支撐與理論依據。
1 材料與方法
1.1 材料與試劑
脫氧核糖核酸(deoxyribonucleic acid,DNA)基因組提取試劑盒:德國QIAGEN公司;10×聚合酶鏈式反應(poly merase chain reaction,PCR)緩沖液、脫氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTPs)Mix:寶生物工程(大連)有限公司;引物ITS4R/ITS3F:武漢天一輝遠生物科技有限公司。
1.2 儀器與設備
ND-2000C微量紫外分光光度計:美國NanoDrop公司;Veriti 96孔梯度PCR儀:美國ABI公司;CR21N高速冷凍離心機:日本HITACHI公司;Fluor Chem FC3化學發光凝膠成像系統:美國ProteinSimple公司;Illumina MiSeq高通量測序平臺:美國Illumina公司。
1.3 方法
1.3.1 樣本采集
南寧米酒曲:采集自廣西壯族自治區南寧市(107°45′~108°51′E,22°13′~22°32′N);孝感米酒曲:采集自湖北省孝感市(113°19′~114°35′E,30°23′~31°52′N)。每個地區采集米酒曲樣本10個,合計采集20個。所有米酒曲均以糯米為原料且添加5%母曲自然發酵而成,均不添加辣蓼草等中草藥,均無蟲眼,形狀均為圓形,無異味、無霉斑且儲藏時間在2~4個月之間,均為家庭自制成品。
1.3.2 Illumina高通量測序
按照DNA提取試劑盒中的方法對研磨碎的米酒曲樣本進行宏基因組DNA提取,以其為模板,使用引物ITS3F(5'-GCATCGATGAAGAACGCAGC-3')/ITS4R(5'-TCCTCCGCTTATTGATATGC-3')參照文獻[17]中的方法對真菌引物內轉錄間隔區(internal transcribed spacer,ITS)2區基因序列進行PCR擴增。將合格的PCR擴增產物送至上海美吉生物醫藥科技有限公司進行Illumina MiSeq高通量測序。
1.3.3 生物信息學分析
首先對序列進行拼接和質控[18]。使用QIIME(V1.9.1)分析平臺對質控后的序列進行分析[19-20],利用PyNAST軟件[21]將序列標準化和對齊,接著使用兩步UCLUST法構建操作分類單元(operational taxonomic units,OTU)矩陣[22],然后對每個OTU的代表性序列使用UNITE數據庫進行同源性比對[23],以97%和100%的相似度進行OTU劃分,將所有樣本中都存在的某一OTU定義為核心OTU。對同一測序深度下的4種α多樣性指數(香農指數、辛普森指數、超1指數、發現物種數)進行分析,同時基于UniFrac距離[24]使用主坐標分析(principal co-ordinates analysis,PCoA)對2個地區米酒曲的真菌類群進行β多樣性解析。
1.3.4 數據處理
使用曼-惠特尼秩和檢驗(Mann-Whitney)和多元方差分析(multivariate analysis of variance,MANOVA)對2個地區米酒曲的差異性進行分析;采用Excel 2016進行數據處理;采用在線網頁(https://www.omicstudio.cn/tool/24)繪制主成分分析(principal component analysis,PCA)圖;利用R軟件(V4.0.3)的waterfall軟件包繪制瀑布圖;使用Origin 8.5繪制其他圖。實驗均重復3次,結果以“平均值±標準差”的形式表示。
2 結果與分析
2.1 不同地區米酒曲真菌類群α多樣性的比較分析
采用Illumina高通量測序技術分別對南寧和孝感地區20個米酒曲樣本進行測序,共得到高質量序列1 072 821條,平均每個樣本53 641條。當測序深度為23 010條序列時,采用Mann-Whitney檢驗對2個地區米酒曲樣本的α多樣性指數(香農指數、辛普森指數、超1指數、發現物種數)進行顯著性分析,結果見圖1。
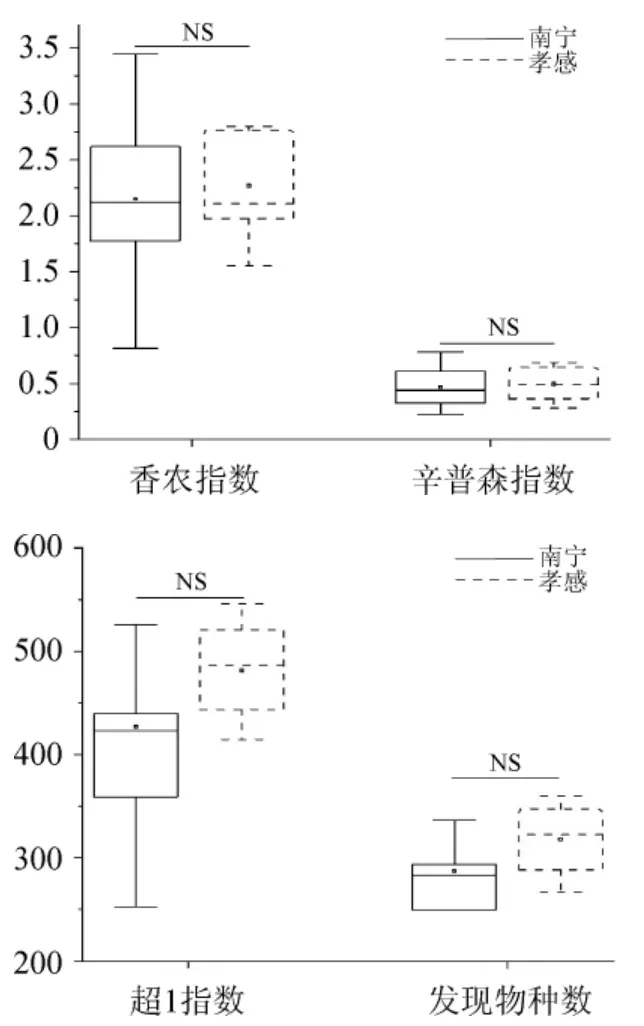
圖1 不同地區米酒曲真菌菌群的α多樣性指數比較分析結果Fig.1 Comparative analysis results of α diversity indexes of fungi community in rice-wine Jiuqu from different regions
由圖1可知,2個地區米酒曲樣本的α多樣性指數差異均不顯著(P>0.05)。由此說明,2個地區米酒曲真菌的豐富度和物種多樣性并無顯著性差異。
2.2 基于OTU水平不同地區米酒曲真菌類群的分析
以97%和100%的相似度進行OTU劃分后,共得到1 648個OTU,南寧米酒曲樣本劃分得到(379±189)個OTU,孝感米酒曲樣本劃分得到(428±37)個OTU,各OTU出現次數統計結果見圖2。
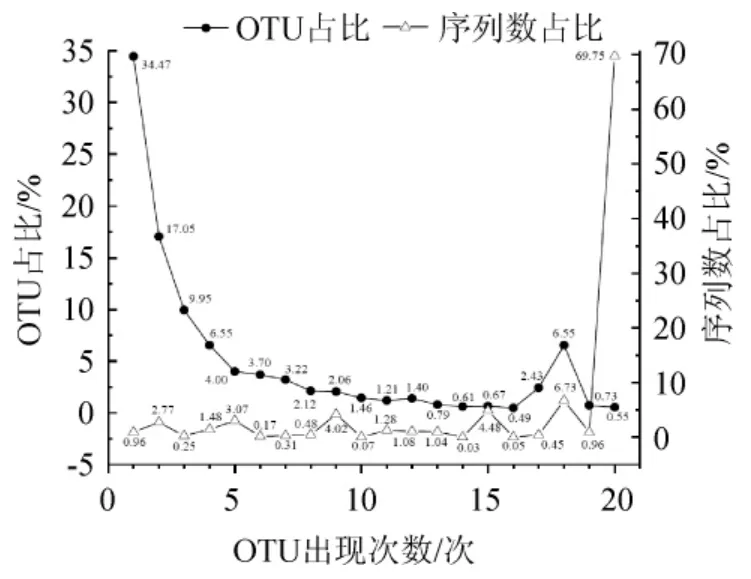
圖2 OTU出現次數統計分析結果Fig.2 Statistical analysis results of OTU occurrence number
由圖2可知,各樣本中的OTU分布不盡相同,隨著OTU出現次數的增加,其所含OTU數占總OTU數的比例整體上呈現逐漸下降的趨勢,而所含序列數占總序列數的比例則呈現相反的趨勢。由圖2亦可知,出現20次的OTU占總OTU數的比例僅為0.55%,而其所含序列數占到總序列數的69.75%,這說明不同地區米酒曲樣本共有大量相同的真菌菌群,雖然各樣品特有真菌類群的物種數較多但其在各樣本的含量少。值得一提的是,1 648個OTU中核心OTU僅有9個,其相對含量瀑布圖見圖3。
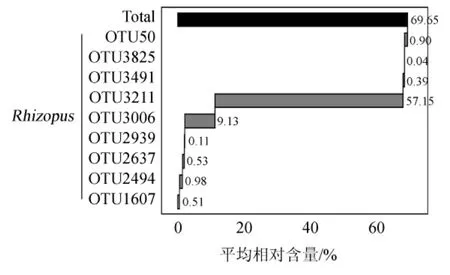
圖3 核心OTU相對含量的瀑布圖Fig.3 Waterfall plot of relative content of core OTU
由圖3可知,核心OTU及其平均相對含量分別為OTU50(0.90%)、OTU3825(0.04%)、OTU3491(0.39%)、OTU3211(57.15%)、OTU3006(9.13%)、OTU2939(0.11%)、OTU2637(0.53%)、OTU494(0.98%)和OTU21607(0.51%),這9個OTU均隸屬于根霉屬(Rhizopus),這也進一步說明Rhizopus是2個地區米酒曲中的優勢真菌屬。
2.3 不同地區米酒曲真菌類群β多樣性的比較分析
采用基于加權和非加權的UniFrac距離對2個地區米酒曲中真菌類群的β多樣性進行解析,結果見圖4。
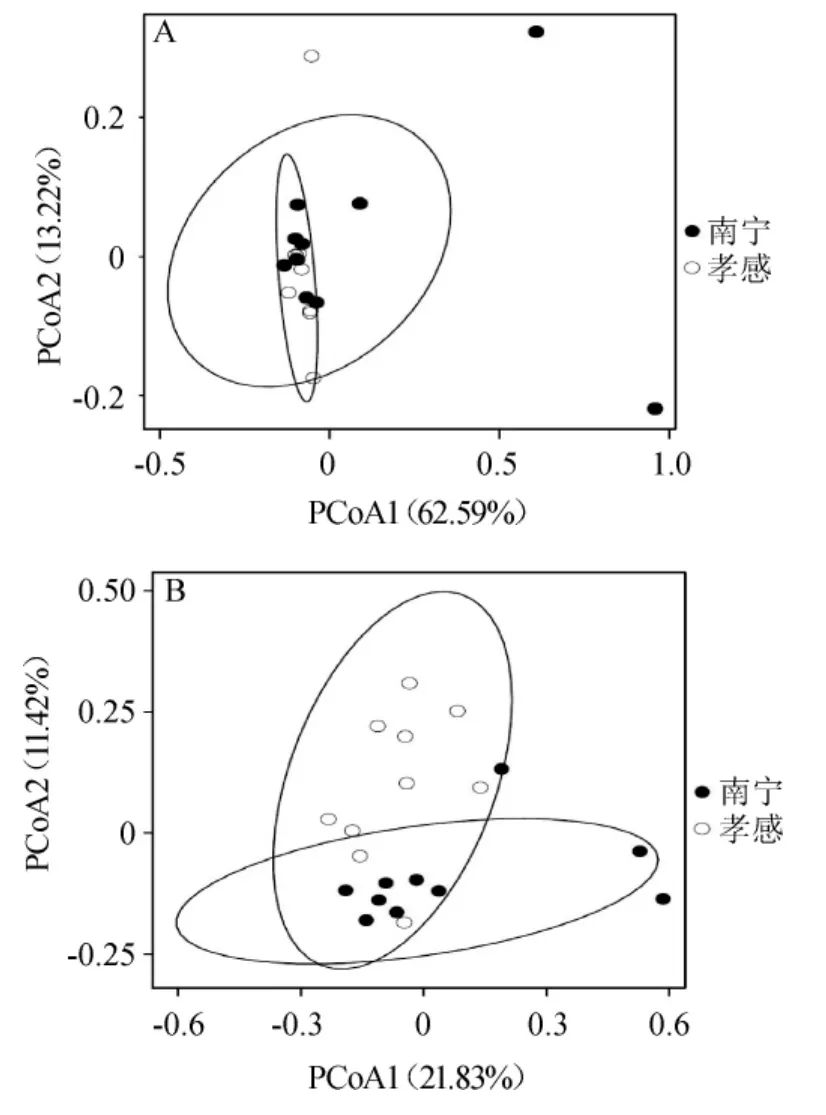
圖4 基于加權距離(A)和非加權距離(B)的主坐標分析Fig.4 Principal coordinate analysis based on weighted distance (A)and unweighted distance (B)
由圖4A可知,在考慮物種豐度的情況下,2個地區的米酒曲在空間排布上交疊明顯,且經多元方差分析發現,2個地區米酒曲真菌群落結構差異不顯著(P>0.05)。由圖4B可知,在僅考慮真菌種類而不考慮其豐度的情況下,2個地區的米酒曲在空間排布上較分散,其中南寧地區的樣本主要位于Y軸負方向,而孝感地區樣本主要位于Y軸正方向,且經多元方差分析發現,2個地區米酒曲真菌群落結構差異顯著(P<0.05)。由此說明,2個地區米酒曲真菌類群的差異可能主要體現在一些低豐度的OTU上。
2.4 不同地區米酒曲真菌菌群結構分析
在門和屬水平上,南寧地區米酒曲中的真菌類群可被鑒定為5個門和63個屬,孝感地區米酒曲可被鑒定為4個門和23個屬,不同地區米酒曲的真菌菌群結構見圖5。
由圖5A可知,毛霉菌門(Mucoromycota)在南寧和孝感地區米酒曲中的平均相對含量分別為78.58%和91.90%,子囊菌門(Ascomycota)的平均相對含量分別為21.18%和8.08%。由此可見,Mucoromycota和Ascomycota為2個地區米酒曲中的優勢真菌門,經Mann-Whitney檢驗發現其在南寧、孝感地區米酒曲中的平均相對含量差異顯著(P<0.05)。
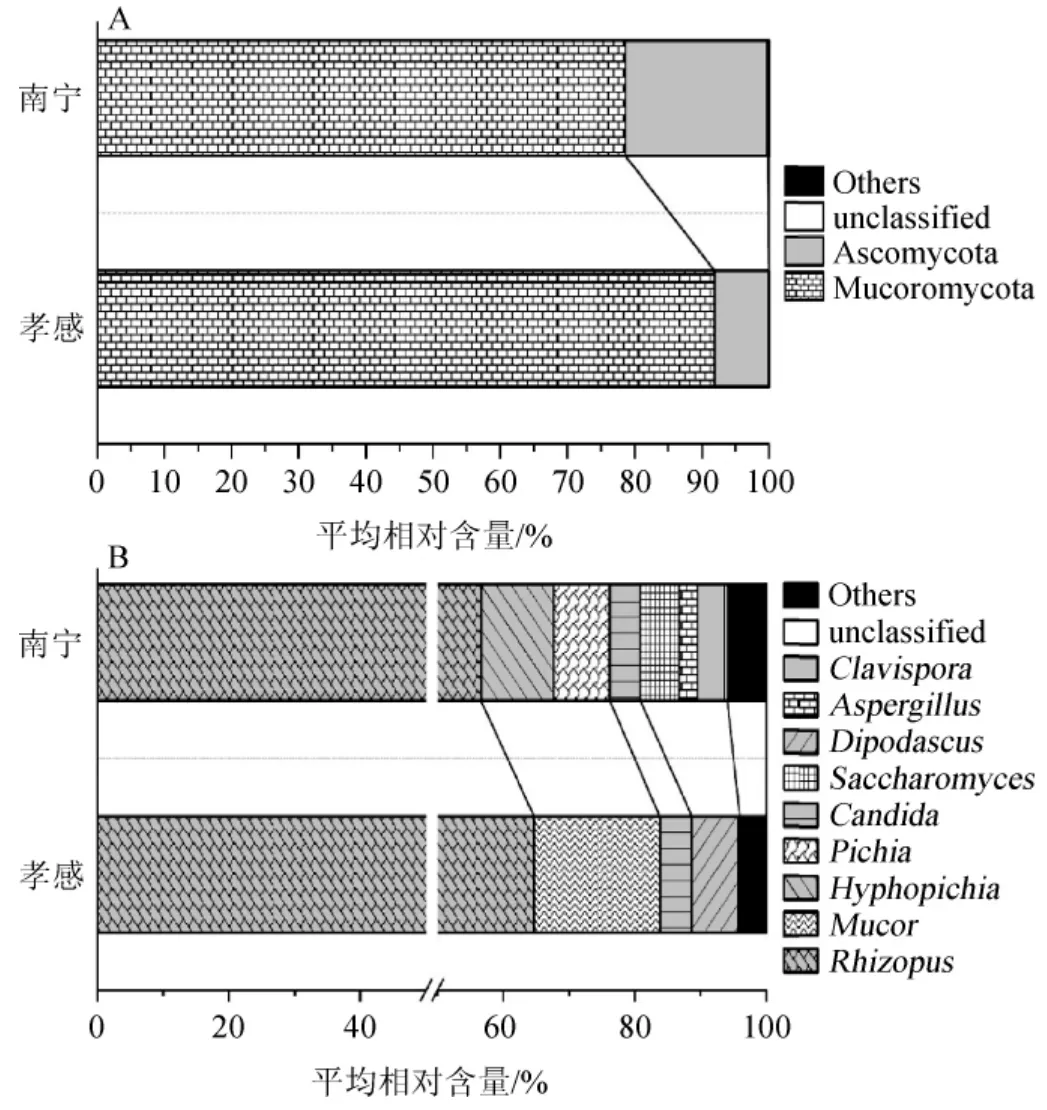
圖5 基于門(A)和屬(B)水平南寧和孝感地區米酒曲的真菌群落結構Fig.5 Fungal community structure of rice-wine Jiuqu from Nanning and Xiaogan based on phylum (A) and genus (B) level
由圖5B可知,南寧地區米酒曲中的優勢真菌屬分別為根霉屬(Rhizopus)(78.29%)、絲孢畢赤酵母屬(Hyphopichia)(5.52%)、畢赤酵母屬(Pichia)(4.27%)、酵母菌屬(Saccharomyces)(2.95%)、假絲酵母屬(Candida)(2.33%)、枝包酵母屬(Clavispora)(2.06%)和曲霉屬(Aspergillus)(1.40%);而孝感地區米酒曲中的優勢真菌屬分別為Rhizopus(82.32%)、毛霉屬(Mucor)(9.58%)、雙足囊菌屬(Dipodascus)(3.53%)和Candida(2.45%)。由此可見,2個地區的米酒曲優勢真菌屬均以Rhizopus為主,這與圖3結果一致。已有研究結果表明,Rhizopus是米酒曲中最主要的微生物,不僅具有較強的糖化能力、酒化能力同時還能產生各種有機酸,可顯著影響米酒的風味和質量[25]。周金虎等[26]從4種甜酒曲中篩選出了一株高產淀粉酶的米根霉(Rhizopus oryzae);姚淑敏等[27]對湖南韶山、湘潭和祁東、福建福州以及浙江麗水和蘭溪6種甜酒曲進行真菌多樣性分析亦發現,樣本主要真菌類群均包含Rhizopus。
經Mann-Whitney檢驗發現,Aspergillus在南寧地區米酒曲中的平均相對含量顯著偏高(P<0.05),而Mucor在孝感地區米酒曲中的平均相對含量顯著偏高(P<0.01)。由此可見,2個地區的米酒曲真菌類群存在一定差異。王丹丹等[28]對孝感鳳窩米酒曲的真菌多樣性研究發現,孝感鳳窩米酒曲中優勢真菌為淀粉霉屬(Amylomyces)、小克銀漢霉屬(Cunninghamella)、毛霉屬(Mucor)、Saccharomycopsis、Aspergillus、Candida、擬威爾酵母屬(Cyberlindnera)和接合酵母屬(Zygosaccharomyces)。由此可見,不同地區的米酒曲其真菌類群可能存在一定的差異。
3 結論
本研究通過Illumina MiSeq高通量測序技術對廣西省南寧地區和湖北省孝感地區米酒曲真菌類群的多樣性進行分析比較,結果表明,2個地區米酒曲真菌豐富度和物種多樣性均無顯著性差異(P>0.05),米酒曲中共有9個核心OTU,所含序列數占總序列數的69.75%,經鑒定均隸屬于根霉屬(Rhizopus)。2個地區米酒曲的優勢真菌門均為毛霉菌門(Mucoromycota)和子囊菌門(Ascomycota),優勢真菌屬均以Rhizopus為主,真菌類群的差異可能主要體現在一些低豐度的OTU上。

