基于網絡藥理學研究加味柴芍六君湯治療慢性萎縮性胃炎的作用機制
林澤豪,傅 頤,陳靜怡,莊芬妮,黃安聞,連雄瀚,朱景茹,涂文玲,甘慧娟
(福建中醫藥大學中醫學院,福建 福州350122)
慢性萎縮性胃炎(chronic atrophic gastritis,CAG)是臨床常見的消化性疾病,為胃癌發生發展過程中的關鍵始動環節,以胃黏膜固有腺體萎縮為主要病理特點,甚至伴見腸化或上皮內瘤變,被世界衛生組織定義為癌前狀態。該病癥狀易反復發作,嚴重影響患者的生活質量,其發病率和檢出率隨年齡增長而增加[1-2]。現代醫學治療CAG主要采取根除幽門螺桿菌(Hp)、胃黏膜保護、抗氧化治療、促進胃黏膜再生、內鏡微創技術等治療方法[3],臨床取得一定療效,但多以對癥治療為主,遠期療效較差。因此,迫切需要一種替代療法用以防治CAG。中醫藥治療消化疾病具有獨特的優勢和廣闊前景,且因其療效安全,不良反應小的特點而備受關注,臨床上有諸多醫家運用加味柴芍六君湯治療CAG取得了良好的療效[4-6],然而其治療CAG的作用機制尚未得到充分揭示。網絡藥理學是從系統生物學和生物網絡平衡的角度闡釋疾病的發生發展過程、從改善或恢復生物網絡平衡的整體觀角度認識藥物與機體的相互作用并指導新藥發現[7],近年來,越來越多科研工作者從系統的角度探討中藥復方多成分多靶點與疾病的關系,為現代中醫藥的研究提供了新的方向。因此,本文以網絡藥理學為切入點,對加味柴芍六君湯治療CAG的靶點作用網絡進行分析,預測其治療CAG的可能作用機制。
1 方 法
1.1 加味柴芍六君湯有效活性成分與作用靶點搜集與篩選 通過中藥系統藥理學平臺(簡稱TCMSP,http://tcmspw.com/tcmsp.php),分別以“白 芍”“白術”“半夏”“柴胡”“陳皮”“丹參”“莪術”“茯苓”“甘草”“人參”為檢索詞進行檢索,設置口服生物利用度(OB)≥30%和類藥性(DL)≥0.18為篩選條件,搜集加味柴芍六君湯的有效活性成分信息。然后對篩選出的有效活性成分進行蛋白靶標查找,將獲取的蛋白靶標進行基因名稱轉換,獲取加味柴芍六君湯的作用靶點信息。
1.2 CAG的疾病作用靶點獲取 用GeneCards數據庫對“Chronic at-rophic gastritis”進行檢索,獲取CAG的疾病作用靶點。通過Venny 2.1.0在線工具,獲得CAG與加味柴芍六君湯共同作用靶點,即加味柴芍六君湯治療CAG的作用靶點。
1.3 蛋白互作網絡的可視化構建與分析 將加味柴芍六君湯的有效活性成分-作用靶點信息、單味藥-有效活性成分信息和CAG-作用靶點信息導入C-ytoscape3.7.2軟件,分別繪制出三者之間的蛋白互作網絡,再利用“Merge”功能將其合并成加味柴芍六君湯治療CAG的有效活性成分-作用靶點網絡。將共同作用靶點導入到String數據庫“Multiple proteins”檢索框中,以互動得分≥0.900為篩選條件,構建加味柴芍六君湯與CAG之間的相互作用網絡(PPI網絡),并對PPI網絡進行分析。
1.4 GO生物學過程和KEGG信號通路富集分析利用String數據庫分析后的核心靶點進行GO生物學過程和KEGG信號通路富集分析;利用Bioconductor生物信息軟件包,對所預測的化學成分靶點進行富集分析,以P<0.05為篩選條件進行可視化處理,再將加味柴芍六君湯對應的靶蛋白直接映射到通路上,選取既包含藥物靶點又包含疾病靶點的通路做出KEGG信號通路富集分析柱狀圖。
1.5 分子對接 利用PubChem數據庫得到加味柴芍六君湯活性成分的結構信息,在PDB數據庫檢索得到核心靶點的結構信息,最后利用Vina1.1.2軟件完成加味柴芍六君湯活性成分與靶點受體的分子對接。
2 結 果
2.1 加味柴芍六君湯靶點信息獲取 共篩選出加味柴芍六君湯有效活性成分195個(其中白芍13個、白術7個、半夏13個、柴胡17個、陳皮5個、丹參65個、莪術3個、茯苓15個、甘草92個、人參22個),藥物靶點265個。文中只保留OB值排名第1的有效活性成分,見表1。將經過篩選轉化的單味中藥主要活性成分及作用靶點導入Cytoscape 3.7.2軟件構建加味柴芍六君湯治療CAG的有效活性成分-作用靶點網絡,見圖1。

表1 加味柴芍六君湯有效活性成分

圖1 加味柴芍六君湯治療CAG的有效活性成分-作用靶點網絡
2.2 加味柴芍六君子湯治療CAG的作用靶點獲取 通過GeneCards數據庫檢索得到CAG作用靶點613個,將加味柴芍六君子湯的作用靶點和CAG的作用靶點分別輸入Venny 2.1.0在線工具分析,得到共同靶點89個。見圖2。
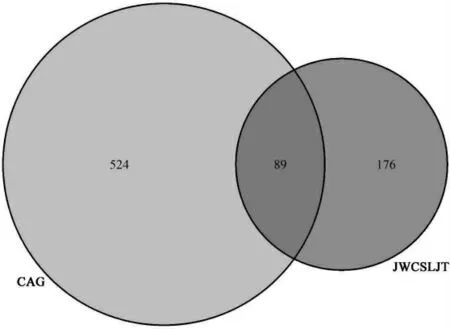
圖2 疾病-藥物-靶點(DDT)韋恩圖
2.3 相互作用網絡構建與分析 將89個共同作用靶點輸入到String數據庫,構建出這89個共同作用靶點的相互作用網絡模型。見圖3。該網絡包含89個共同作用靶點,336條連接線,平均度值為35.8,其中NFKBIA、SPP1、CASP9、TIMP1、MMP1、MCL1、CDKN1A、HIF1A、SERPINE1、STAT1、MPO、VCAM1、PPARG、AR、CASP8、IFNG、ERBB2、ICAM1、BCL2L1、MMP2、CAT、MAPK14、FOS、CCL2、IL1B、CCND1、EGFR、MYC、MAPK1、CXCLB、MMP9、EGF、STAT3、MAPK3、CASP3、VEGFA、MAPK8、PTGS2、JUN、TP53、AKT1的度值高于平均度值即為相對核心靶點。見圖3。

圖3 共同作用靶點互作(PPI)網絡圖
2.4 GO生物學過程富集分析 通過R軟件運行腳本對89個共同作用靶點進行GO生物學過程富集分析,獲得P<0.05的GO條目117個,結果表明加味柴芍六君湯治療CAG過程主要涉及磷酸酶結合、泛素樣蛋白連接酶結合、細胞因子受體結合、受體配體活性、蛋白磷酸酶結合等生物學過程,文中共列出排名前20的GO富集氣泡圖。見圖4。

圖4 前20名GO富集氣泡圖
2.5 KEGG信號通路富集分析 通過R軟件運行腳本對89個共同作用靶點進行KEGG信號通路富集分析,根據P<0.05篩選到152條信號通路,涉及到的信號通路類型主要有病毒感染(卡波氏肉瘤相關皰疹病毒感染、乙型肝炎病毒感染、丙型肝炎病毒感染、人類巨細胞病毒感染等)、癌癥(前列腺癌、膀胱癌、胰腺癌、結直腸癌等)、信號傳導(PI3K-Akt信號、AGE-RAGE信號、MAPK信號、HIF-1信號、JAK-STAT信號、RIG-I樣受體信號、B細胞受體信號、幽門螺桿菌感染中的上皮細胞信號等)、流體剪切應力和動脈粥樣硬化、麻疹等。見圖5。
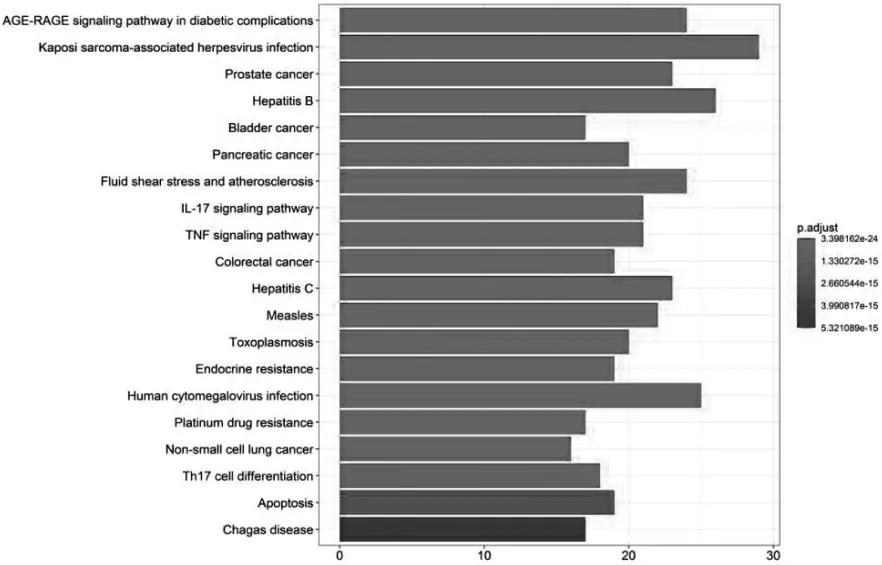
圖5 KEGG信號通路富集分析柱狀圖
2.6分子對接 為了進一步驗證“有效活性成分-作用靶點”網絡的預測結果,將前5位核心靶點AKT1、TP53、JUN、PTGS2、MAPK8與其對應的主要活性成分kaempferol、baicalein、beta-sitosterol、Cavidine、nobiletin進行分子對接,獲得的相關對接參數以及相應的計算結果,見表2。一般認為配體與受體結合的自由能越低,結合構象越穩定,發生作用的可能性越大,加味柴芍六君湯的主要活性成分與核心靶點結合自由能均<-5 kcal/mol,提示篩選出的核心靶點與其對應的活性成分具有良好的親和力,證明結果具有一定的可信度。前5位核心靶點與其對應的活性成分對接結果,見圖6。
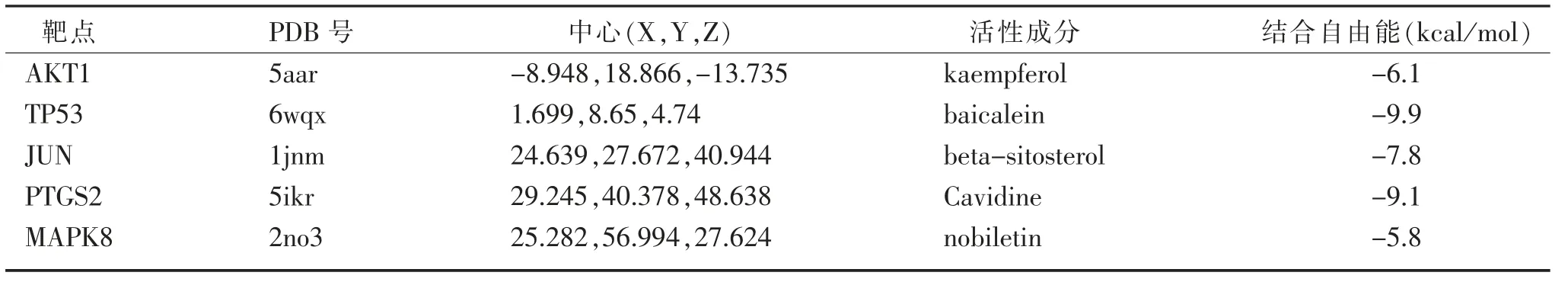
表2 活性成分與核心靶點對接參數及計算結果

圖6 對接結果圖
3 討 論
近年來,CAG的發病率呈明顯上升趨勢,且逐漸趨于年輕化,發病機制尚未明確,由于內外多重因素刺激導致胃黏膜腺體遭受破壞,從而出現萎縮、腸上皮化生甚至異型增生等難以逆轉的病理學改變,長期反復發作容易誘發癌變,是許多科研工作者廣泛關注的熱點問題之一[8]。課題組前期研究證實,肝郁脾虛是CAG重要病理特點,肝郁、脾虛常相互影響,氣郁、脾虛導致水液代謝障礙,產生痰濕,痰濕反過來影響了肝、脾功能,加重病情[9]。加味柴芍六君湯方中柴胡疏肝行氣;白芍養血柔肝;人參、茯苓、白術健脾益氣;半夏、陳皮理氣燥濕化痰,和胃降逆;丹參活血祛瘀,通經止痛;莪術辛溫,破血止痛;甘草調和諸藥。全方共奏健脾和胃、活血祛瘀、疏肝理氣之功。現代藥理研究表明,白術能雙向調節胃腸道,保護胃黏膜,提高免疫功能;白芍具有調節免疫,解除平滑肌痙攣作用,其中芍藥甙能抗炎、保護胃黏膜;甘草具有抗潰瘍、抗痙攣、調節免疫、抗腫瘤及解毒功效[10]。
本研究通過網絡藥理學的方法探討加味柴芍六君湯治療CAG的可能作用機制。通過對加味柴芍六君湯有效活性成分、作用靶點搜集與篩選,獲取195個有效活性成分,包含槲皮素、常春藤皂苷元、甘草甜素、蓽澄茄素、米橘素等。槲皮素能逆轉DKK3啟動子甲基化恢復其表達將有助于抑制胃癌的惡性轉化。槲皮素逆轉MSX1基因的甲基化狀態后,恢復MSX1基因的功能則可誘導DKK3等基因的表達,理論上也可間接抑制胃癌的發生[11]。常春藤皂苷元能抑制胃癌MGC803增殖,對胃癌細胞侵襲、黏附、遷移能力有著明顯的影響,是一種良好的抗腫瘤藥物[12]。在對炎癥趨化因子和促炎癥因子的表達方面,甘草甜素能夠抑制結腸髓過氧化物酶,減少活性氧化物質導致的脂質蛋白變性和器官損傷,改善炎癥癥狀[13]。
將加味柴芍六君湯的作用靶點和CAG的作用靶點分別輸入Venny2.1.0在線工具分析,得到共同作用靶點89個。通過構建共同作用靶點互作網絡,分析得出IL1B、AKT1、TP53、JUN、MAPK8、VEGFA、MAPK3、STAT3、MAPK1等41個相對核心靶點。其中IL-1β是典型的促炎性細胞因子,炎性信號可通過激活炎癥小體而刺激分泌IL-1β,過量分泌的IL-1β會引起廣泛的炎癥反應,導致炎性損傷[14]。IL-1β還是目前發現的最強的胃酸分泌抑制劑,持續的低酸分泌會促進萎縮的發生發展,增加胃癌的發生危險[15-16]。IL-6是一種具有多種生物學效應的細胞因子,是發動炎癥反應的關鍵性因子,可以誘導內皮發生細胞活化,刺激中性粒細胞產生趨化作用,并產生大量的炎癥介質[17]。有研究表明,IL-6在胃黏膜炎癥反應過程中具有極其明顯的指示作用,但是達到了一定的范圍就可能會對胃黏膜產生損傷作用[18]。
通過GO生物學過程富集分析可知,加味柴芍六君湯對CAG的治療作用主要通過參與以下生物學過程而發揮療效:磷酸酶結合、泛素樣蛋白連接酶結合、細胞因子受體結合、受體配體活性、蛋白磷酸酶結合等生物學過程。進一步的KEGG信號通路富集分析提示,加味柴芍六君湯主要通過調控HIF-1、PI3K-Akt、MAPK等多種信號通路而達到治療CAG的作用。HIF-1α與慢性炎性反應的關系密切,是廣泛存在于機體細胞中的一種轉錄調節因子,該基因由低氧誘導并介導細胞對缺氧微環境進行適性反應,缺氧時HIF-1α表達顯著上調,由此啟動60余種下游因子的轉錄以使細胞逐漸適應有氧到缺氧的轉變[19]。PI3K/Akt途徑信號傳導與異常細胞增殖和凋亡有關,這兩者都與腫瘤發生直接相關,PI3K/Akt通路在胃癌細胞增殖和存活中發揮著重要作用[20]。MAP-K途徑可以將細胞表面信號轉導至細胞核,對多數細胞的增生和程序化死亡等的調節起到重要意義[21]。分子對接結果顯示,加味柴芍六君湯活性成分與相應核心靶點對接親和力良好,對接體系穩定,進一步證明了本研究關于加味柴芍六君湯治療CAG機制的有效性與可靠性。
本文采用網絡藥理學方法,從整體和系統的角度初步預測了加味柴芍六君湯治療CAG的作用機制,其可能是通過抗炎,降低炎性因子IL-1β、IL-6的水平來減輕CAG黏膜細胞的缺氧狀態,調節HIF-1α等細胞轉錄因子和蛋白的表達,或通過調控HIF-1、PI3K-Akt、MAPK等信號轉導通路,從而改善胃黏膜瘀血狀態,起到抗胃黏膜萎縮的作用,具有一定的研究價值。為進一步驗證網絡藥理學結果的可靠性,后期有必要開展相應的基礎實驗進一步闡述加味柴芍六君湯治療CAG的作用機制。

