表兒茶素對大鼠腦缺血再灌注損傷的保護作用及抗氧化能力的影響
黃凡,胡婉湘,蔣嫦月,李德麗,謝露
腦缺血再灌注損傷(cerebral ischemia reperfu?sion injury,CIRI)是指腦缺血一定時間恢復血液供應后,大腦功能不僅沒有得到及時恢復,反而出現更加嚴重的腦神經功能障礙[1-3],此過程涉及氧化應激、炎癥反應、神經元凋亡等多種機制。氧化應激不僅能通過活性氧過度積累直接造成細胞損傷,還能激活其他信號通路而間接造成細胞損傷。因此,如何改善機體的抗氧化能力是當前研究的一個重要方向。表兒茶素(Epicatechin,EC)是從茶多酚中分離出的單體化合物,具有抗氧化、降血壓、降血脂等作用[4]。已有研究表明其衍生物表兒茶素沒食子酸酯對腦、心臟、骨骼肌缺血損傷具有保護作用[5-7],但EC對CIRI影響方面的報道較少。本研究旨在觀察EC對大鼠CIRI后的保護作用及抗氧化能力,以期為臨床研究提供理論依據。
1 材料與方法
1.1 實驗動物 雄性清潔級SD大鼠90只,體質量200~240 g,購自廣西醫(yī)科大學實驗動物中心,動物許可證號SCXK(桂)2020-0003,于(23±2)℃環(huán)境下定時喂養(yǎng),自由飲水。實驗中的所有操作均符合廣西醫(yī)科大學實驗動物福利與倫理委員會的相關要求。
1.2 主要試劑與儀器 EC購自索萊寶公司,純度≥98.0%;2,3,5-氯化三苯基四氮唑(TTC)購自Biosharp公司,高效液相色譜測定純度≥98.0%;BCA蛋白濃度測定試劑盒、丙二醛(MDA)檢測試劑盒、超氧化物歧化酶(SOD)活性檢測試劑盒、谷胱甘肽過氧化物酶(GPx)檢測試劑盒均購自碧云天生物技術有限公司。
1.3 分組與造模 將90只大鼠按隨機數字表法分為6組,每組15只,分別為假手術組(Sham組)、CIRI模型組(I/R組)、EC 5 mg/kg組、EC 10 mg/kg組、EC 20 mg/kg組、依達拉奉(ED)3 mg/kg組。適應性喂養(yǎng)1周后,除Sham組外,其余組采用線栓法制備大腦中動脈栓塞(MCAO)模型[8]。大鼠經2%戊巴比妥鈉(50 mg/kg)麻醉后,仰臥位固定于手術板上,頸部去毛,消毒,縱向切開頸部正中皮膚,逐層鈍性分離頸總動脈、頸內動脈、頸外動脈,結扎頸外動脈,在頸總動脈上距離頸內動脈交叉5 mm處造口,插入線栓,至有微弱阻力時停止,扎緊線栓以防止滑落,縫合傷口,缺血后2 h拔栓,恢復血流供應;Sham組相同處理但不進行結扎、造口和插栓操作。各組術后于(23±2)℃條件下喂養(yǎng),正常飲食進水。
1.4 給藥 EC 5 mg/kg組、EC 10 mg/kg組、EC 20 mg/kg組、ED 3 mg/kg組分別于再灌注后0、12、24 h腹腔注射相應劑量的EC或ED,Sham組和I/R組注射同容積的生理鹽水。
1.5 神經功能損傷評分 利用Longa 5分法[9]分別于術后12、24 h進行神經功能損傷評分。0分:無神經功能損傷癥狀;1分:未能完全伸展對側前爪;2分:向對側轉圈;3分:向對側傾倒;4分:不能自發(fā)行走,意識喪失。分值越高,說明大鼠神經功能行為學損傷越嚴重。
1.6 缺血側腦梗死面積百分比測定 采用TTC染色法檢測大鼠腦梗死面積百分比。于再灌注后36 h取大鼠腦組織,置于-20℃冰箱冷凍15 min,去除嗅球、腦干等多余部位,沿冠狀面切成2 mm厚的腦片,切片放入37℃的2%TTC溶液中孵育15 min,每5 min翻動1次。取出后置于10%福爾馬林溶液中避光過夜。拍照并采用Image J軟件計算腦梗死面積,缺血側腦梗死面積百分比=梗死區(qū)面積/缺血側腦面積×100%。
1.7 缺血側腦組織形態(tài)學觀察 采用HE染色法觀察缺血側腦組織形態(tài)。于再灌注后36 h取大鼠腦組織,甲醛固定,石蠟包埋,切片,按照HE染液說明書進行染色,在病理顯微鏡下拍照。
1.8 血清及缺血側腦組織中MDA、SOD、GPx檢測 采用比色法將再灌注后36 h獲取的血清和缺血側腦組織按照試劑盒說明書測定其MDA含量、SOD和GPx活力。
1.9 統計學方法 采用SPSS 22.0軟件對實驗數據進行統計分析,計量資料以均數±標準差(x ±s)表示,多組間比較采用單因素方差分析,組間多重比較行LSD-t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 EC對大鼠CIRI后神經功能行為學評分的影響 與Sham組比較,I/R組神經功能損傷評分升高(P<0.05);與I/R組比較,EC 10 mg/kg組、EC 20 mg/kg組、ED 3 mg/kg組神經功能損傷評分降低(P<0.05),EC 5 mg/kg組無明顯差異;與EC 5 mg/kg組比較,EC 20 mg/kg組、ED 3 mg/kg組神經功能評分降低(P<0.05),EC 10 mg/kg組無明顯差異,見表1。
2.2 EC對大鼠CIRI后缺血側腦梗死面積百分比的影響 與Sham組比較,I/R組腦梗死面積百分比增大(P<0.05);與I/R組、EC 5 mg/kg組比較,EC 10 mg/kg組、EC 20 mg/kg組、ED 3 mg/kg組減少(P<0.05),I/R組與EC 5 mg/kg組比較差異無統計學意義(P>0.05),見圖1、表1。
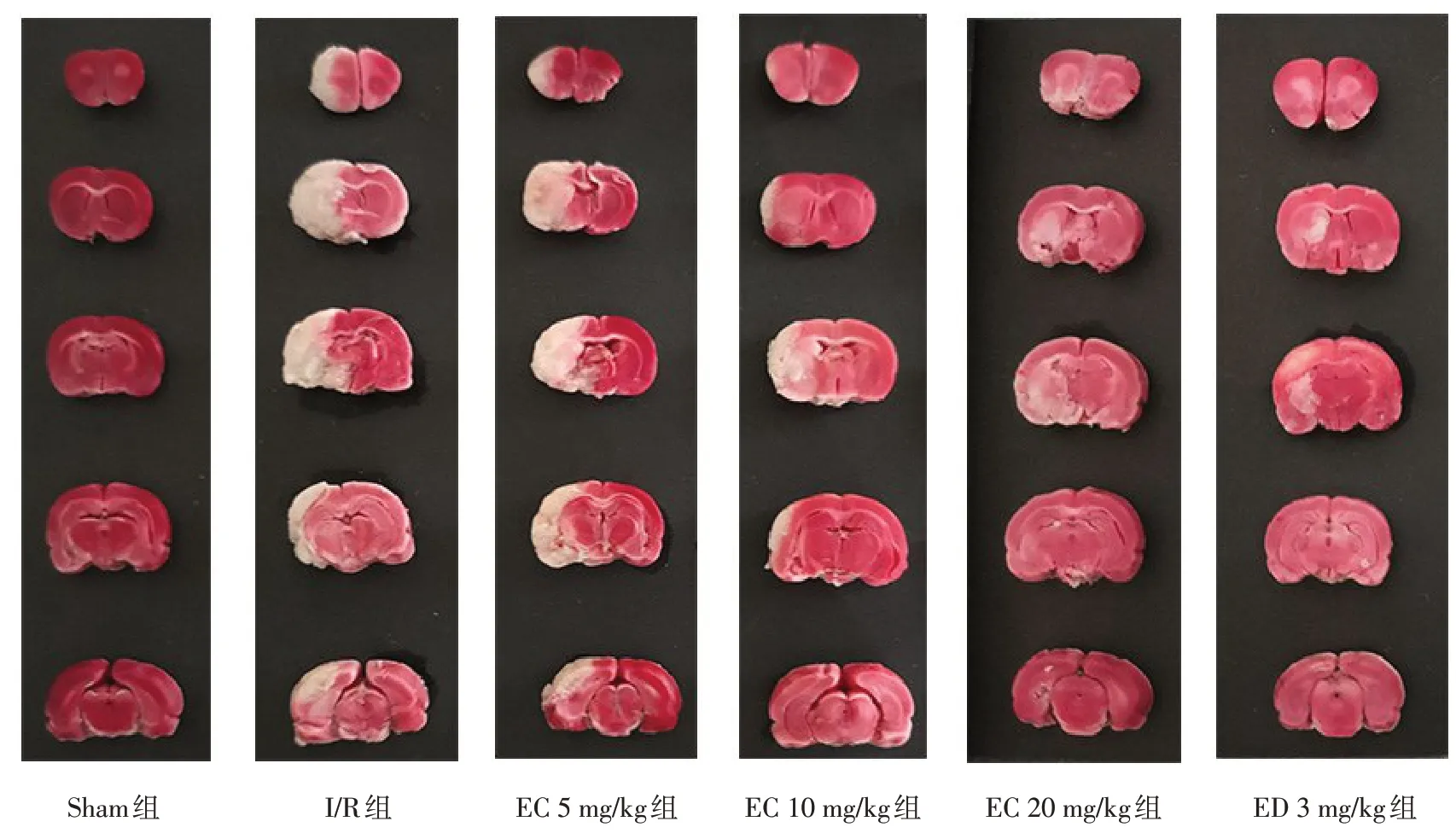
Fig.1 Cerebral infarction of rats in six groups(n=5)圖1 各組大鼠腦組織梗死情況(n=5)
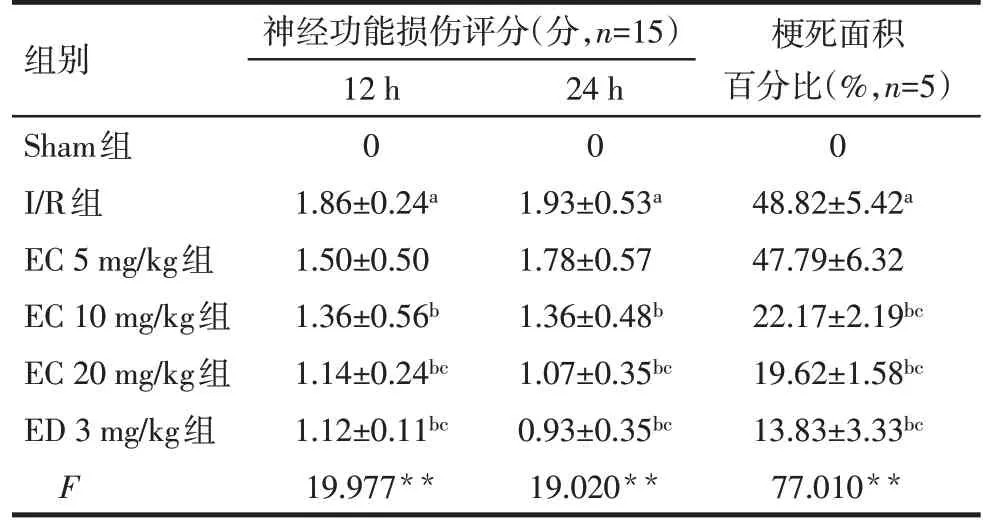
Tab.1 Comparison of the neurological function scores and the percentage of cerebral infarction area in ischemic side of rats between six groups表1 各組大鼠神經功能評分及缺血側腦梗死面積百分比比較 (x±s)
2.3 EC對大鼠CIRI后缺血側腦組織形態(tài)學變化的影響 Sham組細胞數量較多,排列緊密,形態(tài)圓潤且輪廓清晰,核仁居中。與Sham組比較,I/R組細胞數量減少,排列疏散,細胞形態(tài)不規(guī)則,部分發(fā)生核固縮,存在病理損傷;與I/R組比較,EC各組、ED 3 mg/kg組細胞數量明顯增加且形態(tài)規(guī)則,核質間隙明顯;與EC 5 mg/kg組比較,EC 10 mg/kg組、EC 20 mg/kg組、ED 3 mg/kg組改善更為明顯,見圖2。
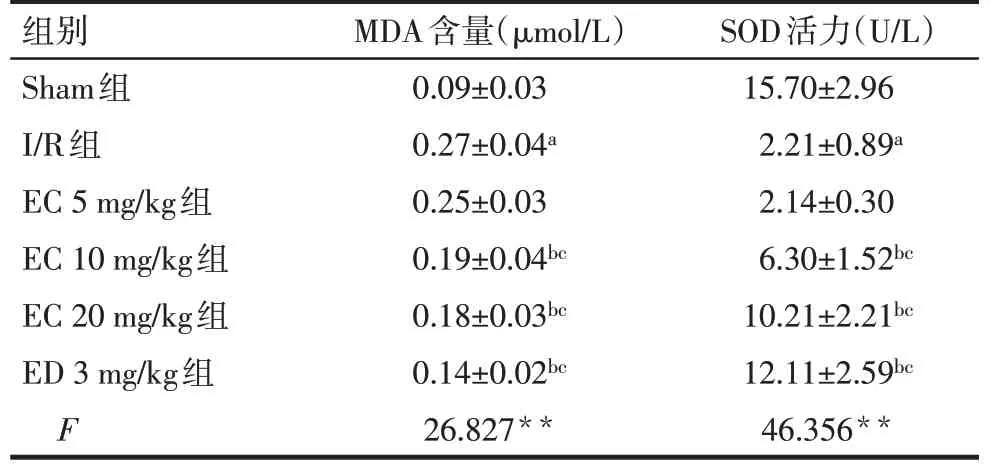
2.4 EC對大鼠CIRI后缺血側腦組織中MDA含量、SOD和GPx活力的影響 與Sham組比較,I/R組腦組織中MDA含量增多、SOD和GPx活力下降(P<0.05);與I/R組比較,EC 10 mg/kg組、EC 20 mg/kg組、ED 3 mg/kg組腦組織中MDA含量減少、SOD和GPx活力升高(P<0.05),EC 5 mg/kg組SOD活力升高;與EC 5 mg/kg組比較,EC 10 mg/kg組、EC 20 mg/kg組、ED 3 mg/kg組腦組織中MDA含量減少、SOD活力升高(P<0.05),EC 20 mg/kg組和ED 3 mg/kg組腦組織中GPx活力升高(P<0.05),見表2。

Tab.2 Comparison of the content of MDA,activity of SOD and GPx in ischemic brain tissue between six groups表2 各組大鼠缺血側腦組織中MDA含量、SOD和GPx活力比較 (n=8,x±s)
2.5 EC對大鼠CIRI后血清中MDA水平、SOD活力的影響 與Sham組比較,I/R組血清中MDA含量增多、SOD活力下降(P<0.05);與I/R組、EC 5 mg/kg組比較,EC 10 mg/kg組、EC 20 mg/kg組、ED 3 mg/kg組血清中MDA含量減少、SOD活力升高(P<0.05),I/R組與EC 5 mg/kg組間差異無統計學意義(P>0.05),見表3。
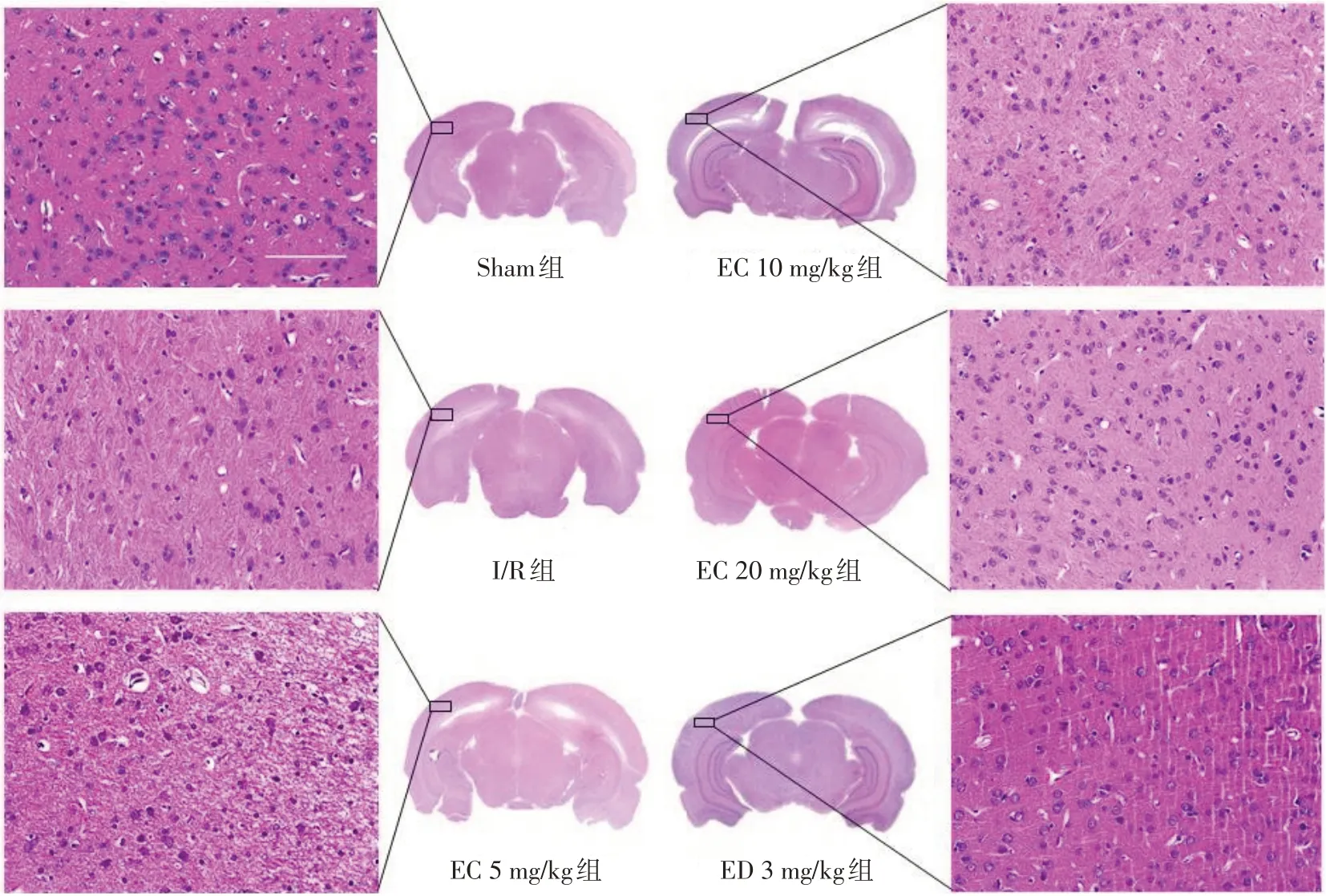
Fig.2 Morphological observation of cerebral cortex on ischemic side of rats in six groups(HE,×400,n=3)圖2 各組大鼠缺血側腦組織皮質部分形態(tài)學觀察(HE,×400,n=3)
Tab.3 Comparison of the serum content of MDA and the activity of SOD between six groups of rats表3各組大鼠血清中MDA含量、SOD活力比較(n=8,x±s)
3 討論
缺血再灌注會對機體造成嚴重的損害,而腦作為對缺血缺氧高度敏感的組織,CIRI更為嚴重,因此研究改善CIRI的藥物尤其重要。
研究表明,在大鼠急性腦出血模型中,綠茶多酚可降低神經功能損傷評分,改善腦組織病理損傷,從而對腦出血后的腦組織發(fā)揮保護作用[10]。另有研究表明,口服EC能通過減輕神經功能損傷,減小病變體積,改善小鼠創(chuàng)傷性腦損傷[11]。本研究采用線栓法制備大鼠MCAO模型,結果顯示,EC各組和ED組神經功能損傷評分、缺血側腦組織梗死面積百分比、缺血側腦組織皮質區(qū)形態(tài)均較I/R組明顯改善,表明EC對大鼠CIRI具有保護作用,且呈一定的劑量依賴性,與Chang等[12]的研究結果一致。
氧化應激是缺血再灌注損傷的核心病理環(huán)節(jié),活性氧的過度生成、SOD和GPx等抗氧化酶的過度消耗是氧化應激損傷的根本原因。過度產生的活性氧攻擊不飽和脂肪酸,從而破壞細胞膜并對核酸造成損傷,引發(fā)DNA的斷裂,促使細胞凋亡。MDA是脂質過氧化的終產物,當發(fā)生氧化應激時,MDA含量升高,進一步加重氧化應激損傷,因此MDA可間接反映氧化應激損傷的程度[13]。SOD是重要的內源性抗氧化酶,能夠減輕氧自由基引起的腦損傷[14]。GPx是體內的氧自由基清除酶,可反映體內脂質過氧化程度和清除自由基的能力[15]。當SOD、GPx在氧化應激損傷過程中被過度消耗時,機體的抗氧化能力減弱,同時使得機體中MDA合成增加,從而加重損傷。
EC是從茶多酚中分離出的一種具有抗氧化活性且能透過血腦屏障的天然成分。本課題組此前研究發(fā)現,在高糖高脂誘導的H9C2細胞模型中,EC預處理可使細胞中還原型谷胱甘肽(GSH)含量及SOD活性升高,對心肌細胞發(fā)揮保護作用,同時在大鼠心臟驟停/心肺復蘇模型中,茶多酚可提高腦組織內源性抗氧化酶SOD1和SOD2的表達[16-17],提示EC在CIRI中發(fā)揮抗氧化效應,具有治療腦卒中的潛在價值。ED是一種抗氧化劑,臨床上常用于治療腦卒中,因此作為本研究中的陽性對照藥。本研究發(fā)現,EC和ED用藥組缺血側腦組織和血清中MDA含量降低,抗氧化酶SOD和GPx的活力增強,表明EC可減少氧自由基的生成,同時提高機體自由基清除能力,且呈一定的劑量依賴性,與Al-Maghrebi等[18]的研究結果一致。
綜上所述,EC可明顯降低CIRI大鼠神經功能損傷評分,減少缺血側腦組織梗死面積,改善腦組織病理學損傷,降低血清和缺血側腦組織中的MDA含量并增強SOD活力,同時增強腦組織中的GPx活力,表明表兒茶素可提高腦抗氧化水平,從而對抗大鼠腦缺血再灌注損傷,且在一定范圍內呈劑量依賴性。今后將深入研究EC發(fā)揮腦保護作用的分子機制,進一步為其應用于臨床治療缺血性腦卒中提供理論基礎。

