外泌體miR-155通過調節SOCS1影響重癥急性胰腺炎肺損傷
繆寶洲,汪敬恒,鐘俊峰,潘恩,林秀麗
福建中醫藥大學附屬福鼎市醫院重癥醫學科,福建福鼎355200
急性胰腺炎(acute pancreatitis,AP)是ICU常見疾病,隨著生活方式的改變,發病日趨年輕化[1-2]。重癥急性胰腺炎(severe acute pancreatitis,SAP)患者伴有或者不伴有多臟器功能衰竭(mutiple organ failure,MOF),決定了其嚴重程度,尤其是急性肺損傷(acute lung injure,ALI)[3]和急性呼吸窘迫綜合征(acute respiratory distress syndrome,ARDS)[4]。外泌體排出細胞外并攜帶核酸傳遞信息,可穿透血管壁,同時可穿透細胞外基質[5],其中MicroRNA即為外面運輸核酸之一,從而影響下游基因表達[6-7]。SAP-ALI的內皮細胞通透性發生改變,可能導致外泌體的分泌增多,攜帶MicroRNA增多[8]。
AP發生發展過程中,胰液的釋放會導致胰腺自我消化[9],從而產生IL-17的CD4+T輔助細胞(Th17)的積聚[10]。文獻中已經證實SOCS1調節STAT5,STAT5是Treg細胞的統計調節器[11]。Wang等[12]人研究發現,miR-155可以抑制SOCS1,從而影響AP的發生發展過程。設想miR-155通過外泌體包裹轉運可以通過SOCS1影響SAP-ALI的過程。因此該文方便選取福建中醫藥大學附屬福鼎醫院重癥醫學科(ICU)2019年1—12月收治入院的128例急性胰腺炎患者血漿進行了相關研究,現報道如下。
1 材料與方法
1.1 材料
方便選取福建中醫藥大學附屬福鼎醫院重癥醫學科(ICU)收治入院的128例急性胰腺炎患者血漿,其中急性胰腺炎伴肺損傷(AP with ALI,AWA)35例,急性胰腺炎不伴肺損傷(AP without ALI,AOA)93例,采集8名非患者志愿者血漿,年齡39~53歲。根據伴有或者不伴有ALI將患者分成兩組,AWA組35例,男女比例為17例∶18例,平均年齡為(48.6±16.1)歲;AOA組93例,男女比例為44例∶49例,平均年齡(45.6±16.5)歲。采集8名非患者志愿者血漿,平均年齡(46.3±4.17)歲。簽署知情同意書后,經過福建中醫藥大學附屬福鼎醫院倫理委員會論證通過,倫理委員會批準文號:鼎醫綜〔2020〕124號。外泌體大體試劑盒:德國QIAGEN公司。
1.2 方法
1.2.1 標本采集因胰腺炎急診入院的患者外周血3~5 mL,抗凝,至實驗室離心,低速1 000 g,10 min。取上層血漿至1.5 m LEP管,分裝做好標記,-80℃保存備用。
1.2.2 提取外泌體將標本從儲存管中取出,用200 mL XBP緩沖液與血漿等體積混合,收集混合液體,注入exoEasy濾柱中離心。使用PexoEasy濾柱加入緩沖液后離心。在濾網膜上,室溫孵育1 min。離心,5 000 g,5 min,備用。
1.2.3 提取RNA加入400 μl酸化酚氯仿,通過震蕩方式進行混勻,時間30~60 s。混勻后加入20 μl外部參照cel-miR-39(5 pmol/L)。純乙醇萃取離心結束。洗滌,離心條件為室溫9 500 g,空轉1 min后棄去收集管,用新的收集管將洗脫液預熱至95℃。預熱好洗脫液后加入濾膜中,根據上述條件再離心30 s,回收收集管內濾液。檢測收集到的溶液。
1.2.4 進行miR-155的熒光定量檢測 以U6為內參基因,U6及miR-155特 異 引 序 列 為,miR-155:Forward primer:5'-GCGAAAGCATTTGCCAAGAA-3',Reverse primer:5'-CATCACAGACCTGTTATTGC-3';內 參U6:Forward primer:5'-AGCGGGAAATCGTGCGTGACA-3',Reverse primer:5'-GTGGACTTGGGAGAGGACTGG-3'。
1.3 統計方法
采用SPSS 22.0統計學軟件處理數據,PCR以celmiR-39作為外源性參照,miR-155相對表達量計算公式45-Ct=45-(CtmiR-155-CtmiR-39)。miR-155結果中,每個樣本設置3個重復,取算術平均值。計量資料以(±s)表示,組間差異比較采用t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 外泌體鑒定
Western blot結果提示,β-actin未在外泌體檢測出,外泌體未被污染;外泌體組,TSG101和CD81特異性標志物表達升高,外泌體分離成功,見圖1A。用細胞攝取動態光散射分析,發現外泌體平均直徑為(80.69±18.11)nm,同時證實外泌體具有膜結構呈囊泡狀,見圖1B。
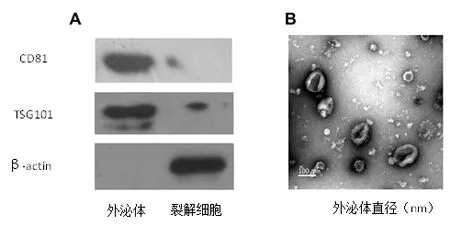
圖1 外泌體鑒定:A.western blot結果顯示TSG101和CD81表達;B.外泌體的形態
2.2 3組血漿外泌體miR-155水平比較
AWA患者血漿外泌體miR-155的相對表達量為(15.11±2.18),AOA患者血漿外泌體miR-155的相對表達量為(10.64±1.65),非患者志愿者(NC)血漿外泌體miR-155的相對表達量為(5.19±0.44)。AOA組血漿外泌體miR-155水平顯著高于健康志愿者(P<0.01);AWA組血漿外泌體miR-155水平顯著高于AOA組,差異有統計學意義(P<0.01),見圖2。
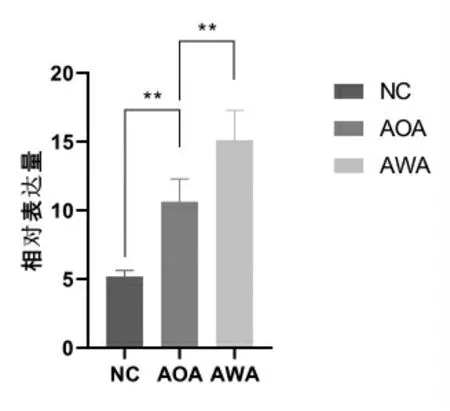
圖2 外泌體miR-155在AWA患者血漿中的表達情況
2.3 miR-155直接靶點SOCS1的確定
為了研究miR-155的潛在靶基因,利用targetscan軟件進行了生物信息學分析。使用這種方法,在3’-UTR的SOCS1 mRNA中預測miR-155結合位點,見圖3A。為了檢測miR-155對SOCS1的調節作用,對CD4+T細胞進行了雙熒光素酶報告試驗。細胞共轉染了野生型(WT)或突變型(MUT)SOCS13’-UTR質粒和miR-155或對照miR轉染。MiR-155顯著抑制WT的熒光素酶報告活性,與對照組相比,差異有統計學意義(P<0.01),但不抑制MUT-SOCS13’-UTR,表明SOCS1是MiR-155的直接靶點(圖3B)。RT-PCR分析miR-155轉染細胞中的SOCS1,證實miRNA下調了CD4+T細胞中SOCS1的表達,差異有統計學意義(P<0.01),見圖3,用miR-155抑制劑處理細胞可逆轉這種作用,差異有統計學意義(P<0.01),見圖3C。

圖3 miR-155直接靶點SOCS1的確定。A.miR-155和SOCS1 mRNA的序列匹配;B.WT或MUT SOCS1 3’-UTR與miR-155或對照miR共轉染的熒光素酶檢測報告;C.轉染后3天CD4+T細胞SOCS1的Rt-PCR分析
2.4 3組血漿CD4+T細胞中SOCS1表達情況比較
為探討miR-155對AP和ALI的作用機制,進一步研究了不同分組中CD4+T細胞的SOCS1的表達情況。研究結果發現,AWA組較AOA組,SOCS1在蛋白和mRNA水平均明顯降低,差異有統計學意義(P<0.05)。AOA組較正常組,SOCS1在蛋白和mRNA水平也均明顯降低,差異有統計學意義(P<0.05)。見圖4。
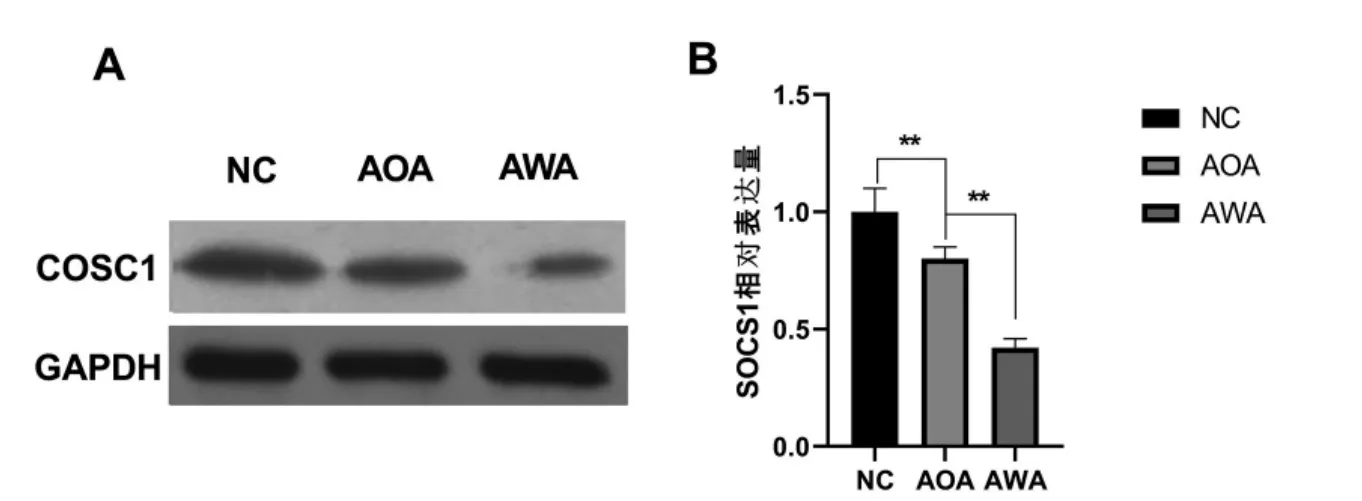
圖4 western blot實驗和實時定量PCR實驗
3 討論
目前AP的診斷包括兩個方面,臨床表現和實驗室檢查,但尚無準確預測AP嚴重程度的標志物,此標志物需要時間準確性,即必須在早期發現并準確預測。miR-155參與了多種疾病的發生發展[13],在某些胰腺疾病中,如星狀細胞通過相關機制轉化時,miR-155表達下調[14]。該課題依據以上調查基礎,采集AP患者血漿并分離純化鑒定血漿外泌體,研究發現外泌體miR-155在AWA患者血漿中顯著高表達,AWA患者相對表達量為(15.11±2.18),AOA患者相對表達量為(10.64±1.65),NC組相對表達量為(5.19±0.44)。AWA組血漿外泌體miR-155水平是AOA組的1.5倍,是NC組的3倍,這從側面提示miR-155可能以外泌體形式存在于血漿中,并與AP的病情發展有一定的關系。Jiménez等[15]人發現,AP能夠產生2個不同的外泌體群,它們在細胞分布、蛋白質和miRNA含量上存在相應的差異,并且可以產生不同的生理效應。其中一個即miR-155明顯升高為特點,且miR-21和miR-122降低,其中AP組外泌體miR-155是對照組的4倍,而該文結果中AWA是NC組的3倍,結果相近,與該研究結果相符。說明外泌體miRNA的異常表達,會對疾病產生較大影響,結果顯示,miR-155在AWA患者血漿外泌體中高表達。
那么外泌體miR-155通過什么途徑對AP的嚴重程度發揮作用?有研究顯示,miR-155可通過靶向結合SOCS1發揮抗腫瘤作用,Zhang等[16]發現,miR-155通過直接靶向SOCS1促進間變性甲狀腺癌的進展,其研究結果表明,熒光素酶實驗驗證了miR-155和SOCS1的靶向結合作用,同時能夠抑制甲狀腺癌細胞中SOCS1的表達,降低其表達后從而造成腫瘤進展。該研究進一步研究了miR-155與SOCS1的關系,利用targetscan軟件進行了生物信息學分析。使用這種方法,在3’-UTR的SOCS1 mRNA中預測miR-155結合位點(圖3A)。為了檢測miR-155對SOCS1的調節作用,對CD4+T細胞進行了雙熒光素酶報告試驗,結果發現miR-155通過抑制性結合SOCS1 mRNA達到抑制其表達(圖3C),對照組明顯高于miR-155組,約為3倍,得到了與Zhang等人的研究類似的結果。同時進行不同分組之間SOCS1的表達情況分析,結果發現,AWA組較AOA組,SOCS1在蛋白和mRNA水平均明顯降低(P<0.05),如圖4所示。AOA組較NC組,SOCS1在蛋白和mRNA水平也均明顯降低(P<0.05),與外泌體miR-155的表達呈負相關。通過以上結果,推論可以發現,SOCS1參與了AP的發生發展過程,外泌體miR-155通過抑制性結合SOCS1的3’TUR來抑制其表達,影響AP的病程進展。在Wang等[12]的研究中,在胰腺炎中已經證實miR-155可以靶向結合SOCS1并通過這一調節軸對Th17/Treg比率進行調節,SOCS1的表達情況與胰腺炎的嚴重程度相關,與該研究結果一致。綜上所述,外泌體miR-155可以作為預測AP病程進展的標志物,值得進一步深入研究。
外泌體miRNA在近些年研究中呈現明顯的應用優勢,尤其在重癥疾病中,包括胰腺炎、腫瘤、腎纖維化等方面。該研究確定了SOCS1是miR-155的直接靶向結合目標,外泌體源性miR-155在AWA患者血漿中高表達,其可通過調節SOCS1的表達影響重癥急性胰腺炎肺損傷,為外泌體在重癥胰腺炎方面的研究打下基礎。但對其機制仍所知甚少,如外泌體源性miR-155如何發生上調,如何發生下調,是否可以確定界定值范圍,來判斷疾病進展情況,需要繼續深入研究。
綜上所述,外泌體源性miR-155的表達水平與重癥胰腺炎患者的發病情況息息相關,使得它對于疾病的預后判斷十分重要,有望成為診斷和提示預后的生物標志物。因此可進一步對miR-200c的發展潛力進行挖掘,從而更好的為臨床服務。

