凈水污泥檸檬酸鈉改性焙燒制備陶粒吸附劑及其對廢水中氨氮吸附性能的研究
羅書舟,王東田,2*
(1.蘇州科技大學環境科學與工程學院,江蘇 蘇州 215009;2.蘇州科技大學化學生物與材料工程學院,江蘇 蘇州 215009)
以鐵鹽和鋁鹽為混凝劑去除原水中的膠體雜質是水凈化的主要預處理工藝,這些膠體雜質不斷聚集沉淀下來則形成了凈水污泥。凈水污泥作為給水廠的廢棄物,少部分用于農田堆肥、建筑利用,還有大量的凈水污泥采用陸上填埋、海洋棄投等方式處理,會對環境造成污染。
氨氮進入水體后會引起藻類異常繁殖,導致水質下降,并對魚類及水生物種產生毒性。吸附法具有低能耗、高效等特點,是去除水中氨氮的有效方法之一,但由于吸附材料的吸附性能及成本等原因,限制了其在實際工程中的應用,因此需要開發更為高效、廉價的吸附劑。
凈水污泥含有豐富的土壤顆粒、鐵鋁氧化物等物質,其表面粗糙、多微孔,還含有大量的鐵(Fe)、鋁(Al)、硅(Si)的活性位點,因此對廢水中污染物有較好的吸附效果,如對重金屬、磷(P)、甲基藍等的吸附。將凈水污泥通過高溫焙燒等工藝制備成污泥灰吸附劑用于去除廢水中污染物已有大量的研究。如李榮等將凈水污泥與粉末活性炭通過復合-焙燒等工藝制備成吸附劑,其對水中氨氮的吸附量可達1.02 mg/g;劉啟迪等研究了煅燒凈水污泥制備除磷材料的可行性,結果表明與未煅燒的凈水污泥相比,煅燒后的凈水污泥對廢水中P的吸附量增加了48.2%。
由于凈水污泥表面的吸附位點有限,其對廢水中污染物的吸附效果不夠理想,許多研究者對凈水污泥進行了改性處理以提高其吸附性能。如杜明展等將煤矸石經鹽酸處理后,發現其內部形成了大量孔隙,且比表面積增大,對稀土廢水中氨氮的吸附能力增強;林豐等研究了氫氧化鉀改性埃洛石對養豬廢水中氨氮的去除效果,結果表明其對養豬廢水中氨氮的吸附量可達14.75 mg/g,較改性前提高了5.1倍;林海等研究了經濃度為0.05 mol/L的檸檬酸鈉改性后的沸石對廢水中氨氮的吸附性能,結果表明改性后的沸石對廢水中氨氮的去除率可達98.14%,比原沸石提高了44.42%。
基于上述研究,本試驗以凈水污泥為原料,選用鹽酸、氫氧化鉀、檸檬酸鈉作為改性劑,通過研磨—改性—造粒—焙燒等工藝制備改性凈水污泥陶粒吸附劑,測定其對水中氨氮的吸附量,得到最優的改性凈水污泥陶粒吸附劑,探討其對廢水中氨氮吸附效果的影響因素,并對試驗數據進行吸附等溫線和吸附動力學模型擬合研究,以期為凈水污泥在氨氮廢水處理方面的應用提供技術支持。
1 材料與方法
1.1 凈水污泥改性試驗
取某自來水廠脫水污泥放入烘箱中于100℃下干燥24 h,經粉碎后過200目篩,得到凈水污泥粉末。將凈水污泥粉末投入不同濃度的酸(鹽酸)、堿(氫氧化鉀)、鹽(檸檬酸鈉)改性劑溶液中攪拌(凈水污泥質量/改性劑溶液體積=50 g/L),在振蕩器中于25℃和120 r/min轉速下振蕩24 h后過濾并用蒸餾水沖洗多次,放入造粒機制成直徑約為5 mm的圓柱形顆粒,經烘箱干燥5 h后,在馬弗爐中于500℃下焙燒5 h,制備得到改性凈水污泥陶粒吸附劑(以下簡稱改性陶粒吸附劑)。以氨氮吸附量為衡量指標,篩選出上述最佳改性陶粒吸附劑和最佳改性陶粒吸附劑濃度。此外,在相同的條件下制備原凈水污泥陶粒吸附劑(以下簡稱原泥陶粒吸附劑),用于對比試驗。
1.2 吸附劑的表征方法
采用能量色散X射線光譜儀(EDX)測定吸附劑的元素組成及其含量;采用X射線衍射(XRD)儀(D-8,德國Brucker)測試分析吸附劑的晶型;采用賽默飛IS50型原位傅里葉紅外光譜(FT-IR)儀測試分析吸附劑的官能團;采用Quanta FEG 250掃描電子顯微鏡(SEM)測試分析吸附劑的表面形貌;采用比表面積及孔徑分析儀(BET)測試分析吸附劑的比表面積和總孔容。
1.3 氨氮水樣的配制及測定方法
采用氯化銨配制模擬氨氮廢水,水中氨氮含量采用納氏試劑分光光度法檢測。吸附劑對水中氨氮的平衡吸附量和去除率由以下公式計算:
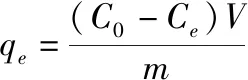
(1)
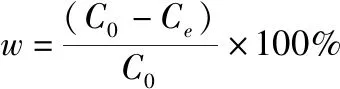
(2)
式中:q
為吸附劑對溶液中氨氮的平衡吸附量(mg/g);m
為吸附劑用量(g);w
為吸附劑對溶液中氨氮的去除率(%);C
為溶液中氨氮的初始濃度(mg/L);C
為吸附平衡時溶液中氨氮的濃度(mg/L);V
為溶液的體積(L)。1.4 吸附試驗
1.4.1 吸附劑對氨氮吸附效果的對比試驗
分別稱取1.0 g不同改性條件下制備的改性陶粒吸附劑和原泥陶粒吸附劑,投入50 mL濃度為50 mg/L的氨氮溶液中,在振蕩器中于25℃和120 r/min轉速下吸附24 h后,測量溶液中氨氮的濃度。
1.4.2 吸附劑對氨氮吸附效果的影響因素分析試驗
(1) 溶液初始pH值對氨氮吸附效果的影響。將氨氮溶液初始pH值分別調節為1、3、5、7、9、11,分別稱取1.0 g原泥陶粒吸附劑和改性陶粒吸附劑投入50 mL濃度為50 mg/L的不同初始pH值氨氮溶液中,在振蕩器中于25℃和120 r/min轉速下吸附24 h后,測量溶液中氨氮的濃度。
(2) 吸附時間對氨氮吸附效果的影響。分別稱取1.0 g原泥陶粒吸附劑和改性陶粒吸附劑投入50 mL濃度為50 mg/L的氨氮溶液中,將溶液調至最佳pH值,在振蕩器中于25℃和120 r/min轉速下吸附時間分別為0.5 h、1 h、2 h、3 h、4 h、5 h、6 h、7 h、8 h時取樣,測量溶液中氨氮的濃度。
(3) 吸附劑投加量對氨氮吸附效果的影響。分別稱取不同質量(0.5 g、1 g、2 g、3 g)的原泥陶粒吸附劑和改性陶粒吸附劑投入50 mL濃度為50 mg/L的氨氮溶液中,將溶液調至最佳pH值,在最佳吸附時間下進行振蕩吸附后,測量溶液中氨氮的濃度。
(4) 氨氮初始濃度對氨氮吸附效果的影響。分別稱取1.0 g原泥陶粒吸附劑和改性陶粒吸附劑投入50 mL不同初始濃度的氨氮溶液中,將溶液調至最佳pH值,在最佳吸附時間下進行振蕩吸附后,測量溶液中氨氮的濃度。
1.5 吸附等溫線與吸附動力學擬合
1.5.1 吸附等溫線擬合
吸附等溫線是指在一定溫度下,當吸附達到平衡時,溶液中離子濃度與吸附劑對該離子的吸附量之間的關系。按照第1.4節(4)中步驟進行吸附試驗,并采用Langmuir模型和Freundlich模型對試驗數據進行了吸附等溫線擬合。其中,Langmuir模型一般用來描述發生在均勻吸附劑表面上的單分子定位吸附;Freundlich模型一般用來描述在非均勻吸附劑表面上的多分子層吸附。Langmuir模型和Freundlich模型的計算公式如下:
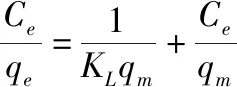
(3)

(4)
式中:q
為單分子層飽和吸附量(mg/g);K
為Langmuir模型平衡常數(L/mg);n
為與吸附能力有關的常數;K
為Freundlich模型平衡常數[(mg/g)·(L/mg)1]。1.5.2 吸附動力學擬合
吸附動力學模型主要表達了吸附材料對污染物的吸附量隨時間的變化情況。按照第1.4節(2)中步驟進行吸附試驗,并采用準一級動力學模型和準二級動力學模型對試驗數據進行了吸附動力學擬合,分析吸附劑對氨氮的吸附過程,并計算吸附速率。其中,準一級動力學模型是假定吸附質從溶液轉移至吸附劑表面的過程受擴散步驟的控制;準二級動力學模型是在假定吸附速率受化學吸附機理控制的基礎上,吸附劑與吸附質之間電子對的公用或轉移。準一級動力學模型和準二級動力學模型的計算公式如下:
ln(q
-q
)=lnq
-k
t
(5)
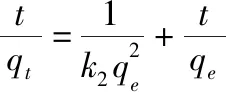
(6)
式中:k
為準一級動力學常數(min);t
為吸附時間(min);k
為準二級動力學常數[g/(mg·min)];q
為t
時刻的氨氮吸附量(mg/g)。1.6 氨氮解吸和重復利用試驗
稱取1.0 g改性陶粒吸附劑投入50 mL濃度為50 mg/L的氨氮溶液中,恒溫吸附24 h后過濾并用蒸餾水沖洗多次;再將吸附飽和的改性陶粒吸附劑分別用50 mL不同濃度(0.01~1.5 mol/L)的NaOH、NaCl、HCl進行解吸,振蕩脫附24 h后過濾,離心分離,測量溶液中氨氮濃度,并利用下式計算其解吸率:
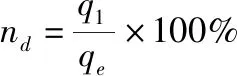
(7)
式中:q
為飽和改性陶粒吸附劑對溶液中氨氮的釋放量(mg/g);n
為改性陶粒吸附劑對溶液中氨氮的解吸率(%)。將解吸后的改性陶粒吸附劑投入50 mL濃度為50 mg/L的氨氮溶液中,多次重復以上吸附解吸步驟,并按公式(2)計算其對氨氮的去除率。
2 結果與討論
2.1 凈水污泥最佳改性條件的確定
分別采用鹽酸、氫氧化鉀和檸檬酸鈉改性劑對凈水污泥進行改性,得到3種改性凈水污泥陶粒吸附劑簡稱改性陶粒吸附劑,得到添加不同改性劑的凈水污泥對溶液中氨氮的吸附效果,見圖1。

圖1 添加不同改性劑的凈水污泥對溶液中氨氮的吸附效果Fig.1 Adsorption effect of different modifiers on ammonia nitrogen in solution
由圖1可見,3種改性劑均能提高凈水污泥對溶液中氨氮的吸附性能,其中0.5 mol/L的檸檬酸鈉對凈水污泥的改性效果最佳,對水溶液中氨氮的吸附量可達1.508 mg/g,因此選用0.5 mol/L的檸檬酸鈉對凈水污泥進行改性。
為了進一步提高檸檬酸鈉改性凈水污泥對溶液中氨氮的吸附性能,將凈水污泥置于0.5 mol/L的檸檬酸鈉溶液中攪拌后,對其進行水浴加熱,考察水浴溫度和水浴時間對溶液中氨氮吸附效果的影響,經此工序后制得的改性陶粒吸附劑對溶液中氨氮的吸附效果,見圖2。

圖2 水浴溫度和水浴時間對改性陶粒吸附劑對溶液中氨氮吸附效果的影響Fig.2 Effect of water bath temperature and bath time on the adsorption effect of ammonia nitrogen by modified ceramsite adsorbent
由圖2可見,在45℃、65℃和85℃的水浴溫度下,對改性過程進行水浴加熱,均能提高改性陶粒吸附劑對溶液中氨氮的吸附性能,其中在65℃下加熱5 h時其對溶液中氨氮的吸附量達到最大,為1.838 mg/g。這是由于隨著水浴溫度的提高,離子的熱運動加快,單位時間內Na接觸凈水污泥表面的次數增多,有利于離子交換過程的進行,但水浴溫度過高時,會降低Na在凈水污泥表面的吸附強度,導致離子交換容量減小。因此,凈水污泥的最佳改性條件為:采用0.5 mol/L的檸檬酸鈉攪拌混合,并在水浴溫度為65℃下浸泡5 h。
2.2 吸附劑的表征結果分析
2.2.1 吸附劑EDX和SEM分析
本文采用能量色散X射線光譜(EDX)儀對原泥陶粒吸附劑和改性陶粒吸附劑的元素組成及其含量進行測試分析,其測試結果見表1。
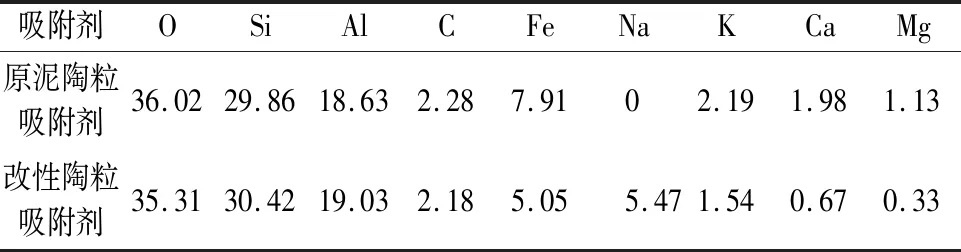
表1 原泥陶粒吸附劑和改性陶粒吸附劑的元素組成及其含量(wt%)Table 1 Element composition of raw sludge ceramsite adsorbent and modified ceramsite adsorbent (wt%)
由表1可知,原泥陶粒吸附劑和改性陶粒吸附劑兩種吸附劑的主要元素組成均為O、Si、Al,而凈水污泥經檸檬酸鈉改性后,其Na元素含量由0%增加至5.47%,說明溶液中的Na已通過置換作用進入凈水污泥中。這是由于Na的半徑較小,根據體積效應,使得改性陶粒吸附劑的空間位阻減小,內擴散速度加快,離子交換容量增大。
本文采用掃描電子顯微鏡(SEM)對原泥陶粒吸附劑和改性陶粒吸附劑的表面形貌進行測試分析,其測試結果見圖3。

圖3 原泥陶粒吸附劑和改性陶粒吸附劑的SEM圖Fig.3 SEM images of raw sludge ceramsite adsorbent and modified ceramsite adsorbent
由圖3可見,與原泥陶粒吸附劑的表層結構相比,改性陶粒吸附劑表面片層數量變多、變薄且更加疏松。這是由于檸檬酸鈉在500℃高溫焙燒時分解后產生了CO等氣體物質,當氣體物質由內向外逸出時產生的沖擊力不斷作用于吸附劑表面,使其表層結構發生了變化。
2.2.2 吸附劑BET分析
本文采用比表面積及孔徑分析(BET)儀對原泥陶粒吸附劑和改性陶粒吸附劑的比表面積及孔容進行測試分析,其測試結果見表2。

表2 原泥陶粒吸附劑和改性陶粒吸附劑的比表面積、孔容和平均孔徑Table 2 Specific surface area,pore volume and average pore size of raw sludge ceramsite adsorbent and modified ceramsite adsorbent
2.2.3 吸附劑XRD分析
本文采用X射線衍射(XRD)儀對原泥陶粒吸附劑和改性陶粒吸附劑的晶型進行測試分析,其測試結果見圖4。

圖4 原泥陶粒吸附劑和改性陶粒吸附劑的XRD圖Fig.4 XRD patterns of raw sludge ceramsite adsorbent and modified ceramsite adsorbent
2.2.4 吸附劑FT-IR分析
本文采用傅里葉紅外光譜(FT-IR)儀對原泥陶粒吸附劑和改性陶粒吸附劑的官能團進行測試分析,其測試結果見圖5。
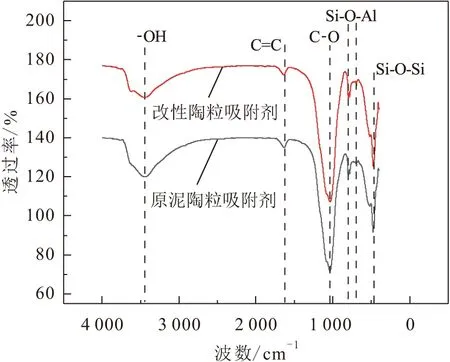
圖5 原泥陶粒吸附劑和改性陶粒吸附劑的FT-IR圖Fig.5 FTIR spectra of raw sludge ceramsite adsorbent and modified ceramsite adsorbent
2.3 吸附劑對氨氮吸附效果的影響因素分析
2.3.1 溶液初始pH值對氨氮吸附效果的影響
溶液初始pH值對原泥陶粒吸附劑和改性陶粒吸附劑兩種吸附劑吸附氨氮效果的影響,見圖6。
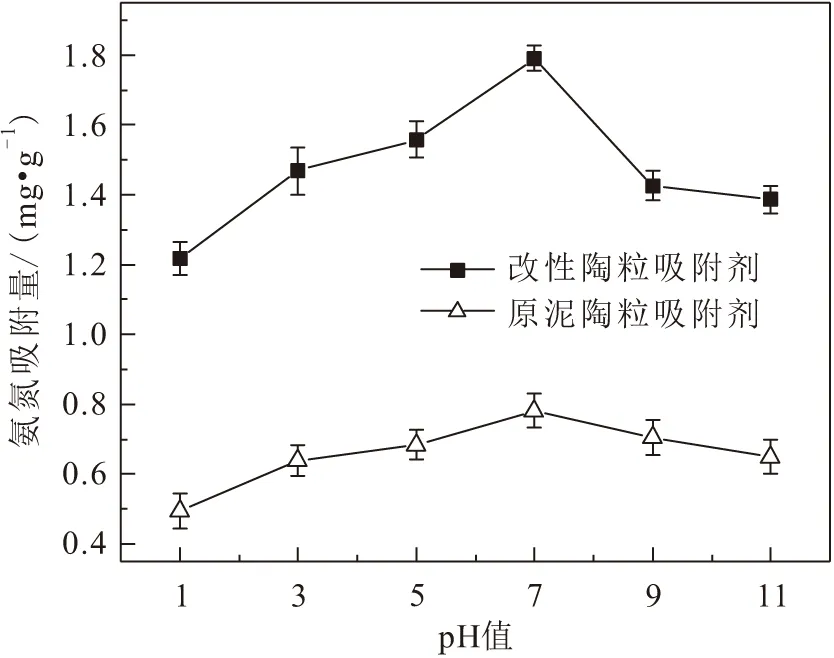
圖6 溶液初始pH值對兩種吸附劑吸附氨氮效果的影響Fig.6 Effect of initial pH of solution on the adsorption of ammonia nitrogen by the two adsorbents
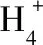
2.3.2 吸附時間對氨氮吸附效果的影響
吸附時間對原泥陶粒吸附劑和改性陶粒吸附劑兩種吸附劑吸附氨氮效果的影響,見圖7。
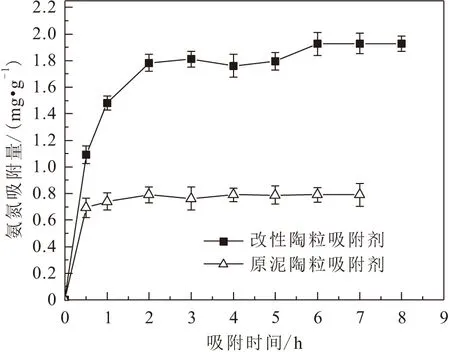
圖7 吸附時間對兩種吸附劑吸附氨氮效果的影響Fig.7 Effect of time on the adsorption of ammonia nitrogen by the two adsorbents
由圖7可見,在前1 h內,改性陶粒吸附劑對溶液中氨氮的吸附量急劇上升,從0 mg/g增加至1.481 mg/g;在4~6 h內,改性陶粒吸附劑對溶液中氨氮的吸附量仍在上升,但吸附速率較前1 h明顯放緩,并在6 h時達到吸附飽和。這是由于在吸附前期,吸附劑表面未被利用的吸附位點的數目較多,且吸附劑表面液膜與溶液之間存在一定的濃度差,加快了氨氮的擴散速度,使得溶液中氨氮被快速吸附。
2.3.3 吸附劑投加量對氨氮吸附效果的影響
吸附劑投加量對原泥陶粒吸附劑和改性陶粒吸附劑兩種吸附劑吸附氨氮效果的影響,見圖8。
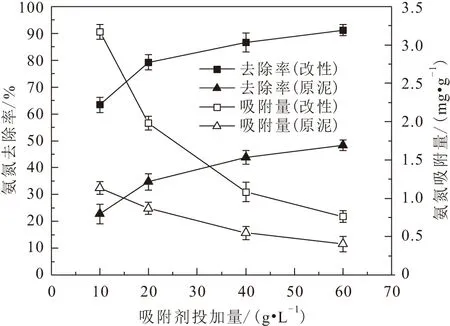
圖8 吸附劑投加量對兩種吸附劑吸附氨氮效果的影響Fig.8 Effect of the dosage of adsorbents on the adsorption of ammonia nitrogen by the two adsorbents
由圖8可見,當改性陶粒吸附劑的投加量由10 g/L增加至60 g/L時,其對溶液中氨氮的平衡吸附量從3.17 mg/g降至0.76 mg/g,而吸附率則從63.40%増至91.20%。
這是由于吸附劑的投加量決定了吸附位點的數目,當其投加量增加時,吸附劑表面的吸附位點未被完全利用,使得單位吸附位點的吸附量變低,對氨氮的吸附效率增加。當改性陶粒吸附劑的投加量由0 g/L增加至20 g/L時,對氨氮的去除率增加了77.52%;而當改性陶粒吸附劑的投加量由20 g/L增加至60 g/L時,對氨氮的去除率僅增加了13.68%。因此,綜合考慮經濟成本因素,選取改性陶粒吸附劑的投加量為20 g/L。
2.3.4 氨氮初始濃度對氨氮吸附效果的影響
氨氮初始濃度對原泥陶粒吸附劑和改性陶粒吸附劑兩種吸附劑吸附氨氮效果的影響,見圖9。
圖9 氨氮初始濃度對兩種吸附劑吸附氨氮效果的影響Fig.9 Effect of initial concentration of ammonia nitrogen on the adsorption of ammonia nitrogen by the two adsorbents
由圖9可見,當氨氮初始濃度為0~150 mg/L時,隨著氨氮初始濃度的升高,兩種吸附劑對氨氮的平衡吸附量增加;當氨氮初始濃度增加至150 mg/L時,兩種吸附劑對氨氮的吸附量趨于平衡,此時兩種吸附劑對溶液中氨氮的吸附量分別為3.115 mg/g、1.702 mg/g。這是由于當氨氮初始濃度較低時,吸附劑表面存在未被利用的吸附位點,使得其對氨氮的吸附量顯著增加;而當氨氮初始濃度較高時,吸附劑表面已無可進行吸附的位點,繼續增加氨氮濃度則其對氨氮的吸附量不再增加。
2.4 吸附等溫線擬合
原泥陶粒吸附劑和改性陶粒吸附劑兩種吸附劑對氨氮吸附過程的吸附等溫線擬合結果,見圖10和圖11。將試驗數據與擬合結果按公式(3)和(4)計算,所得吸附等溫線的擬合參數見表3。

圖10 兩種吸附劑對氨氮吸附過程的Langmuir模型擬合結果Fig.10 Langmuir model fitting of ammonia nitrogen adsorption process by the two adsorbents

圖11 兩種吸附劑對氨氮吸附過程的Freundlich模型擬合結果Fig.11 Freundlich model fitting of ammonia nitrogen adsorption process by the two adsorbents
由表3可知,Langmuir模型的R
值大于Freundlish模型,表明Langmuir模型的擬合效果更佳,說明發生在吸附劑表面的吸附過程為單分子層吸附。吸附模型的性質可以用分離因子R
進行分析,其計算公式為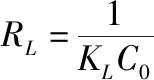
(8)
當0<R
<1時判定為有利吸附。由表3可知,兩種吸附劑的R
值均在0~1之間,說明氨氮在兩種吸附劑上的吸附為有利吸附。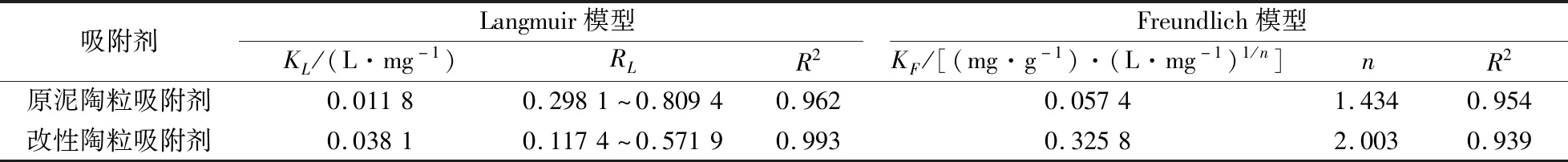
表3 吸附等溫線的擬合參數Table 3 Fitting parameters of the adsorption isotherm model
2.5 吸附動力學擬合
原泥陶粒吸附劑和改性陶粒吸附劑兩種吸附劑對氨氮吸附過程的吸附動力學模型擬合結果,見圖12。將試驗數據與擬合結果按公式(5)和(6)計算,所得吸附動力學模型的擬合參數見表4。
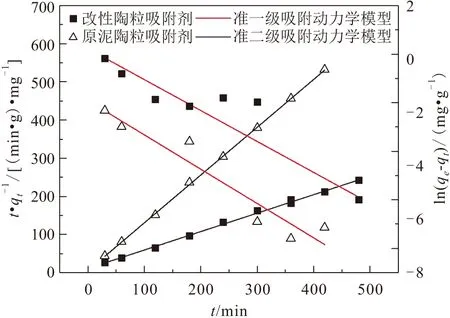
圖12 兩種吸附劑對氨氮吸附動力學過程的準一級動力學模型和準二級動力學模型擬合結果Fig.12 Pseudo-first order kinetics model and Pseudo- second order kinetics model fitting of ammonia nitrogen adsorption process by two adsorbents
由表4可知,準二級動力學模型的R
值大于準一級動力學模型,表明準二級動力學模型的擬合效果更佳,而且改性陶粒吸附劑和原泥陶粒吸附劑兩種的吸附劑對溶液中氨氮的理論吸附值q
,thero(2.06 mg/g、0.81 mg/g)與實際吸附值q
,exp(1.938 mg/g、0.785 mg/g)也更為吻合,說明該吸附過程為在吸附劑表面進行的化學吸附。吸附劑的初始吸附速率h
可由下式計算:
(9)
由表4可知,改性陶粒吸附劑的h
值大于原泥陶粒吸附劑,說明相比于原泥陶粒吸附劑,改性陶粒吸附劑對氨氮的初始吸附速率更快。
表4 吸附動力學模型的擬合參數Table 4 Fitting parameters of the adsorption kinetics model
2.6 氨氮解吸和重復再生結果分析
2.6.1 不同再生液對飽和改性陶粒吸附的氨氮解吸效果對比
按照第1.6節中步驟,采用NaOH、NaCl、HCl 3種再生液對吸附飽和的改性陶粒吸附劑進行解吸試驗,其對氨氮的解吸效果見圖13。
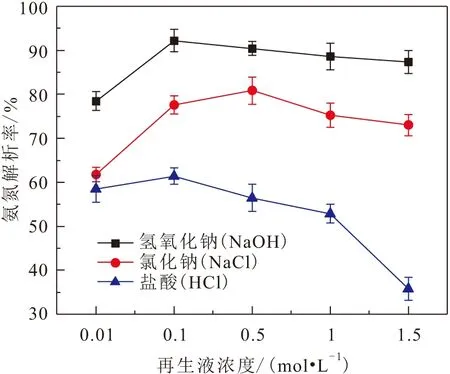
圖13 不同再生液對飽和改性陶粒吸附劑的氨氮解吸效果對比Fig.13 Comparison of different regenerated fluids on ammonia nitrogen desorption by saturated modified ceramsite adsorbents
2.6.2 重復再生效果分析
本文采用NaOH溶液對吸附飽和的改性陶粒吸附劑進行5次重復再生試驗,其對氨氮的解吸效果見表5。
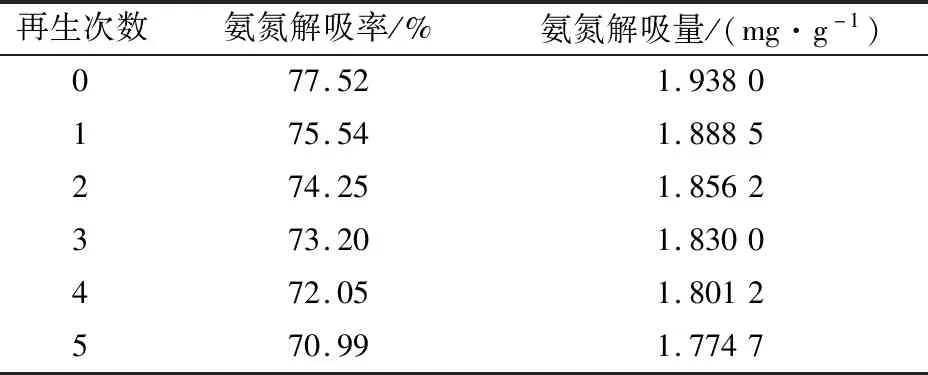
表5 飽和改性陶粒吸附劑的重復再生效果比較Table 5 Comparison of repeated regeneration effect of saturated modified ceramsite adsorbents
由表5可知,NaOH溶液對吸附飽和的改性陶粒吸附劑有較好的重復再生效果,經過5次解吸再生后,改性陶粒吸附劑對氨氮的解吸率和解吸量分別為70.99%和1.7747 mg/g,其再生和解吸能力保持良好。
2.7 改性陶粒吸附劑與商用吸附劑的比較
對于吸附法來說,選擇一種高效、價格低廉的吸附劑對降低處理成本有著重要的現實意義。從吸附性能和經濟性兩方面,將改性陶粒吸附劑與目前商用氨氮吸附劑進行了對比,詳見表6。
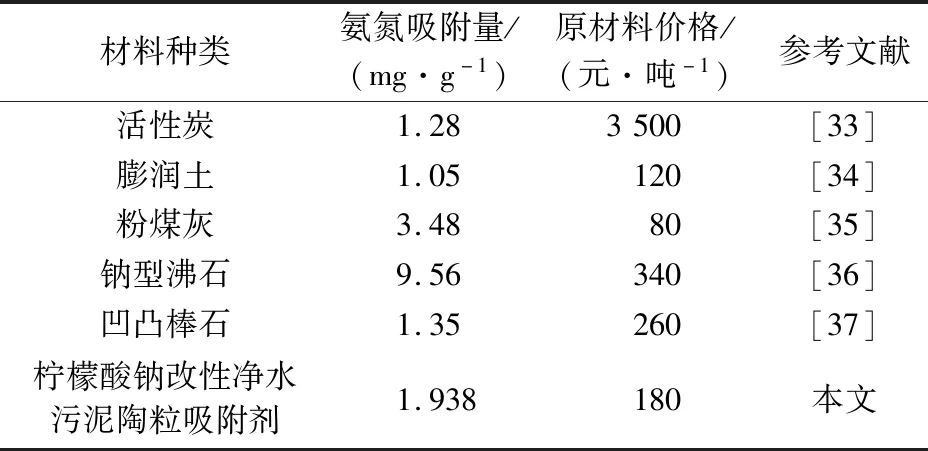
表6 不同氨氮吸附劑的對比Table 6 Comparison of different ammonia nitrogen adsorbents
由表6可知,改性陶粒吸附劑對氨氮的吸附效果優于大部分氨氮吸附劑,其對氨氮的吸附量僅低于鈉型沸石和粉煤灰,而且在原材料成本上也具有一定的優勢,而制成陶粒更易于回收再利用,可以達到以廢治廢的目的,說明檸檬酸鈉改性凈水污泥陶粒吸附劑具有很強的應用潛力。
3 結 論
(1) 凈水污泥的最佳改性條件為:采用0.5 mol/L的檸檬酸鈉攪拌混合,并在水浴溫度為65℃下浸泡5 h。與原泥陶粒吸附劑相比,改性陶粒吸附劑的表面片層數量變多且更加疏松,離子交換容量、孔徑和比表面積增大,提高了對氨氮的吸附性能。
(2) 改性陶粒吸附劑對氨氮的吸附效果與原泥陶粒吸附劑相比有顯著提高,當溶液最佳pH值為7、飽和吸附時間為6 h、吸附劑經濟投加量為20 g/L、氨氮初始濃度為50 mg/L時,改性陶粒吸附劑對氨氮的最大吸附量為1.938 mg/g,為原泥陶粒吸附劑的2.46倍。
(3) 改性陶粒吸附劑和原泥陶粒吸附劑對氨氮的吸附過程均符合Langmuir模型和準二級動力學模型。分離因子R
計算結果表明,氨氮在兩種吸附劑上的吸附均為有利吸附,且改性陶粒吸附劑對氨氮的初始吸附速率高于原泥陶粒吸附劑。(4) 改性陶粒吸附劑的最佳再生液為0.1 mol/L的NaOH溶液,對氨氮的解吸率可達92.22%。吸附飽和的改性陶粒吸附劑經過5次解吸和回用后,對氨氮的解吸率僅下降了6.53%,其再生和解吸能力保持良好。

