血清ApoA1/B、Hcy、脂蛋白a在T2DM合并微血管并發癥患者中的變化及預測價值
王志敏
(北京市順義區醫院檢驗科,北京 101300)
糖尿病(diabetes mellitus,DM)是由多種病因引起的以慢性高血糖為主要特征的代謝性疾病,其中約90%為2型糖尿病(type 2 diabetes mellitus,T2DM)[1-2]。微血管病變為DM特異性并發癥,可累及全身各器官組織,引起非創傷性截肢、失明、慢性腎臟病等,巨大疾病負擔已構成我國公共衛生問題,阻止及延緩T2DM并發癥發生、發展為臨床醫師共同努力目標[3-4]。血清中同型半胱氨酸(homocysteine,Hcy)含量升高,可促進血小板聚集,增加大血管、微血管并發癥危險性[5];譚錦玲[6]研究指出,T2DM患者因胰島素抵抗,長期慢性高血糖基礎上易發生脂質代謝紊亂。近期研究報道,載脂蛋白A1/載脂蛋白B(apolipoprotein A1/apolipoprotein B,ApoA1/B)、脂蛋白a[lipoprotein(a),Lp(a)]在預測血管并發癥發生方面優于低密度脂蛋白膽固醇(low-density lipoprotein cholesterol,LDL-C)[7]。現有文獻對DM微血管并發癥的研究多為單一分析上述指標,較少三者綜合分析探究。本研究旨在探究血清ApoA1/B、Hcy、Lp(a)在T2DM合并微血管并發癥患者中的變化及預測價值,以期為臨床診治、預防T2DM患者微血管并發癥提供指導。報告如下。
1 資 料 與 方 法
1.1一般資料 選取2018年1月—2020年7月我院收治的T2DM患者134例,根據是否合并微血管并發癥分為合并微血管并發癥組(56例)與無微血管并發癥組(78例)。納入標準:①符合《中國T2DM防治指南(2017年版)》診斷標準[8];②合并微血管并發癥組符合《基層糖尿病微血管病變篩查與防治專家共識》診斷標準[9];③無家族性高膽固醇血癥者;④患者及家屬均自愿簽署知情同意書;⑤無意識障礙。排除標準:①妊娠期糖尿病、1型糖尿病或其他特殊類型DM;②嚴重肝腎功能不全者;③伴有DM酮癥酸中毒或高血糖高滲狀態等急性并發癥;④合并內分泌系統疾病,如多囊卵巢綜合征、甲狀腺功能異常等;⑤近1個月應用阿托伐他汀等降脂藥物者;⑥妊娠試驗陽性;⑦自身免疫系統疾病;⑧合并良惡性腫瘤。
本研究經醫院醫學倫理委員會審批通過。
1.2方法
1.2.1資料收集 收集所有患者性別、年齡、吸煙、病程、飲酒比例、合并高血壓、體重指數(body mass index,BMI)、注射胰島素及實驗室指標等臨床資料。
1.2.2樣本采集與處理 采血前1 d患者禁食高脂飲食、停服相關藥物,采集所有患者空腹12 h以上(通常8~12 h)外周靜脈血2份,一份為EDTA-K3抗凝血,一份為普通真空采血管,于室溫條件下,4 000 r/min離心10 min,待測。
1.2.3實驗室指標檢測 選用糖化血紅蛋白分析儀(東曹-G8)及配套試劑,利用高效液相色譜法測定糖化血紅蛋白(glycosylated hemoglobin,HbA1c)水平;選用全自動生化儀(貝克曼AU5800)及其配套試劑,利用葡萄糖氧化酶法測定空腹血糖(fasting blood-glucose,FBG)、餐后2 h血糖(2 h postprandial plasma glucose,2 hPG)水平,測定血清總膽固醇(total cholesterol,TC)、丙氨酸轉氨酶(alanine aminotransferase,ALT)、高密度脂蛋白膽固醇(high density lipoprotein-cholesterol,HDL-C)、三酰甘油(triglyceride,TG)、天冬氨酸轉氨酶(aspartateaminotransferase,AST)、LDL-C、尿素氮(blood usea nitrogen,BUN)、肌酐(serum creatinine,Scr)水平。FBG、2 hPG、TC、HDL-C、TG、LDL-C、BUN、Scr試劑盒購自中生北控生物科技股份有限公司,ALT、AST采用貝克曼試劑盒。
1.2.4血清ApoA1/B、Hcy、Lp(a)檢測 選用全自動生化分析儀(貝克曼AU5800)進行測定,采用免疫比濁法測定ApoA1/B水平;采用循環酶法測定Hcy水平;采用膠乳免疫比濁法測定血清Lp(a)水平,試劑盒均購自中生北控生物科技股份有限公司。
1.3觀察指標 ①比較2組血清ApoA1/B、Hcy、Lp(a)水平。②分析血清ApoA1/B、Hcy、Lp(a)與實驗室指標(FBG、2 hPG、HbA1c、TC、TG)的相關性。③采用多因素Logistic回歸方程分析T2DM合并微血管并發癥的影響因素。④分析血清ApoA1/B、Hcy、Lp(a)對T2DM合并微血管并發癥的預測價值。⑤分析血清ApoA1/B、Hcy、Lp(a)聯合對T2DM合并微血管并發癥的預測價值。
1.4統計學方法 應用SPSS19.0統計軟件處理數據。計數資料比較采用χ2檢驗,計量資料比較采用獨立樣本t檢驗;相關性分析采用 Pearson 相關系數模型;預測效能分析采用受試者工作特征(receiver operator characteristic curve,ROC)曲線,獲取曲線下面積、95%可信區間、敏感度、特異度及cut-off值,不同預測方案間曲線下面積比較采用DeLong 檢驗,聯合診斷實施Logistic二元回歸擬合,返回預測概率logit(p),將其作為獨立檢驗變量。P<0.05為差異有統計學意義。
2 結 果
2.12組臨床資料比較 2組性別、年齡、吸煙、飲酒比例、注射胰島素、AST、ALT、Scr、BUN、HDL-C、LDL-C差異無統計學意義(P>0.05);合并微血管并發癥組病程、BMI、合并高血壓、FBG、2 hPG、HbA1c、TC、TG水平高于無微血管并發癥組,差異有統計學意義(P<0.05)。見表1。
表1 2組臨床資料比較Table 1 Comparison of clinical data between two groups
2.22組血清ApoA1/B、Hcy、Lp(a)水平比較 合并微血管并發癥組血清ApoA1/B水平低于無微血管并發癥組,Hcy、Lp(a) 水平高于無微血管并發癥組,差異有統計學意義(P<0.05)。見表2。
表2 2組血清ApoA1/B、Hcy、Lp(a)水平比較Table 2 Comparison of serum ApoA1/B, Hcy and Lp(a) levels between two groups
2.3血清ApoA1/B、Hcy、Lp(a)與實驗室指標的相關性 Pearson相關性分析結果顯示,血清ApoA1/B與FBG、2 hPG、HbA1c、TC、TG呈負相關,Hcy、Lp(a)與FBG、2 hPG、HbA1c、TC、TG呈正相關(P<0.05)。見表3。

表3 血清ApoA1/B、Hcy、Lp(a)與實驗室指標相關性Table 3 Correlation between serum ApoA1/B, Hcy, Lp(a) and laboratory indicators
2.4T2DM合并微血管并發癥的影響因素分析 將T2DM是否合并微血管并發癥作為因變量(否=0,是=1),以病程(<5.99年=0,≥5.99年=1)、BMI(<25.28=0,≥25.28=1)、合并高血壓(否=0,是=1)、血清ApoA1/B(<1.04=0,≥1.04=1)、Hcy(<15.41 μmol/L=0,≥15.41 μmol/L=1)、Lp(a)(<164.75 mg/L=0,≥164.75 mg/L=1)作為自變量,納入Logistic回歸方程,結果顯示,病程、BMI、合并高血壓、血清ApoA1/B、Hcy、Lp(a)是T2DM合并微血管并發癥的影響因素(P<0.05)。見表4。

表4 T2DM合并微血管并發癥的影響因素分析Table 4 Influencing factors of T2DM with microvascular complications
2.5血清ApoA1/B、Hcy、Lp(a)對T2DM合并微血管并發癥的預測價值 繪制ROC曲線,結果顯示,ApoA1/B預測T2DM合并微血管并發癥的AUC為0.771,敏感度為71.79%,特異度為75.00%;Hcy預測T2DM合并微血管并發癥的AUC為0.824,敏感度為66.07%,特異度為89.74%;Lp(a) 預測T2DM合并微血管并發癥的AUC為0.788,敏感度為55.36%,特異度為93.59%。見表5,圖1。
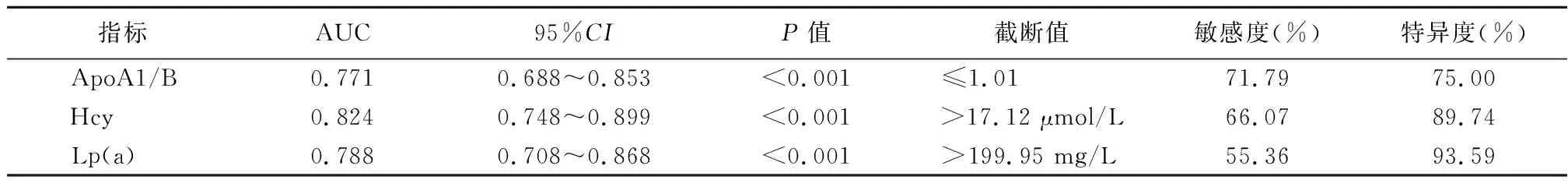
表5 血清ApoA1/B、Hcy、Lp(a)對T2DM合并微血管并發癥的預測價值Table 5 The predictive value of serum ApoA1/B, Hcy, and Lp(a) in T2DM with microvascular complications

圖1 血清ApoA1/B、Hcy、Lp(a)對T2DM合并微血管并發癥的預測價值Figure 1 The predictive value of serum ApoA1/B, Hcy, and Lp(a) in T2DM with microvascular complications
2.6聯合預測價值 將血清ApoA1/B、Hcy、Lp(a)進行Logistic二元回歸擬合,返回預測概率Logit(P)作為獨立檢驗變量,獲取聯合預測的AUC為0.878,95%CI:0.814~0.941,P<0.001,敏感度為73.21%,特異度為88.46%,優于各指標單獨預測(P<0.05),見圖2。

圖2 聯合預測價值Figure 2 Combined forecast value
3 討 論
T2DM患者體內存在多種代謝紊亂,其微血管并發癥發生發展機制較為復雜,目前尚未完全明確,可能是由多種病理機制共同作用、相互聯系所致的結果。近來T2DM與載脂蛋白在機體脂代謝過程中的研究備受廣大學者重視,ApoA1為載脂蛋白主要成分,主要負責血漿中大部分膽固醇酯轉化,ApoB為LDL主要載脂蛋白,可打開細胞導入膽固醇,ApoA1/B反映血液中促動脈粥樣硬化與抗動脈粥樣硬化脂蛋白的平衡狀態[10]。本研究結果顯示,合并微血管并發癥組血清ApoA1/B水平低于無微血管并發癥組,分析其機制在于,T2DM患者因發生胰島素抵抗,對脂肪分解抑制作用減弱,致使TG生成增多,HDL-C水平降低;國內外研究指出[11-12],ApoA1、ApoB分別為HDL-C和LDL-C主要結構蛋白,LDL-C水平升高具有較強致動脈粥樣硬化作用,HDL-C水平升高代表抗動脈粥樣硬化能力增強,故血清ApoA1/B降低,可加速動脈粥樣硬化,致使微血管并發癥發生。Lp(a)是在肝臟中合成的大分子復合物,為臨床評價炎癥所致內皮損傷重要指標,在DM合并高血壓患者并發DM周圍神經病變中呈高表達[13-14];既往研究顯示,Hcy與心血管疾病密切相關,Hcy水平升高為微血管病變獨立危險因素[15-16]。本研究結果顯示,合并微血管并發癥組血清Hcy、Lp(a) 水平高于無微血管并發癥組(P<0.05),與上述研究結果一致。推測其原因可能為,Lp(a)主要抑制纖維蛋白溶解酶原活性,Lp(a)水平升高干擾機體纖溶系統正常運轉,間接引起血管內皮細胞損傷,造成機體微循環障礙和微血管阻塞;Hcy為蛋氨酸代謝過程中重要中間產物,正常情況下其含量極低,T2DM患者Hcy無法代謝轉化時,呈現異常高表達,引起血液中氧自由基生成增加,對血管內皮細胞一氧化氮活性產生抑制,造成血管內皮損害,機體凝血-纖溶平衡被打破,進而引起微血管病變發生[17-18]。
國內外研究顯示,血糖水平升高可致使一氧化氮合成減少、糖化反應亢進、多元醇代謝異常等,進而引起相應損害,通過控制FBG、2 hPG、HbA1c水平,可降低相應并發癥發生率[19-20]。脂肪組織除貯存能量外,還具有重要內分泌功能,可分泌多種生物活性肽,即脂肪細胞因子。脂肪細胞因子可參與調節能量代謝、免疫應答及胰島素敏感性,TC、TG通過調節糖脂代謝、細胞分化,參與T2DM患者微血管并發癥發生過程。本研究結果顯示,血清ApoA1/B與FBG、2 hPG、HbA1c、TC、TG呈負相關,Hcy、Lp(a)與FBG、2 hPG、HbA1c、TC、TG呈正相關(P<0.05),提示ApoA1/B、Hcy、Lp(a)是反映T2DM患者微血管并發癥發生的敏感指標。繪制ROC曲線發現,血清ApoA1/B、Hcy、Lp(a)聯合預測的AUC為0.878,敏感度為73.21%,特異度為88.46%,優于各指標單獨預測(P<0.05),可在一定程度上提高預測效能,為臨床預測T2DM患者微血管并發癥發生提供更準確數據參考,對T2DM患者微血管并發癥預防、控制與治療具有重要臨床意義。此外,對于病程較長、BMI較高、合并高血壓患者,微血管病變發生風險較高,需作為重點觀察對象,進一步加強相關治療或干預措施,以降低微血管病變發生率。
綜上可知,T2DM合并微血管并發癥患者血清ApoA1/B表達水平較低、Hcy、Lp(a)表達水平較高,三者聯合檢測在預測T2DM患者微血管并發癥發生方面具有較高臨床應用價值,可為T2DM患者微血管并發癥發生診斷、預防及治療提供新的線索與思路。但本研究選取樣本量較少,可能造成數據偏移,需擴大樣本量做進一步探究,以獲取更為可靠的數據支持。

