單核細(xì)胞增生李斯特菌對食品加工中的脅迫響應(yīng)及其機制研究進(jìn)展
孫海磊,董鵬程,毛衍偉,梁榮蓉,楊嘯吟,張一敏,*,朱立賢,*,羅 欣,2
(1.山東農(nóng)業(yè)大學(xué)食品科學(xué)與工程學(xué)院,山東 泰安 271018;2.江蘇省肉類生產(chǎn)與加工質(zhì)量安全控制協(xié)同創(chuàng)新中心,江蘇 南京 210095)
單核細(xì)胞增生李斯特菌(Listeria monocytogenes)(以下簡稱單增李斯特菌)是一種人畜共患的病原菌,其引起的死亡率高達(dá)20%~30%,在20世紀(jì)90年代被世界衛(wèi)生組織(World Health Organization,WHO)列為世界第四大食源性致病菌[1-2]。微生物的生長繁殖是通過與外界環(huán)境(水分、氧氣、溫度、酸堿性等)發(fā)生相互作用而進(jìn)行的,如果環(huán)境發(fā)生改變,就會對微生物造成環(huán)境脅迫,而在食品加工過程中所采用的酸噴淋、加熱、冷藏、腌制等加工處理方法均會對微生物形成環(huán)境脅迫[3-4]。
單增李斯特菌對于食品加工過程中的環(huán)境脅迫具有很強的抵抗能力,Almeida等[5]報道稱盡管工廠采取了清潔和消毒措施,但是仍能從食品加工設(shè)備表面檢出單增李斯特菌。這就使得單增李斯特菌極易對肉、乳制品、水產(chǎn)品和蔬菜等食品造成污染,而人受其感染的主要途徑便是食用被其污染的食品[6]。單增李斯特菌暴露于亞致死環(huán)境脅迫條件下一段時間后,會增強抵抗致死性環(huán)境脅迫能力,Skandamis等[7]的研究表明單增李斯特菌暴露于弱酸下一段時間后,可顯著增強其耐酸性。此外,在整個食品加工過程中可能會出現(xiàn)多種不同的脅迫環(huán)境,這極易導(dǎo)致單增李斯特菌產(chǎn)生交叉保護(hù),如低溫下生長的單增李斯特菌可增強抵抗高滲透壓脅迫的能力等[8]。而最應(yīng)該值得注意的是,目前有許多研究表明環(huán)境脅迫可以增強單增李斯特菌耐受胃液的能力,這嚴(yán)重危脅人類身體健康[9-10]。因此,為了開發(fā)有效的措施來防止食品加工過程中的單增李斯特菌的污染以及控制其在食品貯藏過程中的生長,了解單增李斯特菌在食品加工環(huán)境中對脅迫條件的響應(yīng)及耐受機制是至關(guān)重要的。本文在前人研究的基礎(chǔ)上,就單增李斯特菌在食品加工中產(chǎn)生的酸脅迫應(yīng)激、熱脅迫應(yīng)激、冷脅迫應(yīng)激、干燥和高滲透壓脅迫應(yīng)激以及交叉保護(hù)等最新研究結(jié)果進(jìn)行了綜述,旨在為單增李斯特菌在食品加工過程中脅迫響應(yīng)研究及該菌的防控提供指導(dǎo)。
1 酸脅迫
在食品加工過程中單增李斯特菌廣泛存在。代長寶[11]調(diào)查了肉牛屠宰工廠的各個屠宰環(huán)節(jié)(運輸車、待宰圈、糞便、皮毛、去內(nèi)臟后胴體、噴淋后胴體、冷卻后胴體、冷卻肉)單增李斯特菌的檢出情況,發(fā)現(xiàn)經(jīng)酸噴淋后胴體仍可檢出單增李斯特菌。單增李斯特菌最適生存pH值為6~7,但在pH 4.1~9.6的范圍內(nèi)仍可存活生長[12]。當(dāng)食品或加工設(shè)備等用酸處理時,便會對單增李斯特菌形成酸脅迫應(yīng)激。在酸脅迫應(yīng)激條件下單增李斯特菌會產(chǎn)生誘導(dǎo)耐酸反應(yīng)(acid tolerance response,ATR)[1,13]。ATR是指菌株處于亞致死pH值的酸性環(huán)境一段時間后,其抵抗致死性酸環(huán)境的能力會增強的現(xiàn)象。這一反應(yīng)能夠提高單增李斯特菌的毒力和耐受胃酸的能力[14]。還有學(xué)者發(fā)現(xiàn)單增李斯特菌進(jìn)行ATR后不僅可以增強其耐酸能力,還可以產(chǎn)生交叉保護(hù)作用,提高菌株耐熱、耐冷、耐滲透壓等的能力,增強細(xì)菌的毒性,嚴(yán)重危害人類健康[14-16]。
圖1展示了單增李斯特菌的耐酸系統(tǒng)和耐酸機制。單增李斯特菌處于酸脅迫條件下時,質(zhì)子(H+)通過細(xì)胞膜擴散進(jìn)入菌株,造成菌株內(nèi)酸性陰離子含量增加,打破菌株內(nèi)pH值的動態(tài)平衡,使菌株的細(xì)胞膜以及重要的代謝途徑受到破壞和損傷。單增李斯特菌具有F0F1-ATPase系統(tǒng)、谷氨酸脫羧酶系統(tǒng)(glutamate decarboxylase system,GAD)、精氨酸脫亞胺酶系統(tǒng)(arginine deiminase system,ADI)等多種維持pH值平衡的機制來調(diào)控上述過程,故單增李斯特菌在進(jìn)行ATR后可以獲得較強的耐酸能力[18-22]。
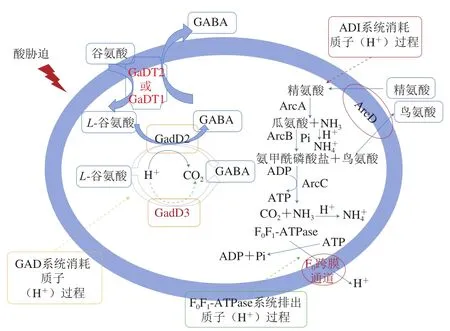
圖1 單增李斯特菌的耐酸機制[17]Fig.1 Mechanisms of stress response in Listeria monocytogenes[17]
1.1 F0F1-ATPase系統(tǒng)
F0F1-ATPase是一種多亞基酶,最初由Datta等[23]發(fā)現(xiàn)其與單增李斯特菌的耐酸性有關(guān)。當(dāng)單增李斯特菌處于酸性環(huán)境時,細(xì)胞內(nèi)外存在pH值梯度差,當(dāng)梯度差達(dá)到一定程度時會導(dǎo)致F0F1-ATPase水解ATP程度增強,進(jìn)而產(chǎn)生質(zhì)子遷移力(proton motive force,PMF),PMF可以促進(jìn)細(xì)胞內(nèi)質(zhì)子(H+)的排出,提高細(xì)胞內(nèi)pH值進(jìn)而維持pH值平衡[24]。
N,N-二環(huán)己基碳二亞胺(N,N-dicyclohexylcarbodiimide,DCCD)是F0F1-ATPase的抑制劑,Datta等[23]用其證實F0F1-ATPase與單增李斯特的耐酸性有關(guān)。Cotter等[25]報道稱單增李斯特菌在pH 5.5條件下誘導(dǎo)1 h,再在pH值為3.0條件下酸激2 h,采用DCCD處理組比未采用DCCD處理組的存活率低3 個對數(shù)值,這表明F0F1-ATPase與單增李斯特菌ATR機制有關(guān)。張一敏[26]發(fā)現(xiàn)單增李斯特菌細(xì)胞膜流動性的改變可以影響其耐酸性,但該學(xué)者并未探討其具體原因。然而有學(xué)者在研究大腸桿菌時發(fā)現(xiàn),細(xì)胞膜流動性改變影響菌株耐酸性的原因是細(xì)胞膜流動性改變了F0F1-ATPase的活性[27]。單增李斯特菌中細(xì)胞膜流動性影響其耐酸性的原因是否與F0F1-ATPase系統(tǒng)有關(guān)還有待闡明。
1.2 GAD系統(tǒng)
GAD系統(tǒng)是影響單增李斯特菌耐酸的一個關(guān)鍵機制[1]。該系統(tǒng)由2 個逆轉(zhuǎn)運蛋白基因(gadT1和gadT2)和3 個脫羧酶基因(gadD1、gadD2和gadD3)組成,逆轉(zhuǎn)運蛋白基因編碼對應(yīng)的逆轉(zhuǎn)運蛋白GadT1和GadT2,脫羧酶基因編碼對應(yīng)的脫羧酶GadD1、GadD2和GadD3。當(dāng)菌株處于低pH值條件(pH<4.5)下時,GadD2催化L-谷氨酸脫羧生成GABA,催化完成后GadT2會將GABA導(dǎo)出胞外并將L-谷氨酸導(dǎo)入胞內(nèi)(圖1)。除此之外,GadD3消耗質(zhì)子(H+)也可以使L-谷氨酸脫羧生成GABA和CO2,這個過程產(chǎn)生的GABA在細(xì)胞內(nèi)累積。GAD系統(tǒng)調(diào)控上述兩個過程維持細(xì)胞內(nèi)pH值的穩(wěn)定[17]。
很多學(xué)者就GAD系統(tǒng)對單增李斯特菌耐酸能力的影響進(jìn)行了相關(guān)研究。Karatzas等[28]通過研究不同類型單增李斯特菌的GAD系統(tǒng),發(fā)現(xiàn)該系統(tǒng)具有菌株依賴性。王宜等[29]研究單增李斯特菌SigB調(diào)控GadD3的抗酸應(yīng)激作用,發(fā)現(xiàn)3 個谷氨酸脫羧酶基因(gadD1、gadD2、gadD3)對單增李斯特菌的耐酸脅迫能力貢獻(xiàn)大小為gadD2>gadD3>gadD1。除此之外該實驗還得出SigB可以正向調(diào)控gadD3的轉(zhuǎn)錄與表達(dá),這與Jeroen等[30]得出的結(jié)論相同。但Kamzierczak等[31]認(rèn)為SigB下調(diào)gadD3的轉(zhuǎn)錄水平。這與王宜[29]和Jeroen[30]等的結(jié)論不同,這可能是實驗所用的菌株類型不同所致。現(xiàn)有的研究結(jié)果表明GAD系統(tǒng)抗酸應(yīng)激作用的具體調(diào)控尚不明確,gadD1基因的調(diào)控因菌株而異,此外,大多數(shù)學(xué)者認(rèn)為SigB參與gadD3基因的轉(zhuǎn)錄與表達(dá)調(diào)控,但對于其是否是正向調(diào)控gadD3基因的轉(zhuǎn)錄與表達(dá)結(jié)論還存在爭議。
1.3 ADI系統(tǒng)
ADI系統(tǒng)在維持單增李斯特菌細(xì)胞內(nèi)pH值穩(wěn)定方面也發(fā)揮著重要作用[1]。ADI系統(tǒng)主要由精氨酸脫亞胺酶(arginine deiminase,ArcA)、分解代謝鳥氨酸氨基甲酰基轉(zhuǎn)移酶(catabolic ornithine carbamoyltransferase,ArcB)、氨基甲酸酯激酶(carbamate kinase,ArcC)和精氨酸-鳥氨酸逆向轉(zhuǎn)運酶(membrane-bound arginineornithine antiporter,ArcD)分別由arcA、arcB、arcC和arcD編碼。當(dāng)單增李斯特菌處于較低pH值時,上述3 種酶將進(jìn)入細(xì)胞內(nèi)的精氨酸分解為NH3、CO2、ATP和鳥氨酸(圖1),NH3與H+結(jié)合生成NH4+進(jìn)而使細(xì)胞內(nèi)pH值升高,維持pH值平衡,而產(chǎn)生的ATP可以參與F0F1-ATPase系統(tǒng)質(zhì)子轉(zhuǎn)運,ArcD可以在不消耗能量的前提下將鳥氨酸轉(zhuǎn)運到細(xì)胞外并交換精氨酸進(jìn)入細(xì)胞內(nèi)[32]。
有很多學(xué)者針對單增李斯特菌的ADI系統(tǒng)進(jìn)行了研究,程昌勇[33]研究了單增李斯特菌酸應(yīng)激(pH 2.5、60 min)后arcA基因的轉(zhuǎn)錄和蛋白表達(dá)水平,結(jié)果顯示兩者均顯著升高,且缺失acrA基因的單增李斯特菌在酸性環(huán)境中的存活性顯著下降。該結(jié)果也進(jìn)一步證實了Ryan[32]得出的ADI系統(tǒng)對于單增李斯特菌的耐酸性起到重要作用這一結(jié)論。Freitag等[34]報道稱ADI系統(tǒng)受SigB因子和毒力因子PrfA調(diào)控。lmo1367編碼精氨酸代謝調(diào)控因子ArgR,lmo0041編碼rpiR家族轉(zhuǎn)錄調(diào)控因子Lmo0041。陳健舜[2]發(fā)現(xiàn)ArgR和Lmo0041在胃液中分別正調(diào)控和負(fù)調(diào)控單增李斯特菌ADI系統(tǒng),且ArgR的作用弱于Lmo0041,同時ArgR還可對Lmo0041正調(diào)控。該學(xué)者還提出ArgR、Lmo0041、SigB和PrfA可以構(gòu)成級聯(lián)調(diào)控網(wǎng)絡(luò)(圖2)的觀點。ADI系統(tǒng)的耐酸調(diào)控機制尚不完全清楚,SigB和PrfA分別對ArgR和Lmo0041的調(diào)控機制還有待闡明;除此之外,ADI系統(tǒng)和GAD系統(tǒng)均可消耗細(xì)胞內(nèi)H+來提高細(xì)胞內(nèi)pH值,但兩個系統(tǒng)之間的關(guān)系以及在耐酸機制中發(fā)揮作用的重要程度也有待深入研究。
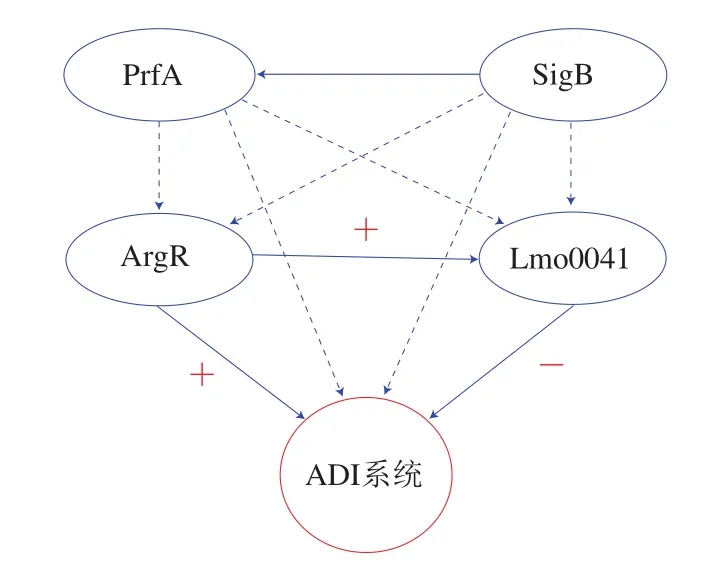
圖2 PrfA、SigB、ArgR、Lmo0041與ADI系統(tǒng)的級聯(lián)調(diào)控網(wǎng)絡(luò)[2]Fig.2 Cascade regulation of PrfA, SigB, ArgR and Lmo0041 on ADI system[2]
2 熱脅迫
熱處理是減少食品尤其是是乳制品和肉類中微生物含量最常用的方法之一。如果環(huán)境溫度發(fā)生改變,微生物體內(nèi)的生理生化反應(yīng)也會發(fā)生相應(yīng)的變化。單增李斯特菌在食品消毒、運輸?shù)冗^程中均有可能遇到溫度升高的情況,因此為了保證自身的存活,單增李斯特菌需具備抵抗熱脅迫應(yīng)激的能力[17]。與ATR類似,亞致死溫度下誘導(dǎo)單增李斯特菌一段時間,其熱應(yīng)激抵抗能力也會增強。Shen Qian等[35]研究單增李斯特菌在亞致死溫度48 ℃下誘導(dǎo)不同時間后暴露于致死溫度(60 ℃)下的存活情況,結(jié)果顯示經(jīng)48 ℃誘導(dǎo)后的單增李斯特菌在60 ℃下的存活率要顯著高于未經(jīng)誘導(dǎo)的單增李斯特菌,說明單增李斯特菌經(jīng)亞致死溫度暴露一段時間后其抵抗致死溫度的能力會增強,這與Wa?ecka-Zacharska等[36]的結(jié)論相一致。除此之外,Shen Qian等[35]還發(fā)現(xiàn)當(dāng)單增李斯特菌在亞致死溫度下誘導(dǎo)30~60 min時,其在致死溫度下的存活能力最強,這也驗證了Linton等[37]得到的單增李斯特菌抵抗熱應(yīng)激能力與其在亞致死溫度下的誘導(dǎo)時間有關(guān)的結(jié)論,但Linton等[37]提出的最佳的亞致死溫度誘導(dǎo)時間為20 min,這與Shen Qian等[35]所得的最佳亞致死溫度誘導(dǎo)時間30~60 min又有所差異,這可能與兩位學(xué)者所用菌株類型不同以及對菌株的培養(yǎng)時間不同有關(guān)。
為了更好地模擬現(xiàn)實中食品加工環(huán)境,Carazo等[38]研究了動態(tài)條件下單增李斯特菌的耐熱情況,發(fā)現(xiàn)相對于等溫處理單增李斯特菌,現(xiàn)實中動態(tài)溫度的處理并不會導(dǎo)致單增李斯特菌的快速減少,且會使單增李斯特菌抵抗熱的能力變得更強,進(jìn)而對食品造成嚴(yán)重污染。此外,該學(xué)者還報道稱單增李斯特菌進(jìn)行動態(tài)溫度處理時的熱脅迫應(yīng)激機制在等溫處理過程中是觀察不到的,但具體相關(guān)機制該學(xué)者并未闡釋。
單增李斯特菌抵抗熱脅迫應(yīng)激的能力來自其細(xì)胞膜固有的穩(wěn)定性和其內(nèi)部大分子(如酶、蛋白、DNA等)。當(dāng)單增李斯特菌暴露于高于45 ℃的環(huán)境中時,其會迅速作出熱應(yīng)激反應(yīng),誘導(dǎo)相關(guān)基因表達(dá),大量合成一組高度保守的蛋白質(zhì),稱為熱休克蛋白(heat shock proteins,HSPs)[17]。大多數(shù)HSPs為分子伴侶和蛋白酶。HSPs是單增李斯特菌抵抗熱脅迫應(yīng)激所必需的,目前單增李斯特菌中已鑒定的HSPs包括DnaK、DnaJ、GroES、GroEL、HtrA和Clp,分別由基因dnak、dnaJ、groES、groEL、htrA和clp編碼。其中DnaK、DnaJ、GroES和GroEL屬于分子伴侶,修復(fù)和復(fù)性應(yīng)激條件下發(fā)生損傷的蛋白、防止蛋白聚集和錯誤折疊等;而HtrA和Clp屬于蛋白酶,主要功能是降解變性蛋白等[2]。表1總結(jié)了最近熱脅迫下HSPs在單增李斯特菌中表達(dá)的研究進(jìn)展。
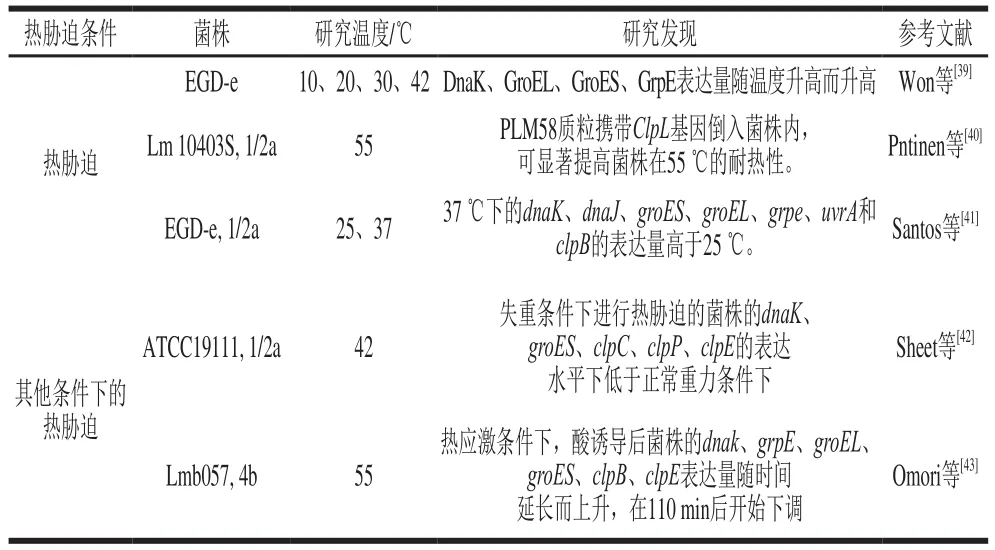
表1 熱脅迫下HSPs在單增李斯特菌中的表達(dá)Table 1 Expression of HSPs in Listeria monocytogenes under heat stress
菌株處于熱脅迫狀態(tài)時會大量合成HSPs,但HSPs并不會一直維持高表達(dá)水平,在適應(yīng)熱脅迫一段時間后HSPs表達(dá)量會降低,這可能是因為HSPs對熱脅迫損傷的蛋白進(jìn)行了修復(fù)和降解[43]。HSPs是單增李斯特菌抵抗熱脅迫應(yīng)激所必需的,但不同的HSPs對菌株抵抗熱脅迫應(yīng)激的貢獻(xiàn)程度因菌株類型不同等原因有所差異。Omori等[43]發(fā)現(xiàn)不同類型的單增李斯特菌在同樣熱脅迫條件下,DnaK、DnaJ及Clp等表達(dá)差異較大,差異的原因可能是菌株類型不同。除此之外,很多學(xué)者對于HSPs的調(diào)控方面做了很多研究。dnaK、dnaJ、groES和groEL屬于DNA操縱子,其表達(dá)受陰遏蛋白HrcA的影響,而HrcA/CIRCE是熱休克陰遏系統(tǒng)之一,故有學(xué)者推測單增李斯特菌中DnaK、DnaJ、GroES和GroEL的表達(dá)可能受HrcA/CIRCE系統(tǒng)調(diào)控[2,44-45]。最近的一項研究中,Sheet等[42]發(fā)現(xiàn)單增李斯特菌在處于熱脅迫條件下時,其菌體內(nèi)dnak、groES、clpC、clpP和clpE表達(dá)水平下調(diào)的同時SigB表達(dá)水平也有所下調(diào),因此該學(xué)者認(rèn)為DnaK、GroES以及Clp的表達(dá)受SigB調(diào)控。現(xiàn)有研究顯示不同的HSPs的調(diào)控有所不同,同一HSPs的調(diào)控也有所差異,關(guān)于單增李斯特菌的熱脅迫應(yīng)激機制以及HSPs的調(diào)控機制還尚未有明確的定論,對上述機制還需要進(jìn)一步的研究探索。
3 冷脅迫
冷藏是延長食品貨架期最常用的手段,單增李斯特菌可耐受低溫,在冷藏條件下仍可存活繁殖,這也是食品中,特別是肉類和海鮮中頻繁檢出單增李斯特菌的原因。低溫會導(dǎo)致單增李斯特菌代謝速率降低、膜彈性降低、蛋白質(zhì)和酶活性降低甚至蛋白質(zhì)出現(xiàn)損傷等[46]。有研究表明蘋果在1、4、10 ℃下貯存12 周后,單增李斯特菌活細(xì)胞數(shù)會下降0.5~1.5(lg(CFU/個)),這表明低溫會影響單增李斯特菌的存活[47]。因此,為了自身生存,單增李斯特菌必須調(diào)節(jié)自身的基因表達(dá)來應(yīng)對低溫帶來的危害。而低溫對于單增李斯特菌的存活也并不全是有害的。當(dāng)單增李斯特菌在相對較低溫度下生長一段時間后,其抵抗冷脅迫應(yīng)激的能力也會大大增強。最近一項研究報道便驗證了該結(jié)論,報道稱處于冷脅迫條下的單增李斯特菌,其抵抗冷脅迫的能力的增強,易形成超級耐冷菌株[48]。
單增李斯特菌冷脅迫應(yīng)激機制主要與冷休克蛋白(cold shock proteins,CSPs)有關(guān)。CSPs是一種高度保守的蛋白質(zhì),長約65~70 個氨基酸,其在DNA和RNA的復(fù)制、轉(zhuǎn)錄和翻譯過程以及穩(wěn)定核酸構(gòu)象防止核酸降解等方面起重要作用[17,43]。單增李斯特菌中有3 個CSPs(CspA、CspB和CspD)對抵抗冷脅迫至關(guān)重要,除此之外,還有一些其他蛋白以及細(xì)胞脂肪酸也與單增李斯特菌冷脅迫應(yīng)激機制有關(guān)(表2)。
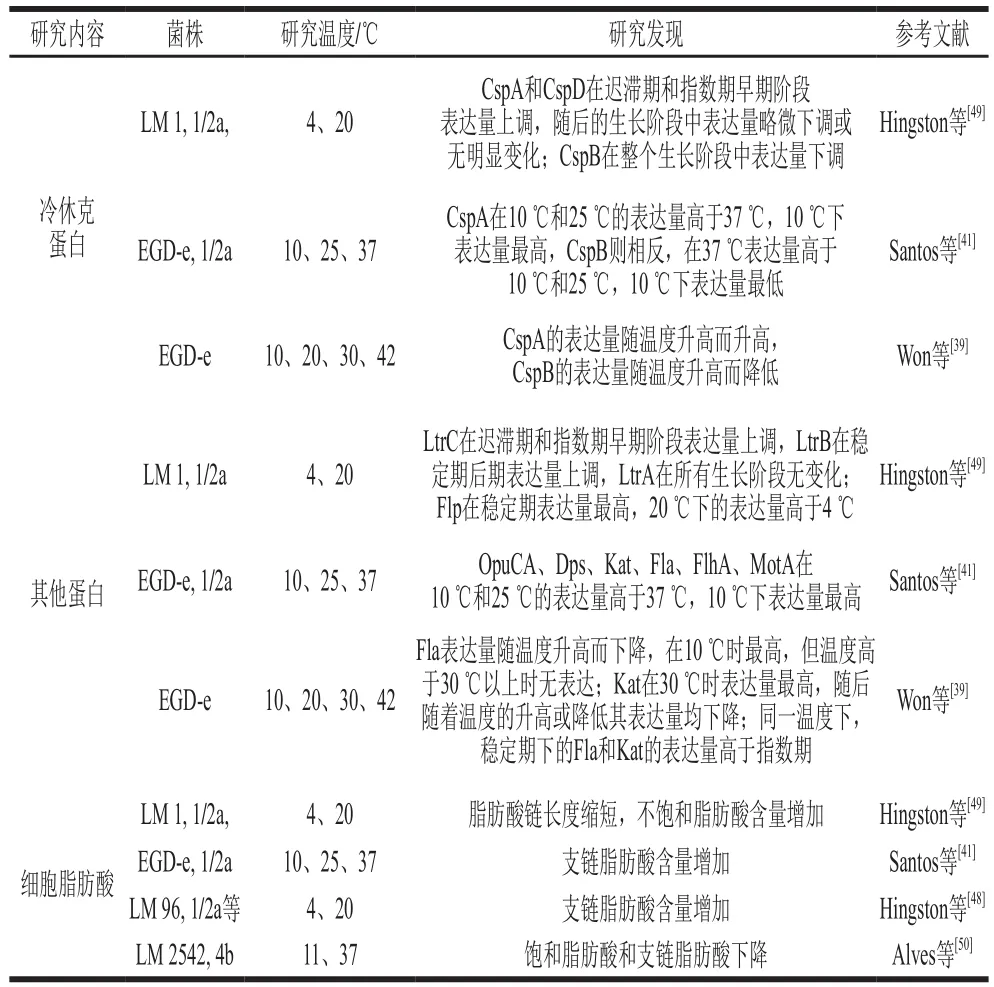
表2 冷脅迫下單增李斯特菌的蛋白和細(xì)胞脂肪酸的變化情況Table 2 Changes in Listeria monocytogenes protein and cellular fatty acids under cold stress
單增李斯特菌在冷脅迫條件下時,菌體內(nèi)CSPs、細(xì)胞脂肪酸以及其他蛋白都會做出相應(yīng)的調(diào)整反應(yīng)。CSPs表達(dá)大致有如下規(guī)律:同一冷脅迫溫度下,CspA和CspD在整個生長階段中先上調(diào),然后到穩(wěn)定期時居于平穩(wěn)或略有下調(diào),而CspB在整個生長階段呈下調(diào)趨勢;同一生長階段下,在溫度相對較低的情況下CspA和CspD表達(dá)量高,CspB表達(dá)量低。冷脅迫條件下單增李斯特菌中細(xì)胞膜變化主要是脂肪酸鏈長度縮短,不飽和脂肪酸和支鏈脂肪酸含量增加,產(chǎn)生變化是為了使細(xì)胞膜流動性增強以更好地抵抗冷脅迫。然而也有學(xué)者發(fā)現(xiàn)冷脅迫條件下支鏈脂肪酸含量減少[50],這與大多數(shù)研究結(jié)果相反,其中原因該學(xué)者并未探究,故在進(jìn)一步的研究中需側(cè)重于菌株脂質(zhì)代謝方面,以期更好了解冷脅迫條件下的細(xì)胞脂肪酸情況,為研究冷脅迫反應(yīng)機制奠定基礎(chǔ)。
冷脅迫條件下的其他蛋白表達(dá)情況也有很多學(xué)者進(jìn)行了研究(表2)。Flp經(jīng)常在冷脅迫研究中被討論,單增李斯特菌在低溫條件下培養(yǎng)到穩(wěn)定期時會誘導(dǎo)flp基因表達(dá)產(chǎn)生Flp[51],這解釋了Hingston等[49]發(fā)現(xiàn)的Flp在穩(wěn)定期表達(dá)量最高的現(xiàn)象。Flp參與冷脅迫應(yīng)激機制可能與低溫下細(xì)胞內(nèi)鐵的合成有關(guān)[51]。鞭毛蛋白如Fla、FlhA和MotA等也經(jīng)常在冷脅迫研究中被討論,鞭毛蛋白表達(dá)量升高與冷脅迫下菌株的運動性變化有關(guān)。OpuCA是肉堿的主要轉(zhuǎn)運體,其在冷脅迫中的作用是吸收肉堿等低溫保護(hù)物質(zhì)到菌體內(nèi)以保護(hù)細(xì)菌在冷脅迫條件下的生長。除此之外,LtrA、LtrB、LtrC也被確定為低溫下生長所必需的蛋白[52],然而關(guān)于這3 種蛋白尤其是LtrC的報道結(jié)果各有不同,有學(xué)者報道稱低溫下LtrC的表達(dá)水平高于37 ℃,而Hingston等[49]發(fā)現(xiàn)較低溫度下LtrC的表達(dá)水平反而較低。盡管產(chǎn)生上述兩種結(jié)果差異的原因尚未可知,但LtrA、LtrB、LtrC在冷脅迫條件下的表達(dá)現(xiàn)已被證實與SigB調(diào)控有關(guān)[49,53]。
4 干燥及高滲透壓脅迫
干燥也是食品加工中常用的延長貨架期方法之一。干燥通過引起菌體內(nèi)蛋白質(zhì)變性和鹽類等物質(zhì)濃度提高來抑制細(xì)菌生長繁殖。滲透壓脅迫通常由向食品中添加鹽或糖造成,這也是食品常用貯藏手段之一。干燥和滲透壓都涉及到降低微生物的水分活度。和眾多微生物一樣,單增李斯特菌生長繁殖需要適宜的水分活度,當(dāng)水分活度降到不適宜生長但又未達(dá)到致死水平時,其會產(chǎn)生應(yīng)激反應(yīng)來保證自身的存活[2,17]。
單增李斯特菌應(yīng)對低水分活度的環(huán)境主要依靠相容性溶質(zhì),如肉堿、脯氨酸、甘氨酸甜菜堿等,相容性溶質(zhì)在胞漿中具有穩(wěn)定酶結(jié)構(gòu)、維持細(xì)胞內(nèi)外滲透壓平衡等作用。BetL、Gbu和OpuC構(gòu)成的轉(zhuǎn)運系統(tǒng)將相容性溶質(zhì)攝入到細(xì)胞內(nèi)。此外,CSPs、鞭毛蛋白等也參與抵抗干燥和滲透壓脅迫[17,53-55]。表3總結(jié)了最近干燥及高滲透壓脅迫下單增李斯特菌的蛋白表達(dá)的研究情況。
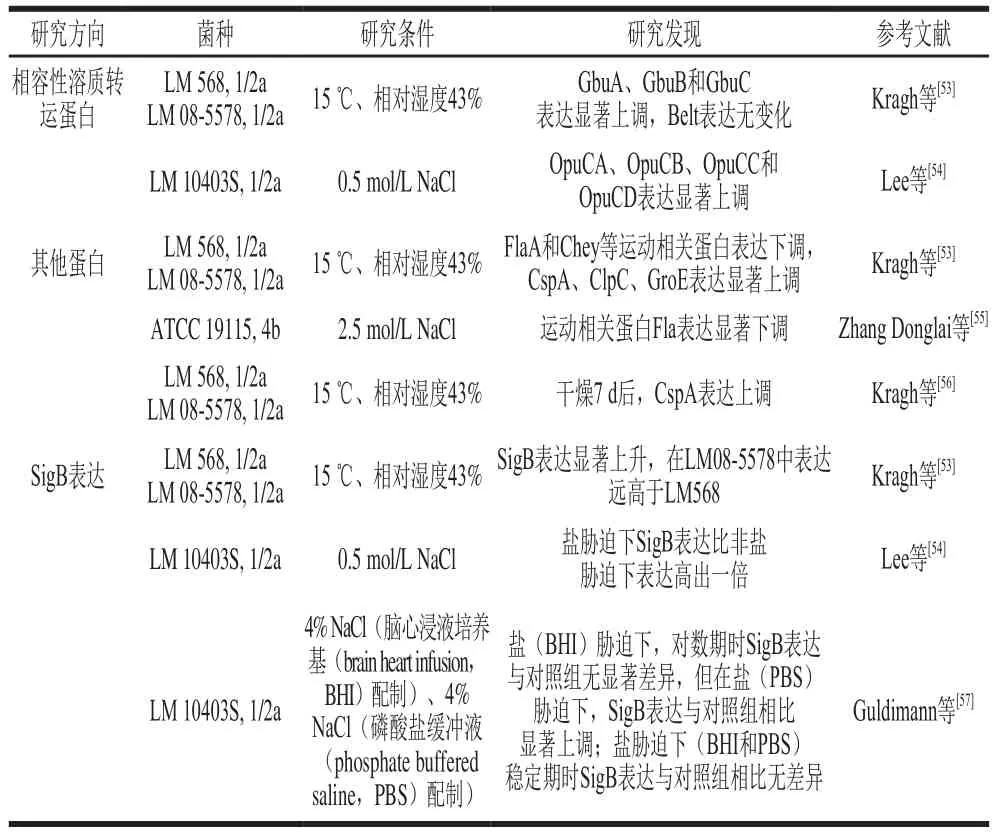
表3 干燥及高滲透壓脅迫下單增李斯特菌的蛋白表達(dá)情況Table 3 Protein expression in Listeria monocytogenes under dryness and osmotic stress
干燥或高滲透壓脅迫下,相容性溶質(zhì)轉(zhuǎn)運蛋白表達(dá)會上調(diào)從而吸收相容性溶質(zhì)到細(xì)胞內(nèi)。然而有學(xué)者發(fā)現(xiàn)BetL在干燥條件下表達(dá)未有顯著變化[53],這是因為BetL轉(zhuǎn)運蛋白與Na+的含量有關(guān),其主要在鹽導(dǎo)致的高滲透壓脅迫中起作用[58]。除了相容性溶質(zhì)外,其他蛋白也參與干燥和高滲透壓脅迫應(yīng)激機制。干燥或高滲透壓脅迫極易導(dǎo)致DNA損傷,而CSPs被證實有助于損傷DNA修復(fù),故在干燥或高滲透壓脅迫下CSPs的表達(dá)也顯著上調(diào)。有學(xué)者報道稱當(dāng)面臨干燥等環(huán)境脅迫時,單增李斯特菌運動相關(guān)基因表達(dá)減少將會導(dǎo)致存活率提高[59],這解釋了Kragh[53]和Zhang Donglai[55]等的研究中發(fā)現(xiàn)運動蛋白表達(dá)下調(diào)的現(xiàn)象。
SigB調(diào)控因子在單增李斯特菌中參與多種脅迫應(yīng)激調(diào)控,在干燥和高滲透壓脅迫下起關(guān)鍵作用。在干燥和高滲透壓脅迫下,SigB表達(dá)上調(diào),參與opuCABCD操縱子、ClpC以及GroE等與干燥和滲透壓脅迫有關(guān)基因和蛋白的調(diào)控[53-54]。此外,同一脅迫條件下,SigB在不同菌株或不同培養(yǎng)基上的表達(dá)也不同[53,57],這可能與SigB表達(dá)的隨機性有關(guān),此前就有學(xué)者發(fā)現(xiàn)SigB在單增李斯特菌中的表達(dá)并不是由確定性的通路誘導(dǎo),而是由多種通路在細(xì)胞中同時“開啟”或“關(guān)閉”SigB表達(dá),這導(dǎo)致SigB的表達(dá)具有隨機性[60]。
5 交叉保護(hù)
越來越多的研究表明單增李斯特菌處于某一環(huán)境脅迫下時,不僅會導(dǎo)致抵抗本環(huán)境脅迫能力增強,也會導(dǎo)致其他環(huán)境脅迫抵抗能力增強,比如經(jīng)亞致死酸性條件處理的單增李斯特菌,其抵抗熱脅迫、高滲透壓脅迫、乙醇脅迫以及氧化應(yīng)激等能力顯著增強,這一現(xiàn)象稱為交叉保護(hù)[17]。
交叉保護(hù)嚴(yán)重危害食品安全,最近一項研究中,有學(xué)者先將單增李斯特菌用10% NaCl脅迫處理24 h,然后將其接種于pH值為4.17左右的奶酪中,結(jié)果顯示隨著時間的延長,菌量有所下降,但與未經(jīng)鹽脅迫菌組相比,經(jīng)鹽脅迫菌組的下降趨勢與幅度遠(yuǎn)低于未經(jīng)鹽脅迫菌組。上述結(jié)果表明單增李斯特菌經(jīng)鹽脅迫后可產(chǎn)生交叉保護(hù),提高其抵抗酸的能力[61]。
交叉保護(hù)因誘導(dǎo)脅迫環(huán)境的不同,其機制也有所不同。眾多學(xué)者發(fā)現(xiàn)在研究單增李斯特菌在某一環(huán)境脅迫應(yīng)激時,主管其他環(huán)境脅迫的蛋白和基因的表達(dá)也有顯著變化,如Kragh等[53]在研究高滲透壓脅迫時,發(fā)現(xiàn)在冷脅迫應(yīng)激中發(fā)揮主要作用的CspA表達(dá)發(fā)生顯著變化。除了這些參與多種脅迫應(yīng)激的蛋白外,SigB的調(diào)控也是產(chǎn)生交叉保護(hù)現(xiàn)象的一個重要原因,SigB是環(huán)境脅迫應(yīng)激的主要調(diào)控因子,盡管不同的環(huán)境脅迫下其表達(dá)程度不同,但其調(diào)控多種環(huán)境脅迫蛋白,SigB表達(dá)量的變化直接影響著其調(diào)控蛋白的表達(dá)[62]。目前關(guān)于單增李斯特菌中交叉保護(hù)的研究還相對較少,但其危害卻非常大,尤其是經(jīng)過某一環(huán)境脅迫后會增強其抵抗胃酸的能力,這給人們的健康帶來極大隱患。因此在進(jìn)一步的研究中我們需要加強交叉保護(hù)這一方向的研究,這對于食品安全和人類健康具有重要意義。
6 結(jié) 語
單增李斯特菌在食品加工過程中極易受到環(huán)境脅迫影響,如果脅迫條件并不能完全致死,反而會使其抵抗環(huán)境脅迫的能力大大增強。因此,了解單增李斯特菌在環(huán)境脅迫下的機制可以幫助工廠在食品加工過程中避免污染,同時也有助于制定更加安全衛(wèi)生的食品安全措施。然而目前關(guān)于單增李斯特菌環(huán)境脅迫應(yīng)激的具體機制尚未完全明確,仍需進(jìn)一步的研究探索。目前的研究中還存在以下問題:1)不同環(huán)境應(yīng)激機制調(diào)控因子不同,有的甚至一個應(yīng)激系統(tǒng)涉及多個調(diào)控因子,目前對單增李斯特菌脅迫機制的調(diào)控因子方面了解甚少,需要進(jìn)一步深入研究。2)在食品加工過程中,單增李斯特菌往往并不是只受到某單一環(huán)境脅迫,而是受多種環(huán)境脅迫,目前關(guān)于單增李斯特菌復(fù)合應(yīng)激尤其是復(fù)合應(yīng)激的蛋白組學(xué)、基因芯片全基因組表達(dá)譜等研究還較少,在這方面還需要進(jìn)一步研究。3)從食品原料到餐桌的過程中,單增李斯特菌有時候要先后經(jīng)歷多種脅迫,比如牛肉在屠宰加工往往要先經(jīng)歷酸脅迫,再經(jīng)歷冷脅迫或其他脅迫。而脅迫順序的不同產(chǎn)生的交叉保護(hù),其抵抗環(huán)境脅迫能力尤其是抵抗胃酸的能力是否會比經(jīng)歷單一環(huán)境脅迫后要強?目前在單增李斯特菌中關(guān)于這方面的研究還比較少。

