本拉珠單抗治療重癥嗜酸粒細胞型哮喘的系統評價①
羅海燕 劉沙 江兵(重慶醫科大學附屬永川醫院呼吸內科,重慶402160)
支氣管哮喘的特征是慢性氣道炎癥,這導致了 氣道高反應的發生和發展。患者通常出現喘息、胸悶、咳嗽等反復發作,多數可以通過藥物控制,近年來全世界哮喘患病率呈逐年上升的趨勢[1]。其中,使用ICS(糖皮質激素)和LABA(長效β2受體激動劑)兩種及以上的控制藥物,規范治療至少半年仍未達到良好控制的哮喘被稱為難治性哮喘,約占支氣管哮喘患者的5%~10%,其急診就醫率和住院率均高于輕、中度哮喘患者,分別為前兩者的15倍和20倍,是造成哮喘治療費用增加的重要原因[2]。哮喘發作期的嚴重程度與嗜酸性粒細胞水平有關,重癥哮喘患者中約50%吸入高劑量糖皮質激素后,嗜酸性粒細胞增多及癥狀急性加重仍持續存在,而IL-5能夠調節嗜酸性粒細胞的分化、成熟、遷移、黏附、滲出等過程,為嗜酸性粒細胞從骨髓向肺的轉移提供重要信號,因此嗜酸性炎癥的發展完全依賴于IL-5的生物活性[3-5]。因此抗IL-5單克隆抗體在重癥嗜酸粒細胞型哮喘患者中的使用將成為此類患者的新希望,國內應用尚不普遍。本拉珠單抗是一種作用于IL-5受體α亞基的人源化IgG1單克隆抗體,2017年11月在美國批準用于年齡≥12歲的嚴重嗜酸粒細胞型哮喘患者的維持治療[6]。因此,本研究采取Meta分析,通過定量系統評價,對相關文獻進行了系統回顧,對本拉珠單抗作為重癥嗜酸粒細胞型哮喘患者的輔助治療的有效性、安全性進行評價。
1 資料與方法
1.1 資料
1.1.1 研究設計公開發表的中英文隨機對照試驗,報道的結局指標至少與一個本研究納入的主要或次要結果指標有關。①納入標準:年齡≥12歲,明確診斷為哮喘,吸入中到大劑量ICS及LABA仍未控制的嗜酸粒細胞型哮喘患者[7]。②干預措施:實驗組:本拉珠單抗。對照組:安慰劑或空白對照。常規的哮喘治療在兩組間保持一致。③結局指標:哮喘年急性發作率,第一秒用力呼氣容積(FEV1),ACQ-6哮喘控制問卷評分,AQLQ哮喘生活質量問卷評分,不良反應,嚴重不良反應等。
1.1.2 排除標準①重復發表的研究,選擇最全面、隨訪時間最長的;②結局指標不一致的;③非中英文文獻;④改良Jadad評分在4分以下的;⑤并發COPD、肺結核、肺癌等其他肺部疾病,使用全身免疫抑制劑、免疫調節劑等生物制劑。
1.2 方法
1.2.1 檢索策略計算機檢索PubMed、Embase、The Cochrane圖書館、中國知網、維普和萬方,檢索建庫至2020年3月的全部文獻。檢索策略:Pubmed為 例:(“Benralizumab”OR“monoclonal antibody”OR“anti-IL-5 receptor”)AND(asthma OR“eosino‐philic asthma”)AND trial,邏輯詞采用AND、OR。
1.2.2 文獻質量評價文獻質量評價使用Cochrane系統評價手冊中推薦的工具,對文獻偏倚風險進行評估,具體見表1。2位研究員獨立地對每篇納入文獻作出判斷,差異由第三方解決。
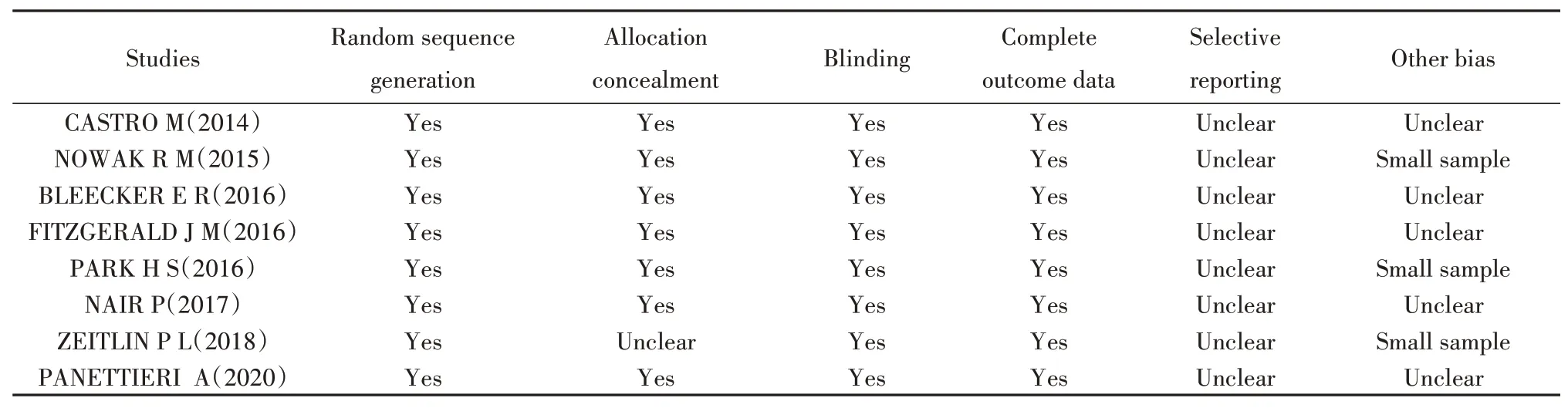
表1 納入文獻的偏倚風險評估結果Tab.1 Methodological quality evaluation results of included studies
1.2.3 資料和數據提取由2位研究者獨立進行,差異由第三方解決。具體內容見表2。
1.3 統計學分析統計分析軟件采用RevMan5.3,其中二分類變量用比值比(OR)作為療效分析統計量,連續變量如果采用的是相同的測量指標則計算均數差(MD),各效應量均使用95%置信區間(CI)來表示。采用Q檢驗計算I2值檢驗各研究結果之間的異質性,若P>0.1,I2<50%,則Meta分析用固定效應模型;若P<0.1,I2>50%,則分析其異質性來源,對可能帶來異質性的因素進行亞組分析,并通過敏感性分析逐篇分析可能帶來的異質性,若臨床上沒有異質性或差異無統計學意義,則Meta分析用隨機效應模型;當兩組間異質性過大或無法找到異質性來源時,則用描述性分析。使用漏斗圖及STATA 15.1軟件中的Egger's、Begg's檢驗進行發表偏倚檢驗。
2 結果
2.1 文獻檢索結果通過計算機檢索方式一共檢索到421篇英文文獻,92篇中文文獻,篩選后納入8篇[8-15]RCTs,具體見圖1。納入文獻均為英文,試驗設計均為吸入中到大劑量ICS和LABA仍未能控制的重癥嗜酸粒細胞型哮喘患者[2],附加本拉珠單抗治療與安慰劑做對照。
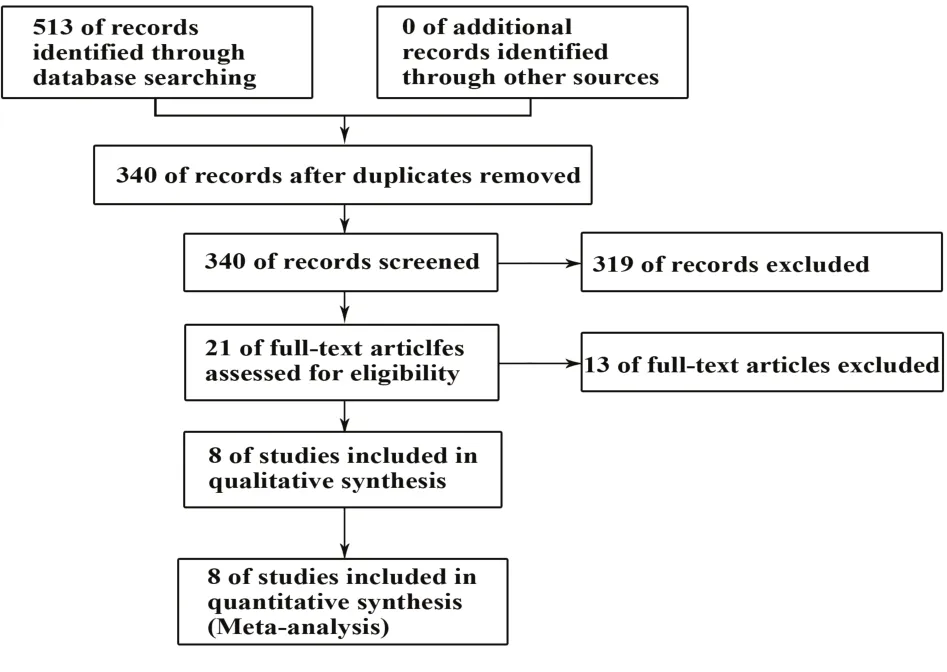
圖1 文獻檢索流程及結果Fig.1 Literature retrieval process and results
2.2 納入研究的基本特征與偏倚風險評價各文獻偏倚風險評估結果見表1,基本特征見表2。
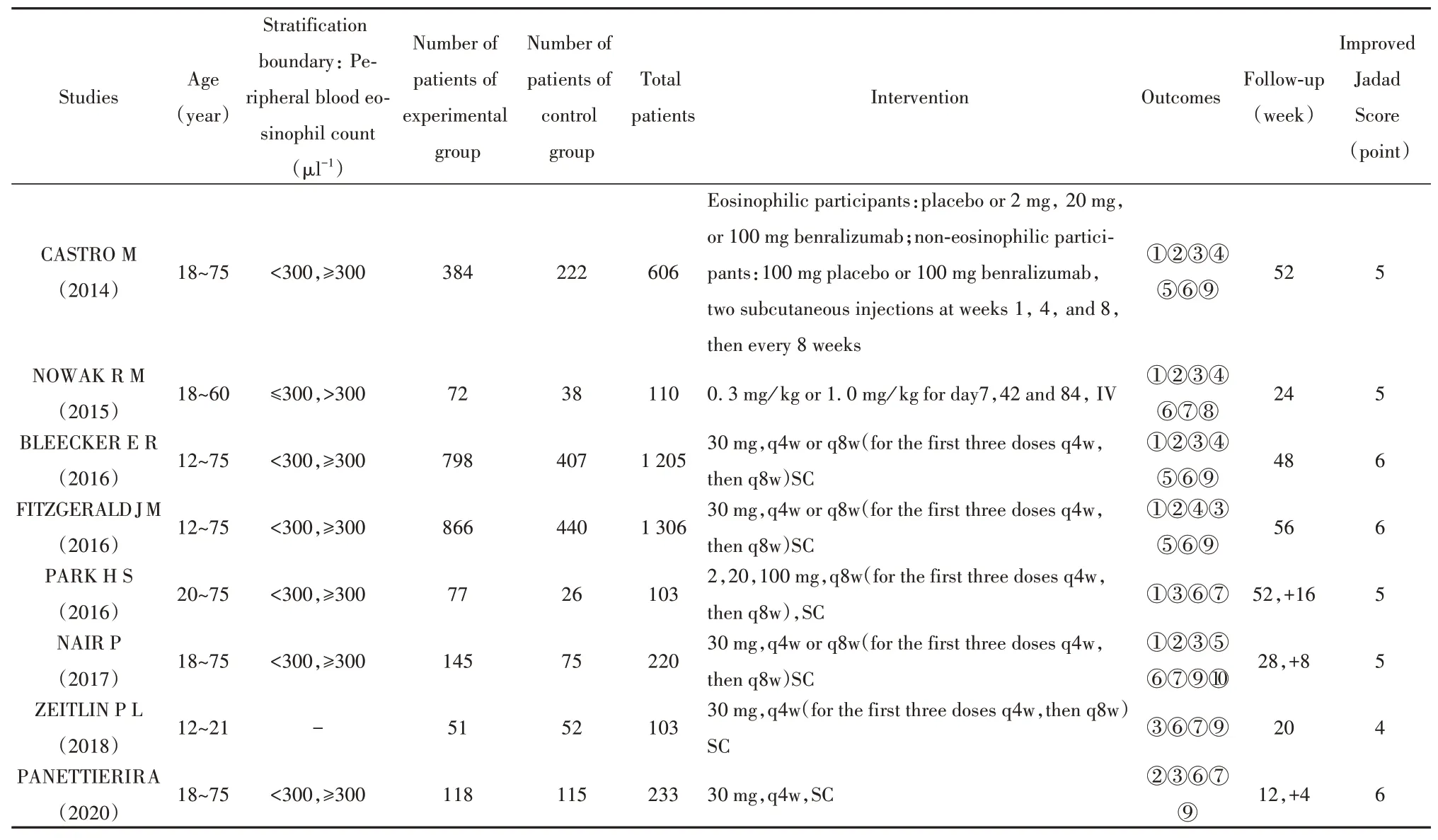
表2 納入文獻基本特征Tab.2 Basic features of included studies
2.3 Meta分析結果
2.3.1 哮喘年急性發作率共有6篇研究報道了哮喘年急性發作率,由于各研究結果間有統計學異質性(I2=59%,P=0.02),逐篇剔除分析得到的結果仍有統計學異質性,所以Meta分析用隨機效應模型[8-13]。結果表明,在哮喘年急性發作率減少方面,本拉珠單抗組優于安慰劑治療組,兩組間差異有統計學意義[OR=0.54,95%CI(0.40,0.73),P<0.000 1],見圖2。
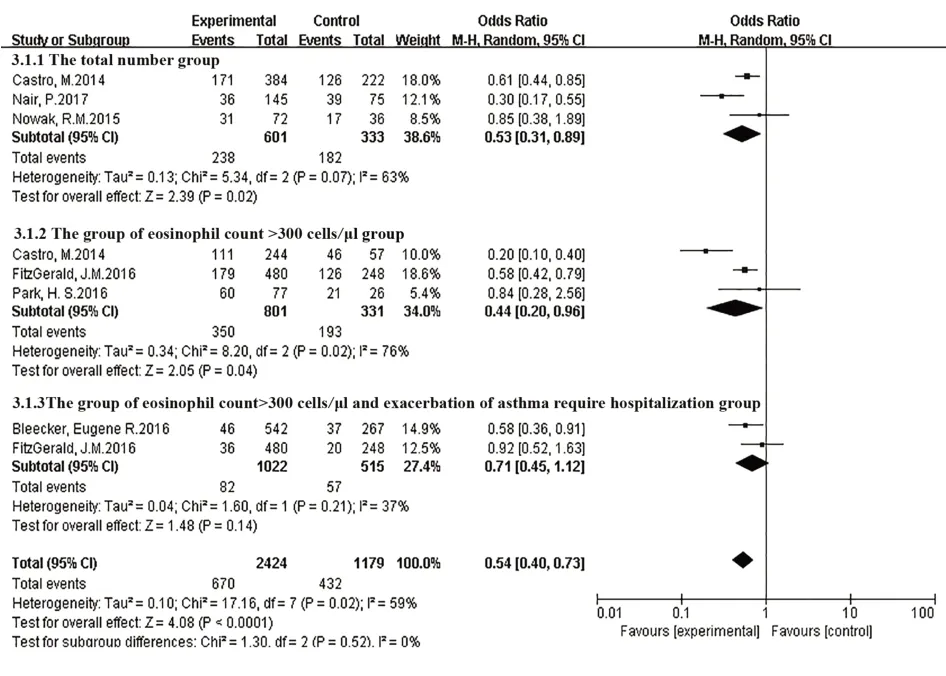
圖2 哮喘年急性發作率Fig.2 Asthma annual exacerbation rate
2.3.2 FEV1峰值較基線變化共有6篇研究[8-11,13,15]報道了FEV1峰值較基線的變化,由于各研究結果間無統計學異質性(I2=14%,P=0.32),所以Meta分析用固定效應模型。結果表明,在FEV1峰值較基線增加方面,本拉珠單抗組優于安慰劑治療組,兩組間差異有統計學意義[MD=0.15,95%CI(0.10,0.19),P<0.000 01],見圖3。
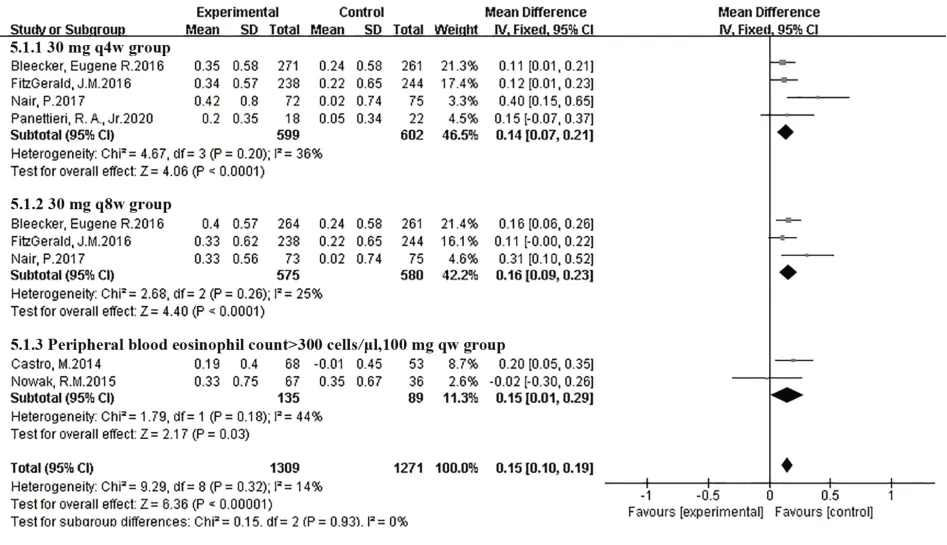
圖3 FEV1峰值較基線變化Fig.3 Peak value of FEV1 varies from baseline
2.3.3 ACQ-6評分8篇研究[8-15]報道了ACQ-6評分變化,各研究結果間無統計學異質性(I2=17%,P=0.27),故采用固定效應模型進行Meta分析。結果表明,在ACQ-6評分較基線減少方面,本拉珠單抗組優于安慰劑治療組,兩組間差異有統計學意義[MD=-0.22,95%CI(-0.29,-0.15),P<0.000 01],見圖4。
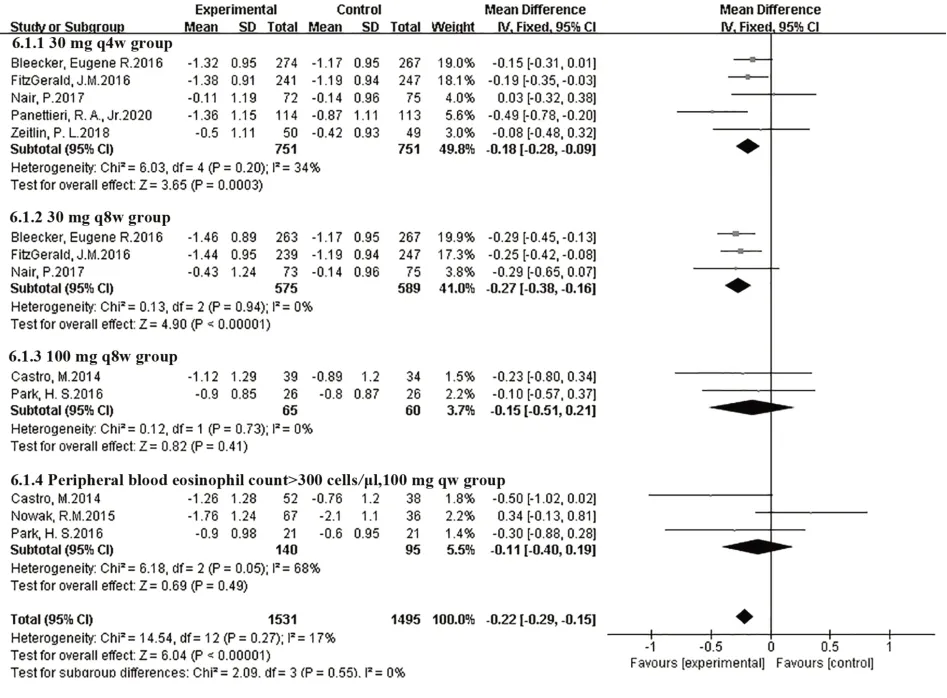
圖4 ACQ-6較基線變化Fig.4 ACQ-6 scores change from baseline
2.3.4 AQLQ評分共有4篇研究[8-11]報道了AQLQ評分變化,各研究結果間無統計學異質性(I2=0,P=0.84),故采用固定效應模型進行Meta分析。結果表明,在AQLQ評分較基線增加方面,本拉珠單抗組優于安慰劑治療組,兩組間差異有統計學意義[MD=0.22,95%CI(0.13,0.30),P<0.000 01],見圖5。
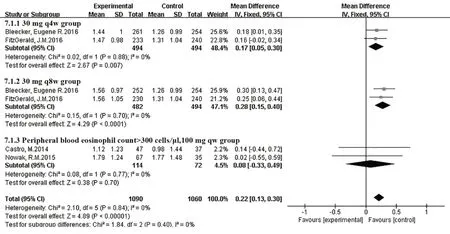
圖5 AQLQ較基線變化Fig.5 AQLQ scores change from baseline
2.3.5 不良反應7篇研究[8,10-15]報道了不良反應,各研究結果間無統計學異質性(I2=36%,P=0.15),故采用固定效應模型進行Meta分析。結果表明,在不良反應方面,本拉珠單抗組與安慰劑組類似,兩組間差異無統計學意義[OR=0.88,95%CI(0.76,1.03),P=0.12],見圖6。
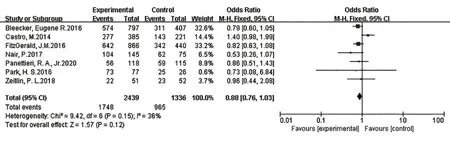
圖6 不良反應Fig.6 Adverse events
2.3.6 嚴重不良反應共有6篇研究[8,10-11,13-15]報道了嚴重不良反應,各研究結果間無統計學異質性(I2=29%,P=0.22),故采用固定效應模型進行Meta分析。結果表明,在嚴重不良反應發生率方面,本拉珠單抗組優于安慰劑組,兩組間差異有統計學意義[OR=0.76,95%CI(0.61,0.94),P=0.01],見圖7。本研究還特別評價了納入文獻中具體的嚴重不良反應發生率,包括哮喘加重{[OR=0.54,95%CI(0.41,0.68),P<0.000 01],見圖8}、蕁麻瘆{[OR=1.64,95%CI(0.53,5.07),P=0.39],見圖9}、超敏反應{[OR=0.95,95%CI(0.26,3.50),P=0.94],見圖10}
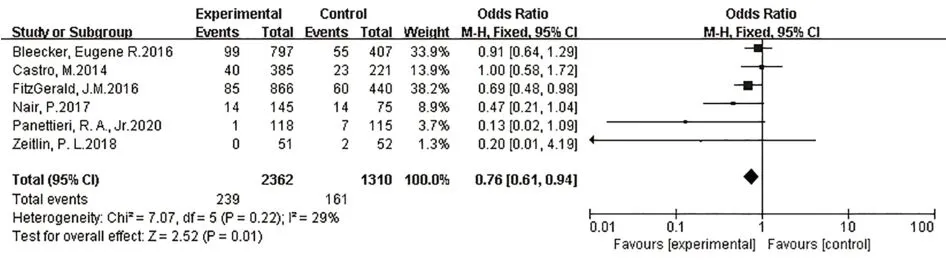
圖7 嚴重不良反應Fig.7 Serious adverse events
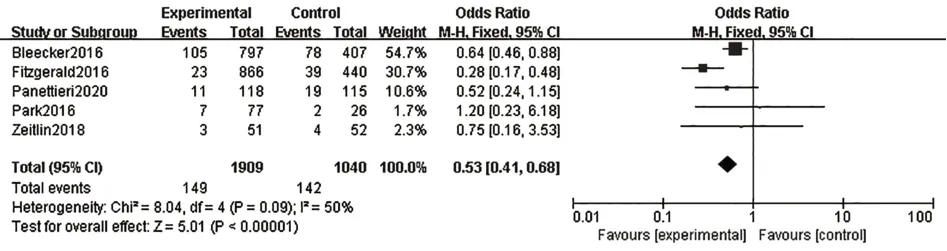
圖8 哮喘加重發生率Fig.8 Exacerbation incidence of asthma
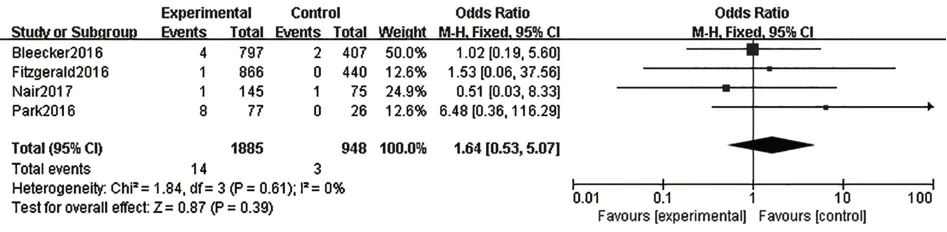
圖9 蕁麻疹發生率Fig.9 Incidence of urticaria
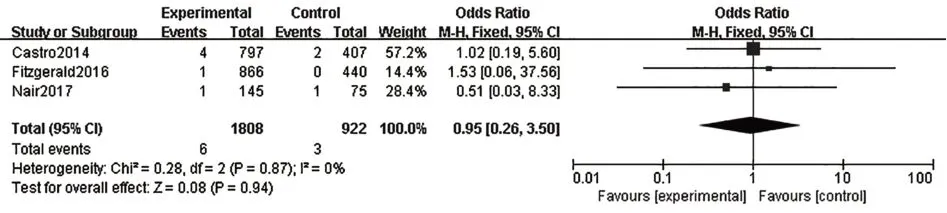
圖10 超敏反應發生率Fig.10 Incidence of hypersensitivity reactions
2.3.7 發表偏倚和敏感性分析本拉珠單抗與安慰劑治療重癥哮喘對不良反應發生率比較的漏斗圖左右對稱,見圖11,Egger's(P=0.187)和Begg's(P=0.553),見圖12,其余終點對應Egger's及Begg's檢驗P值均小于0.05,檢測結果提示無明顯發表偏倚。對每個終點依次刪除單個研究進行敏感性分析,評估本拉珠單抗有效性及安全性結果的穩定性。結果提示,依次刪除單個研究后,各終點對應P值無明顯改變,因此認為本系統評價分析結果穩定可靠。哮喘年急性發作率敏感性分析結果見表3。其余終點對應Egger's及Begg's檢驗結果和圖片、其余終點敏感性分析結果見網絡版附圖1~5(http://www.immune99.com)。
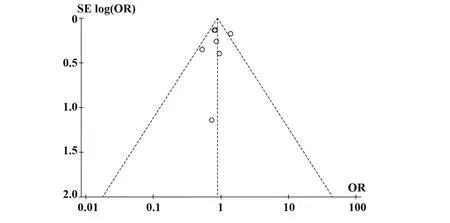
圖11 漏斗圖Fig.11 Funnel plot
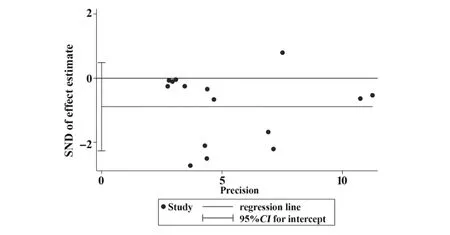
圖12 Egger's檢驗Fig.12 Egger's test
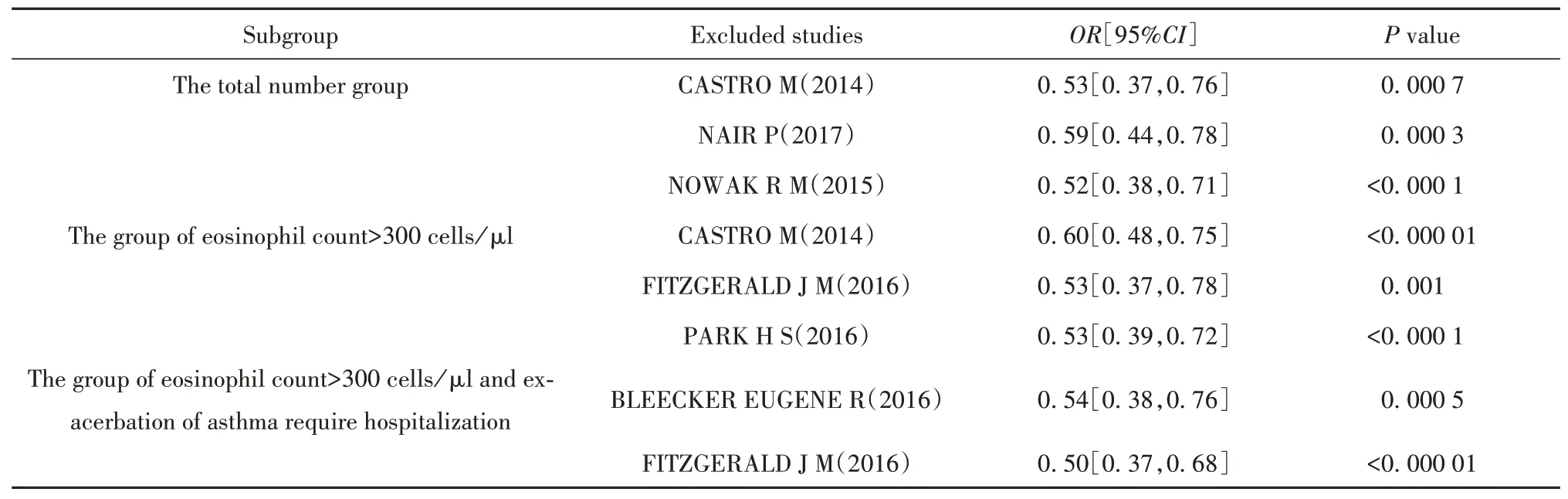
表3 哮喘年急性發作率敏感性分析Tab.3 Sensitivity analysis of annual exacerbation rate
3 討論
支氣管哮喘是多種細胞及細胞因子介導的慢性氣道炎癥為特征的疾病,這導致了氣道高反應的發生和發展,目前糖皮質激素仍是治療本病的基石[16]。支氣管哮喘為異質性疾病按氣道炎癥細胞可為3種表型,嗜酸性粒細胞性哮喘,中性粒細胞性哮喘及寡細胞性哮喘,3個分型對激素治療反應不同,在精準醫學時代,為有效治療各種類型的支氣管哮喘,已開發出針對細胞因子靶點的靶向治療藥物[17]。嚴重變應性哮喘和嚴重嗜酸性粒細胞性哮喘是目前能有效進行靶向生物治療的兩種明確的表型,分別是抗IgE抗體和抗IL-5抗體,針對IgE靶點的奧馬珠單抗已較早用于臨床,對于嚴重嗜酸性粒細胞性哮喘患者,部分患者經過規范的糖皮質激素治療后仍控制不佳[18-20]。研究認為嗜酸性粒細胞是肺部炎癥反應的主要細胞,嗜酸性粒細胞引起的持續性炎癥可導致氣道的持續損傷,損傷修復則導致平滑肌肥大、杯狀細胞增生、細胞外基質蛋白沉積,引起膜增厚和纖維化,從而導致氣道的重塑和高反應性[21],同時白三烯在嗜酸性粒細胞內大量存在,它們的釋放會引起支氣管收縮,激活肥大細胞和嗜堿性粒細胞,這些細胞也會分泌前列腺素、組胺和更多的白三烯使炎癥持續[22],控制氣道中的嗜酸性粒細胞數量是治療的著眼點。IL-5是影響嗜酸性粒細胞分化、生長、活化、存活和氣道聚集的最重要的生物學因子,該細胞因子在嗜酸粒細胞性哮喘的發病機制中發揮關鍵作用[5]。IL-5代表了一個關鍵的致病因子和一個非常有價值的附加生物治療靶點,可用于激抵抗素、難以控制的嗜酸性粒細胞表型哮喘的治療[23]。本拉珠單抗是一個人源化的抗IL-5受體α亞基單克隆抗體,與抗IL-5單克隆抗體相比,本拉珠單抗增強抗體依賴細胞介導的細胞毒性作用,進一步通過自然殺傷細胞,直接、快速、幾乎完全地清除血嗜酸性粒細胞[24],IL-5受體不僅表達在嗜酸細胞上,也表達在嗜酸性粒細胞的祖細胞和嗜堿細胞上,一項評估本拉珠單抗對骨髓、外周血、痰和氣道等不同腔室嗜酸性粒細胞影響的研究表明,骨髓和外周血嗜酸細胞被完全抑制,氣道嗜酸細胞(組織和痰)也被廣泛耗竭[25],在針對嚴重嗜酸性粒細胞性哮喘Ⅲ期臨床試驗中取得陽性結果,2017年上市后對本藥物的進一步研究仍有隨機對照試驗結果發表,現全球已有多項關于本拉珠單抗附加治療重癥嗜酸粒細胞型哮喘的多中心隨機對照試驗發表,國內目前無相關研究結果發表,這些研究主要終點是研究ICS+LABA仍不能控制的嚴重嗜酸粒細胞型哮喘患者附加治療的療效和安全性,本研究納入近年發表的8項關于本拉珠單抗治療重癥嗜酸粒細胞型哮喘患者的隨機對照試驗結果,共3 946例,所有研究均有明確的納入與排除標準,通過漏斗圖發現本研究中各研究間無明顯發表偏倚。
本研究結果表明,本拉珠單抗較安慰劑治療組明顯減少了哮喘年急性發作率、ACQ-6評分,增加了FEV1、AQLQ評分,表明本拉珠單抗治療對哮喘患者的癥狀控制、肺功能、生活質量等方面有明顯改善,在研究期內有效減少哮喘急性發作次數,對于糖皮質激素治療抵抗的嗜酸性粒細胞哮喘是一個有效的分子靶向藥物,有廣闊的應用前景,相比經典的糖皮質激素治療而言,是一個治療難治性哮喘的新思路。
本研究發現本拉珠單抗與對照組的不良事件包括頭痛、咽炎、上呼吸道感染、支氣管炎、鼻竇炎、發熱、過敏反應、注射部位反應等。不良反應方面,總體上本拉珠單抗和安慰劑組無明顯差異,而總體嚴重不良反應優于安慰劑組,提示本拉珠單抗治療哮喘安全性較高,但應進一步研究在治療中發生哮喘惡化機理及處理辦法。
多項研究納入的研究對象包括12~18歲未成年人,其結果與成年人的結果相類似,但未成年人的具體樣本量并未報道,未能進一步評估,結果的可靠性有待對更大未成年人樣本量的研究進行系統評價以驗證。
本研究也存在一定的不足,首先,本研究僅納入了8項RCT,有些RCT的樣本量小,有些亞組分析的組數也只有2~3組;其次,在Meta分析的過程中發現納入研究雖然有很多共同點,但也存在許多異質性,如本拉珠單抗的劑量和頻次、研究隨訪時間、各個亞組的終點報告等,基于上述原因和未考慮的因素,需慎重詮釋本Meta分析的結果。
綜上所述,基于目前現有的研究證據,本拉珠單抗在治療哮喘過程中安全,不良反應發生率低,在常規方案的基礎上加用本拉珠單抗治療,可降低哮喘年急性發作率、ACQ-6評分,改善哮喘患者肺功能、提高哮喘患者生存質量,間接減少患者的經濟負擔。但目前國內尚沒有關于本拉珠單抗治療重癥嗜酸粒細胞型哮喘的相關經驗,尤其是大樣本、多中心RCT來確定本拉珠單抗在治療我國哮喘的有效性與安全性。