LncRNA DANCR靶向miR-423-5p調控ox-LDL誘導的血管內皮細胞凋亡、炎癥反應①
李騫 李秀研 林麗麗 許景芬 陳芬
(福建醫科大學附屬泉州第一醫院全科醫學科,泉州362000)
動脈粥樣硬化(atherosclerosis,AS)是一種由多種危險因素引起的慢性炎癥性血管疾病,是全球范圍內死亡率和發病率升高的主要原因[1]。內皮細胞在血管功能中發揮重要作用,其功能障礙被認為是AS發生的重要標志。氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)是誘導內皮細胞損傷的關鍵因子,可刺激內皮細胞炎癥反應和氧化應激,增加細胞凋亡,破壞細胞功能,進而促進AS發生發展[2]。因此,抑制ox-LDL誘導的內皮細胞損傷對防治AS意義重大。長鏈非編碼RNA(long non-cod‐ing RNA,LncRNA)是一類長度超過200個核苷酸的非編碼RNA,其通過在轉錄后、轉錄和染色質水平上調控基因表達,參與調控內皮細胞功能障礙、膽固醇積聚、炎癥等病理過程,與AS進展密切相關[3]。分化拮抗非蛋白編碼RNA(differentiation antagonis‐tic non-protein coding RNA,DANCR)是一種腫瘤相關lncRNA,包括肝癌、乳腺癌和肺癌在內的多種惡性腫瘤中DANCR表達失調,其異常表達有助于癌細胞的增殖、遷移和侵襲,是一種潛在的癌癥標志物和治療靶點[4-5]。此外,DANCR還可提高腎小管上皮細胞活力,抑制脂多糖誘導的炎癥反應和凋亡[6]。然而,XIST介導AS進展的潛在機制仍不清楚。本研究采用ox-LDL誘導人臍靜脈內皮細胞(human umbilical vein endothelial cell,HUVEC)模擬AS細胞損傷,重點探討LncRNA DANCR對ox-LDL誘導的HUVEC凋亡和炎癥因子分泌的作用,分析其潛在靶基因,以期為AS治療提供新的方向。
1 材料與方法
1.1 材料HUVEC購于中國典型培養物保藏中心;DMEM培養基、胎牛血清購于美國Sigma公司;一步法PCR逆轉錄試劑盒、微小RNA(microRNA,miRNA)逆轉錄試劑盒、SYBR Green master Mix購于北京天根生化科技有限公司;miRNA模擬物(miR‐NA mimics)、miRNA抑制物(anti-miR)、過表達載體(pcDNA-RNA)、小干擾RNA(si-RNA)、雙熒光素酶報告基因載體由上海生工公司提供;ox-LDL、Trizol試劑、細胞計數試劑盒(cell counting kit 8,CCK-8)、膜聯蛋白V-異硫氰酸熒光素/碘化丙啶(Annexin VFITC/PI)凋亡檢測試劑盒購于北京索萊寶生物科技公司;細胞周期素D1(CyclinD1)小鼠單克隆抗體、活化型半胱氨酸蛋白酶3(Cleaved-caspase-3)兔單克隆抗體、β-actin兔單克隆抗體、羊抗兔IgG、羊抗鼠IgG購于上海碧云天生物公司;IL-1β、IL-6、TNF-α ELISA檢測試劑盒購于上海冠導生物工程有限公司。
1.2 方法
1.2.1 HUVEC體外損傷模型建立用含10%胎牛血清的DMEM培養基置于含5%CO2、37℃恒溫細胞培養箱中培養HUVEC,然后用含50 mg/L ox-LDL的細胞培養液處理細胞24 h構建體外損傷模型,模擬HUVEC AS損傷,記為OX-LDL組,同時設置正常對照(normal control,NC)組[7]。
1.2.2 細胞轉染和實驗分組將對數期HUVEC接種于6孔板,利用脂質體轉染法分別將pcDNA-con、pcDNA-DANCR、anti-miR-con、anti-miR-423-5p、pcD‐NA-DANCR+miR-con、pcDNA-DANCR+miR-423-5p mimics分別轉染HUVEC,轉染成功后用含50 mg/L ox-LDL的細胞培養液處理細胞24 h,依次命名為ox-LDL+pcDNA-con組、ox-LDL+pcDNA-DANCR組、ox-LDL+anti-miR-con組、ox-LDL+anti-miR-423-5p組、ox-LDL+pcDNA-DANCR+miR-con組、ox-LDL+pcDNADANCR+miR-423-5p組。
1.2.3 實時熒光定量PCR(RT-qPCR)檢測Ln‐cRNA DANCR和miR-423-5p表達按照Trizol試劑說明書提取細胞總RNA,測定濃度和純度后-20℃保存備用。取適量的總RNA,分別使用一步法PCR逆轉錄試劑盒或miRNA逆轉錄試劑盒合成cDNA,用SYBR Green master Mix進行RT-qPCR擴增。具體引物如下(5'-3'):DANCR上游引物CTGCATTCCTGAACCGTTATCT,DANCR下游引物GGGTG‐TAATCCACGTTTCTCAT;β-actin上游引物CCAACCGCGAGAAGATGA,β-actin下游引物CCAGAGGC‐GTACAGGGATAG;miR-423-5p上游引物ATGGTTC‐GTGGGTGA,miR-423-5p下 游 引 物GTGCAGGGTCCGAGGT;U6上游引物CTCGCTTCGGCAGCACA,U6下游引物AACGCTTCACGAATTTGCGT。2-ΔΔCt法計算LncRNA DANCR(內參為β-actin)和miR-423-5p(內參為U6)相對表達量。
1.2.4 CCK-8法檢測細胞活力收集各組細胞,按照100 μl/孔、5×103個/孔接種于96孔板,24 h后每孔加入10 μl的CCK-8溶液,培養箱繼續孵育2.5 h,酶標儀檢測450 nm波長處每孔的吸光度(A)值。細胞存活率(%)=A實驗組/A對照組×100%。
1.2.5 流式細胞術檢測細胞凋亡收集各組細胞,結合緩沖液調整為1×108個/L的單細胞懸液。取100 μl細胞懸液,按照Annexin V-FITC/PI雙染法細胞凋亡檢測試劑盒分別加入Annexin V-FITC和PI,室溫條件下暗室孵育15 min,補加結合緩沖液至總體積為500 μl,流式細胞術檢測細胞凋亡。
1.2.6 Western blot檢 測CyclinD1、Cleaved-cas‐pase-3蛋白表達水平放射免疫沉淀緩沖液提取各組細胞的總蛋白。蛋白定量后取適量蛋白和等體積上樣緩沖液混合,煮沸5 min使蛋白變性冷卻至室溫后備用。按照每泳道30 μg蛋白上樣,100 V 90 min進行聚丙烯酰胺凝膠電泳。快速蛋白濕轉移將蛋白轉移至硝酸纖維素膜后,用含5%脫脂奶粉的封閉液室溫孵育2 h。用稀釋的CyclinD1抗體(1∶200)、Cleaved-caspase-3抗體(1∶1 000)、β-actin抗體(1∶1 000)溶液孵育室溫孵育膜2 h。用稀釋的羊抗兔IgG、羊抗鼠IgG溶液(1∶1 000)室溫孵育膜1 h。用化學發光顯色試劑盒進行顯影。曝光后,Image J1.8.0軟件檢測每個條帶灰度值,以目的蛋白與內參蛋白β-actin灰度值比值表示目的蛋白相對表達水平。
1.2.7 雙熒光素酶報告基因實驗將含有miR-423-5p結合位點的LncRNA DANCR野生(WT)序列或突變(MUT)序列克隆到雙熒光素酶報告質粒,構建雙熒光素酶報告基因載體WT-LncRNA DANCR、MUT-LncRNA DANCR。利用脂質體轉染法將WTLncRNA DANCR、MUT-LncRNA DANCR分 別 與miR-con或miR-423-5p mimics共 轉 染 至HUVEC,48 h后檢測細胞相對熒光素酶活性。同時將pc-DNA-con、pcDNA-DANCR、si-con、si-DANCR分別轉染HUVEC,48 h后RT-qPCR檢測miR-423-5p表達水平。
1.2.8 ELISA法檢測IL-1β、IL-6、TNF-α分 泌水平收集各組細胞上清液,參照ELISA試劑盒說明書步驟分別檢測IL-1β、IL-6、TNF-α水平。
1.3 統計學分析每組設置3個平行實驗,重復3次,所有計量資料符合正態分布,用±s表示。采用SPSS22.0軟件進行統計學分析,兩組間比較采用t檢驗,多組間比較采用單因素方差分析,組件多重比較采用SNK-q檢驗。P<0.05為差異具有統計學意義。
2 結果
2.1 ox-LDL處理HUVEC中LncRNA DANCR、miR-423-5p的表達情況與NC組比較,ox-LDL組HU‐VEC中LncRNA DANCR的表達水平顯著降低,miR-423-5p表達水平顯著升高(P<0.05)。見表1。
表1 HUVEC中LncRNA DANCR和miR-423-5p表 達 量(±s,n=9)Tab.1 Expressions of LncRNA DANCR and miR-423-5p in HUVEC(±s,n=9)

表1 HUVEC中LncRNA DANCR和miR-423-5p表 達 量(±s,n=9)Tab.1 Expressions of LncRNA DANCR and miR-423-5p in HUVEC(±s,n=9)
Note:Compared with NC,1)P<0.05.
?
2.2 過表達DANCR對ox-LDL誘導的HUVEC增殖和凋亡的影響與NC組比較,ox-LDL組HUVEC中LncRNA DANCR表達顯著降低,細胞存活率、Cy‐clinD1蛋白表達顯著降低,細胞凋亡率、Cleaved-cas‐pase-3蛋白表達顯著升高(P<0.05);與ox-LDL+pcDNA-con組比較,ox-LDL+pcDNA-DANCR組HU‐VEC中LncRNA DANCR表達顯著升高,細胞存活率、CyclinD1蛋白表達顯著升高,細胞凋亡率、Cleaved-caspase-3蛋白表達顯著降低(P<0.05)。見圖1、表2。
表2 過表達DANCR對ox-LDL誘導的HUVEC細胞增殖和凋亡的影響(±s,n=9)Tab.2 Effect of DANCR overexpression on proliferation and apoptosis of ox-LDL-induced HUVEC cells(±s,n=9)
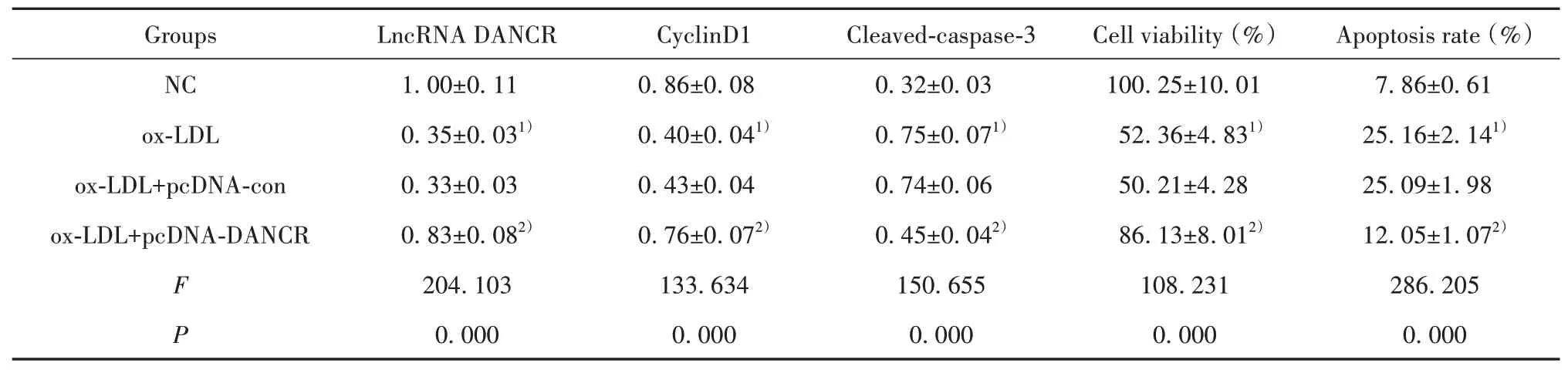
表2 過表達DANCR對ox-LDL誘導的HUVEC細胞增殖和凋亡的影響(±s,n=9)Tab.2 Effect of DANCR overexpression on proliferation and apoptosis of ox-LDL-induced HUVEC cells(±s,n=9)
Note:Compared with NC,1)P<0.05;compared with ox-LDL+pcDNA-con,2)P<0.05.
?
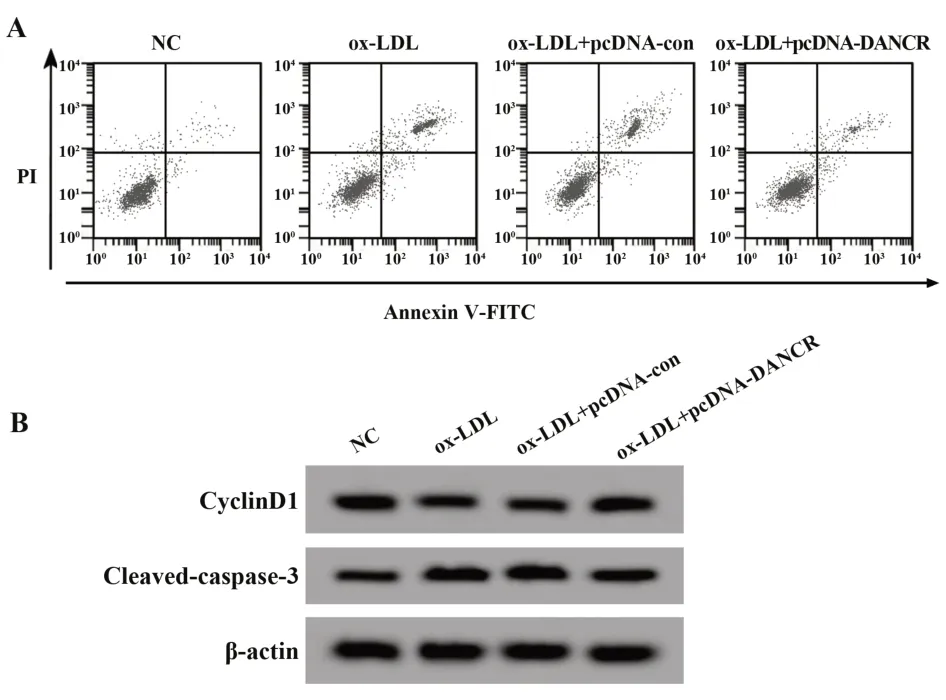
圖1 過表達DANCR對ox-LDL誘導的HUVEC增殖和凋亡的影響Fig.1 Effect of DANCR overexpression on proliferation and apoptosis of ox-LDL-induced HUVEC
2.3 抑 制miR-423-5p對ox-LDL誘導 的HUVEC增殖和凋亡的影響與ox-LDL+anti-miR-con組比較,ox-LDL+anti-miR-423-5p組HUVEC中miR-423-5p表達顯著降低,細胞存活率、CyclinD1蛋白表達顯著升高,細胞凋亡率、Cleaved-caspase-3蛋白表達顯著降低(P<0.05)。見表3、圖2。
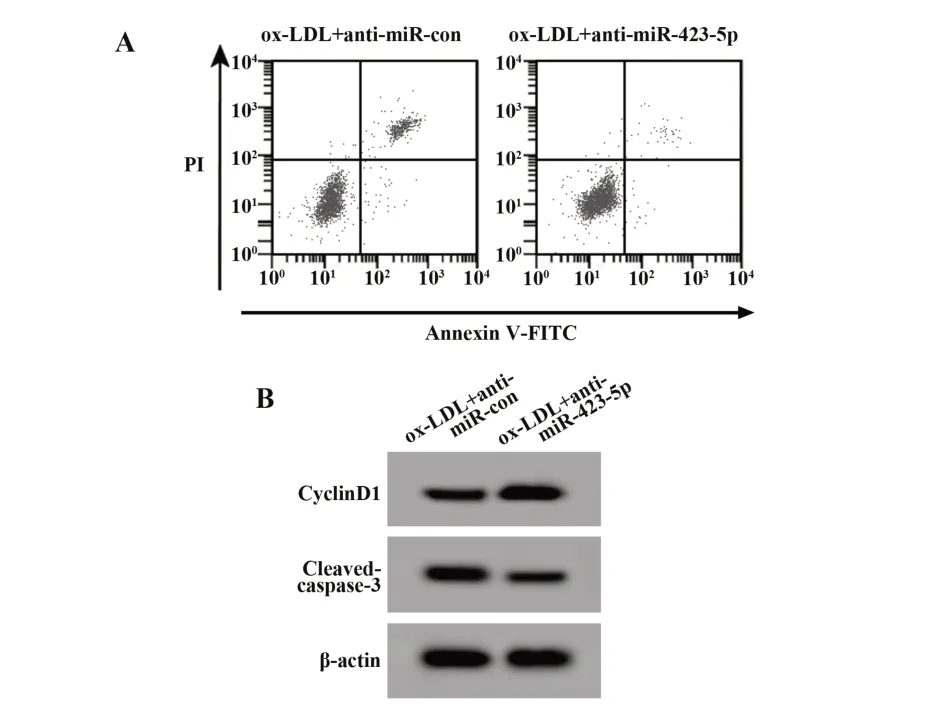
圖2 抑制miR-423-5p表達對ox-LDL誘導的HUVEC細胞增殖和凋亡的影響Fig.2 Effect of miR-423-5p inhibition on proliferation and apoptosis of ox-LDL-induced HUVEC cells
表3 抑制miR-423-5p表達對ox-LDL誘導的HUVEC增殖和凋亡的影響(±s,n=9)Tab.3 Effect of miR-423-5p inhibition on proliferation and apoptosis of ox-LDL-induced HUVEC(±s,n=9)
表3 抑制miR-423-5p表達對ox-LDL誘導的HUVEC增殖和凋亡的影響(±s,n=9)Tab.3 Effect of miR-423-5p inhibition on proliferation and apoptosis of ox-LDL-induced HUVEC(±s,n=9)
Note:Compared with ox-LDL+anti-miR-con,1)P<0.05.
?
2.4 LncRNA DANCR靶向miR-423-5p LncRNA DANCR與miR-423-5p之間存在特異性互補結合位點,見圖3。與miR-con和WT-LncRNA DANCR共轉染比較,miR-423-5p mimics和WT-LncRNA DANCR共轉染后HUVEC相對熒光素酶活性顯著降低(P<0.05);與miR-con和MUT-LncRNA DANCR共轉染比較,miR-423-5p mimics和MUT-LncRNA DANCR共轉染后HUVEC相對熒光素酶活性無顯著變化,見表4。pcDNA-DANCR組HUVEC中miR-423-5p表達顯著低于pcDNA-con組(P<0.05);si-DANCR組HUVEC中miR-423-5p表達顯著高于si-con組(P<0.05),見表5。
表4 雙熒光素酶報告實驗(±s,n=9)Tab.4 Double luciferase report experiment(±s,n=9)
表4 雙熒光素酶報告實驗(±s,n=9)Tab.4 Double luciferase report experiment(±s,n=9)
Note:Compared with miR-con,1)P<0.05.
?
表5 RT-qPCR檢測miR-423-5p的表達(±s)Tab.5 RT-qPCR detects expressions of miR-423-5p(±s)
表5 RT-qPCR檢測miR-423-5p的表達(±s)Tab.5 RT-qPCR detects expressions of miR-423-5p(±s)
Note:Compared with pcDNA-con,1)P<0.05;compared with si-con,2)P<0.05.
?

圖3 miR-423-5p和LncRNA DANCR結合預測示意圖Fig.3 Schematic diagram of miR-423-5p and LncRNA DANCR binding prediction
2.5 過表達miR-423-5p可以逆轉DANCR過表達對ox-LDL誘導的HUVEC增殖和凋亡的影響與ox-LDL+pcDNA-DANCR+miR-con組 比較,ox-LDL+pcDNA-DANCR+miR-423-5p組HUVEC中miR-423-5p表達顯著升高,細胞存活率、CyclinD1蛋白表達顯著降低,細胞凋亡率、Cleaved-caspase-3蛋白表達顯著升高(P<0.05)。見表6、圖4。
表6 過表達miR-423-5p可以逆轉DANCR過表達對ox-LDL誘導的HUVEC增殖和凋亡的影響(±s,n=9)Tab.6 miR-423-5p overexpression can reverse effect of DANCR overexpression on proliferation and apoptosis of ox-LDLinduced HUVEC(±s,n=9)

表6 過表達miR-423-5p可以逆轉DANCR過表達對ox-LDL誘導的HUVEC增殖和凋亡的影響(±s,n=9)Tab.6 miR-423-5p overexpression can reverse effect of DANCR overexpression on proliferation and apoptosis of ox-LDLinduced HUVEC(±s,n=9)
Note:Compared with ox-LDL+pcDNA-DANCR+miR-con,1)P<0.05.
?
圖4 過表達miR-423-5p可以逆轉DANCR過表達對ox-LDL誘導的HUVEC細胞增殖和凋亡的影響Fig.4 miR-423-5p overexpression can reverse effect of DANCR overexpression on proliferation and apop?tosis of ox-LDL-induced HUVEC cells
2.6 ELISA檢測各組炎癥因子分泌水平與NC組比較,ox-LDL組HUVEC上清中IL-1β、IL-6、TNF-α水平顯著升高(P<0.05);與ox-LDL組比較,ox-LDL+pcDNA-DANCR組、ox-LDL+anti-miR-423-5p組HU‐VEC上清中IL-1β、IL-6、TNF-α水平顯著降低(P<0.05);與ox-LDL+pcDNA-DANCR組相比,ox-LDL+pcDNA-DANCR+miR-423-5p組HUVEC上 清 中IL-1β、IL-6、TNF-α水平顯著升高(P<0.05)。見表7。
表7 ELISA檢測各組炎癥因子分泌水平(±s,n=9)Tab.7 ELISA detects secretion levels of inflammatory factors in each group(±s,n=9)
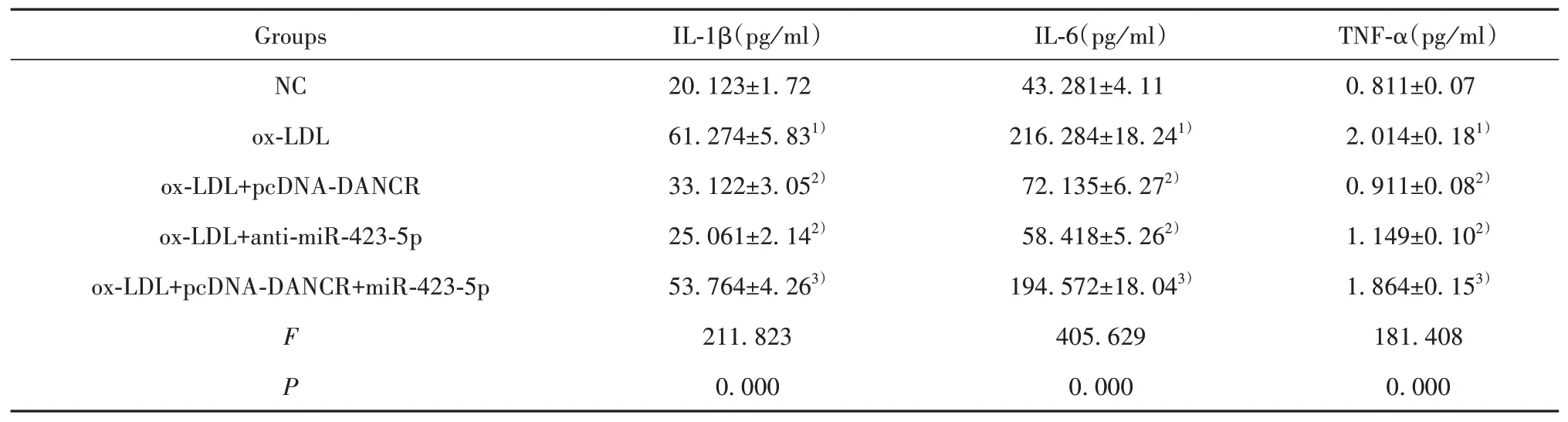
表7 ELISA檢測各組炎癥因子分泌水平(±s,n=9)Tab.7 ELISA detects secretion levels of inflammatory factors in each group(±s,n=9)
Note:Compared with NC,1)P<0.05;compared with ox-LDL,2)P<0.05;compared with ox-LDL+pcDNA-DANCR,3)P<0.05.
?
3 討論
AS是冠心病和腦卒中的主要病理基礎,是心血管疾病發生的主要原因。內皮細胞損傷及其功能障礙在AS的發展中起著至關重要的作用,探討與內皮細胞損傷相關的基因,分析其作用機制,有望為AS治療提供新的策略。
LncRNA DANCR在缺氧誘導的大鼠心肌細胞中表達降低,LncRNA DANCR高表達通過上調缺氧誘導因子1α(hypoxia-inducible factor 1α,HIF-1α)表達減輕缺氧誘導的心肌細胞損傷[8]。LncRNA DANCR高表達可增強糖氧剝奪處理的腦微血管內皮細胞的增殖、遷移和血管生成,對改善缺血性腦卒中具有重要意義[9]。本研究結果表明,ox-LDL處理HU‐VEC后,細胞存活率顯著降低,凋亡率顯著升高,Lnc-RNA DANCR表達量顯著降低。IL-1β、IL-6、TNF-α等炎癥因子的分泌是參與AS的發病機制的重要因素[10-11]。本研究顯示,ox-LDL誘導后HUVEC上清中IL-1β、IL-6、TNF-α水平顯著升高,提示LncRNA DANCR低表達可能與ox-LDL誘導的HUVEC損傷有關。CyclinD1是一種重要的周期蛋白,磷脂酰肌醇激酶抑制劑BYL719通過下調CyclinD1表達可誘導HUVEC阻滯于G1期,抑制細胞增殖[12]。Cas‐pase-3是細胞凋亡發展中最關鍵的執行分子,其活化是檢測細胞凋亡的重要指標[13]。進一步轉染DANCR過表達載體上調LncRNA DANCR表達發現,ox-LDL誘導的HUVEC存活率、CyclinD1升高,凋亡率、Cleaved-caspase-3表達降低,IL-1β、IL-6、TNF-α水平降低,說明過表達LncRNA DANCR能夠改善ox-LDL誘導的HUVEC炎癥反應和凋亡。
miRNA為非編碼RNA家族重要成員,研究顯示,miRNA通過與LncRNA相互作用參與調解氧化應激、細胞凋亡和炎癥反應等多種細胞過程[14-16]。為探索LncRNA DANCR作用機制,本研究發現miR-423-5p是其潛在靶基因。研究表明缺氧誘導的心肌細胞中miR-423-5p表達增加,miR-423-5p高表達導致線粒體膜電位的丟失、活性氧生成增加,促進心肌細胞凋亡[17]。在急性腎損傷后,miR-423-5p通過誘導內質網絡應激和氧化應激,抑制腎小管上皮細胞的修復[18]。此外,LncRNA RPSAP52通過靶向下調miR-423-5p能夠抑制缺氧誘導的腎近端小管上皮細胞凋亡[19]。本研究顯示,ox-LDL誘導后HU‐VEC中miR-423-5p表達顯著升高,抑制miR-423-5p表達可提高HUVEC存活率,減輕ox-LDL誘導的HUVEC凋亡、炎癥因子分泌,與過表達LncRNA DANCR作用一致。進一步研究證實,LncRNA DANCR對miR-423-5p具有靶向負調控作用,且過表達miR-423-5p能夠逆轉LncRNA DANCR對ox-LDL處理的HUVEC炎癥因子分泌、存活、凋亡以及相關蛋白表達的影響,說明LncRNA DANCR可提高靶向miR-423-5p減輕ox-LDL誘導的HUVEC炎癥反應和凋亡。
綜上所述,ox-LDL引起HUVEC中LncRNA DANCR表達降低,過表達LncRNA DANCR通過靶向下調miR-423-5p可促進HUVEC存活,改善ox-LDL誘導的HUVEC炎癥反應和凋亡,為基于HUVEC損傷的AS治療提供了新的方向。