基于臨床療效的注射用益氣復脈(凍干)質量標志物確證
張 磊,蘇小琴,李德坤,岳洪水,鞠愛春,楊 峰,侯 穎,張鐵軍,劉昌孝*
1.天津天士力之驕藥業有限公司,天津 300410
2.天津市中藥注射劑安全性評價企業重點實驗室,天津 300410
3.天津藥物研究院,天津 300462
中醫藥是我國獨特的醫療資源,是國民健康體系的重要組成部分,對我國經濟發展意義重大。構建科學的中藥質量研究模式,挖掘與臨床療效緊密結合的物質基礎,形成更加合理的質量控制標準,對促進中醫藥產業發展具有現實意義。劉昌孝院士[1]于2016年提出“中藥質量標志物(quality marker,QMarker)”的創新概念,并對其科學內涵及方法學做了系統性闡述[2-4]。中藥Q-Marker是存在于中藥材和中藥產品(如中藥飲片、中藥煎劑、中藥提取物、中成藥制劑)中固有的或加工制備過程中形成的、與中藥的功能屬性密切相關的化學物質,作為反映中藥安全性和有效性的標示性物質進行質量控制[1]。中藥Q-Marker理念的提出,開創了中藥質量研究新模式,將藥效物質基礎與中藥生物屬性、配伍理論等自身醫藥體系特點深度融合,強化了中藥有效性-物質基礎-質量控制指標的關聯度。在中藥Q-Marker理論及其方法學指導下,國內學者對不同中藥材及復方制劑開展了系統性的質量研究[5-8]。
注射用益氣復脈(凍干)(Yiqi Fumai Lyophilized Injection,YQFM)是由紅參、麥冬及五味子為原藥材,采用現代工藝精制而成的中藥凍干粉針劑。其功效為益氣復脈、養陰生津,臨床上用于冠心病勞累型心絞痛氣陰兩虛癥以及冠心病所致慢性心衰的治療。前期工作基于中藥Q-Marker理論體系,采用藥效學、網絡藥理學、藥動學及藥性等方法,初步預測分析了YQFM中的13個Q-Marker,并建立了全程質量控制體系[9]。為了使建立的Q-Marker更好地控制制劑質量,本文在前期研究基礎上,從YQFM的臨床研究入手,探索YQFM的Q-Marker與臨床有效性之間的關系,分析Q-Marker在YQFM臨床療效中的潛在作用,進一步完善YQFM的QMarker體系。
1 YQFM中的Q-Marker
YQFM是典型的中藥復方制劑,化學成分復雜。前期工作對YQFM的化學物質基礎開展了系統性研究,結果顯示YQFM的化學成分主要包括糖類、皂苷類、木脂素類等。周垚垚等[10]采用超高效液相四級桿-飛行時間質譜(UPLC-Q-TOF/MS)技術對YQFM進行化學成分全解析,鑒定出145個化合物,其中有26個藥效成分為首次檢出,包括17個黃酮類化合物、4個麥冬皂苷類化合物以及5個木脂素類化合物。Liu等[11]采用超快速液相色譜串聯離子阱-飛行時間質譜(UFLC-IT-TOF/MS)技術解析了YQFM所含的人參皂苷類、木脂素類、麥冬皂苷類、高異黃酮類等成分,最終鑒定出非糖類成分65個,包括來自紅參藥材成分42個、五味子藥材成分16個以及麥冬藥材成分7個,并對其中21個化合物完成了定量分析。李莉等[12]采用高效液相色譜聯用蒸發光散射檢測器(HPLC-ELSD)技術,開展YQFM中鈉元素研究,并對鈉元素成分完成了定量分析。通過上述一系列工作,基本明確了YQFM的化學成分,為進一步開展制劑Q-Marker的研究提供了條件。
在化學成分研究基礎之上,以中藥Q-Marker理論及方法為指導,采用中藥藥性學、藥效學、電子舌技術以及網絡藥理學等方法,對YQFM的QMarker開展了預測分析研究[9]。最終確定8種人參皂苷類(人參皂苷Rb1、Rg1、Rf、Rh1、Rc、Rb2、Ro、Rg3)、3種麥冬皂苷類[麥冬皂苷C、麥冬苷元- 3-O-α-L-吡喃鼠李糖基-(1→2)-β-D-吡喃葡萄糖苷、偏諾皂苷元-3-O-α-L-吡喃鼠李糖基-(1→2)-β-D-吡喃木糖基-(1→4)-β-D-吡喃葡萄糖苷]以及果糖和五味子醇甲共13個化學成分為YQFM的Q-Marker,其化學結構見圖1。
2 YQFM的藥理作用和臨床應用
根據中醫藥傳統藥性配伍理論,YQFM方中人參為君藥,大補元氣,益肺、生津止渴;麥冬為臣藥,甘寒養陰、清熱生津,人參、麥冬配伍,發揮益氣養陰之功效。佐以五味子,具有酸收、斂陰止汗之功效,與人參、麥冬配伍,起到補固正氣與收斂陰津的作用[13]。YQFM在現代臨床上主要用于慢性心力衰竭、冠心病心絞痛等心血管疾病的治療。
為了明確YQFM所含Q-Marker與臨床療效之間的關系,需要對YQFM的藥效學、藥理機制以及臨床有效性開展系統性研究。近年來,圍繞YQFM的藥理作用和臨床應用內容較為集中,主要針對心血管系統的影響,包括抗心肌缺血、抗心肌缺氧損傷、抗心衰等的治療。
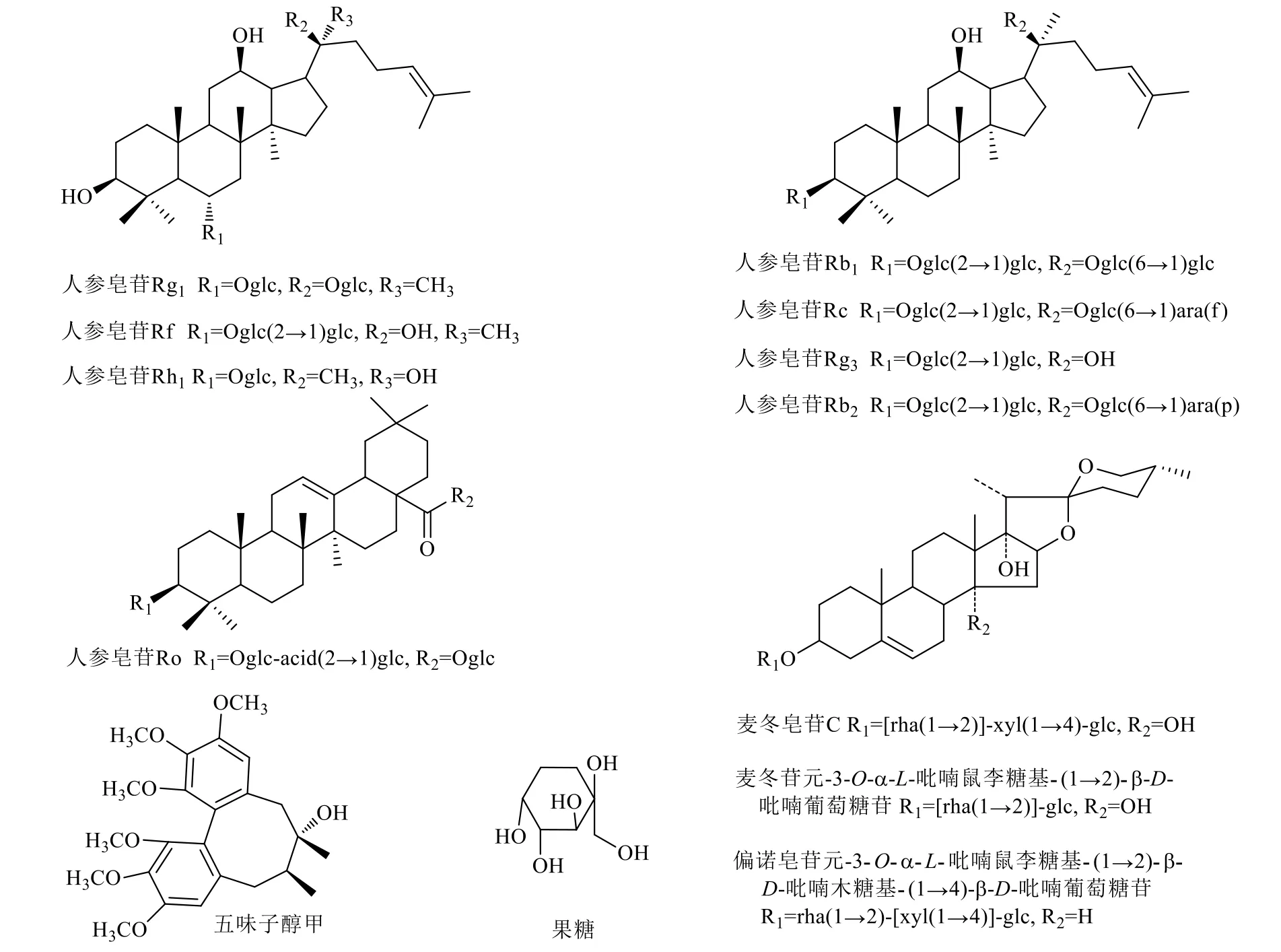
圖1 YQFM中Q-Marker的化學結構Fig.1 Chemical structures of Q-Marker in YQFM
2.1 YQFM的藥理作用
在YQFM治療心力衰竭機制的研究方面,Xing等[14]建立大鼠冠狀動脈結扎慢性心衰模型,考察了YQFM對心臟收縮功能和炎癥介質水平的影響。研究證明YQFM能夠引起心電圖ST段的明顯下降,降低血漿腦鈉肽(brain-type natriuretic peptide,BNP)水平,抑制血清以及心肌組織中腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)、白細胞介素(interleukin,IL)-6和IL-1β等炎癥因子的釋放。慢性心衰大鼠心肌間質膠原纖維增生、膠原網絡結構改變導致心肌細胞外基質重構,與基質金屬蛋白酶(matrix metalloproteinase,MMP)系統活性增強有關[15]。張秋月等[15]研究了YQFM對心肌MMP及其組織抑制因子(tissue inhibitor of metalloproteinase,TIMP)蛋白表達的影響,結果顯示,YQFM能夠降低MMP-2、MMP-9、MMP-3的含量,升高TIMP1和TIMP-2水平,維持MMP-2/TIMP-2的動態平衡,從而改善慢性心衰大鼠心肌細胞外基質重構的程度,緩解大鼠慢性心衰癥狀。在一項YQFM對心功能及心力衰竭標志物影響的研究中發現,YQFM對改善心衰模型大鼠心功能和心室重塑方面有顯著療效。實驗結果證實,YQFM能夠提高心衰大鼠左室射血分數(left ventricular ejection fractions,LVEF)、縮短分數(fractional shortening,FS),降低左室收縮末期內徑(left ventricular end-systolic diameter,LVDs),增加收縮末左室后壁厚度。推測其機制可能與減少心肌纖維化和抑制腎素-血管緊張素-醛固酮系統激活作用有關[16]。此外,YQFM能夠改善心衰小鼠的左心結構和功能,降低乳酸脫氫酶(lactate dehydrogenase,LDH)、肌酸激酶、丙二醛、腦自然肽氨基端前體蛋白(N-terminal pro-B-type natriuretic peptide,NT-proBNP)和尿羥脯氨酸的含量,從而減輕心肌組織的損傷以及膠原沉積和纖維化,推測其與抑制絲裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)通路的磷酸化有關[17]。Yuan等[18]采用冠狀動脈永久結扎建立小鼠慢性心力衰竭模型,YQFM干預治療14 d,采用非靶向代謝組學技術篩選小鼠血漿和尿液樣本的內源性代謝物。結果表明,YQFM治療改變了慢性心力衰竭的代謝模式,調節了纈氨酸、亮氨酸和異亮氨酸的生物合成、牛磺酸和次牛磺酸的代謝、組氨酸的代謝和精氨酸的生物合成等。
采用小鼠冠狀動脈左前降支結扎誘導心肌缺血再灌注損傷模型研究顯示,YQFM能夠有效改善缺血再灌注造成的小鼠心肌損傷,降低心臟梗死面積、提高LVEF和FS;顯著降LDH及肌酸激酶活性,改善心肌病理組織形態學變化,減少炎性細胞浸潤,改善心功能,降低血清心肌酶活性[19]。Li等[20]研究顯示,YQFM對提高體外細胞存活率,減少LDH釋放,抑制含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,Caspase-3)的表達等有顯著作用。此外,YQFM能夠調節B淋巴細胞瘤-2基因及其相關蛋白X的表達,通過提升線粒體膜電位和三磷酸腺苷(adenosine triphosphate,ATP)的含量進而改善線粒體功能。在YQFM給藥組中加入腺苷酸活化蛋白激酶adenosine monophosphate-activated protein kinase,AMPK)抑制劑后,轉染AMPK α siRNA的心肌細胞均出現凋亡。該結果提示,YQFM抗心肌細胞凋亡的作用機制可能通過激活AMPK信號通路實現。在一項YQFM保護異丙腎上腺素誘導的小鼠心肌缺血損傷模型的研究中發現,YQFM能夠降低心肌缺血損傷小鼠血清中LDH、肌酸激酶含量,減少生理記錄儀T波升高,降低丙二醛和髓過氧化物酶水平,改善心肌組織病理損傷狀況[21]。此外,YQFM可以明顯減輕低氧環境所致心臟組織內皮細胞的腫脹、空泡化,增加心臟收縮功能,提高心肌缺氧耐受性[22]。基于網絡藥理學技術開展的YQFM治療心-腦缺血疾病多靶點的研究中,揭示了YQFM與缺血性疾病相關的靶點通路有12條,主要的有核轉錄因子κB(nuclear factor-κB,NF-κB)、MAPK、轉錄因子環磷腺苷效應元件結合蛋白(adenosine cyclophosphate-response element binding protein,CREB)和哺乳動物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)等信號通路[23]。Gou等[24]采用血管加壓素注射成功建立大鼠心絞痛模型,探討YQFM對血管加壓素誘導的大鼠心絞痛模型的保護作用及其潛在途徑。采用超聲心動圖系統、染色法、全自動生化分析儀等方法檢測心臟功能、組織形態及血清心肌酶,評價心臟損傷程度,采用Western blotting法檢測促炎因子TNF-α、IL-6水平及相關NF-κB通路相關蛋白表達,研究結果表明YQFM可以通過NF-κB/p65信號通路改善血管加壓素誘導的心絞痛。這些發現為YQFM治療心絞痛的臨床應用提供了藥理學證據。
上述一系列研究結果表明,YQFM對心血管疾病的作用機制包括增強心臟的收縮功能、延緩心室重構、抗炎、抗氧化、保護心肌損傷、改善線粒體功能、抑制細胞凋亡、改善能量代謝、減少心肌組織膠原沉積等。與這些機制相關的蛋白分子信號通路主要包括NF-κB、AMPK、MAPK、CREB和mTOR等。
2.2 YQFM的臨床應用
慢性心力衰竭也稱慢性心功能不全,是心臟收縮舒張功能受損,最終導致心功能不全的一組臨床綜合征,以心排血量不足,血液灌注不足以及肺循環和體循環瘀血為特征[25]。在一項對1134例冠心病所致心力衰竭患者的多中心臨床研究中,采用YQFM治療14 d,結果顯示患者心臟功能顯著改善,胸片異常人數減少,Lee氏心力衰竭計分和明尼蘇達心力衰竭評分等指標也明顯改善,彩超多項檢測指標均有好轉[26]。NT-proBNP是心功能紊亂程度最敏感的標志物,研究顯示,對慢性心力衰竭的患者在常規西藥治療基礎上聯用YQFM,可以顯著降低患者血漿NT-proBNP水平,提高LVEF值,改善心衰患者的心臟功能,提高慢性心衰患者6 min步行距離,改善活動耐受度[27-28]。針對缺血性心肌合并心力衰竭的治療,在常規西藥基礎上加用YQFM,心功能評估參照美國紐約心臟病學會心功能分級標準。研究結果顯示,YQFM組的心功能分級改善I~II級的比例明顯高于常規組,關鍵標志物NTproBNP的水平顯著下降。同時,YQFM治療組后6 min步行結果明顯優于對照組,且心肌受損程度減輕[29-30]。
臨床上常規治療聯用YQFM可改善冠心病心衰患者的臨床癥狀,使心衰計分、明尼蘇達生活質量量表積分降低,明顯減少冠心病心衰合并心絞痛患者的心絞痛發作次數,改善總有效率可以達到85.36%[31]。對慢性心力衰竭的患者給予YQFM治療,結果顯示,左心室收縮及舒張期內徑縮小,LVEF增加。同時,BNP水平明顯降低,與心功能的改善成正相關[32]。對于急性心力衰竭患者的臨床研究結果顯示,YQFM治療組緩解急性心衰癥狀的時間短于對照組,YQFM治療能夠顯著提高患者的LVEF,降低左室舒張末期容積,縮小左房內徑,升高二尖瓣口舒張早期最大血流速度與舒張晚期最大血流速度比值[33]。在對120例急性心衰患者臨床試驗研究中,在常規治療基礎上加用YQFM,結果顯示YQFM能顯著降低患者血清中肌鈣蛋白-I與BNP水平,減輕心肌損傷,改善心功能分級,保護心臟[34-35]。
在對冠心病心絞痛治療的臨床研究中,給予患者YQFM靜脈滴定治療,結果顯示治療后心電圖改善明顯,硝酸甘油停減率為91.5%,心絞痛分級及發作次數等有大幅度改善[36]。采用西雅圖心絞痛量表評價YQFM聯合西藥對不穩定型心絞痛的療效,YQFM能夠提高冠心病心絞痛患者的生活質量和滿意度[37],同時還能夠有效降低老年穩定型心絞痛患者收縮壓[38-39]。血細胞比容、全血黏度、纖維蛋白原等血液流變學指標升高極易導致血栓的形成,進而阻塞冠狀動脈引發冠心病心絞痛。張崇榮等[40]納入62例氣陰兩虛型冠心病心絞痛患者觀察YQFM的臨床療效,研究表明在常規基礎治療上聯用YQFM可以降低患者血液流變值、明顯降低心絞痛復發率和心肌梗死發生率。血管內皮細胞功能的損傷容易引發不穩定型心絞痛[41],不穩定型心絞痛發作時,氧化應激等因素可導致血管內皮系統慢性微炎癥狀態的過度激活,加劇血管內皮損傷,加重動脈斑塊的不穩定性。在一項對88例不穩定型心絞痛患者治療的臨床研究中[42],在常規治療基礎上加用YQFM,結果顯示治療后患者血漿一氧化氮水平較治療前明顯升高,內皮素以及血清單核細胞趨化蛋白-1顯著降低,且治療組指標改善情況均優于對照組。上述結果說明,YQFM可以減輕不穩定型心絞痛患者的氧化應激反應,保護血管內皮功能。
綜上所述,YQFM在臨床上主要用于心力衰竭、冠心病心絞痛、心肌梗死等心血管疾病的治療,療效顯著,且其臨床療效的發揮是通過多種作用機制來實現的。
3 YQFM中Q-Marker藥效機制與其臨床療效的相關性
“藥性”與“藥效”均是中醫藥理論的核心概念,在創建及完善中藥Q-Marker理論體系中誕生的“性-效-物”三元論,是在對中藥藥效及化學成分研究的基礎上,將“藥性”相關物質納入質量評價中,從中藥的基本屬性及術語出發,完整闡釋中藥治療疾病的物質基礎和作用機制的創新概念,是指導中藥Q-Marker研究的核心思想[3-4]。YQFM的臨床有效性體現了其組方藥材的藥性與藥效的協同作用,而中藥藥效作用的發揮與其藥效物質密切相關。因此,借助“性-效-物”三元論的指導,解析各組方藥材中與藥效有關的活性成分,揭示YQFM的藥效物質基礎,特別是Q-Marker與其臨床療效背后所蘊含的多重藥理機制之間的相關關系,對于確證YQFM中QMarker的合理性,并進一步借助中藥Q-Marker理論及方法學提升中藥質量標準,實施中藥質量控制具有現實意義。
3.1 紅參中Q-Marker與YQFM臨床有效性關系辨識
紅參為YQFM組方中的君藥,具有大補元氣、復脈固脫之功效。YQFM中來源于紅參的Q-Marker為人參皂苷類物質,現代研究表明,人參皂苷具有增強免疫力、抗血小板凝集、保護神經、改善心血管功能、抗炎、抗氧化等活性。作為Q-Marker的8個人參皂苷之一,其作用機制與YQFM臨床對心衰、心絞痛等疾病的治療密切相關。在以結扎大鼠冠狀動脈左前降支慢性心衰模型考察YQFM心臟保護機制的研究中發現[14],YQFM中所含的人參皂苷Rb1、Rg1、Rf、Rh1、Rc、Rb2、Ro和Rg3具有抗炎作用,并證實人參皂苷Ro是一種NF-κB抑制劑。而NF-κB信號通路及細胞因子的抑制被看作是YQFM改善大鼠慢性心衰的主要機制之一。謝薇等[43]研究了白消安誘導人臍靜脈內皮細胞凋亡及人參皂苷Rb1對此的干預效應,結果顯示高濃度(0.12 g/L)白消安可顯著誘導人臍靜脈內皮細胞凋亡,人參皂苷Rb1可以抑制凋亡作用,說明人參皂苷Rb1可以通過抑制細胞凋亡發揮對內皮細胞的保護效應。Zhou等[44]以實驗豬為模型研究了人參皂苷Rb1對于高同型半胱氨酸誘導產生的血管內皮功能障礙形成的血管損傷的影響。結果表明人參皂苷Rb1能夠有效阻滯高同型半胱氨酸誘導的血管舒張依賴性內皮功能障礙,阻滯超氧化物負離子的產生,抑制內源性一氧化氮合酶的下調。郭佳等[45]考察了人參皂苷Rb1對心肌細胞缺氧復氧損傷的保護作用。結果顯示,人參皂苷Rb1處理組的細胞生存率增加2.28倍,凋亡率減少5.29%,LDH、丙二醛含量分別降低了59.2%、72.3%,一氧化氮活性增加了2.67倍。說明人參皂苷Rb1能顯著減輕肥厚心肌細胞的脫氧復氧損傷,該機制與抑制細胞凋亡,減少脂質過氧化以及增強一氧化氮活性相關。對缺血再灌注大鼠模型分別采用人參皂苷Rb1和人參皂苷Re治療,結果顯示人參皂苷Rb1和人參皂苷Re治療的心肌細胞凋亡數顯著低于模型組。表明人參皂苷Rb1和人參皂苷Re可以有效抑制缺血再灌注心肌細胞凋亡,減輕心肌損傷[46-47]。古云等[48]采用大鼠心衰模型研究了人參皂苷Rg1對心功能的保護作用。以依那普利為對照,將人參皂苷Rg1治療分為高、中、低[4、2、1 mg/(kg·d)] 3個劑量組。結果顯示,人參皂苷Rg1高劑量組LVEF、左心室最大內壓上升/ 下降速率(±dp/dtmax)明顯增高,LVDs和左室舒張末期內徑(left ventricular end-diastolic diameter,LVDd)明顯降低,高劑量組的Ca2+,Mg2+-ATP酶、總ATP酶、總糖原、堿性磷酸酶、LDH以及心肌細胞胞漿內心肌肌漿網鈣離子ATP酶的表達與其他組相比明顯升高,Na+,K+-ATP酶明顯降低。結果說明,人參皂苷Rg1可改善心衰大鼠的心功能,與升高LVEF、±dp/dtmax、Ca2+,Mg2+-ATP酶、T-ATP酶、總糖原、堿性磷酸酶、LDH、心肌細胞胞漿內心肌肌漿網鈣離子ATP酶表達及降低LVDs、LVDd、Na+,K+-ATP酶有關。采用結扎SD大鼠左冠狀動脈前降支建立大鼠急性心肌梗死模型觀察人參皂苷Rg1對心肌梗死后心臟纖維化的影響[49]。結果顯示,手術1、2周后,人參皂苷Rg1組的心臟瘢痕形成要明顯少于對照組,說明人參皂苷Rg1對大鼠急性心肌梗后心臟纖維化有顯著抑制作用。張聰等[50]研究了人參皂苷對過氧化氫誘導的人肝癌HepG2細胞氧化應激損傷的保護作用。與過氧化氫損傷組比較,人參皂苷Rh1、F1、Rd、Ro保護組的細胞存活率顯著升高。在以小鼠單核巨噬細胞考察人參皂苷Rh1抗炎活性的研究中,人參皂苷Rh1能夠有效組織組胺釋放,并能抑制誘導性一氧化氮合酶(inducible nitric oxide synthase,iNOS)與環氧合酶2(cyclooxygenase-2,COX-2)的生成[51]。此外,研究顯示人參皂苷Rh1能夠有效緩解異丙腎上腺素引起的大鼠心肌損傷并改善心臟功能,該機制與人參皂苷Rh1抑制丙二醛、TNF-α和IL-1β含量升高,提高超氧化物歧化酶和過氧化氫酶的活性有關[52]。人參皂苷Rf能夠抑制由缺氧誘導的COX-2蛋白表達,說明人參皂苷Rf在缺氧條件下具有抗炎活性[53]。人參皂苷Rb2對過氧化氫及缺血再灌注引起的小鼠氧化應激反應導致的心臟損傷具有明顯的保護作用[54]。研究顯示,人參皂苷Rb2能夠減少心肌過氧化物的生成,下調gp91phox基因表達,降低IL-1β、IL-6、TNF-αmRNA表達及活性,說明人參皂苷Rb2能夠顯著緩解由缺血再灌注損傷導致的氧化應激和炎癥反應。Chen等[55]研究了人參皂苷Rc對缺氧復氧損傷心肌細胞的保護作用及其機制。結果顯示,人參皂苷Rc能夠顯著提高損傷心肌細胞的活力,其機制與改善能量代謝有關,包括提高ATP含量、減少LDH滲出和降低肌酸激酶含量。對人參皂苷Rg3的研究表明,人參皂苷Rg3對脂多糖導致的人臍靜脈內皮HUVECs細胞損傷具有保護功能,該藥效機制與降低細胞內鈣離子濃度,抑制纖溶酶原激活物抑制劑-1(plasminogen activator inhibitor 1,PAI-1)產生以及調節組織型纖溶酶原激活物和PAI-1平衡有關,說明人參皂苷Rg3具有血管保護和抗動脈粥樣硬化的功能[56]。人參皂苷Rg3能夠顯著減小心肌缺血再灌注損傷導致的大鼠心肌梗死面積,提高心臟功能,降低血漿中肌酸激酶和LDH水平,表明人參皂苷Rg3對缺血所致的心肌損傷具有保護功能[57]。此外,人參皂苷Rg3對過氧化氫導致的氧化應激損傷具有明顯的抑制作用[58]。上述研究結果表明,人參皂苷類Q-Marker對于心血管疾病具有多種的生物活性。在YQFM用于心衰、心絞痛的療效中,人參皂苷類Q-Marker發揮著保護患者血管內皮細胞、改善線粒體功能、抗氧化應激損傷、抗炎等功能。
除以上已經確定的Q-Marker在心衰心絞痛治療中發揮療效之外,人參皂苷Re可以有效抑制缺血再灌注心肌細胞凋亡,減輕心肌損傷[46-47]。Li等[59]采用離體皮下脂肪組織和心外膜脂肪組織體外YQFM給藥24 h,采用HPLC-Q-TOF/MS技術檢測脂肪組織和對照樣品,確定益氣復脈中人參皂苷Rd是結合成分,并采用缺氧復氧實驗發現YQFM和人參皂苷Rd可以顯著增加網膜素的含量。結果表明人參皂苷Rd可能部分介導YQFM的網膜素相關性保護作用。崔如意等[60]利用中醫藥整合藥理學研究平臺V2.0,分析得到人參皂苷Rg1、Re、Rf、Rb2為人參治療心衰的Q-Marker。本課題組采用高效液相色譜技術,建立了一測多評法可以檢測人參皂苷Rd、Re在YQFM中的含量,能夠對其準確定量分析[61]。因此,本文進一步將人參皂苷Rd和人參皂苷Re納入YQFM的Q-Marker中,以期完善YQFM的Q-Marker體系。人參皂苷Re和Rd的化學結構見圖2。
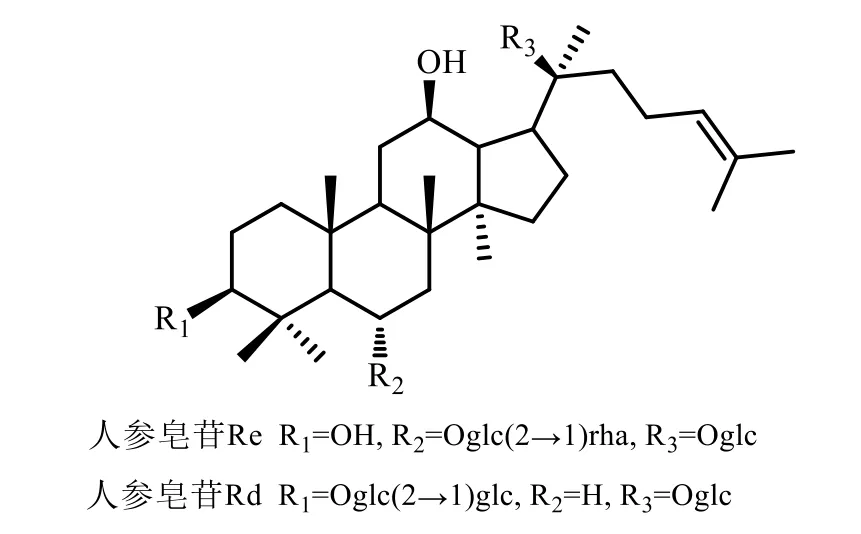
圖2 人參皂苷Re和Rd的化學結構Fig.2 Chemical structures of ginsenoside Re and Rd
3.2 麥冬中Q-Marker與YQFM臨床有效性關系辨識
麥冬為YQFM中的臣藥,其味甘、微苦,性微寒,歸心、肺、胃經,具有養陰潤肺、益胃生津、清心除煩的功效。麥冬的藥效成分主要為麥冬多糖和麥冬皂苷,隨著對麥冬研究的深入,發現其在心腦血管疾病中具有良好的藥理活性。劉春花[62]對麥冬及其化學活性成分在YQFM中治療心血管疾病的作用機制開展了系統性研究。利用大鼠H9c2缺氧-復氧細胞模型和慢性間歇性缺氧小鼠模型探索了麥冬抗缺氧誘導心臟損傷發揮的保護作用及能量代謝調節作用。發現麥冬能較好的保護心臟抵抗缺氧-復氧損傷,在YQFM中具有改善能量代謝的功能。研究結果顯示,麥冬能夠促進糖酵解限速酶6-磷酸果糖激酶(6-phosphofructokinase,6-PFK)和丙酮酸激酶(pyruvate kinase M2,PKM2)的蛋白表達,抑制丙酮酸脫氫酶激酶4(pyruvate dehydrogenase kinase 4,PDK4)的蛋白水平表達,提示麥冬可以通過調節糖代謝限速酶促進能量代謝產能效率。與紅參和五味子相比,麥冬尤其能促進糖酵解中PKM2的蛋白表達,從而促進丙酮酸生成,增加丙酮酸水平。麥冬果糖能夠提高缺氧H9c2細胞上清液中丙酮酸水平,顯著促進PKM2和果糖轉運體(glucose transporter 5,Glut5)的蛋白表達水平。3種皂苷類物質:麥冬皂苷C、麥冬苷元-3-O-α-L-吡喃鼠李糖基-(1→2)-β-D-吡喃葡萄糖苷、偏諾皂苷元-3-O-α-L-吡喃鼠李糖基-(1→2)-β-D-吡喃木糖基-(1→4)-β-D-吡喃葡萄糖苷均顯著降低缺氧-復氧導致的心肌細胞損傷,并能促進能量代謝中間產物丙酮酸的生成,促進能量代謝限速酶6-PFK和PKM2的蛋白水平表達,明顯抑制PDK4的蛋白水平,從而提高丙酮酸脫氫酶的活性。上述結果說明,來源于麥冬的Q-Marker在YQFM中主要通過調節糖代謝限速酶表達和提供足夠的底物來提高糖類能量代謝效率。說明在YQFM臨床治療心血管疾病中,麥冬的Q-Marker發揮著全方位改善能量代謝的重要作用。
3.3 五味子中Q-Marker與YQFM臨床有效性關系辨識
五味子在YQFM配伍中為佐藥,具有收澀、斂陰止汗之功效。其主要活性成分五味子醇甲被確定為YQFM中的Q-Marker。研究顯示,五味子醇甲具有較強的抗炎活性,能夠顯著降低角叉菜膠引起的大鼠足部腫脹和醋酸引起的大鼠血管通透性增加,其抗炎活性與抑制COX-2和iNOS蛋白表達有關[63]。楊敏[64]研究顯示,五味子醇甲可降低去甲腎上腺素誘導的心肌細胞凋亡并提高心肌細胞存活率,對心肌細胞的形態具有改善作用,其機制與下調心肌肌鈣蛋白T、心肌肌鈣蛋白I和內皮素-1的表達,降低炎性反應有關。此外,五味子醇甲有保護血管內皮細胞作用,五味子醇甲10~100 mmol/L能夠減少HUVECs細胞的缺氧復氧損傷,增加細胞活力和一氧化氮水平,降低LDH和丙二醛含量,減少細胞內活性氧的生成[65]。上述結果表明,作為QMarker的五味子醇甲在YQFM對心血管疾病的臨床治療中,主要通過抗炎、保護心肌細胞機制發揮作用。
綜上所述,在前期研究基礎上,納入人參皂苷Rd和人參皂苷Re作為YQFM的Q-Marker。QMarker的數量與各自組方藥材在YQFM配伍原則中的地位相對應,各Q-Marker具有不同的藥效機制與作用靶點,其在YQFM臨床療效中發揮著不同效用。YQFM的Q-Marker藥效機制與其臨床療效相關性分析結果見圖3。
4 結語
YQFM在臨床上主要用于心力衰竭、冠心病心絞痛等心血管疾病的治療,其作用機制包括增強心臟的收縮功能、延緩心室重構、抗炎、抗氧化、保護心肌損傷、改善線粒體功能、抑制細胞凋亡、改善能量代謝等。YQFM中15個Q-Marker具有不同的藥效活性特點和對應靶點,分別從不同的活性機制實現YQFM在臨床上對冠心病、心絞痛等心血管疾病的治療作用。其中,10個來自于君藥紅參的皂苷類成分具有保護患者血管內皮細胞、改善線粒體功能、抗氧化應激損傷、抗炎等功能。4個來源于臣藥麥冬的成分(3個麥冬皂苷和果糖)可以通過調節糖代謝限速酶表達和提供足夠的底物來提高糖類能量代謝效率,有效改善患者的能量代謝。佐藥五味子中的五味子醇甲能夠通過抗炎、保護血管內皮細胞功能發揮作用。YQFM是遵照經典的中藥配伍理論組方而成的中藥復方制劑,來自組方藥材紅參、麥冬和五味子的Q-Marker以不同的生物活性對心血管疾病發揮作用。
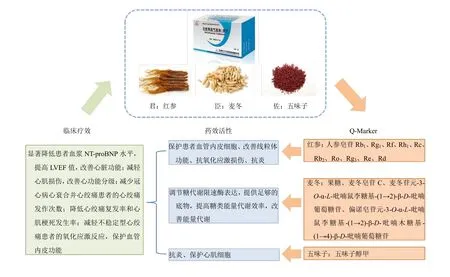
圖3 YQFM中Q-Marker的藥效機制與其臨床療效相關性分析Fig.3 Correlation analysis between Q-Marker of YQFM,pharmacodynamic mechanism,and clinical efficacy
中藥產品的質量控制是中藥產業長期健康發展的核心問題。在明確中藥制劑臨床有效性及其作用機制的基礎上,發掘其化學物質基礎并對其實施有效控制是解決該問題的關鍵。中藥Q-Marker創新理念及其“性-效-物”三元論方法學體系,為中藥物質基礎表征、中藥Q-Marker發現以及質量評價系統的建立開辟了新的研究模式與思路。辨析中藥制劑的Q-Marker與其臨床療效之間的關系,能夠從臨床實踐角度進一步佐證Q-Marker選擇的科學性,并為產品質量的全面表征與控制提供充實的依據。本文在前期對YQFM所含Q-Marker預測研究結果之上,進一步分析了YQFM臨床療效機制與其Q-Marker作用機制之間的內在關系,揭示了Q-Marker在YQFM臨床治療心血管疾病中發揮的關鍵作用,佐證了Q-Marker的合理性,為構建更加全面的產品質量評價體系提供了基礎。中藥Q-Marker借助于中藥Q-Marker創新理論與方法學篩選,結果反映了中藥傳統藥性配伍理論的物質本源。本文將中藥QMarker理論體系成果與現代臨床研究的有效性證據相結合,通過Q-Marker客觀實體將傳統中藥藥性配伍理論與現代臨床研究達成統一,充分證明中藥Q-Marker理論在現代中藥基礎研究中發揮的作用與應用前景。
利益沖突所有作者均聲明不存在利益沖突

