黑磷納米片應用及生物毒性研究進展
向思靚,曾潔,阮鋒凱,左正宏,何承勇
廈門大學生命科學學院,細胞應激生物學國家重點實驗室,廈門 361102
黑磷(black phosphorus, BP)是納米材料家族的新成員,主要包括黑磷量子點(black phosphorus quantum dot, BPQD)、黑磷納米顆粒(black phosphorus nanoparticle, BPNP)和黑磷納米片(black phosphorus nanosheet, BPNS)。2014年,Li等[1]將二維層狀BPNS從塊狀黑磷(Bulk-BP)中剝離出后,便引起了研究人員的廣泛關注。BPNS是二維結構材料,由單原子層厚度的納米片堆積而成。BPNS的層狀結構賦予其較大表面積,有利于在醫學上用于藥物運載[2]。BPNS可通過機械剝離[3]、液相剝離[4]或電化學剝離[5]等方法制備。隨著納米技術的飛速發展和人們對BP材料的研究深入,BPNS在生產生活中的應用會愈加廣泛,我們可能頻繁接觸到BPNS,或使用BPNS制成的藥物,因此,有必要深入了解BPNS對人體和生物體潛在的影響。近期Qu等[6]全面詳細地綜述了BP相關研究進展,從BP的物理化學特性、合成、鈍化、生物醫學應用,到BP與生物分子、細胞、動物間的相互作用,以及BP潛在的生態風險和BP的改性修飾。這篇綜述對BP納米材料實驗研究的開展及未來發展方向,提供了重要的指導。本文主要關注和論述BPNS的生物毒性研究進展,試圖更詳細地分析BPNS對人體和環境生物的影響,闡述BPNS生物安全性研究的現狀與不足,為將來的研究提供方向和思路。
本文首先簡要介紹BPNS在電子、光電、電化學、環境和生物醫學等領域的應用前景,并從BPNS的環境危害和健康危害的角度進行綜述。通過對環境生物包括細菌及單細胞水生生物的毒性檢測,來評估BPNS潛在生態風險。通過對哺乳動物體內外毒理實驗綜述,以期評估BPNS對人類的健康風險。由于哺乳動物的結構更加復雜、生命周期更長,BPNS與其之間的相互作用更加繁雜。但不管是哺乳動物還是單細胞生物,BPNS對它們的毒性機制可能存在一定的相似之處,比如BPNS與生物膜界面的相互作用方式、BPNS體內降解產物誘發毒性損傷等。本文重點論述國內外在BPNS生物毒性方面的研究進展,為開發應用更加安全、更加環境友好的BP納米材料提供科學依據。
1 BPNS的結構性能及應用(Structural performance and application of BPNS)
1.1 BPNS的結構性能
BP屬于磷的一種同素異形體,相比于白磷和紅磷,它的活性較弱,在空氣中不易自燃,比較穩定[7]。BP晶體具有層狀結構,該結構是由正交晶體中的褶皺六邊形環組成[8]。而BPNS是BP的單層或幾層形式,在其層狀結構中,每個磷原子都與相鄰的3個磷原子通過共價鍵結合,從而形成了沿鋸齒狀方向的雙層結構和沿扶手椅方向的皺縮結構。層間靠范德華力維系[9]。這種結構對于BPNS的光學特性、力學特性、導電性能以及拓撲結構都有重要影響。
相比其他二維材料,BPNS擁有獨特的優勢。石墨烯近10年來發展迅速,但其零帶隙結構特點限制了石墨烯在半導體領域的應用[10]。而BPNS的帶隙取決于它的層數,可剝離成少數幾層,故它擁有可調節的帶隙寬度,若應用于光電設備,可優化設計,提高靈活性[11]。BPNS在平面內還有極高的各向異性,可應用于生物傳感[12]。同時,BPNS能夠廣泛吸收可見光、紅外光以及紫外光,擁有優異的光學性能[13]。BPNS還有很高的開關電流比,可應用于場效應晶體管傳感[14]。相比于MoS2,BPNS有很高的載流子遷移率,可應用于氣體傳感器等領域[14]。此外,BPNS還擁有很高的生物相容性,在體內可降解為對人體無害的磷酸鹽,這是其他無機納米材料所不具備的,具有應用于生物醫學領域的良好前景。總的來說,BPNS具有直接帶隙、高度各向異性、廣譜光吸收性、高開關電流比、高載流子遷移率和高生物相容性等優點。因此,BPNS在電子、光電、電化學、環保和生物醫學等領域具有廣泛的應用前景(圖1)。

圖1 黑磷納米片(BPNS)結構及應用領域Fig. 1 The structure and applications of black phosphorus nanosheet (BPNS)
1.2 BPNS的應用
1.2.1 BPNS在電子、光電及電化學領域的應用
在2014年,新型的BPNS二維半導體材料出現后,由于其場效應與硅相似,有望代替硅,應用于制作場效應晶體管。研究發現,BPNS場效應管可進行雙極操作[15],優化傳輸性能[16]。另外,納米BPNS對周圍環境非常敏感,當處于氣體環境或有氣體吸附其上時,電阻率會發生變化,因此可用于制備氣體傳感器[17-18]。
由于有可調帶隙,BPNS吸收能量后,可以光子形式將能量再釋放出來。因此,BPNS能夠高效地將電信號轉化為光信號。BPNS還可廣泛吸收紅外光、可見光以及紫外光,可制備優良的光電元件[19-20]。
BPNS的可調帶隙特性使得它還可作為電化學裝置中的電極材料。以BPNS作為電極材料,制備的超級電容器,具有快速的充電/放電速率,高功率密度以及長循環壽命等優勢[21]。BPNS也可用于鋰離子電池的陽極,如此制得的電池具有高容量、高導電性和長壽命[22]。
1.2.2 BPNS在生物醫學領域的應用
由于BPNS尺寸較小,它可以利用腫瘤的增強滲透滯留效應,在腫瘤部位富集。同時,相比于小分子藥物,BPNS又不至于因為尺寸太小而被腎臟過濾排出[2]。除此之外,由于BPNS的本質是磷元素,而磷元素是生物體的大量元素之一,故BPNS擁有出色的生物相容性。BPNS還擁有良好的光敏和光動力特征。因此,BPNS在生物醫學領域擁有巨大的應用前景。
BPNS被光照射后,能將其吸收的光子能量以熱能形式散發,然后引起溫度迅速升高。而當溫度升高到一定時,腫瘤細胞可被誘導凋亡。因此BPNS可制成高效的光熱制劑,用于光熱療法(photothermal therapy, PTT)。通過對腫瘤細胞BPNS富集部位局部照射,抑制腫瘤的生長,同時減少周圍正常細胞的損傷[23-24]。BPNS還可以制成光敏劑,用于光動力治療(photodynamic therapy, PDT)。研究表明,在整個可見光區域里,超薄BPNS在腫瘤細胞內產生活性氧(reactive oxygen species, ROS)[25],進一步抑制腫瘤細胞增殖、誘導凋亡。相比其他光敏劑,BPNS所需量更少,產生ROS需要光照時間更短[26]。更重要的是,BPNS在光照下可以轉化為生物相容性良好的磷酸鹽化合物,生物殘留少。另外,在Yang等[27]研究中,BPNS可與糖酵解抑制劑協同作用,可以抑制自噬和能量代謝,有望在腫瘤饑餓治療中發揮重要作用。
由于BPNS的比表面積大,它還可以作為藥物載體,與帶正電的小分子藥物結合。相比其他二維納米材料,BPNS載藥量較大[28]。而且,在酸性腫瘤微環境下,BPNS能快速釋放藥物;以BPNS作為藥物載體,還可保持藥物的穩定狀態且對生物體副作用較小[29-30]。
研究表明,BPNS可用于治療金屬離子濃度過高導致的神經退行性疾病。由于BPNS可以選擇性地捕獲Cu2+,降低神經毒性。而且在近紅外光(near infrared, NIR)照射下,BPNS透過血腦屏障比例顯著提高,還能抑制神經細胞凋亡[31]。BPNS所制成的復合支架在輕度氧化應激刺激下,可誘導血管和神經生成,促進軸突伸長和髓鞘增厚[32]。除了神經損傷修復以外,BPNS還可用于骨再生[33],修復腫瘤引起的骨缺損;還可作為傷口敷料,在NIR照射下,能顯著促進傷口愈合和皮膚再生[34]。
1.2.3 BPNS在環境與能源領域的應用
太陽能產氫是綠色環保的新方法,但需要非常高效的光催化劑。BPNS具有可調帶隙和高載流子遷移特性,可利用以BPNS為原料設計的光催化劑來實現電子有效遷移,驅動水分解反應[35]。BPNS經過可見光和NIR活化,可催化氫氣產生,快速析出氫氣[36-37]。BPNS作為光催化劑,還可用于污染物降解,解決環境污染問題[38-40]。
2 BPNS的環境危害(Environmental hazard of BPNS)
2.1 BPNS對細菌毒性
Xiong等[41]研究了BPNS對2種模式細菌——大腸桿菌和枯草芽孢桿菌的毒性,結果表明,BPNS的毒性呈現時間和劑量依賴性。當BPNS濃度為100 μg·mL-1時,其對大腸桿菌的殺菌效果最大可達91.65%,對枯草芽孢桿菌可達99.69%。相比于枯草芽孢桿菌,BPNS處理6 h時對大腸桿菌的毒性更強,隨后毒性減弱。其原因可能是大腸桿菌的細胞壁相較薄,對BPNS更敏感,在更早期就表現出毒性反應。另外,由于大腸桿菌外膜有自我修復能力,使得毒性部分逆轉,隨著暴露時間推移BPNS對大腸桿菌的毒性降低。BPNS的殺菌機制主要是產生ROS和破壞細胞膜。Ouyang等[42]用銀納米粒子(Ag nanoparticles, AgNP)修飾BPNS,構建了Ag@BP納米雜化物。Ag@BP經NIR照射,可在短時間內通過局部高溫殺死金黃色葡萄球菌,顯示出良好的殺菌能力。
2.2 BPNS對水生單細胞生物毒性

綜上所述,BPNS對于環境生物具有較顯著的毒性,可破壞生物膜結構,甚至導致死亡。其次,BPNS會通過吞噬內在化或降解成磷酸鹽,干擾水生生物的正常生長、代謝和繁殖等,以上研究表明BPNS對環境生物具有毒性效應,可能對生態環境造成不良影響(表1)。
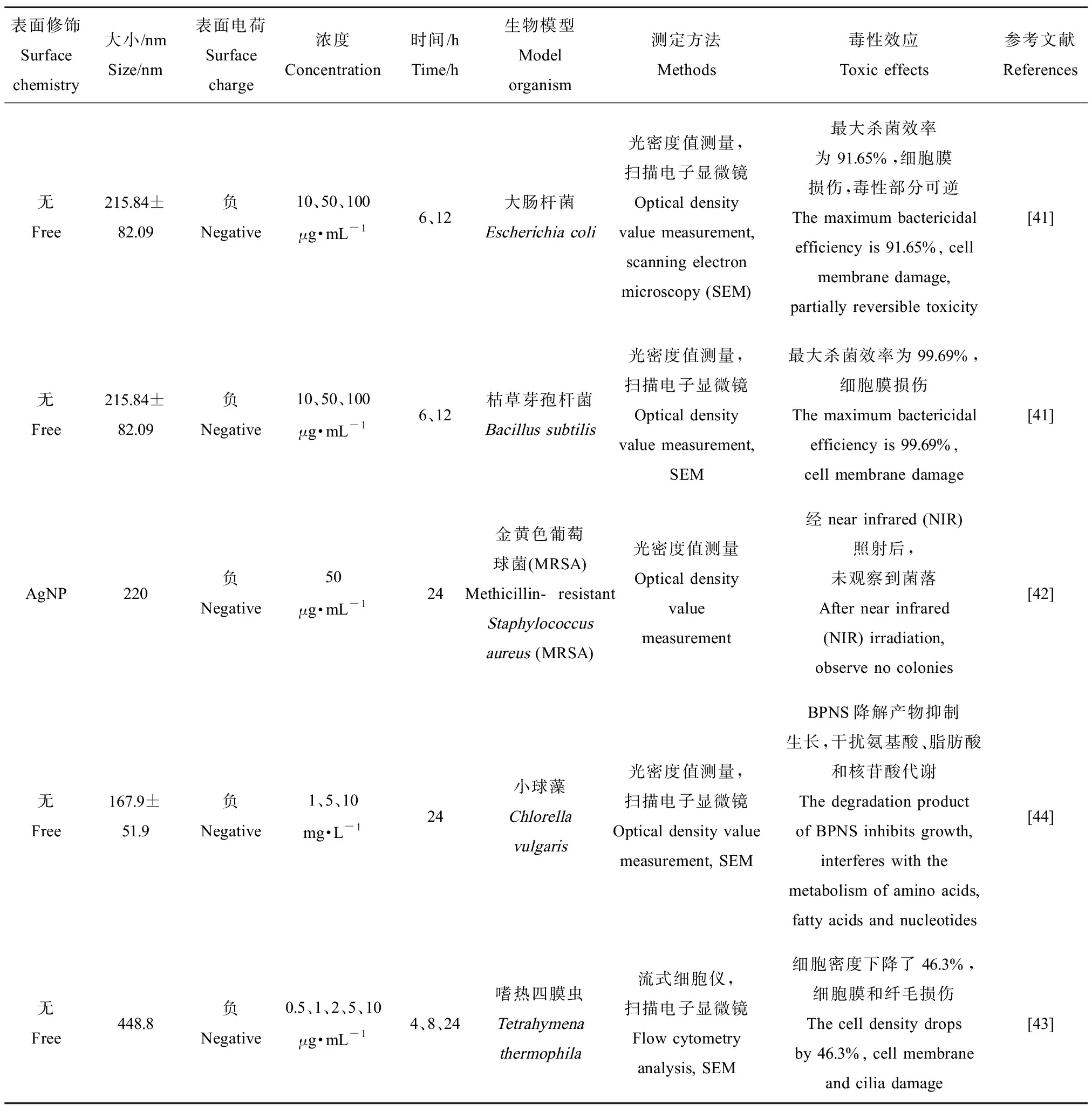
表1 BPNS對環境生物的毒性Table 1 Toxicity of BPNS on environmental organisms
3 BPNS健康危害(Health risks of BPNS)
納米材料尺寸較小,易穿透各種屏障。但同時,納米材料在人體內半衰期長、不易被清除,容易積累在特定的細胞或組織,可能對機體造成損害。而且,納米材料的組成、橫向尺寸、厚度、表面功能化和晶體結構等都能影響其在生物界面上的作用[45]。BPNS由于其獨特的物理化學性質,在生物醫藥領域被寄予厚望。隨著BPNS將來廣泛應用,BPNS對哺乳動物毒性研究是必不可少的。
3.1 BPNS體外毒性
BPNS毒性主要集中在體外細胞毒性研究。我們將主要從BPNS的細胞毒性及修飾對細胞毒性影響進行論述。
Qiu等[46]為了檢測BPNS細胞毒性,用不同濃度BPNS處理MDA-MB-231、A549、HeLa和B16這4種細胞,結果顯示,即使在200 μg·mL-1高濃度下,也幾乎沒有觀察到毒性作用。Chen等[28]將BPNS與紅細胞共培養8 h,溶血率<5%;然后又測試了BPNS對4T1、HeLa、L929和A549這4種細胞的毒性,發現當BPNS濃度高達200 μg·mL-1時,也幾乎沒有毒性作用。相反地,Latiff等[47]將不同濃度BPNS處理A549細胞,BPNS細胞毒性具有劑量依賴性,50 μg·mL-1BPNS可將細胞存活率降至48% (WST-8法檢測)和34% (MTT法檢測),細胞毒性介于石墨烯和MoS2之間;他們還觀察到,高濃度的BPNS由于對光具有顯著的吸收作用,對WST-8和MTT這類通過檢測吸光度值的實驗結果存在干擾。在后續研究中[48],比較了磷其他同素異形體(紫磷和紅磷),以及氣相生長的BP (BP VPG)和高壓轉化的BP (BP HPC)細胞毒性,發現BP細胞毒性較紫磷和紅磷更高,較薄的BP HPC比BP VPG毒性大,另外氧化比例高的磷材料毒性更大。
Zhang等[49]的研究證明BPNS的細胞毒性還有材料尺寸大小和靶細胞類型依賴性。橫向尺寸和厚度最大的BPNS表現出最強細胞毒性,而尺寸過大的BPNS可直接破壞細胞膜的完整性,導致細胞內容物釋放,甚至細胞死亡。并且不同細胞系敏感性有所差異,該實驗中對BPNS的敏感度順序為293T>NIH3T3>HCoEpiC。Song等[50]研究了BPNS對成纖維細胞L-929的毒性,結果表明,毒性與BPNS濃度及暴露時間成比例,且毒性機制是氧化應激介導的代謝活性降低與膜完整性破壞。Sun等[51]的BPNS體外研究結果表明,BPNS會降低人支氣管上皮細胞活力,且具有時間和劑量依賴性。機制研究表明,BPNS會降低線粒體電位,導致細胞內ROS增加,進而活化caspase-3,引起細胞凋亡。
另外,Mo等[53]的研究證明,血漿蛋白會吸附到BPNS上,形成BP納米材料-蛋白冠復合物,這會影響巨噬細胞的攝取,且復合物激活了NF-κB通路,使得促炎細胞因子分泌增加,增強巨噬細胞的促炎和免疫干擾作用。為了進一步開發可有效用于生物醫學的BPNS,后續應更加關注BPNS的修飾,控制蛋白冠的形成。另一方面,Zhang等[54]研究了BPNS與牛血清白蛋白(bovine serum albumin, BSA)和牛血紅蛋白(bovine hemoglobin, BHB)的結合機理,結果表明,BPNS抑制了BSA和BHB的固有熒光,誘導了蛋白質肽鏈的延伸,改變了BHB的三級結構,破壞了BHB與膽紅素的結合域。Tao等[55]的研究表明,聚乙二醇(polyethylene glycol, PEG)修飾的BPNS可使自噬體數量顯著增加,誘導癌細胞自噬。
在環境條件下,BPNS較不穩定性,對氧氣和水具有很高的反應性,導致化學變化、發生降解[56]。BPNS降解速率也影響它的毒性,而降解速率與BPNS的厚度和表面修飾關系密切,較薄的BPNS降解速度更快[57]。目前,針對BPNS的不穩定性,研究人員已從多個方面進行改良。例如,Zhao等[58]使用幾種不同的離子溶液,再結合研磨與超聲處理,剝離到厚度分別為3.58、5.50和8.90 nm的多層BPNS。Zhao等[56]將磺酸鈦配體(TiL4)用于BPNS的表面配位,配位后的BPNS在水環境中或長期暴露于空氣時,均表現出良好的穩定性,顯著延長了BPNS壽命。Qu等[59]的研究表明,TiL4配位的BPNS可逃避巨噬細胞的攝取,并減少細胞毒性和抑制促炎作用。還有聚多巴胺[60]、尼羅藍染料[61]等也被應用于BPNS的表面修飾,增強其穩定性。
細胞毒性機制可能是BPNS誘導細胞內產生ROS,進而致使其凋亡,還可破壞生物膜的完整性。而且BPNS進入細胞內,還可能誘導細胞自噬。除此之外,BPNS可形成蛋白冠影響免疫細胞的功能,還可導致某些特定蛋白質結構的改變。
總而言之,BPNS的體外毒性呈現出劑量、時間、尺寸以及靶細胞類型依賴性,且與BPNS降解速率相關。為了更加準確地測定BPNS毒性,需要運用多種標準方法綜合評價其體外毒性,以減少不同方法間的系統誤差。研究細胞毒性時,為了減少細胞敏感性差異,還需要采用多種細胞系綜合判定。而且,有必要區別BPNS對腫瘤細胞和正常細胞的影響,如果BPNS在治療腫瘤方面應用,應對腫瘤細胞有較好的抑制作用,而對正常細胞的影響可忽略不計[62]。目前,納米材料體外毒性評價主要是利用二維培養的細胞系,可以利用原代細胞[63]、干細胞[64]、誘導性多潛能細胞[65],以及類器官等模型進行毒性評估。其中,類器官在體外環境下培育形成,具備類似真實器官的三維結構,能部分模擬來源組織或器官的生理功能,類器官比二維培養細胞更具代表性,具有類似組織的三維結構和細胞間相互作用,維持細胞對藥物、污染物的代謝能力,因此在納米材料生物安全性評價等方面具有誘人的應用前景[66]。我們前期成功構建出小鼠腎類器官,并利用它篩選發現BPQD具有腎臟毒性,其敏感性顯著高于二維培養的人近曲小管上皮細胞株HK-2,同時還發現BPQD會引起胰島素敏感度下降以及內質網應激。類器官將來也可應用于BPNS生物安全性評價和毒性機制研究[67]。針對不同尺寸、電荷和修飾的納米材料,需要充分比較這些物理化學特征及其對BPNS毒性影響,可以運用計算毒理學的技術手段找到影響生物安全性的關鍵影響因素。關于BPNS毒性效應機制的研究,需要區分是BPNS本身還是其降解產生的磷酸鹽導致的毒性[43]。此外,僅僅有體外毒性評價遠遠不夠,需要進行開展體內暴露實驗,才能更全面的評價BPNS的生物安全性。表2歸納了相關文獻中有關BPNS的細胞毒性的實驗及結論。

表2 BPNS對不同細胞的毒性Table 2 Toxicity of BPNS to different cells
3.2 BPNS體內毒性
關于BPNS的體內暴露實驗較少,對于其體內毒性效應還不甚清楚。本文也將從目前僅有的BPNS毒性效應和機制進行論述。
Shao等[68]制備了結合BPNS的溫度敏感水凝膠(BP@PLEL),可用于PTT治療癌癥。單次皮下注射BP@PLEL到小鼠的背部,20 d后,主要器官無明顯病變。Chen等[28]在給健康小鼠單次注射BPNS,7 d后未檢測到肝腎功能的明顯變化。Jin等[69]合成了負載有藥物氟西汀(fluoxetine, Flu)的BPNS用來治療抑郁癥,體內毒性研究結果顯示,小鼠的血液生化指標均正常,肝腎功能無顯著變化。Hou等[70]通過實驗發現,BPNS會優先積累在腎臟,在生物體內最終降解為PxOy離子,對心、肝、脾、肺和腎均無明顯損傷。Sun等[71]向小鼠靜脈注射100 μg PEG修飾的BPNP,通過組織病理學分析,沒用觀察到明顯的器官損傷。然而在Sun等[51]的研究中,單次注射的BPNS(20 mg·kg-1)對小鼠器官沒有明顯損傷,但當3次注射BPNS后,小鼠的肝臟和腎受損,不過一定時間后可恢復正常。Kong等[72]的研究表明,低劑量時BPNS可用于抑制腫瘤和藥物負載,當小鼠靜脈注射過高劑量的BPNS(30 mg·kg-1)時,肝臟與腎臟內的ROS增加,并觀察到水腫現象,炎性細胞浸潤導致的凝固性壞死,淋巴細胞浸潤,腎小球萎縮以及腎小管腫脹。在表3中歸納了以上關于BPNS急性暴露后體內毒性損傷效應。

表3 BPNS體內毒性Table 3 In vivo toxicity of BPNS
總體而言,目前BPNS體內毒性試驗一般都是單次急性暴露,大部分結果顯示BPNS相對比較安全,但劑量過高會引起組織損傷和炎癥反應。另外,Qu等[59]發現當給小鼠按500 μg·kg-1靜脈注射暴露于BPQD后,短時間內會出現明顯的炎癥反應,例如嗜中性粒細胞數量增加,一部分炎癥細胞因子濃度升高。長時間后癥狀消失。Mu等[73]評估了BPQD對機體的毒性,其體內研究表明,BPQD可短暫地誘導氧化應激反應和脂質過氧化,降低過氧化氫酶活性,誘發DNA斷裂以及骨髓有核細胞損傷,但這些損傷可逐漸恢復。這些BPQD相關的體內毒性研究結果可能對于BPNS毒性研究具有一定參考價值,但是否完全相似有待后續研究比較。
然而,僅有急性毒性數據不足以全面評價BPNS生物安全性,需要繼續開展體內急性重復暴露、亞急性、亞慢性、慢性暴露實驗,以及遺傳毒性、生殖毒性、代謝動力學等方面實驗。另外,目前組織病理實驗主要是觀察肝、腎、心、肺、脾。而之前有研究表明,一些無機納米材料可對腸道或胰腺產生損傷,可能促進炎癥性腸病,導致腸道屏障功能異常,以及影響腸膜的正常結構,致使腸道通透性增加,損害胰腺的正常功能,從而影響代謝[74-77]。BPNS如果長期重復暴露,也可能會對腸道及胰腺產生不良作用。除了小鼠之外,也還需對其他模式動物如爪蟾、斑馬魚、四膜蟲和線蟲等,進行BPNS的潛在毒性研究。
4 總結與展望(Summary and prospect)
近些年來,BPNS在很多領域成為熱門,與此相關的研究也日益增多。雖然BPNS在電子學、光電學、電化學、環境以及生物醫學尤其是腫瘤治療方面取得了可喜的進展,但還必須考慮BPNS對機體以及環境可能存在的毒性效應。影響BPNS毒性的因素有很多(圖2),BPNS對不同類型的細胞引起的毒性效應可能不盡相同,不同尺寸的BPNS對同種細胞的毒性效果也存在差異,文獻結果表明尺寸大的BPNS毒性可能更大[49]。暴露時間、材料濃度和降解速率也是影響BPNS毒性的重要因素。另外,檢測方法在一定程度上也可影響實驗結果。對BPNS進行表面修飾可改變其毒性大小,如PEG、水凝膠、聚多巴胺和TiL4等,修飾后可中和BPNS表面部分負電荷,增強納米材料穩定性,降低毒性效應。

圖2 BPNS毒性作用和毒性影響因素注:ROS表示活性氧。Fig. 2 The toxic effects of BPNS and its influencing factorsNote: ROS means reactive oxygen species.
在毒性機制方面(圖3),BPNS可在細胞內產生ROS,引起氧化應激、相關酶活性下降和DNA損傷,最終誘導細胞凋亡[51, 72]。BPNS進入細胞內還可導致自噬體數量增加,誘導細胞自噬[55]。層狀的BPNS還可破壞細胞膜的完整性,釋放內容物,導致細胞死亡[50]。BPNS還能對免疫細胞[53]和血漿蛋白[54]產生影響,導致溶血現象[28]。

圖3 BPNS生物毒性機制Fig. 3 Mechanisms of BPNS’s biotoxicity
目前,關于BPNS的生物毒性和機制均未完全了解。在毒性評估過程中,細胞類型會影響BPNS毒性檢測結果,所以將來研究要以多種細胞系作為研究對象。還可以用原代細胞[63]、干細胞[64]以及類器官[65-66]等更接近人體細胞或真實體內環境的模型,評估BPNS納米材料生物毒性效應和作用機制。其次,在研究BPNS細胞毒性時,最好運用多種標準的方法綜合評估,以減少不同方法間的系統誤差。再者,還要分析比較BPNS材料本身物理化學性質對生物毒性的影響,例如尺寸、形狀、聚集狀態、電荷密度和帶隙等。表面修飾也會影響BPNS穩定性和降解速率。例如,有研究通過粒子摻雜和表面鈍化等方式設計出更安全的納米材料[78],這也為解決BPNS將來在臨床轉化中的安全性問題提供了一個思路。
動物實驗對于全面評估BPNS毒性至關重要,現有關于BPNS體內毒性研究還不夠全面、深入。(1)目前BPNS體內毒理學實驗較少,實驗對象也局限在小鼠上,缺乏對BPNS在其他脊椎動物體內的研究,如魚類、兩棲類等。Peng等[79]將體外建立的氧化應激模式應用于水生生物斑馬魚體內,以此來評估納米顆粒對生物的潛在損傷作用。(2)BPNS缺乏急性重復、亞急性和慢性暴露實驗數據,目前實驗多數采取的是單次急性暴露。將來BPNS大量投入使用,人們勢必在日常生產、生活中通過接觸、攝入、吸入等多種方式頻繁暴露于BPNS。因此,有必要開展多種途徑、長期毒性暴露實驗。(3)還要研究BPNS對不同器官、組織的影響,尋找BPNS的毒性靶器官,全面評估BPNS生物安全性,深入研究揭示BPNS的毒性機制。(4)在對BPNS納米材料進行風險評估時,應該將暴露特征與潛在危害綜合起來分析。如同Lin等[80]總結了納米材料進入水環境的潛在接觸途徑、納米材料的命運、在不同介質間的轉移,以及使用模式生物進行的毒性測試,以此對納米材料進行更系統的風險評估。
總而言之,BPNS與生物大分子及生態環境之間的相互影響和作用機制亟待開展研究,BPNS生物安全性研究有助于其未來的安全應用,可促進BP納米材料的產業轉化,保障人群和生態環境健康。

