花期高溫干旱對玉米雄穗發育、生理特性和產量影響
閆振華,劉東堯,賈緒存,楊琴,陳藝博,董朋飛,王群
花期高溫干旱對玉米雄穗發育、生理特性和產量影響
閆振華,劉東堯,賈緒存,楊琴,陳藝博,董朋飛,王群
河南農業大學農學院/省部共建小麥玉米作物學國家重點實驗室,鄭州 450046
【】全球季節性高溫、干旱已經成為影響作物生長發育和產量形成的主要限制性因素,本研究通過人工模擬階段高溫干旱氣候特征,旨在探究夏玉米花期高溫、干旱以及高溫干旱復合脅迫對其雄穗發育、生理特征及產量形成的影響。連續2年利用人工智能溫室,采用盆栽試驗,以鄭單958(ZD958)和華農138(HN138)為試驗材料,設置對照(CK)、高溫脅迫(T)、干旱脅迫(D)和高溫干旱復合脅迫(TD)4個處理,研究了夏玉米雄穗形態、花藥、花粉結構、花粉活力及雄穗抗氧化指標和產量對花期高溫、干旱的響應特征。2年結果表明,高溫、干旱及復合脅迫使玉米雄穗分枝數、主軸小花數和分枝小花密度顯著減少,T處理3個參數分別平均比CK減少17.31%、15.70%、13.56%,D和TD處理分別比CK減少33.85%、24.87%、27.08%和45.59%、32.02%、26.00%,干旱及復合脅迫使玉米雄穗主軸比CK平均顯著縮短23.64%和27.51%。花期高溫、干旱脅迫均導致花藥皺縮變形,絨氈層細胞結構松散,花粉粒表面凸起,復合脅迫加劇了花藥皺縮變形,絨氈層細胞裂解,藥隔維管束變細減少,花粉粒網紋狀凸起更為明顯,萌發孔內陷。高溫、干旱及復合脅迫顯著降低雄穗日散粉量,T、D和TD處理日散粉量分別比CK平均減少22.18%、54.75%和67.28%,且使最大散粉量日期提前;T、D和TD處理高活力花粉所占比例顯著低于CK,且兩兩間差異達顯著水平。T處理雄穗SOD、POD酶活性升高,較CK平均提高21.91%、32.50%,D和TD處理較CK平均增加24.95%(SOD)、53.37%(POD)和17.12%(SOD)、67.24%(POD),峰值均與CK有極顯著差異;T、D和TD處理下雄穗MDA含量較CK平均增加44.18%、64.24%和79.12%,含量較CK平均增加22.55%、51.65%和72.29%,處理間峰值差異達顯著水平。高溫、干旱及復合脅迫導致玉米產量和行粒數大幅度降低,T、D和TD產量比CK平均降低18.05%、34.58%、46.24%,行粒數比CK平均減少24.58%、41.80%和52.99%。脅迫處理下,2個品種以HN138雄穗分枝數、主軸小花數和分枝小花密度下降幅度大于ZD958,且HN138的高活力花粉占比和散粉量比ZD958分別減少27.00%和17.28%;HN138花藥和花粉結構畸變程度超過ZD958,其抗氧化酶活性升高幅度小于ZD958,但MDA和含量比ZD958高13.07%和20.29%,2個品種以HN138對高溫、干旱及復合脅迫響應更為敏感。玉米花期高溫、干旱及復合脅迫顯著抑制雄穗生長發育,導致花藥和花粉形態結構畸變,抗氧化酶活性降低,散粉量顯著減少,導致穗粒數減少,最終導致產量下降;且高溫干旱復合脅迫對玉米雄穗的影響大于干旱脅迫大于高溫脅迫,不同類型品種對高溫、干旱的響應程度不同。
夏玉米;高溫干旱;雄穗形態;花粉結構與活力;抗氧化酶活性;產量
0 引言
【研究意義】玉米是世界重要的糧食和飼料作物,是我國第一大糧食作物,在保障國家糧食安全中有著不可替代的作用[1]。2019年IPCC報告指出,隨著全球氣候變暖,未來極端高溫天氣出現頻率將從過去的3.5%增加到4.5%以上,且中國北方未來暖干化趨勢越來越明顯[2-3]。黃淮海平原是我國重要的夏玉米產區,近年來在玉米生育期內(6—9月)>35℃高溫天氣出現頻率呈逐年上升趨勢,尤其以玉米花期(7—8月份)最為明顯[4],且高溫與干旱時常相伴相隨[5],嚴重影響著玉米結實率和產量。【前人研究進展】研究表明,玉米花期高溫、干旱脅迫導致玉米葉片凈光合速率和氣孔導度下降,葉片中光合產物不同程度降低[6-8]。高溫、干旱脅迫對玉米生殖生長的影響遠遠大于對營養生長的影響,對雄配子(花粉粒)生長發育的影響大于雌配子[9]。玉米抽穗至開花期是對高溫最敏感的時期,此期高溫熱害極易引起花粉敗育,無法正常開花散粉,致使雌穗不能受精而形成空粒,結實率大幅下降,玉米嚴重減產[10]。花粉粒的膨大是花藥開裂的原初動力之一,高溫、干旱脅迫阻礙了花粉粒吸水膨脹過程[11],花藥開裂不全或不開裂,花粉發育異常,影響花粉正常生理功能,使產量下降[12]。研究發現,高溫脅迫使水稻花藥藥隔結構解體,絨粘層細胞排列混亂,最終導致花粉敗育[13-14]。高溫和干旱脅迫均會使玉米雄穗分枝數減少,雄穗主軸長縮短且低于頂葉,形成封閉桶,致使桶內形成無效花粉或花粉量不足[15]。高溫、干旱對植株生理特性也有顯著影響,逆境使植株體內大量ROS積累,ROS通過激活植株體內的抗氧化系統以調控其對逆境脅迫的響應[16-19]。研究表明,對花期玉米植株增溫處理3—8 d后,植株中ROS積累,超氧化物歧化酶、過氧化物酶和過氧化氫酶活性顯著升高,雄穗中可溶性糖和可溶性蛋白含量呈增加趨勢[20]。而花期干旱脅迫亦導致玉米葉片抗氧化酶活性、細胞滲透調節物含量不同程度上升,源庫平衡被破壞[21]。作物生殖器官對逆境脅迫也會產生反饋效應,當花粉感知高溫或干旱信號后,可通過質膜上的鈣離子通道、未折疊蛋白反應、活性氧的積累以及含有組蛋白H3的核小體等途徑實現對逆境脅迫的響應和反饋[22-25]。相對單一脅迫而言,復合脅迫加劇了逆境對作物形態和生理特性的影響,并協同降低作物產量和生產力[26];但是,復合脅迫對作物的影響并不是單一脅迫的簡單相加效應,且很少能夠從單一脅迫中預測出來其影響力度[27-29]。【本研究切入點】過去大量研究集中在單一脅迫對玉米穗發育、生長和產量的影響,而對復合脅迫下玉米雄穗生長發育、生理特征及二者復合疊加效應研究較少。當前夏玉米實際生產中,復合脅迫如高溫和干旱往往是相伴或相繼發生,尤其在黃淮海夏玉米區高溫干旱疊加多發生于抽雄至散粉期(7月下旬至8月上中旬),即玉米穗發育和散粉關鍵時期,二者已成為限制玉米產量形成的2個重要的非生物逆境。因此,研究玉米花期高溫干旱復合脅迫對玉米雄穗發育、花粉結構形態及產量形成的影響,對保障夏玉米生長和保證糧食穩定供應具有重要意義。【擬解決的關鍵問題】本研究通過人工智能溫室模擬玉米花期高溫、干旱及復合脅迫,采用盆栽試驗,研究花期高溫、干旱及其復合脅迫對玉米雄穗的形態、結構、生理特性的影響,明確二者復合脅迫的交互效應,以期為夏玉米抗逆穩產提供理論依據和技術支撐。
1 材料與方法
1.1 試驗設計與材料
試驗于2018—2019年在河南農業大學西平試驗基地人工智能溫室內進行,采用盆栽試驗,設置4個處理,分別為CK(對照),T(花期高溫),D(花期干旱),TD(花期高溫干旱),其中T處理采用人工智能溫室控制溫度,溫室溫度比外界對照溫度高4℃,且保證白天溫度始終處于35℃以上,達到高溫脅迫要求,其他條件與對照保持一致;D處理采用透光率95%以上的PO塑料薄膜搭建的旱作棚進行干旱處理,旱作棚頂部與玉米冠層保持2 m間距,保持旱作棚內與對照溫度一致,干旱脅迫處理于正式脅迫處理開始前2—3 d進行水分控制預處理,并使用水分測定儀實時監測水分變化,確保在處理當天干旱處理的水分控制在田間最大持水量的60%—65%,且脅迫處理期間實時監測水分狀況,根據每盆裝土重量計算需要補充的水分量,以保持脅迫處理期間土壤含水量為田間最大持水量的60%—65%;TD處理在人工智能控制溫室內進行,保持溫室溫度比外界對照溫度高4℃,白天溫度能保持在35℃以上,達到高溫脅迫,即與T處理溫度控制一致,同時使用水分測定儀實時監測水分,使土壤含水量控制在土壤最大持水量的60%—65%,與D處理的水分控制一致。各脅迫處理均于玉米雄穗露出頂葉2—3 cm時開始進行,處理時間為14 d,之后將盆栽轉移至正常大田條件生長直至成熟。供試材料為本課題組前期篩選的熱敏感型品種華農138(HN138)和耐熱較好的鄭單958(ZD958)品種,試驗土壤類型為砂姜黑土,取0—20 cm的耕層土壤,風干、過篩、裝盆,盆體上口直徑為35 cm,下底部直徑為25 cm,高30 cm,每盆裝土15 kg;土壤基礎養分為有機質含量17.8 g·kg-1、堿解氮含量為106.86 mg·kg-1、速效磷含量為52.47 mg·kg-1、速效鉀含量為229.03 mg·kg-1。
1.2 測定項目與方法
1.2.1 田間小氣候監測 利用人工智能溫室自動記錄系統和小型氣象站監測記錄處理期間日均溫和日最高溫度的變化,采用BY-TWS型便攜式土壤溫濕度速測儀實時測定和記錄土壤含水量(圖1),保證D處理與TD處理土壤的水分含量的一致性,T處理與TD處理期間平均溫度和日最高溫一致。
1.2.2 玉米雄穗形態觀察 在雄穗開花后第3天,各處理選代表性植株5株取其雄穗,測量和記錄雄穗主軸和分枝的長度。以雄穗最下部的分枝基部為節點,從該節點到雄穗主軸頂端的距離,為雄穗主軸長度;每個分枝基部到頂端的距離為分枝長度,雄穗主軸的最下部到雄穗頂端的小花數量為主軸小花數,每個分枝底部到分枝頂端的小花數量為該分枝小花數,分枝底部到分枝頂端的長度為分枝長度,分枝小花密度=分枝長度/分枝小花數。

CK:對照;TMAX:高溫脅迫日最高溫度;CKMAX:對照日最高溫度;TAVE:高溫脅迫日平均溫度;CKAVE:對照日平均溫度;T:花期高溫脅迫;D:花期干旱脅迫;TD:花期高溫干旱復合脅迫。下同
1.2.3 花藥、花粉粒形態結構觀察和花粉活力測定 各脅迫處理期間,采用雄穗套袋方法,在玉米抽雄后第5—6天(玉米雄穗盛花期)取新鮮花藥和花粉粒分3份,1份花藥采用番紅固綠法[30]制作切片,之后在OLYMPUS BX43顯微鏡下鏡檢觀察,并進行拍照和采集圖像。1份新鮮花粉粒用2.5%電鏡固定液固定處理,用0.1 mol·L-1磷酸緩沖液洗3次,超純水沖洗2次,乙醇梯度脫水后浸入叔丁醇保存,使用Quorum K850臨界點干燥儀進行干燥,真空噴鍍,用日產S3400N型掃描電鏡進行觀察、拍照。第3份新鮮花粉粒采用TTC染色法[30]測定花粉活力,根據花粉粒染色后的顏色,將花粉活力分為3類:一類是高活力花粉粒,即染色后顏色為深紅色或鮮紅色的花粉粒;二類是無活力花粉粒,即染色后呈現黃褐色的花粉粒;三類是低活力花粉粒,染色介于深紅或鮮紅色與黃褐色之間的淺粉或淺紅色的花粉粒。
1.2.4 單株散粉量測定 在玉米雄穗小花開放前,各個處理選取長勢一致的5株玉米進行雄穗套袋處理,于每天下午16:00收集花粉,去除雜物后過篩、稱重,為單日單株散粉量,連續每天取樣直至散粉結束。
1.2.5 雄穗生理指標測定 從脅迫處理開始,每2 d取各個處理的雄穗中部3 g左右,用液氮速凍后放置于-80℃超低溫冰箱中保存,測定抗氧化酶活性和過氧化產物含量,其中SOD活性采用氮藍四唑法(NBT)法測定,POD活性采用愈創木酚顯色法測定,MDA含量采用硫代巴比妥酸(TBA)法測定,含量采用羥胺氧化法測定[31]。
1.2.6 考種計產 在玉米成熟時,各處理取10穗測量其穗長、穗粗、禿尖長、穗行數、行粒數和百粒重,并折合14%的水分進行計產。
1.2.7 統計分析 試驗數據采用Excel 2010進行數據處理,利用SPSS.26軟件進行數據分析,采用GraphPad Prism 8進行作圖。
2 結果
2.1 不同脅迫處理下玉米雄穗農藝性狀的變化特征
脅迫處理下玉米雄穗農藝性狀受脅迫程度表現為高溫干旱復合脅迫>干旱脅迫>高溫脅迫>對照(表1)。受脅迫影響玉米雄穗主軸長、主軸小花數、分枝數以及分枝小花密度均低于對照,其中D、TD處理與CK間差異顯著。T、D和TD脅迫處理下雄穗主軸長比CK平均降低11.86%、23.64%和27.51%,主軸小花數比CK平均降低15.70%、24.87%和32.02%,分枝數和分枝小花密度則比CK分別降低17.31%、33.85%、45.59%和13.56%、27.08%、26.00%。2個品種比較,ZD958雄穗是短軸多分枝類型,主軸長度平均為38.33 cm,分枝數平均為16.32個,而HN138屬于長軸少分枝類型,主軸長度平均為44.37 cm,分枝數平均4.40個。在2018高溫年份中,T、D和TD處理下HN138的雄穗主軸長與分枝數分別比CK降低20.71%、25.57%、30.30%和14.00%、34.25%和50.00%,脅迫處理與對照差異顯著,而ZD958主軸長和雄穗分枝數則比CK分別減少17.57%(T)、31.08%(D)、36.49%(TD)和17.57%(T)、31.08%(D)、36.49%(TD);HN138的T、D和TD處理主軸小花數比CK降低15.23%、22.62%和32.65%,分枝小花密度比CK降低13.01%、28.10%和22.96%,而ZD958各處理主軸小花數和分枝小花密度比CK分別降低8.89%、18.01%、26.43%和14.10%、26.06%、29.05%。各指標除小花密度外,均表現為逆境脅迫下HN138降幅顯著高于ZD958,且各脅迫處理與對照間、以及單一脅迫與復合脅迫間差異均達顯著水平。
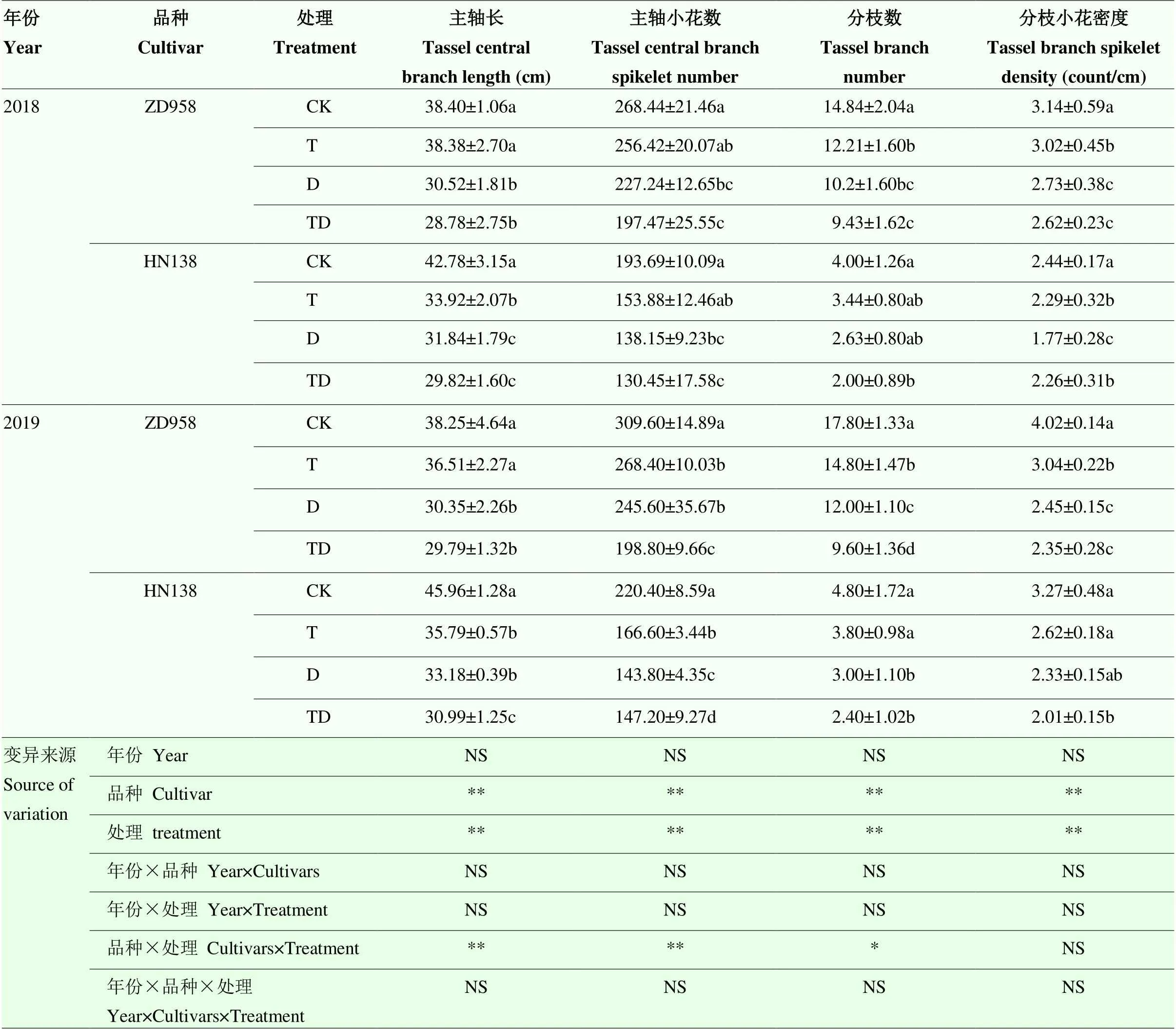
表1 不同脅迫處理對玉米雄穗農藝性狀的影響
同一列同一品種不同小寫字母表示在0.05水平上差異顯著。**表示在<0.01 水平差異顯著, *表示在<0.05 水平差異顯著, NS 表示差異不顯著。下同
Values within a column followed by different letters are significantly different at 0.05 probability level. **, significantly different at<0.01, *, significantly different at<0.05, NS, the difference was not significant. The same as below
2.2 不同脅迫處理下雄穗花粉活力和日散粉量的變化特征
高溫、干旱及復合脅迫下玉米雄穗花粉活力顯著下降,染色后在顯微鏡×40倍視野下觀察(圖2),各處理高活力花粉粒占比依次為CK>T>D>TD,其中CK(圖2-A、圖2-E)的花粉粒絕大多數呈現高活力的紅色或深紅色;T(圖2-B、圖2-F)和D處理(圖2-C、圖2-G)花粉粒呈現3種形態,一部分高活力的紅色,少部分低活力的淺粉紅色,一部分無活力褐色;而TD處理(圖2-D、圖2-H)絕大多數花粉粒染色后呈現無活力的褐色,少數花粉粒呈現低活力的淺粉紅色和高活力的紅色,且視野中CK中高活力花粉粒的數量明顯多于T、D處理,更多于TD處理。
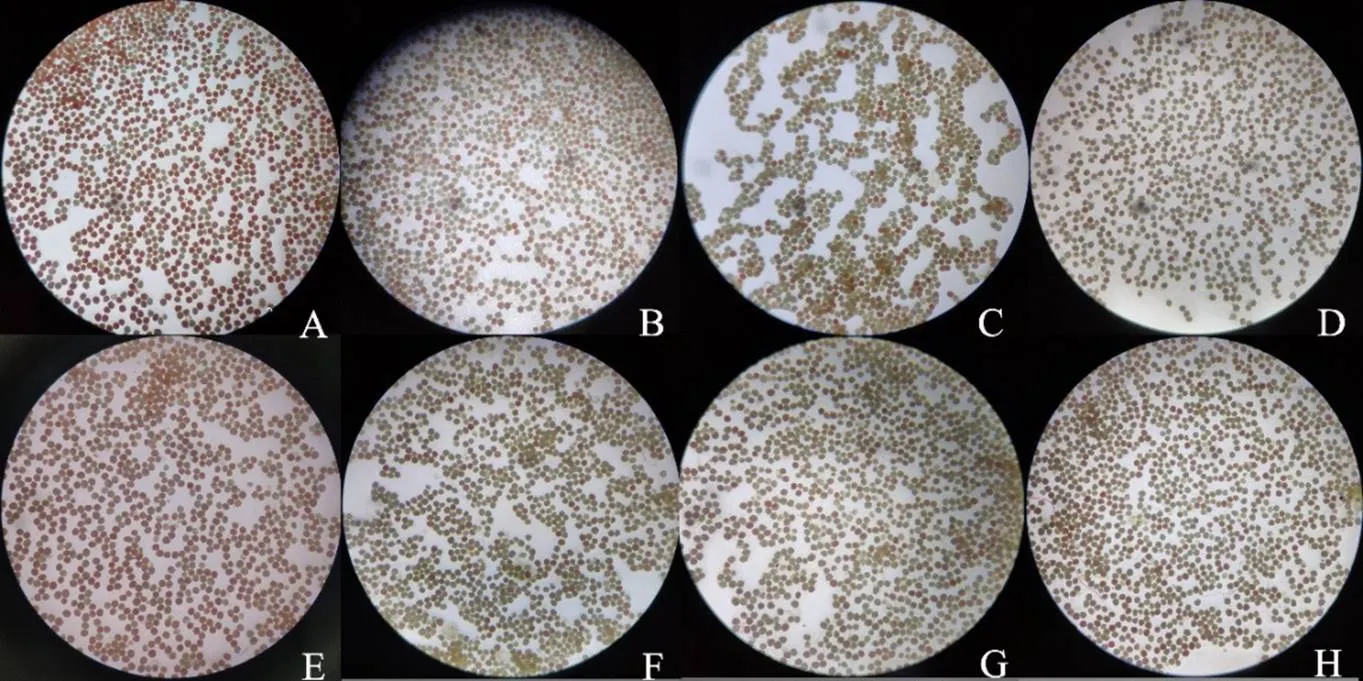
HA:高活力;LA:低活力;NA:無活力;A:CK-ZD958;B:T-ZD958;C:D-ZD958;D:TD-ZD958;E:CK-HN138;F:T-HN138;G:D-HN138;H:TD-HN138(×40)。同一組不同小寫字母表示在0.05水平上差異顯著
HA: High activity; LA: low activity; NA: No activity. A: CK-ZD958; B: T-ZD958; C: D-ZD958; D: TD-ZD958; E: CK-HN138; F: T-HN138; G: D-HN138; H: TD-HN138(×40). Values within a group followed by different letters are significantly different at 0.05 probability level
圖2 不同脅迫處理對雄穗花粉活力的影響
Fig. 2 Effects of different stress treatments on pollen activities of tassel
2年數據來看,T、D和TD處理的高活力花粉粒數量分別占總花粉粒的46.00%、29.75%和22.67%,高活力花粉粒比例比CK降低22.00%、38.25%、45.33%(圖2),與CK間差異顯著,D、TD處理高活力花粉數量顯著低于T處理;而T、D和TD處理無活力花粉比CK顯著增加10.50%、33.00%和37.00%,D和TD處理無活力花粉比T處理顯著高22.83%、26.83%,T與D、T與TD處理間無活力花粉數量差異顯著,但D與TD處理間差異不顯著。2個品種比較,在T、D和TD處理下,HN138無活力花粉比例分別為36.50%、52.83%和55.33%,而ZD958無活力花粉比例為19.33%、48.67%和54.17%,表現為HN138高溫、干旱脅迫下無活力花粉數量遠高于ZD958,而ZD958高活力花粉比例為51.66%,32.33%和21.17%,HN138則分別為40.33%、27.17%和24.17%,表現為ZD958高活力花粉比例高于HN138,尤其在2018年的高溫年份表現更為突出。
2年試驗結果表明玉米雄穗的日散粉量呈單峰曲線(圖3),單株日散粉量最大值出現在開始散粉后的4—5 d,散粉持續時間最長為8 d。脅迫處理使散粉持續時間平均縮短1—2 d,其中TD處理縮短2 d,D處理縮短1 d;散粉峰值出現時間提前1—2 d,處理間表現為TD處理早于D處理早于T處理早于CK,其中T、D和TD處理散粉峰值期比CK平均提早了0.5 d、1.5 d和2.5 d。脅迫減少了雄穗每日散粉量,T、D和TD處理的日散粉量較CK降低22.18%、54.75%和67.28%,且處理間差異顯著。不同品種比較,二者散粉峰值期對逆境反應差異明顯,CK條件下ZD958與HN138的散粉高峰期分別出現在散粉后第4天與第5天;ZD958的散粉峰值期T處理與CK一致均出現在第4天,D處理比CK提早1 d,TD處理則比CK提早2 d;而HN138日散粉峰值期在T、D、TD處理下比CK分別提早1 d、2 d和3 d。正常條件下ZD958的花粉量比HN138平均多20.89%,脅迫顯著減少了雄穗散粉量,其中ZD958的日散花粉量在T、D和TD處理下比CK平均降低21.59%、57.18%和68.46%, HN138則比CK平均降低22.77%、52.33%和66.10%,但兩品種間差異不顯著。
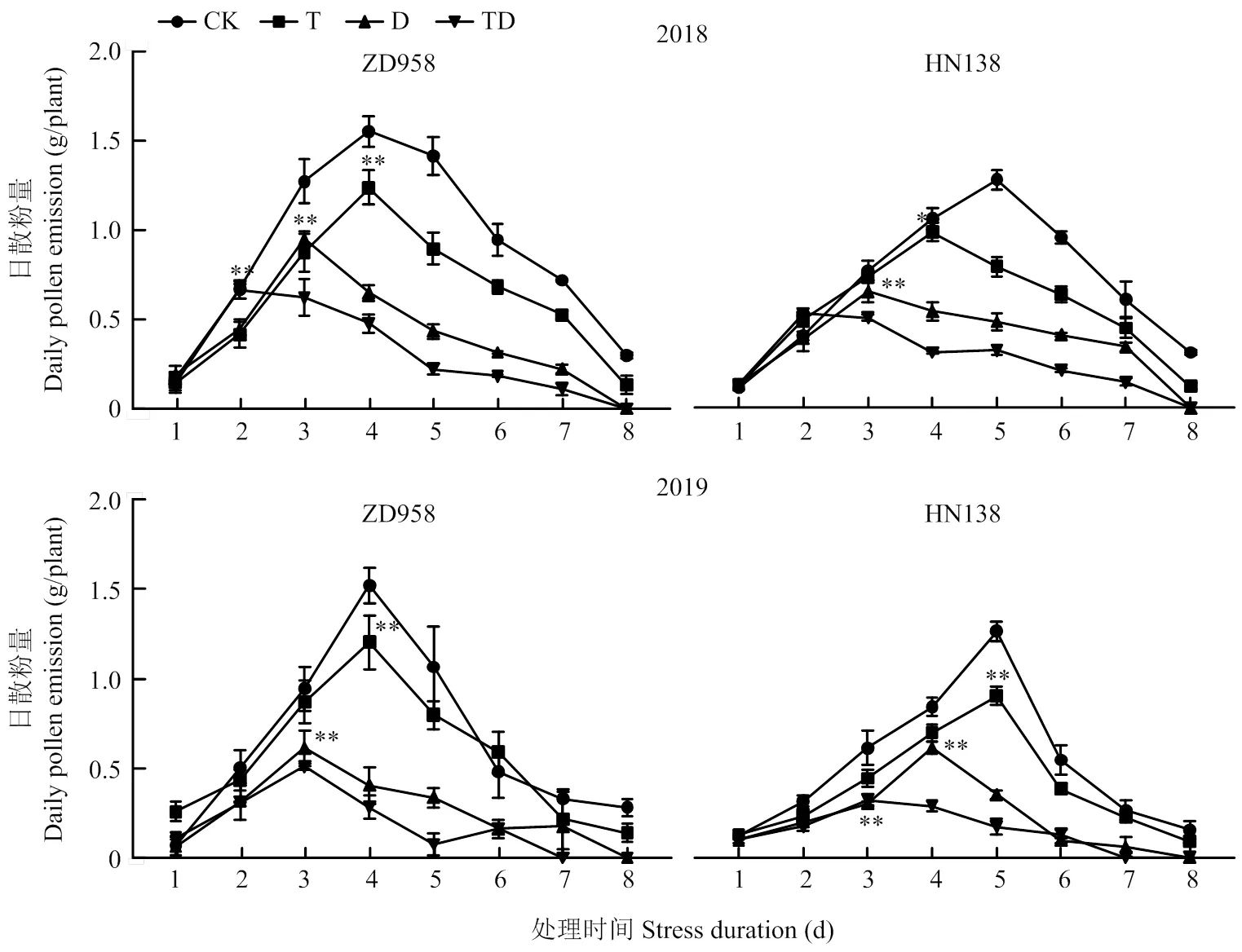
*,**分別表示不同處理峰值在 0.05 和 0.01 水平差異顯著。下同
2.3 不同脅迫處理下花藥結構和花粉粒形態變化
高溫、干旱及其復合脅迫影響著雄穗花藥結構和花粉粒形態。由圖4可以看出,CK的(圖4-A1、圖4-E1)花藥圓潤飽滿,藥隔分明,藥室排列整齊,花藥壁細胞排列整齊,大小均勻,絨粘層細胞正常,T處理(圖4-B1、圖4-F1)的花藥皺縮變小,藥室發生變形,部分花藥壁表皮細胞發生畸形,結構排列松散,藥隔維管束變小,絨氈層細胞基本正常,D(圖4-C1、圖4-G1)和TD(圖4-D1、圖4-H1)處理的花藥皺縮變小更為明顯,藥室變形嚴重甚至部分斷裂,呈現凹陷和褶皺,花藥壁表皮細胞出現膨大或縮小,絨氈層細胞退化,藥隔維管束變少、變細,花藥整體趨近解體。2個品種比較,逆境脅迫下HN138的花藥皺縮變小比ZD958更為嚴重,如T處理下HN138(圖4-F1)花藥壁出現斷裂,而ZD958花藥壁尚保持完整;D和TD處理的HN138藥室(圖4-G1、圖4-H1)變形皺縮比ZD958(圖4-C1、圖4-D1)更為明顯,且褶皺多且深,HN138在T和TD處理下(圖4-F1、圖4-H1)藥隔維管束更細,維管束外層薄壁細胞層數的減少和斷裂程度亦比ZD958(圖4-B1、圖4-D1)更明顯。

1:表皮細胞;2:絨氈層細胞;3:藥室;4:花粉粒;5:藥隔內維管束(×200)。A1:CK-ZD958;B1:T-ZD958;C1:D-ZD958;D1:TD-ZD958;E1:CK-HN138;F1:T-HN138;G1:D-HN138;H1:TD-HN138(×200);A2:CK-ZD958;B2:T-ZD958;C2:D-ZD958;D2:TD-ZD958;E2:CK-HN138;F2:T-HN138;G2:D-HN138;H2:TD-HN138(×1000)
電鏡掃描觀察花粉粒形態發現(圖4),CK的(圖4-A2、圖4-E2)花粉粒外觀近似圓形或橢圓,表面光滑且具有清晰且稍微突出的萌發孔;T處理的(圖4-B2、圖4-F2)花粉表面始現網紋狀凸起,但其網紋凸起程度較淺,且褶皺紋路淺且少;D處理(圖4-C2、圖4-G2)的表面網紋狀凸起明顯增多,皺縮加劇且褶皺紋路加深,萌發孔輕微凹陷,而TD處理(圖4-D2、圖4-H2)的表面網紋狀更明顯,且異常凸起成高脊,皺褶凹陷更深,萌發孔明顯皺縮內陷,導致萌發困難。
2.4 不同脅迫處理下雄穗超氧化物歧化酶(SOD)和過氧化物酶(POD)活性的變化
隨生育進程推進,各處理玉米雄穗SOD活性呈先升后降的單峰曲線(圖5),峰值出現在處理后的第4—8天。脅迫處理初期酶活性增加,顯著高于CK,但不同脅迫增加幅度存在差異,T、D和TD處理初期SOD活性平均比CK增加21.91%、24.95%和17.12%,其中D和TD處理的SOD活性最大值比CK顯著增加61.21%和72.69%,但峰值之后迅速下降,各處理SOD活性低于對照。2個品種比較,SOD活性達到峰值的日期不同,ZD958品種SOD活性在脅迫后的第6天達到最大,HN138則在第4天達到最大,比ZD958早2 d;T、D和TD處理下ZD958的SOD活性最大值比CK平均高48.85%、82.38%和78.39%, HN138則比CK高61.66%、64.11%和74.99%,且SOD活性峰值在高溫年份(2018年)均較正常年份(2019年)提前0—2 d。

圖5 不同脅迫處理對超氧化物歧化酶活性的影響
玉米雄穗POD活性與SOD活性變化趨勢基本一致(圖6),隨生育進程呈先上升后下降的單峰曲線,其峰值出現在第6—8天,且脅迫初期的玉米雄穗POD活性顯著高于對照,隨著脅迫時間延長,8 d后活性明顯下降,但依然高于對照。處理間比較,T、D和TD處理的POD活性比CK平均高32.50%、53.37%和67.24%,且與CK差異極顯著;且D、TD處理POD活性最大值分別比CK增加108.42%和144.70%,差異極顯著。2個品種比較,高溫、干旱及復合脅迫下,ZD958品種POD活性最大值出現在處理后的第8天,HN138則出現在處理后的第6—8天;且在T、D和TD處理下ZD958品種的POD活性峰值比CK增加97.21%、130.15%和171.82%,而HN138的POD活性峰值比CK增加40.10%、118.18%和137.23%。
2.5 不同脅迫處理下丙二醛(MDA)含量和超氧陰離子自由基()含量變化
隨著生育進程,各處理MDA含量呈先增后降趨勢(圖7),且逆境處理下MDA含量最大值出現在處理后6—8 d,之后下降并趨于平緩。高溫、干旱及復合脅迫使玉米雄穗MDA含量顯著高于對照,其中T、D和TD處理MDA含量比CK平均增加44.18%、64.24%和79.12%。不同脅迫間比較,D、TD處理2 d后,玉米雄穗MDA含量迅速增加,并在6—8 d達到最大值,且兩處理MDA含量最大值較CK平均增加94.40%和115.78%;而T處理的MDA含量變化平緩,變化趨勢與CK一致,比CK平均增加39.03%。2個品種對逆境脅迫的響應不同,ZD958在TD處理下MDA含量峰值出現在處理后8 d,而HN138的峰值出現在處理后6 d,且在D和T處理下,HN138的MDA含量平均比ZD958高22.61%和16.18%。
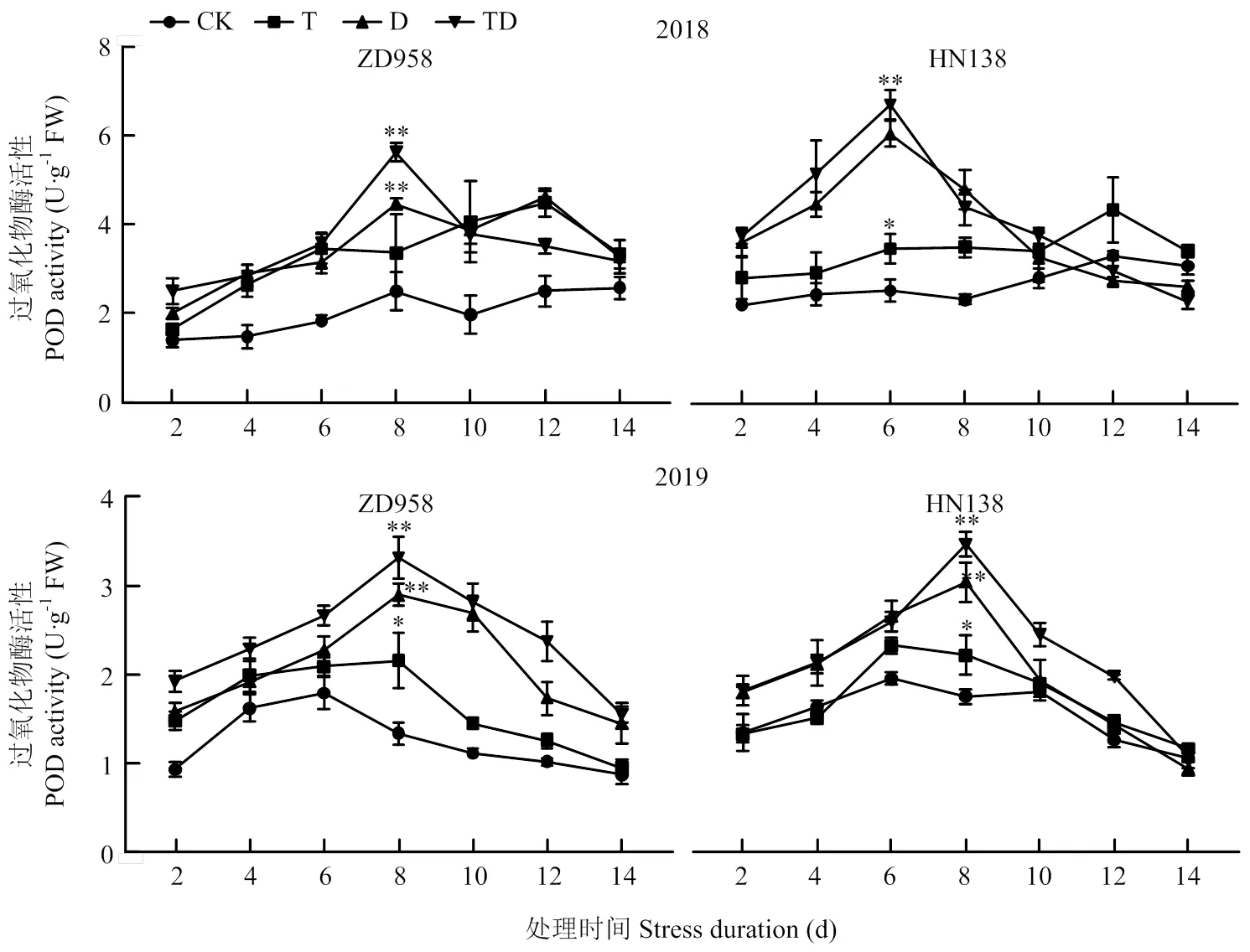
圖6 不同脅迫處理對過氧化物酶活性的影響
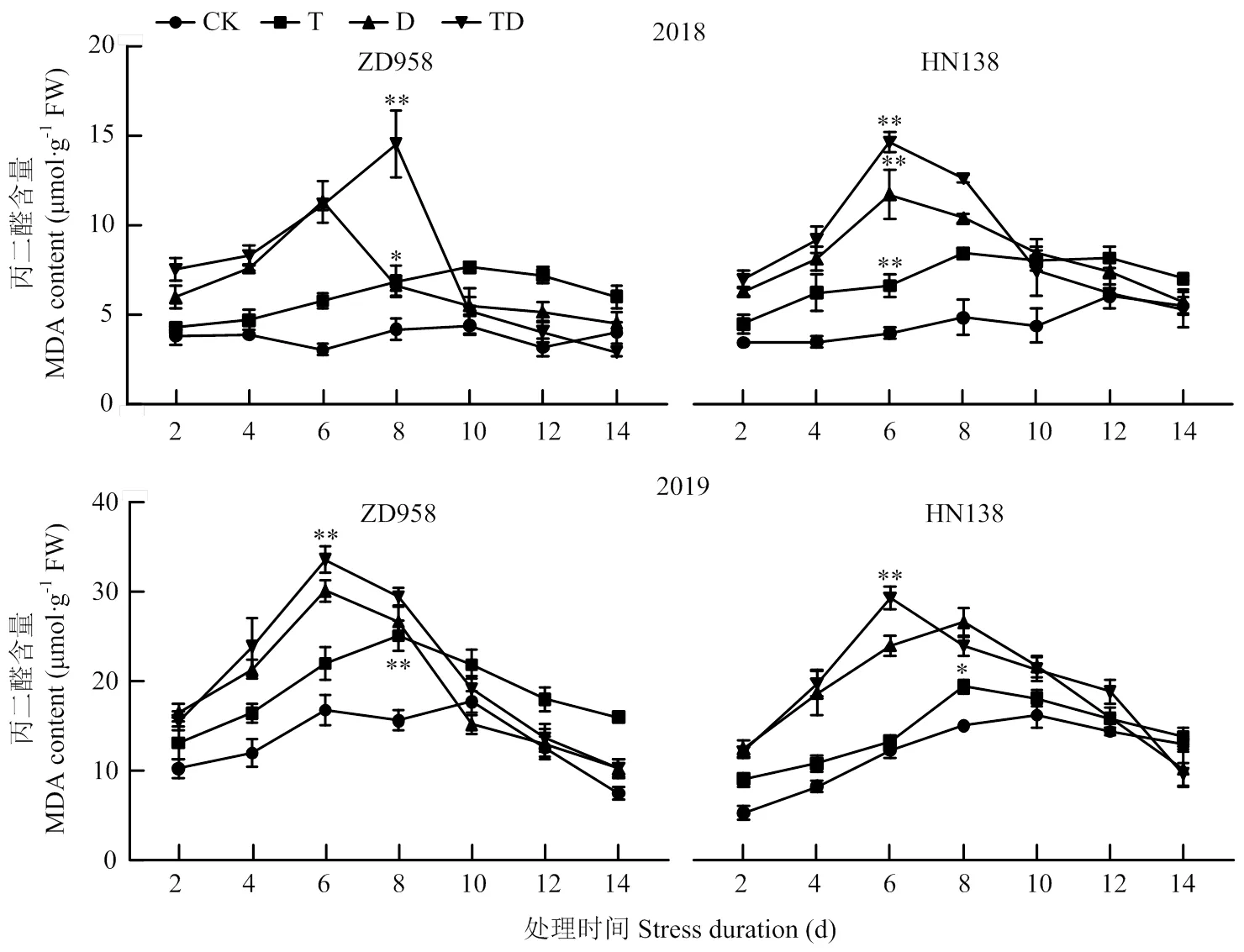
圖7 不同脅迫處理對MDA含量的影響
隨生育進程玉米雄穗的含量與MDA含量變化一致(圖8),均呈現先升后降趨勢,其最大值出現在處理后的4—8 d。脅迫增加了含量,T、D和TD處理含量比CK平均增加22.55%、51.65%和72.29%,差異顯著。不同處理在逆境脅迫初期(2—6 d),含量均急劇增加,但含量達到峰值時間不同,D和TD處理峰值出現在處理后第4—6天,T處理的峰值出現在處理后第6—8天,D和TD處理的含量變幅遠大于T處理,D和TD處理與CK間最大含量差異極顯著。2個品種比較,ZD958的含量的峰值出現時間較HN138平均滯后1—2 d,且最大值平均比HN138低16.73%。2個品種的含量峰值出現時間在高溫年份(2018年)較正常年份(2019年)平均提前1—2 d。
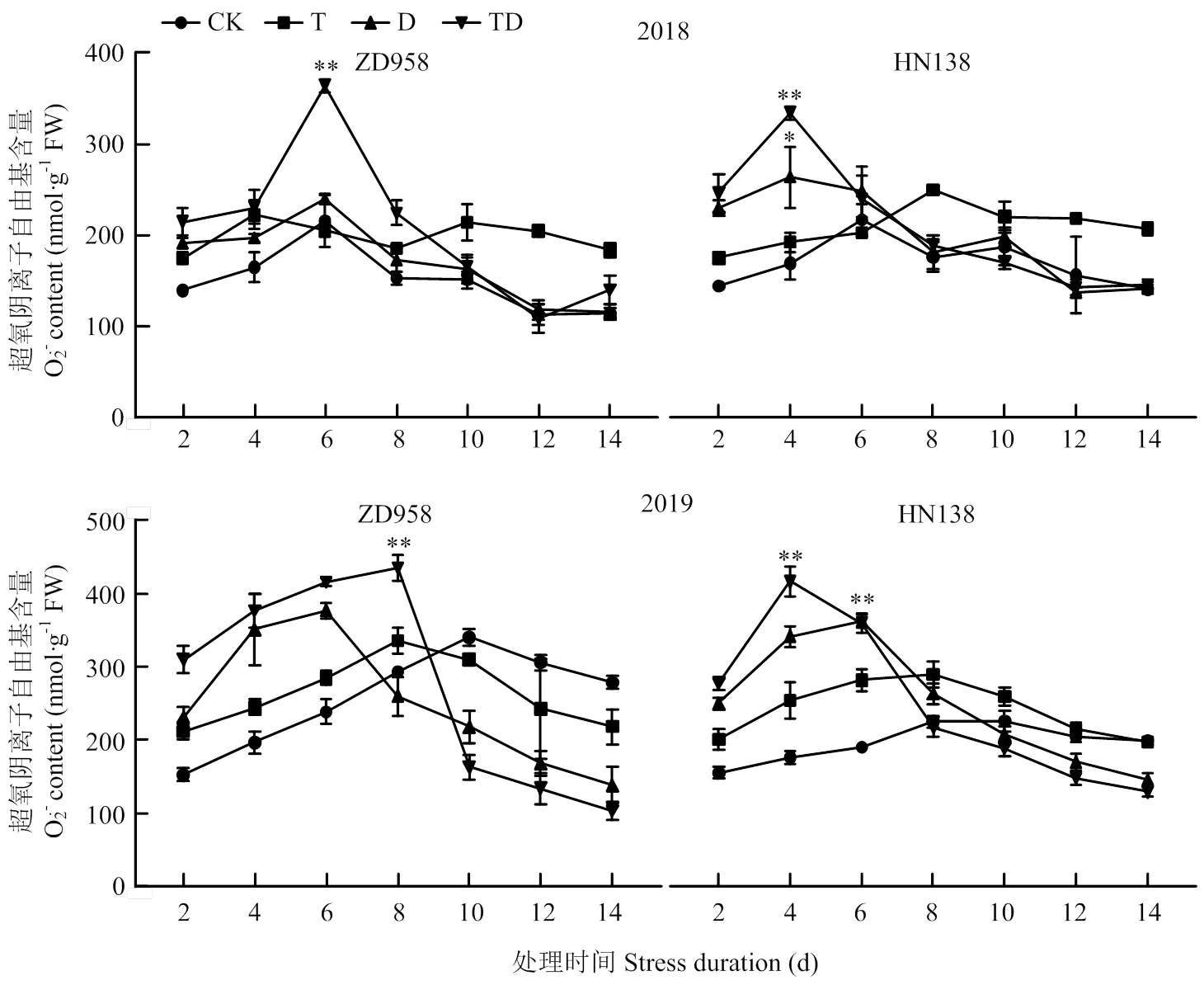
圖8 不同脅迫處理對超氧陰離子自由基含量的影響
2.6 不同脅迫處理下產量、產量構成因素變化及其相關性
逆境脅迫下玉米穗長、穗粗顯著下降,禿尖長顯著增加(表2),其中T、D、TD處理穗長和穗粗比CK平均降低8.52%、25.52%、36.07%和2.54%、11.35%、15.34%,禿尖長比CK增加319.95%、410.93%、578.82%。高溫、干旱及復合脅迫顯著降低了玉米產量、行粒數和千粒重,穗行數受影響較小;T、D和TD處理的產量比CK平均降低18.05%、34.58%和46.24%,行粒數較CK平均減少24.58%、41.80%和52.99%,千粒重比CK平均降低3.01%、6.68%和8.22%,處理間兩兩差異顯著。2個品種比較,高溫、干旱及復合脅迫下ZD958的穗長、穗粗、行粒數、產量下降幅度小于HN138,禿尖長顯著短于HN138。在T、D、TD處理下,ZD958穗長比CK降低7.05%、25.29%、33.23%,HN138穗長比CK降低9.99%、25.74%、38.92%,HN138禿尖長比ZD958長763.64%、351.39%、71.25%;T和TD處理下ZD958行粒數比HN138多5.34%、1.64%,千粒重分別比HN138高27.38%、24.96%,在T、D、TD處理下ZD958產量較HN138高15.18%、36.14%和40.18%。
2年數據的相關性分析表明(表3),主軸長、主軸小花數、花粉量、花粉活力與產量呈極顯著正相關,與穗粒數呈顯著正相關,與千粒重呈正相關,但不顯著,雄穗分枝數、分枝小花密度與穗粒數、產量呈正相關關系。2個品種在不同年份也存在差異,在高溫干旱年份(2018年),ZD958的花粉量、花粉活力與千粒重、產量顯著正相關,HN138的花粉量、花粉活力則與產量、穗粒數顯著正相關,且HN138分枝數與產量呈顯著正相關,ZD958的分枝數與產量呈正相關,但不顯著;2019年,ZD958的分枝數與產量、穗粒數、千粒重均顯著正相關,HN138的分枝小花密度與產量、穗粒數、千粒重顯著正相關。

表2 不同脅迫處理對產量及其構成要素的影響
3 討論
3.1 高溫干旱脅迫對雄穗形態特征的影響
逆境脅迫下玉米雄穗的正常發育對花藥發育以及花粉量的多少有著至關重要的影響[32]。本研究結果表明,高溫脅迫下主軸小花數、分枝小花密度大幅下降,干旱脅迫下雄穗主軸長度、分枝小花密度均顯著減少,分枝數減少但差異不顯著,而高溫干旱脅迫下雄穗主軸長度、分枝數顯著降低,同時主軸小花數和分枝小花密度顯著減少,表現出既有干旱脅迫導致的雄穗主軸、分枝退化變短,又有高溫引發小花數量和分枝小花密度的大幅度減少,且明顯表現出了高溫干旱脅迫對雄穗生長脅迫的疊加效應,因此導致雄穗花粉總量的驟減,這與前人研究表明結果基本一致[33]。本結果也表明,雄穗主軸長度、分枝小花密度對高溫、干旱及復合脅迫均較為敏感,而雄穗分枝數和主軸小花數則對干旱和高溫干旱復合脅迫反應更敏感,而受高溫影響較小,且二者復合脅迫加劇了分枝小花數和小花密度的減少,呈現出二者的疊加效應。高溫敏感型品種HN138具有雄穗主軸長、分枝少的特點,而主軸短、分枝多的品種ZD958對高溫、干旱脅迫具有更好的適應性和抗脅迫性。可見玉米雄穗主軸長度、分枝數量及主軸、分枝小花數量可作為判斷玉米能否適應花期高溫、干旱脅迫的重要指標之一。

表3 不同脅迫處理下產量、產量構成要素與雄穗相關指標的相關分析
3.2 高溫干旱脅迫對花藥結構和花粉活力的影響
玉米花期高溫干旱改變了其生殖生長,導致花期不遇,雄穗散粉量減少,花粉活力降低,造成雌穗禿尖加長和籽粒敗育增多,產量下降[34-37]。本研究發現,高溫、干旱及其復合脅迫導致玉米散粉期縮短,雄穗散粉盛期提前,且對逆境越敏感的品種(HN138),散粉盛期提早越多,這也是HN138抗高溫脅迫能力較ZD958差的原因之一。高溫、干旱均可引起花藥畸變、花藥維管束發育異常導致花粉敗育、活力降低[38],但本研究結果發現,兩類脅迫引起花藥畸變程度和對花粉粒形態影響程度不同,其中高溫脅迫引起花藥藥室輕度形變,花粉粒表面出現網紋狀凸起,而干旱脅迫則導致花藥藥室顯著皺縮,且花藥維管束顯著變小,表皮細胞退化變形,表面網紋狀凸起明顯增多,皺縮加劇且形成脊,復合脅迫則使花藥藥室變形嚴重,花藥壁斷裂,絨氈層細胞退化,花藥趨近解體,萌發孔嚴重內陷,使萌發和生理功能受到嚴重影響,表現出干旱脅迫基礎上疊加高溫脅迫。綜合雄穗農藝性狀和花粉結構發現,高溫、干旱及復合脅迫對花粉活力及敗育影響的主導因素不同,高溫脅迫下花粉活力下降主要是由于高溫影響花粉和花藥結構而使活力降低,而干旱和復合脅迫則一方面導致花藥、花粉結構畸變加劇,另一方面是雄穗小花數、分枝數顯著減少,農藝和結構雙重影響導致了干旱及復合脅迫下玉米雄穗花粉量銳減且活力低下。復合脅迫影響雖大于單一脅迫,但并不是二者脅迫相加,而是以干旱脅迫為主,高溫脅迫由于對雄穗影響小而被弱化。品種間以分枝數和小花密度較多的品種類型(ZD958)更能適應干旱脅迫和復合脅迫。綜合分析,復合脅迫對花粉、花藥結構的不利影響大于干旱脅迫大于高溫脅迫,但高溫、干旱及復合脅迫下玉米雌穗花絲數量、活力及與結實性和產量的關系還有待于進一步深入研究。
3.3 高溫干旱脅迫對雄穗生理特性的影響
植株體內抗氧化系統和活性氧代謝的平衡變化是植株逆境脅迫的最直接生理表現[18],當植株體內的抗氧化酶無法清除自身體內過多活性氧時,則引起膜脂過氧化,產物積累[20]。本研究結果顯示在高溫、干旱及復合脅迫早期,雄穗SOD、POD活性和含量、MDA含量快速增加,且活性氧和過氧化產物含量的高峰期早于抗氧化酶活性的高峰期2—4 d,說明逆境下先是活性氧和過氧化產物的生成打破了平衡,進而引起植株抗氧化酶活性增加來增強其清除能力,但隨著脅迫時間延長,脅迫后期酶活性快速下降,酶促清除速度低于活性氧和過氧化產物產生速度,生理機能整體下降并趨于衰老,形成了持續逆境下的酶系統與產物生成的新動態平衡,因此表現出持續脅迫后期先是酶活性下降迅速,過氧化物則是緩慢下降,之后二者趨于平緩。但不同脅迫下抗氧化酶和代謝產物變化幅度不同,二者形成動態平衡的時間點存在差異,高溫脅迫下含量和MDA含量增減變幅小于干旱及復合脅迫,表現出高溫脅迫一方面造成過氧化產物迅速積累,另一方面其酶清除能力(SOD、POD酶活性)也隨之增大,能夠較快形成高溫脅迫下的新動態平衡,而干旱及復合脅迫下過氧化物產物含量累積量大于高溫脅迫,但其抗氧化酶清除能力(SOD、POD酶活性)未能有與之相匹配的速度增加,由于酶系統不能及時清除過量的活性氧和過氧化產物,因此造成含量和MDA含量增幅較大,因此干旱和復合脅迫下含量和MDA含量的峰值出現時間早于高溫脅迫,尤其復合脅迫下含量峰值比干旱脅迫平均早1.5 d左右,使得復合脅迫的雄穗更早進入衰老狀態。本研究結果還發現,雄穗MDA含量脅迫后第6天達到最大值,含量脅迫后第4—6天達到最大值,酶清除系統(POD、SOD活性)則在第8天達到最大值,表現為過氧化物(MDA)積累高峰略晚于活性氧()積累高峰,因此與之對應的POD酶活性的峰值晚于SOD酶活性的峰值。這主要是在植物的生理反應中,通過自氧化反應、電子傳遞鏈、內質網細胞色素反應等均可生成,逆境脅迫下則更易產生較多,而進一步轉化成羥自由基,羥自由基氧化性較強且可以穿透細胞膜,啟動脂質過氧化反應,為膜脂過氧化反應及過氧化產物的產生造就了充分條件,因此逆境脅迫下超氧陰離子自由基的產生早于過氧化產物MDA的產生。熱敏感型品種HN138抗氧化酶活性和過氧化產物含量峰值較鈍感型品種ZD958提早1—2 d。綜上,高溫脅迫早期生理指標的迅速升高是作物對高溫的應急反應,并未加速或導致雄穗的死亡,而干旱和復合脅迫各指標升高一方面是應急性生理響應,同時也是加速雄穗程序性死亡(衰老)的表現,其抗氧化酶活性在干旱和復合脅迫后迅速達到峰值隨后迅速下降,就是其衰老死亡的直接生理表現。
3.4 不同脅迫處理對玉米產量、產量構成要素的影響及其相關性
玉米穗行數、行粒數和粒重是產量構成要素,穗長、穗粗、禿尖以及籽粒容庫協調性是影響產量構成的重要因素[39]。本研究發現,脅迫處理下玉米產量及其構成因素顯著低于對照,以復合脅迫影響大于干旱大于高溫;穗行數不受脅迫影響,這與本試驗逆境處理開始時小穗分化已完成有關。高溫脅迫下,行粒數減少是穗粒數大幅減少和產量大幅度下降的重要原因之一,且與花粉數量、活力極顯著相關;干旱脅迫下產量下降與行粒數減少和粒重降低均顯著相關,復合脅迫則在干旱脅迫基礎上增大了行粒數減少的幅度,尤其是有效籽粒數大大減少,同時伴隨粒重降低,這主要和花粉活力進一步降低,花粉量銳減有關。
2個品種比較,脅迫下ZD958產量高于HN138,原因是高溫脅迫下ZD958產量下降是行粒數減少所致,HN138產量降低則是行粒數、粒重雙重因素減少所致;干旱和復合脅迫下行粒數和粒重下降,且降幅增大是二者產量下降的主要原因,但復合脅迫下玉米的行粒數降幅更大,出現嚴重敗育和不結實現象。綜合2個品種雄穗農藝性狀和產量構成因素發現,高溫、干旱脅迫下雄穗短軸、多分枝的品種(ZD958),可以通過單穗花粉數量多來彌補逆境造成的花粉量減少、花粉活力低的劣勢,提高行粒數和結實性,因此比主軸長、分枝少的品種(HN138)更能抵御高溫、干旱傷害。
4 結論
花期高溫、干旱及復合脅迫導致玉米雄穗主軸變短,分枝數變少和分枝小花密度降低,花藥和花粉結構劣變,花粉數量減少,活力下降;酶促清除和過氧化產物產生平衡打破,穗粒數減少,產量降低。高溫干旱復合脅迫對雄穗生理指標及產量的脅迫程度大于干旱大于高溫,以雄穗短軸、多分枝、散粉量多的品種抵御高溫、干旱脅迫能力更強。
[1] 張在一, 毛學峰, 楊軍. 站在變革十字路口的玉米: 主糧還是飼料糧之論? 中國農村經濟, 2019, 6(9): 38-53.
ZHANG Z Y, MAO X F, YANG J. Maize at the crossroads: Staple food grain or feed grain? Chinese Rural Economy, 2019, 6(9): 38-53. (in Chinese)
[2] 許吟隆, 黃曉瑩, 張勇, 林萬濤, 林而達. 中國21世紀氣候變化情景的統計分析. 氣候變化研究進展, 2005, 1(2): 80-83.
XU Y L, HUANG X Y, ZHANG Y, LIN W T, LIN E D. Statistical analyses of climate change scenarios over China in the 21st century. Advances in Climate Change Research, 2005, 1(2): 80-83. (in Chinese)
[3] 蘇勃, 高學杰, 效存德. IPCC《全球1.5℃增暖特別報告》冰凍圈變化及其影響解讀. 氣候變化研究進展, 2019, 15(4): 395-404.
SU B, GAO X J, XIAO C D. Interpretation of IPCC SR1.5 on cryosphere change and its impacts. Climate Change Research, 2019, 15 (4): 395-404. (in Chinese)
[4] 和驊蕓, 胡琦, 潘學標, 馬雪晴, 胡莉婷, 王曉晨, 何奇瑾. 氣候變化背景下華北平原夏玉米花期高溫熱害特征及適宜播期分析. 中國農業氣象, 2020, 41(1): 1-15.
HE H Y, HU Q, PAN X B, MA X Q, HU L T, WANG X C, HE Q J. Characteristics of heat damage during flowering period of summer maize and suitable sowing date in North China plain under climate change. Chinese Journal of Agrometeorology, 2020, 41(1): 1-15. (in Chinese)
[5] CAIRNS J E, CROSSA J, ZAIDI P H. Identification of drought, heat, and combined drought and heat tolerant donors in maize. Crop Science, 2013, 53(4): 1335-1346.
[6] 袁宏偉, 蔣尚明, 楊繼偉, 劉佳. 基于生理生態指標的玉米受旱脅迫響應規律研究. 節水灌溉, 2019(5): 5-10.
YUAN H W, JIANG S M, YANG J W, LIU J. The response regularity of maize under drought stress based on physiological indexes. Water Saving Irrigation, 2019(5): 5-10. (in Chinese)
[7] 劉云鵬, 梁效貴, 申思, 周麗麗, 高震, 周順利. 梯度干旱脅迫下玉米光合碳的日變化及品種偏向性. 中國農業科學, 2017, 50(11): 2083-2092.
LIU Y P, LIANG X G, SHEN S, ZHOU L L, GAO Z, ZHOU S L. Diurnal variation and directivity of photosynthetic carbon metabolism in maize hybrids under gradient drought stress. Scientia Agricultura Sinica, 2017, 50(11): 2083-2092. (in Chinese)
[8] 趙龍飛, 李潮海, 劉天學, 王秀萍, 僧珊珊. 花期前后高溫對不同基因型玉米光合特性及產量和品質的影響. 中國農業科學, 2012, 45(23): 4947-4958.
ZHAO L F, LI C H, LIU T X, WANG X P, SENG S S, Effect of high temperature during flowering on photosynthetic characteristics and grain yield and quality of different genotypes of maize (L.). Scientia Agricultura Sinica, 2012, 45(23): 4947-4958. (in Chinese)
[9] 于康珂, 孫寧寧, 詹靜, 顧海靖, 劉剛, 潘利文, 劉天學. 高溫脅迫對不同熱敏型玉米品種雌雄穗生理特性的影響. 玉米科學, 2017, 25(4): 84-91.
YU K K, SU N N, ZHAN J, GU H J, LIU G, PAN L W, LIU T X. Effect of heat stress stress on physiological characteristics of tassel and ear in different maize varieties. Journal of Maize Sciences, 2017, 25(4): 84-91. (in Chinese)
[10] 宋方威, 吳鵬, 邢吉敏, 周小英, 崔筱然, 于秀萍, 王進. 高溫脅迫對玉米自交系父本花粉生活力的影響. 玉米科學, 2014, 22(3): 153-158.
SONG F W, WU P, XING J M, ZHOU X Y, CUI X R, YU X P, WANG J. Influences of heat stress on viability of pollen grain inbred lines of male parent. Journal of Maize Sciences, 2014, 22(3): 153-158. (in Chinese)
[11] TSUTOMU M, KENJI O. Rice (L.) cultivars tolerant to high temperature at flowering: Anther characteristics. Annals of Botany, 2002(6): 683-687.
[12] PORCH T G, JAHN M. Effects of high temperature stress on microsporogenesis in heat-sensitive and heat-tolerant genotypes of phaseolus vulgaris. Plant Cell & Environment, 2001, 24(7): 723-731.
[13] 張桂蓮, 張順堂, 肖浪濤, 唐文幫, 肖應輝, 陳立云. 抽穗開花期高溫脅迫對水稻花藥、花粉粒及柱頭生理特性的影響. 中國水稻科學, 2014, 28(2): 155-166.
ZHANG G L, ZHANG S T, XIAO L T, TANG W B, XIAO Y H, CHEN L Y. Effect of heat stress on physiological characteristics of anther, pollen and stigma of rice during heading-flowering stage. Chinese Journal of Rice Science, 2014, 28(2): 155-166. (in Chinese)
[14] 鄧運, 田小海, 吳晨陽, 松井勤, 肖波. 熱害脅迫條件下水稻花藥發育異常的早期特征. 中國生態農業學報. 2010, 18(2): 377-383.
DENG Y, TIAN X H, WU C Y, SONG J Q, XIAO B. Early signs of heat stress-induced abnormal development of anther in rice. Chinese Journal of Eco-Agriculture, 2010, 18(2): 377-383. (in Chinese)
[15] 宋鳳斌, 戴俊英. 玉米對干旱脅迫的反應和適應性. 吉林農業大學學報, 2005, 27(1): 1-5, 10.
SONG F B, DAI J Y. Response and adaptability of maize to drought stress. Journal of Jilin Agricultural University, 2005, 27(1): 1-5, 10. (in Chinese)
[16] 劉永輝. 夏玉米不同生育時期對水分脅迫的生理反應與適應. 干旱區資源與環境. 2013, 27(2): 171-175.
LIU Y H. Physiological responses and adaptation of summer maize (L.) to water stress during different growth periods. Journal of Arid Land Resources and Environment, 2013, 27(2): 171-175. (in Chinese)
[17] BARNANAS B, JAJER K, FEHER A. The effect of drought and heat stress on reproductiveprocesses in cereals. Plant Cell & Environment, 2008(31): 11-38.
[18] 劉聰, 董臘嬡, 林建中. 逆境脅迫下植物體內活性氧代謝及調控機理研究進展. 生命科學研究, 2019(3): 253-258.
LIU C, DONG L Y, LIN J Z. Research advances on regulation mechanism of reactive oxygen species metabolism under stresses. Life Science Research, 2019(3):253-258. (in Chinese)
[19] BAI L P, SUI F G, GE T D, SUN Z H, LU Y Y, ZHOU G S. Effect of soil drought stress on leaf water status, membrane permeability and enzymatic antioxidant system of maize. Pedosphere, 2006, 16(3): 326-332.
[20] 趙龍飛, 李潮海, 劉天學, 王秀萍, 僧珊珊, 潘旭. 玉米花期高溫響應的基因型差異及其生理機制. 作物學報, 2012, 38(5): 857-864.
ZHAO L F, LI C H, LIU T X, WANG X P, SENG S S, PAN X, Genotypic responses and physiological mechanisms of maize (Zea Mays L.) to high temperature stress during flowering. Acta Agronomica Sinica, 2012, 38(5): 857-864. (in Chinese)
[21] 張仁和, 郭東偉, 張興華, 路海東, 劉建超, 李鳳艷, 郝引川, 薛吉全. 吐絲期干旱脅迫對玉米生理特性和物質生產的影響. 作物學報, 2012, 38(10): 1884-1890.
ZHANG R H, GUO D W, ZHANG X H, LU H D, LIU J C, LI F Y, HAO Y C, XUE J Q. Effects of drought stress on physiological characteristics and dry matter production in maize silking stage. Acta Agronomica Sinica, 2012, 38(10): 1884-1890. (in Chinese)
[22] SAIDI Y, FINKA A, MURISET M, BROMBERG Z, WEISS Y G, MAATHUIS F J M, GOLOUBINOFF P. The heat shock response in moss plants is regulated by specific calcium-permeable channels in the plasma membrane. Plant Cell, 2009, 21: 2829-2843.
[23] FRAGKOSTEFANAKIS S, MESIHOVIC A, HU Y, SCHLEIFF E. Unfolded protein response in pollen development and heat stress tolerance. Plant Report, 2016, 29: 81-91.
[24] HU L, LIANG W, YIN C, CUI X, ZONG J, WANG X, HU J, ZHANG D . Rice MADS3 regulates ROS homeostasis during late anther development. Plant Cell, 2011 23: 515-533.
[25] KUMAR S V, WIGGE P A. H2A.Z-containing nucleosomes mediate the thermosensory response in. Cell, 2010, 140: 136-147.
[26] CAIRNS J, CROSSA J, ZAIDI P H, GRUDLOYMA P, SANCHEZ C, ARAUS J L, THAITAD S, MAKUMBI D, MAGOROKOSHO C, BANZIGER M, MENKIR A, HEARNE S, ATHIN G N. Identification of drought, heat, and combined drought and heat tolerant donors in maize. Crop Science, 2013, 53(4): 13-35.
[27] GIRAUD E, HO L H M, CLIFTON R, CARROLL A, ESTAVILLO G, TAN Y F, HOWELL K A, IVANOVA A, POGSON B J, MILLAR A H, WHELAN J. The absence of alternative oxidase inresults in acute sensitivity to combined light and drought stress. Plant Physiology, 2008, 147: 595-610.
[28] VILE D, PERVENT M, BELLUAU M, VASSEUR F, BRESSON J, MULLER B, GRANIER C, SIMONNEAU T.growth under prolonged heat stress and water deficit: independent or interactive effects? Plant Cell & Environment, 2012, 35: 702-718
[29] SUZUKI N, RIVERO R M, SHULAEV V, BLUMWALD E, MITTLER R. Abiotic and biotic stress combinations. New Phytologist, 2014, 203: 32-43
[30] 趙俊, 木萬福, 張志星. 植物石蠟切片技術改進. 安徽農學通報, 2009, 15(5):75-78.
ZHAO J, MU W F, ZHANG Z X. Improvement of plant paraffin section technical. Anhui Agricultural Science Bulletin, 2009, 15(5): 75-78. (in Chinese)
[31] 趙世杰. 植物生理學實驗指導. 北京: 中國農業出版社, 2016.
ZHAO S J. Experimental Guidance of Plant Physiology. Beijing: China Agriculture Press, 2016.(in Chinese)
[32] 岳玉蘭, 朱敏, 于雷. 玉米雄穗對產量影響研究進展. 玉米科學, 2010, 18(4): 150-152.
YUE Y L, ZHU M, YU L. Research progress on the impact of maize tassel on yield. Journal of Maize Sciences, 2010, 18(4): 150-152. (in Chinese)
[33] 于康珂. 玉米穗發育對高溫脅迫的響應[D]. 鄭州:河南農業大學, 2016.
YU K K. Responses of reproductive organs development in maize (L.) to high temperature stress[D]. Zhengzhou: Henan Agriculture University, 2016. (in Chinese)
[34] OBATA T, WITT S, LISEC J, PALACIOS-ROJAS N, FLOREZ- SARASA I, YOUSFI S, ARAUS J L, CAIRNS J E, FERNIE A R. Metabolite profiles of maize leaves in drought, heat and combined stress field trials reveal the relationship between metabolism and grain yield. Plant Physiology, 2015(169): 2665-2683
[35] 郭晶心, 曾文智, 周寶津. 開花期高溫脅迫對不同水稻品種花粉萌發和結實的影響. 華南農業大學學報. 2010, 1(2): 50-53.
GUO J X, ZENG W Z, ZHOU B J. Effects of high temperature stress on pollen germination and seed setting of different rice varieties at flowering stage. Journal of South China Agricultural University, 2010, 1(2): 50-53. (in Chinese)
[36] GUILIONI L, WERY J, LECOEUR J. High temperature and water deficit may reduce seed number in field pea purely by decreasing plant growth rate. Functional Plant Biology, 2003(30): 1151-1164.
[37] 于康珂, 劉源, 李亞明, 孫寧寧, 詹靜, 尤東玲, 牛麗, 李潮海, 劉天學. 玉米花期耐高溫品種的篩選與綜合評價. 玉米科學, 2016, 24(2): 62-71.
YU K K, LIU Y, LI Y M, SUN N N, ZHAN J, YOU D L, NIU L, LI C H, LIU T X. Screeningand comprehensive evaluation of heat-tolerance of maize hybrids in flowering stage. Journal of Maize Sciences, 2016, 24(2): 62-71. (in Chinese)
[38] 張桂蓮, 陳立云, 張順堂, 劉國華, 唐文邦, 李梅華, 雷東陽, 陳信波. 高溫脅迫對水稻花粉粒性狀及花藥顯微結構的影響. 生態學報, 2008, 28(3): 1089-1097.
ZHANG G L, CEHN L Y, ZHANG S T, LIU G H, TANG W B, LI M H, LEI D Y, CHEN X B. Effects of high temperature stress on pollen characters and anther microstructure of rice. Acta Ecologica Sinica, 2008, 28(3): 1089-1097. (in Chinese)
[39] 安盼盼, 明博, 董朋飛, 張秒, 黃大召, 趙亞麗, 李潮海. 黃淮南部玉米產量對氣候生態條件的響應. 作物學報, 2018, 44(3): 442-453.
AN P P, MING B, DONG P F, ZHANG M, HUANG D Z, ZHAO Y L, LI C H. Response of Maize (L.) yield to climatic ecological condition on the South Yellow-Huaihe-Haihe Rivers plain. Acta Agronomica Sinica, 2018, 44(3): 442-453. (in Chinese)
Maize Tassel Development, Physiological Traits and Yield Under Heat and Drought Stress During Flowering Stage
YAN ZhenHua, LIU DongYao, JIA XuCun, YANG Qin, CHEN YiBo, DONG PengFei, WANG Qun
College of Agronomy, Henan Agricultural University/National Key Laboratory of Wheat and Maize Crop Science, Zhengzhou 450046
summer maize; high temperature and drought; tassel-related traits; pollen structure and vitality; antioxidant enzyme activity; yield

10.3864/j.issn.0578-1752.2021.17.004
2020-09-03;
2021-01-05
國家重點研發計劃(2017YFD0300300)、國家現代農業產業技術體系專項(CARS-02-17)
閆振華,E-mail:yanzhenhua1996@163.com。通信作者王群,E-mail:wangqun177@163.com
(責任編輯 楊鑫浩)

