干擾乙酰輔酶A合成酶2對三陰性乳腺癌MDA-MB-468細胞增殖及凋亡的影響
傅聰,周月鵬,尹超云,凌銳,浦希,湯翔,陳德玉
(江蘇大學附屬醫院 1. 腫瘤治療中心; 2. 腫瘤學實驗室; 3. 血管外科, 江蘇 鎮江 212001)
三陰性乳腺癌即雌激素受體、人表皮生長因子受體-2和孕激素受體均陰性,是一種具有高侵襲性、高耐藥性、進展快、預后差且缺乏明確治療靶點的亞型[1],占所有病例的10%~15%,患者死亡率較其他類型高2.6倍[2-3]。研究表明,乙酰輔酶A在惡性實體腫瘤細胞代謝中發揮重要調控作用。異常高表達的乙酰輔酶A合成酶2(acetyl-CoA synthetase 2,ACSS2)作為關鍵調控酶,參與食管癌細胞缺氧誘導的放療抵抗,抑制腫瘤細胞凋亡[4];宮頸癌細胞中ACSS2可促進營養缺乏(1%血清培養條件)誘導的癌細胞遷移和侵襲[5];同樣,腎細胞癌患者腎臟病理組織中ACSS2高表達,且與腫瘤進展、侵襲行為及不良預后密切相關[6]。然而ACSS2在三陰性乳腺癌中具體作用尚不清楚。因此,本實驗以MDA-MB-468細胞為研究對象,基于siRNA技術研究ACSS2在三陰性乳腺癌細胞增殖以及凋亡發生中的作用,探討磷酸肌醇3-激酶(phosphatidylinositide 3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB,又稱 AKT)信號通路調控乳腺癌細胞凋亡的作用。
1 材料和方法
1.1 細胞、主要試劑及儀器
人三陰性乳腺癌MDA-MB-468細胞株購自上海吉凱基因化學技術有限公司;人正常乳腺上皮MCF-10A細胞株購自中國科學院上海生命科學研究院細胞資源中心。
L15基礎培養基和胎牛血清(美國Gibco公司);MCF-10A細胞專用培養基(瑞士Lonza公司);RNA提取試劑盒(上海奕杉生物科技有限公司);實時熒光定量PCR(qRT-PCR)試劑盒和逆轉錄試劑盒(南京諾唯贊生物科技股份有限公司);鼠抗人ACSS2抗體(美國Santa Cruz公司);兔抗人PI3K、p-PI3K、AKT、p-AKT、Ki-67、cleaved-caspase-3、Bcl-2、Bax抗體(美國Cell Signaling Technology公司);HRP標記的抗小鼠或抗兔二抗(北京索萊寶科技有限公司);脂質體Lipofectamine 2000(美國Invitrogen公司);CCK-8以及Annexin V-FITC/7-AAD凋亡試劑盒(杭州聯科生物技術有限公司);針對ACSS2的特異性干擾RNA(siRNA-ACSS2)及無序序列的陰性對照(siRNA-NC)由上海吉凱基因技術公司設計并合成,siRNA-ACSS2序列: 5′-UAUGCUUGGUGACAGGCU CAUCUCC-3′,siRNA-NC序列:5′-GCGACGAUCUGC CUAAGAUdTd -3′。
細胞恒溫培養箱、超凈工作臺(德國Heraeus公司);化學發光凝膠成像機(上海勤翔科學儀器有限公司);Mx3000p 熒光定量 PCR擴增儀(美國 Stratagene公司);紫外分光光度儀(美國Thermo公司);多功能酶標儀(美國Bio Tek公司);流式細胞分析儀(美國BD公司)。
1.2 細胞培養
三陰性乳腺癌MDA-MB-468細胞株用含10%胎牛血清、100 U/mL青霉素及 0.1 mg/mL鏈霉素的L15基礎培養基,正常乳腺上皮MCF-10A細胞株用專用培養基,均于 37 ℃、5% CO2的培養箱中培養。
1.3 qRT-PCR檢測ACSS2 mRNA表達
按照RNA提取試劑盒說明書提取細胞RNA,并使用紫外分光光度儀分析其純度及濃度。按照試劑盒說明書操作方法將RNA逆轉錄為cDNA。ACSS2上游引物:5′-GGATTCCAGCTGCAGTCTTC-3′,下游引物:5′-CAGCCAGCTCCTTCAGGTT-3′;β-肌動蛋白上游引物:5′-TCACCCACACTGTGCCCATCTACGA-3′,下游引物:5′-CAGCGGAACCGCTCATTGCCAATGG-3′。按照反應試劑盒說明書在冰上配制反應體系 20 μL:10 μL TB Green PremixExTaq(Tli RNaseH Plus)、上下游引物各0.4 μL、0.4 μL ROX Reference Dye、2 μL DNA模板和6.8 μL滅菌水。95 ℃預變性 30 s;95 ℃ 10 s,60 ℃ 30 s,共循環 40 次;退火:95 ℃ 15 s,60 ℃ 60 s。循環結束后記錄各樣品Ct值結果,用2-ΔΔCt法計算相對表達水平,以β-肌動蛋白為內參照基因。
1.4 細胞分組與轉染
細胞分組如下:空白對照組(正常培養)、陰性對照組(轉染siRNA-NC)和實驗組(轉染siRNA-ACSS2)。選取生長狀態良好且處于對數生長期MDA-MB-468細胞;轉染前一天,將2×105的細胞種于6孔板,待密度達到40%~50%時,加入5 μL siRNA(陰性對照組加入siRNA-NC;實驗組加入siRNA-ACSS2)和 5 μL Lipo2000TM混合液,補齊培養基至最終體積為 2 mL/孔,孵育8 h;更換為完全培養基繼續培養24 h,進行后續實驗。
1.5 蛋白質印跡法檢測ACSS2、PI3K/AKT通路相關蛋白、增殖相關蛋白Ki-67和凋亡相關蛋白表達
取“1.4”分組轉染細胞,分別以2×105個/孔密度種于6孔板,待24 h細胞貼壁,棄上清液,PBS 清洗2次;每孔加入50~100 μL蛋白裂解液(含蛋白酶及磷酸酶抑制劑),置于冰上孵育5 min,每15 min將EP管混勻,重復3次;4 ℃,12 000×g離心30 min,收集上清液;加入4×上樣緩沖液,混勻后 100 ℃煮10 min。取5~10 μL上樣,60 mA恒流電泳30 min;利用濕轉法100 V恒壓轉移30~100 min,將蛋白轉移至PVDF膜;用5%牛血清白蛋白封閉1 h;TBST洗3次;加入一抗ACSS2、PI3K、p-PI3K、AKT、p-AKT、Ki-67、cleaved-caspase-3、Bcl-2、Bax(TBST稀釋,均為1 ∶1 000),4 ℃孵育過夜,TBST洗膜;加入對應HRP標記的相應二抗(TBST稀釋,均為1 ∶1 000) ;室溫孵育1 h;TBST洗膜3次;曝光顯影,Image J軟件用于灰度分析。以β-肌動蛋白作為內參,計算目的蛋白相對表達量。
1.6 CCK-8法檢測細胞增殖能力
取“1.4”分組轉染細胞,分別以2×103個/孔密度種于96孔板。繼續培養24、48和72 h;加入5 mg/mL的CCK-8試劑10 μL并混勻,繼續培養 2 h;波長450 nm處測量光密度(D)值,并計算細胞增殖活力。細胞增殖活力(%)=(實驗組D值-空白組D值)/(對照孔D值-空白組D值)×100%。實驗重復3次。
1.7 流式細胞術檢測細胞凋亡水平
取“1.4”分組轉染細胞,分別以2×105個/孔種于6孔板,孵育至細胞貼壁后進行由Lipo2000TM介導的siRNA轉染。轉染后24 h重新計數,以每管收集3×105個細胞置入流式管中,按照Annexin V-FITC/7-AAD凋亡試劑盒說明書,將5×緩沖液稀釋成1×工作液,取300 μL重懸細胞,每管加入 5 μL Annexin V-FITC和10 μL 7-AAD,室溫避光孵育10 min;選擇最低的上樣速度于流式細胞分析儀檢測。每組重復3次。
1.8 統計分析
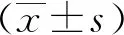
2 結果
2.1 ACSS2在三陰性乳腺癌MDA-MB-468細胞中呈高表達
結果顯示,三陰性乳腺癌MDA-MB-468細胞中ACSS2 mRNA和蛋白相對表達量均明顯高于正常乳腺上皮MCF-10A細胞(t=15.14,21.2,P均<0.01)。見圖1。
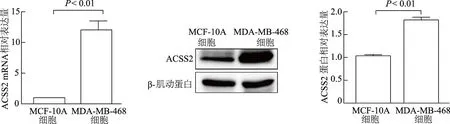
圖1 qRT-PCR和蛋白印跡法分別檢測MDA-MB-468和MCF-10A細胞中ACSS2 mRNA和蛋白表達
2.2 鑒定siRNA干擾ACSS2效果
qRT-PCR和蛋白印跡法結果顯示,與陰性對照組相比,實驗組中ACSS2mRNA和蛋白表達量明顯下降(t= 31.73,26.88,P均<0.01);空白對照組與陰性對照組間差異無統計學意義(P均>0.05)。見圖2。
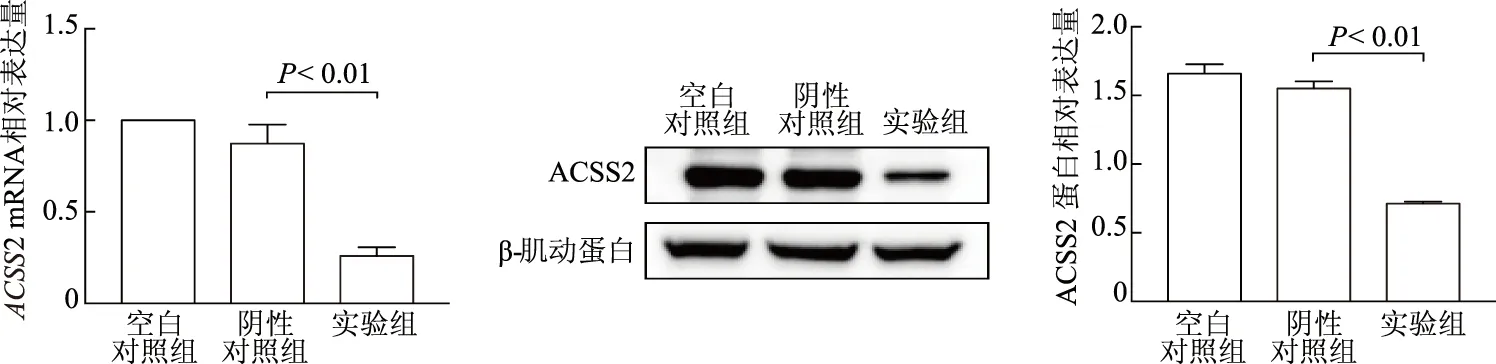
圖2 qRT-PCR和蛋白印跡法鑒定ACSS2干擾效果
2.3 siRNA-ACSS2抑制MDA-MB-468細胞增殖并促進其凋亡
CCK-8法結果顯示,干擾ACSS2處理24、48、72 h后,實驗組細胞增殖能力較陰性對照組明顯下降(t=5.056、5.324、13.240,P均<0.01);空白對照組與陰性對照組間差異無統計學意義(P均>0.05)。見圖3。流式細胞術結果顯示,實驗組細胞凋亡率較陰性對照組明顯上升(t= 9.215,P<0.01);空白對照組與陰性對照組間差異無統計學意義(P均>0.05)。見圖4。
圖3 CCK-8法檢測各組MDA-MB-468細胞增殖能力變化

圖4 流式細胞術檢測各組MDA-MB-468細胞凋亡率變化
2.4 siRNA-ACSS2降低細胞增殖相關蛋白表達并增加PI3K/AKT信號通路及凋亡相關蛋白表達
蛋白印跡法結果顯示干擾ACSS2表達后,PI3K/AKT信號通路相關蛋白p-PI3K、p-AKT表達量較陰性對照組均明顯下降(P均<0.01);Ki-67和Bcl-2蛋白表達量也較陰性對照組均明顯下降(P均<0.01),而cleaved-caspase-3和Bax蛋白表達量明顯上升(P均<0.01);空白對照組與陰性對照組間無明顯差異(P均>0.05)。見圖5。
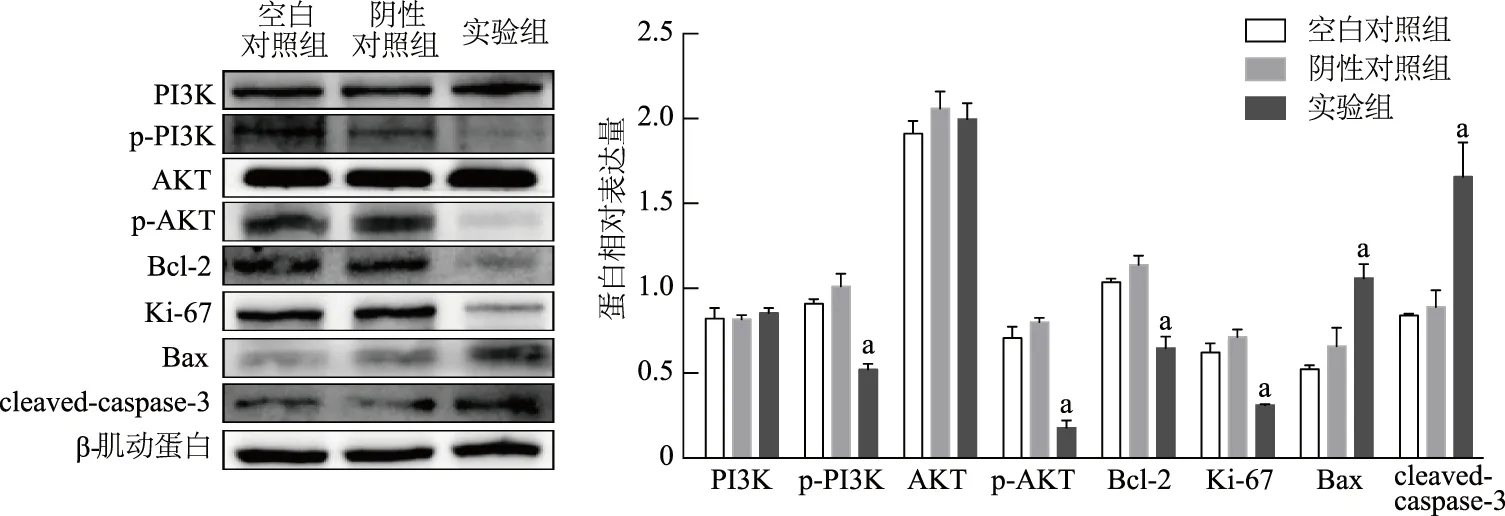
a: P<0.01,與陰性對照組比較圖5 蛋白印跡法檢測各組MDA-MB-468細胞相關蛋白表達
3 討論
現有研究發現,腫瘤微環境中的乙酸鹽可經腫瘤細胞中異常高表達的ACSS2利用,催化形成乙酰輔酶A,通過調節組蛋白乙酰化修飾,進一步激活調控細胞增殖、凋亡、自噬等特定基因表達或激活相關信號通路[7]。前期研究表明,ACSS2蛋白在胃癌[8]、宮頸癌[5]、食管癌[4]、腎癌[6]中呈不同程度高表達。本研究表明,無論是轉錄還是翻譯水平,三陰性乳腺癌MDA-MB-468細胞中ACSS2表達明顯高于正常乳腺上皮MCF-10A細胞,與上述研究相一致。進一步證實ACSS2利用糖酵解途徑代謝產生的乙酸鹽合成乙酰輔酶A,并在一系列酶促反應下合成脂肪酸作為細胞能量來源及合成原料[9],而正常細胞的能量代謝方式并不依賴ACSS2。
Zhang等[6]研究表明,下調ACSS2蛋白表達可抑制腎細胞癌細胞增殖、遷移和侵襲。Wang等[10]研究表明,在肝癌細胞中,細胞核內ACSS2第一個轉錄起始位點表達增加,使組蛋白釋放的醋酸酯去乙酰化,增加核糖體產生,進而促進腫瘤細胞增殖、侵襲和轉移。本研究表明,靶向干擾ACSS2表達可抑制三陰性乳腺癌MDA-MB-468細胞增殖,并下調增殖相關Ki-67蛋白的表達水平,從而可能進一步延緩腫瘤發展,可能與細胞核內組蛋白去乙酰化有關。由此提示,ACSS2沉默可能與抑制乳腺癌細胞生長相關。
凋亡是細胞程序性停止生長和分裂的過程,其調控失敗,可致體內受損細胞累積,導致癌癥發生[11]。細胞凋亡的啟動依賴于一系列的半胱氨酸-天冬氨酸蛋白酶的激活,其中cleaved-caspase-3是具有活性的執行蛋白酶,其可激活內切酶導致DNA片段化和細胞骨架破壞等一系列引起細胞凋亡事件發生[12]。此外,細胞凋亡過程還涉及Bcl-2家族成員Bax激活,而Bcl-2可在線粒體水平對抗凋亡刺激,與Bax形成異源二聚體,進而抑制凋亡,對細胞起保護作用。Yao等[13]研究顯示,植物提取物Wikstromol可在乳腺癌MDA-MB-231細胞中通過抑制Bcl-2、促進Bax蛋白表達以及激活Caspase-3誘導三陰性乳腺癌細胞凋亡。同樣,Du等[14]研究發現,敲減長鏈非編碼RNA DLX6的反義RNA(DLX6-AS1)可通過抑制Bcl-2蛋白表達、促進Caspase-3蛋白活化誘導腫瘤細胞凋亡,而過表達DLX6-AS1則相反。本研究發現,靶向下調ACSS2表達后乳腺癌細胞凋亡率明顯上升,并使Bax和cleaved-caspase-3蛋白表達增加,Bcl-2蛋白表達減少。由此說明,ACSS2缺失可誘導三陰性乳腺癌細胞凋亡。
研究發現PI3K/AKT信號轉導通路在多種惡性腫瘤中異常激活,如肝癌[15]、胰腺癌[16]及胃腸道腫瘤[17-18]等,其與腫瘤發生、發展密切相關,調控細胞增殖、凋亡、轉化、黏附和胞外基質降解等功能,參與腫瘤的全程。Yao等[13]研究顯示,Wikstromol可通過降低NF-κB的轉錄水平從而抑制PI3K/AKT通路誘導三陰性乳腺癌細胞凋亡。Niu等[19]研究發現,在三陰性乳腺癌MDA-MB-468細胞中,蠶繭中的大分子蛋白Sericin通過PI3K/AKT途徑抑制細胞增殖,誘導細胞周期停滯和促進細胞凋亡。本研究結果顯示,在MDA-MB-468細胞中,靶向干擾ACSS2可通過磷酸化PI3K和AKT蛋白,活化PI3K/AKT信號通路促進乳腺癌細胞凋亡。目前研究顯示,抑制ACSS2表達可降低乙酰輔酶A活性和組蛋白乙酰化,從而抑制癌細胞侵襲轉移[20]。然而在三陰性乳腺癌MDA-MB-468細胞中,ACSS2、組蛋白乙酰化與細胞增殖凋亡間的關系尚未明確,有待后續研究。本研究通過體外靶向下調ACSS2探究其生物學特性,但由于體外實驗無法完全模擬體內環境,ACSS2生物學特性有待在體內以及組織樣本中進一步驗證。
綜上,ACSS2在三陰性乳腺癌MDA-MB-468細胞中高表達;干擾ACSS2表達可抑制腫瘤細胞增殖,其可能通過PI3K/AKT信號通路促進乳腺癌細胞凋亡。

