成團泛菌CQ10脂多糖對紫花苜蓿種子萌發及苗期生長的影響
黃 榮, 姚 博, 張玉娟, 賈倩英, 李向陽, 張 宏, 張振粉*
(1.甘肅農業大學草業學院,甘肅 蘭州 730070;2.草業生態系統教育部重點實驗室,中-美草地畜牧業可持續發展研究中心,甘肅 蘭州 730070)
紫花苜蓿(MedicagosativaL.)為豆科苜蓿屬多年生牧草,莖葉中含有豐富的蛋白質、礦物質和維生素,因其營養豐富、適應性強、產草量高等優點,有“牧草之王”的美譽[1-3]。它不僅可以作為飼料作物,而且在改土肥田、保持水土和改善生態環境等方面也發揮著重要作用[4]。此外,紫花苜蓿是中國乃至世界上種植面積最大、種植范圍最廣的豆科牧草[5]。然而由于紫花苜蓿多種植在沒有灌溉條件的貧瘠地與低產田上[6],其生產潛力受限無法充分發揮其價值,嚴重影響了苜蓿的經濟利益和產業的發展[7]。因此,如何提高苜蓿在外界環境條件不適宜時的產量和質量成為苜蓿產業化發展領域的研究重點。
脂多糖(Lipopolysaccharide,LPS)是革蘭氏陰性細菌細胞壁(Gram negative bacteria,GNB)的主要組成成分[8],也是一種重要的微生物相關分子模式(Microbe-associated molecular patterns,MAMPs),它可以引起植物葉綠體損傷和活性氧(Reactive oxygen species,ROS)迸發等反應[9],在植物生長發育調控過程中起到重要作用。研究表明從銅綠假單胞菌(Pseudomnasaeruginosa)中純化的10~50 mg·mL-1商用LPS可引發植物先天免疫反應[10]和觸發擬南芥ROS的雙相產生[11]。前人對脂多糖的研究都集中在其對植物的致病能力的測定。種子、植物中分布著大量脂多糖,卻并未引發大規模的植物病害,因此推測脂多糖在低濃度時無致病功能。冷靜等[12]研究表明成團泛菌的脂多糖(Pantoeaagglomeranslipopolysaccharide,LPSp)是一種低毒性、安全性良好和純度活性高的免疫增強劑,可以有效調節作物的生長發育進程[13]。因此,探索不同濃度的脂多糖對植物生長發育調節的作用具有重要意義。
為此,本試驗以紫花苜蓿‘巨能551’品種為供試材料,測定了不同濃度成團泛菌CQ10菌株脂多糖(CQ10-LPSp)對紫花苜蓿種子萌發及苗期生長的影響,以期為開發具有促生性的外源添加脂多糖制劑提供理論指導。
1 材料和方法
1.1 供試菌株及紫花苜蓿品種
供試菌株成團泛菌(Pantoeaagglomerans)CQ10分離自紫花苜蓿種子,由甘肅農業大學草業學院牧草病理實驗室提供。
供試紫花苜蓿品種:紫花苜蓿‘巨能551’(Medicagosativa‘Juneng 551’),由甘肅農業大學牧草種質資源實驗室提供,種樣在4℃恒溫條件下保存。
1.2 供試培養基
營養瓊脂培養基(Nutrient agar,NA)[14],主要用于成團泛菌CQ10菌株的純化培養。
1.3 CQ10-LPSp的提取
CQ10菌株在NA培養基上生長48 h后,使用貝博生物科技有限公司BBproExtra脂多糖提取試劑盒,提取CQ10-LPSp,具體方法參照說明書。
1.4 CQ10-LPSp的活性檢測
定量法鱟試劑測定CQ10-LPSp活性。具體參照GenScript的ToxinSensorTMEndotoxin Detection System試劑盒使用說明書操作方法。
根據說明書操作方法得出標準曲線,結果見圖1。將3次測定樣品的平均值帶入標準曲線求得CQ10-LPSp活性為0.267 EU·mL-1。

圖1 LPS含量測定標準曲線
1.5 種子發芽試驗
1.5.1前期準備 (1)參照《牧草種子檢驗規程GB/T 2930.4-2001》[15]挑選籽粒飽滿、無病蟲害的的干凈種子400粒,平均分為2組,各200粒。
(2)向玻璃發芽瓶中加入200 mL蒸餾水和不同濃度的(0,0.267,0.534和0.801 EU·mL-1)CQ10-LPSp,并記為CK(對照組),A,B和C處理,高溫高壓滅菌鍋(121℃,0.11 Mpa)滅菌21 min后待用。
1.5.2發芽試驗 種子分消毒組(消除種子表面微生物干擾)和未消毒組。其中消毒組采用質量濃度為75%的酒精浸泡1 min,質量濃度為3% NaClO浸泡5 min,無菌水沖洗3~4次;未消毒組不作任何處理。
將處理好的種子等距置于上述滅好菌的發芽瓶的發芽床上,每瓶25粒,n=4。接入種子后將發芽瓶放置于溫度23℃、濕度45%、光照(18 Klux)18 h、黑暗6 h的生長室進行培養,期間需觀察對照組和處理組種子生長狀態。于種子發芽第7 d測定發芽勢,第10 d測定發芽率和發芽指數,第30 d觀察紫花苜蓿幼苗根系結瘤情況并取樣測定幼苗根長、苗長、鮮重、干重和根系形態指標,并持續觀察剩余樣品的生長情況。
1.5.3指標測定 種子萌發的標準為胚根突破種皮,長出0.3 cm左右長的白色種根。
種子發芽率(Germination rate,GR)(%)=(第10 d發芽的種子數/25)×100%;發芽勢(Germination potential,GP)(%)=(第7 d發芽的種子數/25)×100%;發芽指數(Germination index,GI)=∑Gt/Dt(Gt:第t d天的發芽數;Dt:相應的發芽日數)。
苗長(Seedling length,SL)和根長(Root length,RL)的測定:隨機從各處理中選取10株紫花苜蓿幼苗,測量幼苗從根基部到植株最高部位的絕對長度為苗長;測量根基部到根尖的長度為根長。
鮮重(Fresh weight,FW)和干重(Dry weight,DW)的測定:隨機從各處理中選取10株紫花苜蓿幼苗,濾紙吸干表面水分后稱其鮮重,測完鮮重后將幼苗放置烘箱,75℃烘48 h至恒重后稱重即為干重。
根系形態指標是將紫花苜蓿幼苗根系從發芽瓶取出,蒸餾水中沖洗干凈,整理后用根系掃描系統掃描,輸出的圖片使用Win-RHIZO根系分析系統軟件(Regent Instruments Canada Inc)進行分析,分別得出總根表面積(Surface area,SA,單個測量植株的所有根的面積,cm2)、總根體積(Root volume,RV,單個測量植株的所有根總體積,cm3)、平均根直徑(Average diameter,AD,單個測量植株的所有根的平均直徑,cm)。
1.6 數據分析
用Microsoft Excel 2010軟件進行數據整理并作圖,數值用平均值表示;運用SPSS 23.0統計軟件對數據進項Duncan法比較種子處理和CQ10-LPSp濃度及二者交互作用對種子發芽及幼苗生長的影響;采用t檢驗效應分析CQ10-LPSp處理下不同種子處理對種子發芽及幼苗生長的影響。
2 結果與分析
2.1 不同濃度CQ10-LPSp對紫花苜蓿種子萌發的影響
由圖2可知,隨著CQ10-LPSp濃度升高,消毒組和未消毒組紫花苜蓿種子的發芽均受到了抑制。A,B處理下消毒組種子發芽率比對照組分別降低4.00%,9.00%,C處理時種子發芽率為0;A,B,C處理下未消毒組種子發芽率分別降低4.00%,3.00%,10.00%。隨著CQ10-LPSp濃度升高,未消毒組種子發芽率差異不顯著,而消毒組發芽率在C處理時顯著降低,表明種子表面微生物使種子對脂多糖處理的響應有顯著性差異。
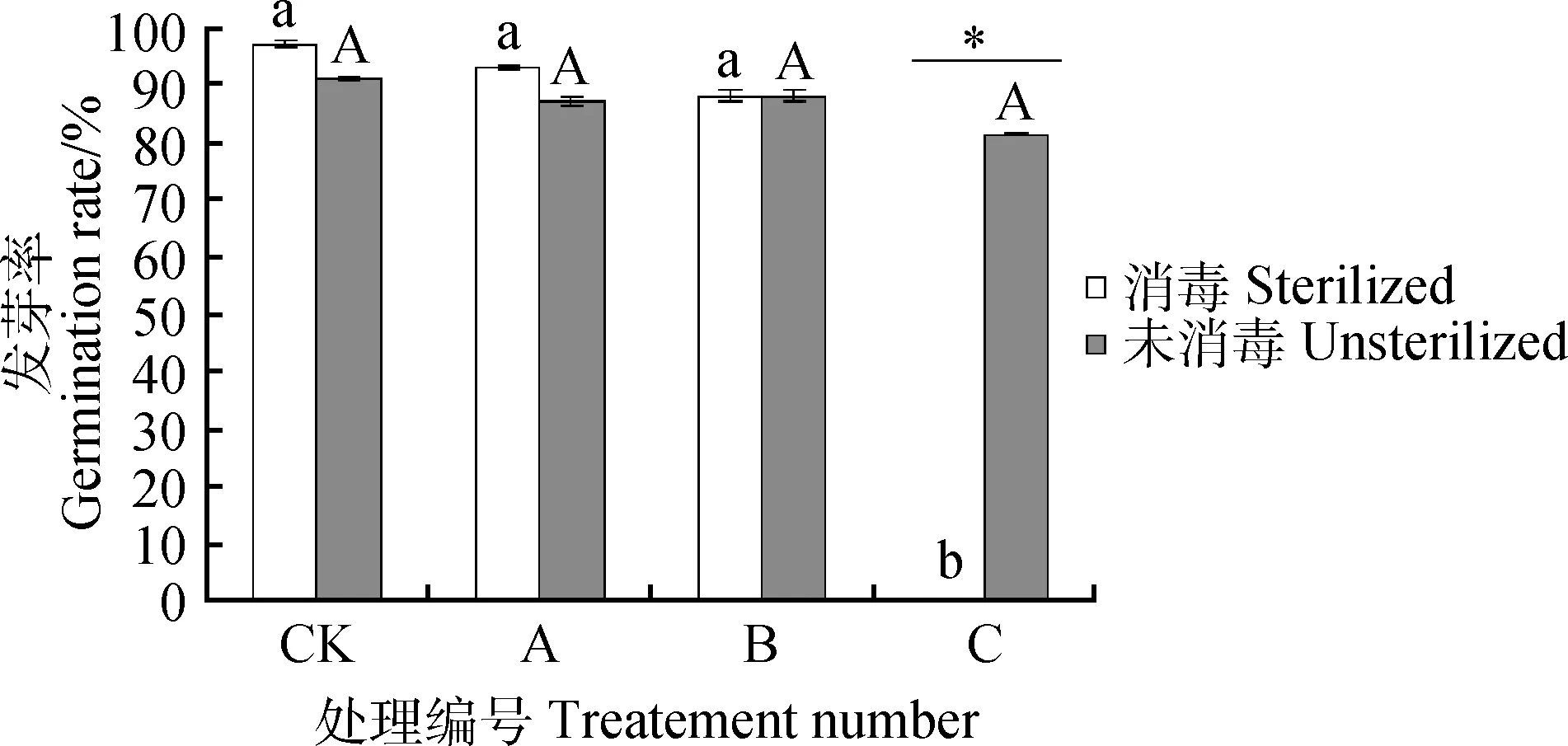
圖2 紫花苜蓿在4個不同脂多糖濃度處理下的發芽率
由圖3可知,隨著CQ10-LPSp濃度升高,消毒組和未消毒組種子發芽勢和發芽指數均降低。A處理下,消毒組發芽勢和發芽指數分別比CK降低了4.00%,4.40,比B處理和C處理分別高1.00%和5.88,93.0%和8.16;未消毒組發芽勢和發芽指數分別比CK降低了5.00%,9.23,比C處理升高了4.67%,8.16;消毒組發芽勢、發芽指數分別比未消毒組高7.00%,9.81。B處理下,消毒組發芽勢和發芽指數分別比CK降低了5.00%,14.21,比C處理高92.00%,32.85;未消毒組發芽勢和發芽指數分別比CK降低了9.67%,9.95;消毒組發芽勢和發芽指數比未消毒組分別高4.00%,2.69。C處理下,消毒組的發芽勢和發芽指數均是0,與其他處理存在顯著性差異(P<0.05);未消毒組的發芽勢和發芽指數分別比CK降低了9.67%,9.95;未消毒組發芽勢和發芽指數顯著高于消毒組(P<0.05)。

圖3 紫花苜蓿在4個不同脂多糖濃度處理下的發芽勢和發芽指數
2.2 不同濃度CQ10-LPSp對紫花苜蓿幼苗根系生長的影響
如圖4所示,隨著CQ10-LPSp濃度的升高,消毒組和未消毒組的平均根直徑呈上升趨勢;總根表面積呈下降趨勢。A處理下,消毒組紫花苜蓿幼苗的根長、苗長和平均根直徑分別較CK增加了2.20,2.00,0.01 cm;未消毒組分別較CK增加了0.31,1.12,0.03 cm;消毒組較未消毒組根長和苗長分別增加了4.34,3.71,平均根直徑減小了0.04 cm。B處理下,紫花苜蓿幼苗根系表現為短粗狀,消毒組平均根直徑和總根體積分別較CK和A處理增加了0.27 cm,0.50 cm3,根長、苗長和總根表面積顯著低于CK和A處理(P<0.05);未消毒組平均根直徑和總根體積分別較CK和A處理增加了0.02 cm,0.46 cm3,根長、苗長和總根表面積顯著低于CK和A處理(P<0.05)。C處理下,消毒組種子未萌發,未消毒組種子雖有萌發,但后期逐漸枯萎腐爛,因此未測得幼苗的苗長和根長等指標(生長狀況見圖6-C和圖6-G)。結果表明0.267 EU·mL-1CQ10-LPSp會促進消毒組和未消毒組紫花苜蓿幼苗的根長和苗長,對根直徑和總根體積沒有影響;0.534 EU·mL-1CQ10-LPSp會增加紫花苜蓿的根直徑,降低其根長和苗長。

圖4 紫花苜蓿在4個不同脂多糖濃度處理處理下的平均根直徑、總根體積、總根表面積、根長和苗長
2.3 不同濃度CQ10-LPSp對紫花苜蓿幼苗鮮重和干重的影響
如圖5所示,CQ10-LPSp在高濃度時對紫花苜蓿的生長有抑制作用,但在低濃度(A處理)時,對未消毒組生長有促進作用。A處理下,未消毒組鮮重和干重顯著高于CK,B和C(P<0.05);未消毒組鮮重和干重高于消毒組。B處理下,未消毒組鮮重和干重均高于消毒組,且消毒組和未消毒組鮮重存在顯著性差異(P<0.05)。

圖5 紫花苜蓿在4個不同脂多糖濃度處理下的鮮重、干重
2.4 不同濃度CQ10-LPSp對紫花苜蓿結瘤的影響
結果如圖6所示,添加不同濃度CQ10-LPSp對紫花苜蓿幼苗結瘤的影響差異較大,其中僅A處理未消毒組幼苗根部結瘤。且結瘤時間大約為處理后第22~24 d,比對照提前約16~18 d。隨著生長期的延長,所結根瘤逐漸增多并變大(圖6-J),但植株葉片伴有白化現象。

圖6 4個不同CQ10-LPSp濃度處理下紫花苜蓿幼苗結瘤情況
3 討論
3.1 CQ10-LPSp對紫花苜蓿生長的影響
糖類作為微生物、動植物及人體細胞表面的重要組成部分,在生命體的生長、發育和代謝等過程中發揮著極其重要的作用,可以調節植物的營養傳輸、下胚軸伸長、子葉綠化和芽的發育[16]。細菌細胞存在許多結構特異的莢膜多糖(Capsular polysaccharide,CPS)、胞外多糖(Exopolysaccharide,EPS)和脂多糖,在適應環境和與寄主互作中起著重要的作用。這些糖類結構復雜多樣且高度保守,可作為一種有效的抗原類化合物[17]。張文平等[18]研究發現乳酸菌胞外多糖(20~2 000 mg·L-1)對水稻種子根的生長有促進作用;向達兵等[19]研究了內生真菌(Bionectriapityodes)多糖浸種對苦蕎種子萌發的影響,結果表明當所用內生真菌多糖濃度為100 mg·kg-1時,對苦蕎株高有明顯的提高效果,但當多糖濃度繼續升高時,其提高效果顯著下降,而當濃度上升到800 mg·kg-1時,真菌多糖浸種處理有明顯的抑制效果。本試驗首次證實,成團泛菌脂多糖會影響紫花苜蓿種子的萌發和苗期的生長。結果表明,隨著CQ10-LPSp濃度的升高,消毒組和未消毒組紫花苜蓿種子的發芽會受到抑制,其中發芽指標包括發芽指數、發芽勢和發芽率,當CQ10-LPSp濃度為0.267 EU·mL-1時,消毒組和未消毒組的種子發芽指數、發芽勢和發芽率和對照無顯著差異,且紫花苜蓿幼苗的根長、苗長和平均根直徑高于對照,未消毒組幼苗鮮重、干重和平均根直徑高于對照。當CQ10-LPSp濃度為0.801 EU·mL-1時,會完全抑制消毒組種子的萌發和生長,這與前人的研究結果一致[18-19]。王娜等[20]認為植物內生菌提取物對植物的生長發育有明顯的調控效應,并認為外用植物內生菌提取物必然會影響植株體內某些激素的含量以及激素間的平衡。綜上,0.267 EU·mL-1CQ10-LPSp雖抑制了紫花苜蓿種子的發芽,但與對照無顯著差異,未消毒組單株紫花苜蓿根長、苗長、平均根直徑、鮮重和干重均高于對照,所以0.267 EU·mL-1CQ10-LPSp總體上提高了紫花苜蓿的總產量。因此,推測LPS作為一種外源物質,具有閾值效應,對植物具有雙重作用,低濃度時會促進紫花苜蓿的生長和結瘤,高濃度時可能會導致植株體內的激素水平不平衡和活性氧過量產生而出現抑制現象[11,21-22]。基于此,0.267 EU·mL-1CQ10-LPSp具備作為一種植物生長調節物質的潛力。
3.2 CQ10-LPSp對紫花苜蓿結瘤的影響
紫花苜蓿可以和根瘤菌共生固氮,其共生固氮體系是自然界中固氮效率較高的體系之一[23],對改良土壤結構、增加土壤肥力和氮肥的施用量、養畜、保持水土及美化環境都有良好的改善作用,對于保護環境和農業的可持續發展也具有巨大的經濟效益和生態效益。一氧化氮(Nitric oxide,NO)作為一種自由基反應性氣體信號分子,在豆科植物根瘤菌共生體系的功能結瘤、共生固氮和響應非生物脅迫等方面發揮著重要的功能[24-26]。最近的研究表明,LPS可作為一種重要的生物類激發子可以誘導原生質體產生大量的NO[27-28]。在根瘤菌與植物共生過程中,LPS在根瘤菌對根毛的吸附、根瘤及侵染結構的形成保護細胞免受植物防衛反應的作用等方面都有重要的作用[29]。本試驗結果發現,不同濃度CQ10-LPSp對紫花苜蓿根的結瘤影響差異較大,僅0.267 EU·mL-1CQ10-LPSp的未消毒組紫花苜蓿幼苗根會結瘤,其他試驗組均無結瘤現象,推測出現該現象可能有兩個原因:一是CQ10-LPSp誘導紫花苜蓿原生質體產生了NO,NO促使紫花苜蓿結瘤[27-28],且NO的含量是控制結瘤的重要因素之一;二是種子表面消毒殺死了紫花苜蓿種子表面的一些腐生菌,其中包括根瘤菌,該方法破壞了紫花苜蓿種子表面微生物的微生態環境,使得紫花苜蓿幼苗分泌的黃酮類化合物無法作用于根瘤菌的結瘤基因從而表達信號分子-結瘤因子[30],這一假設需要更進一步的研究來證實。
4 結論
本試驗研究了CQ10-LPSp對紫花苜蓿種子萌發及苗期生長的影響,結果表明隨著CQ10-LPSp濃度的升高,消毒組和未消毒組紫花苜蓿種子萌發受到不同程度地抑制。其中在0.267 EU·mL-1CQ10-LPSp處理下,種子發芽雖受到抑制,但與對照無顯著差異,未消毒組單株紫花苜蓿根長、苗長、平均根直徑、鮮重和干重均高于對照,且根瘤形成時間比對照組提前約16~18 d,根瘤數量也大于對照組。所以0.267 EU·mL-1CQ10-LPSp處理可促進未消毒組紫花苜蓿的生長和結瘤,總體上提高了紫花苜蓿的總產量。

