細菌源3-羥基脂肪酸作為環境變化代用指標的研究進展
孫棋棋, 宋金明, 4, 袁華茂, 4, 李學剛, 4
細菌源3-羥基脂肪酸作為環境變化代用指標的研究進展
孫棋棋1, 2, 3, 宋金明1, 2, 3, 4, 袁華茂1, 2, 3, 4, 李學剛1, 2, 3, 4
(1. 中國科學院海洋研究所海洋生態與環境科學重點實驗室, 山東 青島 266071; 2. 青島海洋科學與技術試點國家實驗室 海洋生態與環境科學功能實驗室, 山東 青島 266237; 3. 中國科學院海洋大科學研究中心, 山東 青島 266071; 4. 中國科學院大學, 北京 100049)
細菌源3-羥基脂肪酸(C10–C18)作為環境變化指示指標具有良好的應用前景, 但相關研究還很不系統, 在海洋環境中的應用剛剛起步。3-羥基脂肪酸主要用于環境中pH和溫度的重建, 通過其支鏈比(異構和反異構3-羥基脂肪酸之和/正構3-羥基脂肪酸之和)與pH的顯著正相關關系反演環境中的pH, 通過其C15和C17同系物的反異構/正構比(RAN15和RAN17)與大氣年均溫的顯著負相關關系反演環境中的溫度, 相比基于甘油二烷基甘油四醚類化合物或其他生物標志物的環境代用指標具有明顯的優勢。然而, 陸地生態系統中基于3-羥基脂肪酸的環境指標不適用于海洋環境, 最新研究提出了基于3-羥基脂肪酸的新的海洋溫度指標(RAN13), 而3-羥基脂肪酸作為海洋環境中pH替代指標的成功應用尚未見報道。3-羥基脂肪酸與特定細菌群落的空間耦合或菌株培養實驗顯示含有3-羥基脂肪酸的細菌可能主要是變形菌、藍細菌等。分析表明, 3-羥基脂肪酸作為全球環境演變有效的替代指標需要更多的數據和證據支持, 未來可從海洋適用性、新指標體系和微生物來源幾個方面展開繼續研究。
3-羥基脂肪酸; 革蘭氏陰性細菌; 環境變化代用指標; 溫度; pH
新的環境代用指標的發掘有利于評估海洋環境中的氣候變化和改善對過去全球氣候的理解, 微生物來源的膜脂類化合物即為其中之一[1]。為了應對環境變化, 微生物(細菌、古菌和一些原核生物)通過調整其細胞膜組分維持其流動性并保證細胞膜的最佳狀態, 這一內穩態保持機制稱為“均黏調試”[2]。具體而言, 細菌通過改變不飽和脂肪酸與飽和脂肪酸的比值、調整支鏈脂肪酸的比值和減少碳鏈長度來適應外界溫度變化[3]。例如, 在低溫時微生物會趨向于增加磷脂脂多糖中熔點較低的羥基脂肪酸的含量, 從而降低膜脂的熔點, 使其在低溫下也能夠保持較好的流動性, 維持正常的生理代謝[4]。相反地, 在pH較低的條件下微生物會降低支鏈脂肪酸的含量, 從而降低細胞膜的流動性和滲透性來阻止氫離子的脅迫滲入, 維持細胞內部接近中性的pH[5]。微生物類脂物結構和組成相對穩定, 其完整的分子骨架能保存在地質樣品中, 并靈敏地響應地質環境條件的變化[1]。因此基于微生物類脂物結構變化的環境代用指標可以迅速、高分辨地記錄古環境變遷, 具有良好的應用前景。
現有的微生物環境代用指標各有優缺點, 準確估測基于生物標志物的古溫度或古環境面臨巨大的挑戰[6]。近年來, 細菌源的支鏈甘油雙烷基甘油四醚(brGDGTs)作為少數能夠用來重建陸地溫度和pH的有機生物標志物成為研究熱點[7]。然而, 其甲基化指數僅在10~25 ℃范圍內與溫度呈良好的相關性, 基于其重建的溫度數據在干旱等極端環境下存在較大偏差[1], 且生物合成來源不明確[8], 因此基于brGDGT的古環境數據須謹慎理解。基于古菌源的類異戊二烯甘油雙烷基甘油四醚(iGDGTs)的溫度指標TEX86已廣泛應用于全球海洋[9]。然而, 基于TEX86的溫度估算結果會受到季節變化和其他與溫度無關的因素影響而產生偏差[9-10], 在受陸源輸入影響較大的邊緣海用TEX86重建古溫度需慎重。另外, 不同有機生物標志物提供的環境信息可能存在沖突, 獨立的指標能夠保證古環境重建的可靠性, 因此尋找能夠示蹤環境變化的獨立指標十分必要。
細菌3-羥基脂肪酸(3-hydroxy fatty acids, 3-OH- FAs), 也稱為β-羥基脂肪酸, 是革蘭氏陰性菌細胞膜外膜(細胞壁)上的脂多糖中類脂A的主要成分[11]。3-羥基脂肪酸最初主要是作為內毒素的特征標志物廣泛地應用于人或哺乳動物醫藥研究和臨床生物標志物發掘[12], 近年來逐漸應用于環境健康和環境監測[13-14]、植物識別病原菌的免疫通路[15]等方面。通過對3-羥基脂肪酸的定量, 可以實現對環境和臨床樣本中細菌內毒素和革蘭氏陰性細菌的檢測和定量[16]。
本文從結構與分布特征、微生物來源、指示環境變化的原理和優勢及其在不同生態系統中的應用等方面歸納總結了一個新的微生物來源的環境變化指示指標3-羥基脂肪酸的研究概況。
1 3-羥基脂肪酸的基本特征
1.1 3-羥基脂肪酸的結構與組成
環境中占主導地位的3-羥基脂肪酸包括10到18個碳原子并在距離羧基的第三個碳原子位置上有一個羥基(表1, 圖1), 通過酯鍵或酰胺鍵與大分子結合, 因而不易降解, 能夠較為完好的保存在地質環境中[17]。3-羥基脂肪酸的前體物質是革蘭氏陰性菌, 在變形菌黃桿菌屬[18]、浮游態藍細菌[19]、新型隱球菌[20]、酵母菌[21]、分枝桿菌[22]等細菌中都能檢測到。此外, 革蘭氏陽性乳桿菌也能夠產生碳鏈長度為C10到C18的3-羥基脂肪酸[23]。隨著碳數增加, 熔點逐漸升高, 低碳數的脂肪酸呈無色液體, 有刺激性氣味, 而高碳數的脂肪酸是蠟狀固體, 無明顯氣味。人工合成的3-羥基脂肪酸標準品呈無色粉末狀固體, 室溫儲存, 其中C10至C16的3-羥基脂肪酸均可溶于有機溶劑正己烷, 而C17和C18僅溶于甲醇。

表1 3-羥基脂肪酸的種類
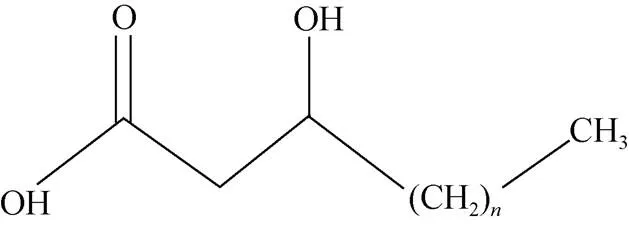
圖1 3-羥基脂肪酸的結構式(n=6~14)
支鏈脂肪酸(Branched-chain fatty acids, BCFA)是一類碳骨架上帶有一個或多個支鏈(主要是甲基)的脂肪酸, 由于特定的支鏈結構, 使其區別于直鏈脂肪酸具有一些特殊的理化性質, 如較低的凍點、良好的熱穩定性和氧化穩定性。在一些微生物(芽孢桿菌等)中約90%的膜脂脂肪酸是BCFA, 可使細胞膜具有良好的流動性[24]。末端甲基位置對單甲基BCFA分子構型非常重要: 甲基位于脂肪酸分子碳鏈骨架倒數第2個碳原子上形成的結構稱為異構型(iso), 甲基位于脂肪酸碳鏈骨架倒數第3個碳原子上形成的結構稱為反異構型(anteiso)。不同構型BCFA性質相差較大, 相同碳鏈長度的BCFA反異構型熔點遠低于異構型。微生物通過降低細胞膜中iso/anteiso-BCFA的比例適應外部環境溫度的變化, 保持細胞膜的功能性和流動性[25-26]。
1.2 3-羥基脂肪酸在環境中的分布特征
3-羥基脂肪酸在環境中普遍存在且含量豐富。研究表明, 來自坦桑尼亞不同氣候帶的39個土壤樣品中總3-羥基脂肪酸的含量為0.8~24.2 μg/g(干重)[27]。北太平洋西海岸邊緣海的45個表面沉積物樣品中檢測到, 總3-羥基脂肪酸的濃度為1.0~36.0 μg/g(干重)[10]。黑海的研究[28]發現, 3-羥基脂肪酸約占黑海顆粒態有機物中總羥基脂肪酸的100%, 約占沉積物中羥基脂肪酸的60%。赤道太平洋、墨西哥灣和北海中超濾可溶有機物(高分子量溶解有機物)的研究[29]表明, 短鏈的3-羥基脂肪酸占海水超濾可溶有機物的6%~91%, 這表明細菌細胞膜來源的類脂化合物或許是海洋溶解態有機物質的重要組成成分之一。黑海的研究同時還發現, 3-羥基脂肪酸的濃度在30 m的表層水中含量較高, 并隨著深度增加而降低。表層水同時具有最高的革蘭氏陰性菌豐度和3-羥基脂肪酸含量, 因而推測海洋沉積物中3-羥基脂肪酸可能主要來自于表層水[28]。
神農架的26個土壤樣品包括異構的C11, C13, C15, C16, C17和反異構的C13, C15, C173-羥基脂肪酸, 但以正構C143-羥基脂肪酸為主碳峰[5]。來自湖北和尚洞一根2.5 m的石筍以-C10、-C12、-C14、-C16和-C183-羥基脂肪酸的含量最高[30]。最近有研究報道了酸性礦坑水樣品中3-羥基脂肪酸的分布特征以-C12和-C16為主, 這是首次對極端酸性環境中3-羥基脂肪酸分布的報道[31]。類似的, 坦桑尼亞跨緯度跨氣候帶的39個土壤樣品也以偶數的正構同系物為主, 其中尤以-C14、C16和C18為最豐富的3-羥基脂肪酸[27]。北太平洋西海岸邊緣海的表層沉積物中3-羥基脂肪酸組成主要包括偶數的C12、C14和C16正構同系物和奇數的C15反異構同系物[10]。比較分析發現, 海洋表層沉積物中具有較多的反異構3-羥基脂肪酸, 土壤中則含有較多的正構和異構高分子量3-羥基脂肪酸(C15–C18)。實際上, 無論是土壤[5]還是海洋表層沉積物[10],-C14都是3-羥基脂肪酸主要的同系物。一般來說, 3-羥基脂肪酸主要的同系物都屬于C12、C14或C16之一。與此不同的是, 海南尖峰嶺土壤樣品經過皂化處理使得通過酯鍵結合的游離態脂肪酸能夠被儀器檢測到, 獲得了主峰碳為C18的3-羥基脂肪酸, 這與酸解獲得的3-羥基脂肪酸分布模式不同, 這是由于皂化不能打斷酰胺鍵, 因此通過酰胺鍵結合的C14或C16含量較少[32]。
1.3 3-羥基脂肪酸的微生物來源
對于微生物環境代用指標而言, 細菌膜脂的不同來源可能混淆或掩蓋其反映的環境信息, 判別細菌生物標志物準確的生物合成來源非常必要。基于微生物類脂物的生物標志物和微生物群落都能夠反映其所在的環境地球化學條件的變化[33], 二者的耦合關系是現有研究判別3-羥基脂肪酸微生物來源的主要依據。
由于不同的環境條件影響革蘭氏陰性菌及其膜脂的組成成分(也就是3-羥基脂肪酸), 目前的研究結果隨生態系統的不同而變化。多數研究認為, 以洞穴土壤、滴水和石筍為代表的陸地生態系統中, 3-羥基脂肪酸的生產者是-變形菌假單胞菌屬[30]。楊毅等在北太平洋西海岸邊緣海的研究[10]探索和比較了海洋沉積物和土壤中不同的3-羥基脂肪酸和微生物分布, 推測海洋沉積物中3-羥基脂肪酸的生產者可能是-及-變形菌, 而土壤中可能是-、-、-、-變形菌和酸桿菌的混合來源。然而在地下水和河口次表層沉積物中盡管-C16: 0 3-OH-FA占其磷脂脂多糖脂肪酸的16.9%, 卻未能在定向培養的4個Gammaproteobacterium菌株中被檢測到, 說明-變形菌不是該環境條件下沉積物中3-羥基脂肪酸的來源[34]。黑海的系列研究根據革蘭氏陰性菌和3-羥基脂肪酸在海洋水柱中一致的分布格局(表層富集, 且隨深度下降)推測黑海中3-羥基脂肪酸的生物合成起源可能是微藻、藍細菌類脂物和一些厭氧甲基營養的細菌[28]。然而, 在2°S的赤道太平洋未能觀測到超濾溶解有機物中3-羥基脂肪酸濃度隨深度變化的現象[29]。
不同的微生物屬/種也能夠產生不同組分的3-羥基脂肪酸。對內毒素標準品系的研究指出, 大腸桿菌中只含有3-羥基十四烷酸, 且大腸桿菌型別對3-羥基脂肪酸種類無影響, 認為只要出現3-羥基十四烷酸以外的3-羥基脂肪酸即可斷定含有非腸道菌[35]。有研究指出, 有10、12或14個碳原子的3-羥基脂肪酸主要來自不同的假單胞菌屬[36], 而在擬桿菌屬和梭桿菌屬中最豐富的同系物是C14或C163-羥基脂肪酸[37]。菌株培養實驗發現Deltaproteo-bacterium地桿菌屬中以3-OH-14: 0和3-OH-16: 0為主要同系物[38]。另一個菌株培養研究卻發現-C15: 0 3-OH-FA或-C17: 0 3-OH-FA才是脫硫弧菌屬細胞膜磷脂脂多糖中最主要的羥基脂肪酸[39]。赤道太平洋、墨西哥灣和北海中超濾可溶有機物的研究發現, C12: 0 3-羥基脂肪酸是革蘭氏陰性假單胞菌屬中羥基酸的主要同系物; 聚球藻屬中的3-14: 0和3-16: 0 3-羥基脂肪酸占總脂肪酸的10%, 支鏈(異構和反異構)3-15: 0和3-17: 0 3-羥基脂肪酸僅占總脂肪酸的5%; 束毛藻屬sp中僅僅包含痕量的(約為1%)C12: 0 3-羥基脂肪酸和C14: 0 3-羥基脂肪酸; 而革蘭氏陽性芽孢桿菌屬則幾乎不存在羥基脂肪酸[29]。
目前關于3-羥基脂肪酸生產者的研究尚未達成一致結論, 僅可推測其生物合成來源可能以變形菌和藍細菌門為主。現有研究的判別依據主要是環境中3-羥基脂肪酸與特定微生物群落的空間耦合, 或者定向菌株培養實驗, 前者不能提供直接強有力的證據, 結果并不可靠, 后者費時費力, 目標靶向性較弱。
1.4 3-羥基脂肪酸的檢測分析
3-羥基脂肪酸的前處理流程主要包括: 酸解-萃取-濃縮-甲酯化-柱層析-衍生化等步驟, 內標法判定回收率, 外標法建立標準曲線。3-羥基脂肪酸經過甲酯化和硅烷化后的脂肪酸甲酯的特征離子峰為175 m/z (圖2), 為第3個和第4個碳原子之間的鍵斷裂造成, 是3-羥基脂肪酸區別于其他脂肪酸質譜最重要的特征。基準峰為平均分子質量減去1個甲基(15 Da)。內標為DL-3-羥基十四烷酸, 其特征離子峰為m/z 178, 包括離子碎片中有3個氘原子。

圖2 C16 3-羥基脂肪酸衍生化甲酯的質譜圖[5]
Blyth等[40]首次提出, 酸解法可提高從石筍中獲取脂肪酸和3-羥基脂肪酸的效率。在此基礎上, Wang等[41]優化了從石筍中獲取高產3-羥基脂肪酸的酸解法, 通過對比不同的HCl濃度、加熱溫度和加熱時間, 得到最優的酸解條件為3 mol/L的鹽酸、130 ℃加熱和3 h的加熱時間, 并提出5 g石筍/土壤樣品、10 g海洋沉積物即足夠用來脂類提取和分析檢測。Yang等[42]比較了酸解和皂化兩種提取方法對土壤中3-羥基脂肪酸分布模式和濃度的影響, 得出酸解法提取效率顯著高于皂化的結論, 這是由于3-羥基脂肪酸的主要分子都是通過酰胺鍵與大分子相結合, 而酰胺鍵很難通過皂化斷裂。
目前, 氣相色譜-質譜聯用(gas chromatographic- mass spectrometry, GC-MS)是最常用的細菌3-羥基脂肪酸檢測方法[5, 10, 13, 27, 30, 43], 典型的GC-MS譜圖見圖2和圖3。科學家們也嘗試了其他的檢測儀器, 如, 氣相色譜-四級桿質譜聯用與氣相色譜-串聯離子阱質譜聯用相結合(quadrupole GC-MS and ion trap GC- MS/MS)[44]、液相色譜-串聯質譜聯用(liquid chroma-tography coupled to tandem mass spectrometry: LC- MS/MS)[16]等。Larsson等[45]比較了GC-離子阱MC (GC-MS/MS)和傳統的四級桿GC-MS檢測復雜樣品中3-羥基脂肪酸的能力, 發現GC-MS/MS能夠獲得全部標志物的子離子色譜, 其靈敏度接近GC-MS的檢出限, 因此GC-MS/MS作為一個化學標志物分析技術具有廣闊的應用前景。也有研究比較了四級桿GC-MS和GC-MS/MS檢測室內降塵的效果[44]發現, GC-MS/MS優異的分選特性使其能夠呈現清晰可辨的圖譜, 而GC-MS獲得的圖譜由于較高的背景值和混合析出的化合物而難以解讀, 因此GC-MS/ MS優于GC-MS。針對目前報道的3-羥基脂肪酸GC-MS/MS分析方法無法實現與其同分異構體2-羥基脂肪酸的分離, 可能導致共流出的2-羥基脂肪酸干擾其定量這一問題, 傅博強等[46]通過優選毛細管色譜柱實現了二者在色譜柱上的基線分離。盡管如此, 基于GC-MS的3-羥基脂肪酸檢測方法仍然存在樣品準備階段甲酯化和衍生化耗時費力, 且衍生化會導致多源和多峰現象影響定量結果的問題[16]。近年, 液相色譜-串聯質譜聯用(liquid chromatography-tandem mass spectrometry, LC-MS/ MS)以其高靈敏度和分選特征開始應用于3-羥基脂肪酸的檢測。Uhlig等[16]利用高分辨LC-MS/MS (ultraper-formance LC-MS/MS, UPLC- MS/MS)的方法檢測到環境中11種3-羥基脂肪酸。他們最新的研究基于結構依賴的保留時間預測模型, 利用UPLC-MS/MS建立了全球通用的判別3-羥基脂肪酸與其同分異構體2-羥基脂肪酸的測定方法[47], 顯示了巨大的應用潛力。

圖3 南海、黃海、白令海、北太平洋表層沉積物和土壤中3-羥基脂肪酸萃取離子質譜圖(特征離子峰m/z 175)的典型分布[10]
2 3-羥基脂肪酸與環境變化的關系
2.1 3-羥基脂肪酸指示環境變化
由于脂肪酸的支鏈能夠增加細胞膜的流動性[26]和滲透性[48], 細菌可以通過改變細胞膜上3-羥基脂肪酸等不同脂類的甲基支鏈數來響應環境變化[49]。
3-羥基脂肪酸指示環境中pH變化主要是通過其支鏈比(異構和反異構3-羥基脂肪酸之和/正構3-羥基脂肪酸之和)與pH的顯著正相關關系反演環境中的pH(表2)。在pH較低的條件下支鏈比降低反映了化學滲透耦聯這一內穩態機制, 即, 細菌產生具有較少支鏈的同系物從而降低細胞膜的流動性和滲透性來抗衡細胞膜內外較大的氫離子濃度差, 目的是為了維持細胞內部接近中性的pH。細胞內自由態的氫離子能損害DNA轉錄、蛋白質合成等過程并抑制酶活性。細菌細胞膜兩側氫離子濃度差的存在和維持, 通過影響那些存在于細胞膜核心脂上、傳遞氫離子的水分子, 對細胞的能量供應至關重要[50], 其大小取決于周圍環境中的氫離子濃度。細菌適應較低pH環境的通常策略為: 一方面累積鈉離子平衡細胞膜兩側的濃度梯度, 一方面降低3-羥基脂肪酸的支鏈比, 使得細胞膜組裝得更加致密厚實, 建立氫離子化學滲透屏障, 阻止氫離子的被動滲透[31]。同時, 細胞膜滲透性降低可在細胞水平上降低能量流失, 從而幫助微生物在極端酸性條件下幸存。
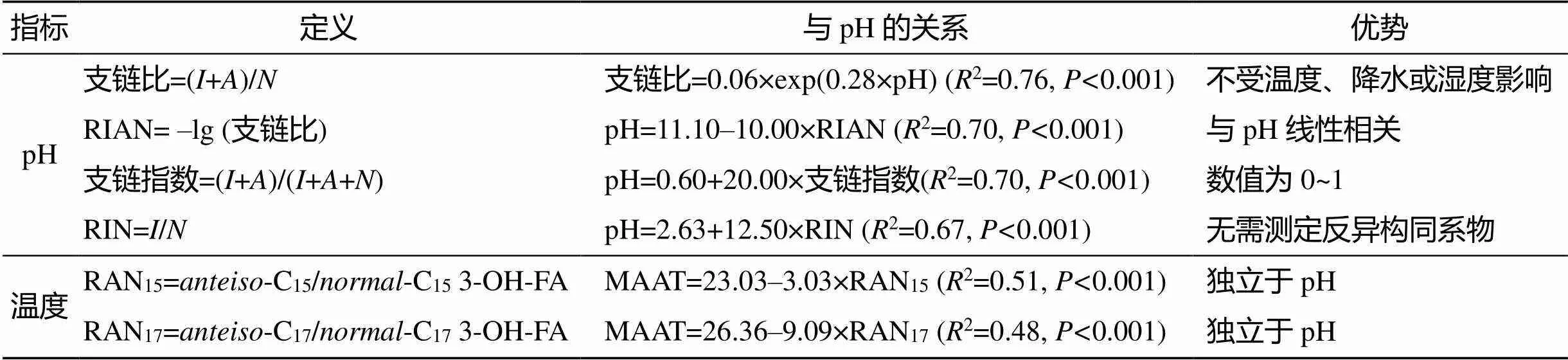
表2 基于3-羥基脂肪酸的環境代用指標及其優勢[5]
注: 其中,(normal-)代表所有正構3-羥基脂肪酸的和,(iso-)代表所有異構3-羥基脂肪酸的和,(anteiso-)代表所有反異構3-羥基脂肪酸的和。MAAT代表年均氣溫(℃)
3-羥基脂肪酸指示環境中溫度的變化主要是通過其C15和C17同系物的反異構/正構之比(RAN15和RAN17)與年均溫的顯著負相關關系反演環境中的溫度(表2)。3-羥基脂肪酸C15和C17同系物的反異構/正構之比隨溫度的降低而增加, 即在低溫時細菌合成更多的反異構同系物。反異構3-羥基脂肪酸具有獨特的物理化學性質, 能夠在低溫條件下維持微生物細胞膜的液晶狀態, 使其保持較好的流動性。反異構脂肪酸具有比正構脂肪酸較低的熔點, 其固液相轉變溫度顯著低于異構脂肪酸[51]。當溫度較低時, 細菌為了維持細胞膜的流動性、保持正常的生理代謝, 需要增加反異構3-羥基脂肪酸(RAN指數)。異構與正構3-羥基脂肪酸之比則未能表現出同樣的響應特征, 這是由異構和反異構脂肪酸不同的物理化學性質造成的。反異構的甲基支鏈位于距離甲基終端第3個碳原子上, 異構的甲基支鏈位于距離碳鏈末端的第2個碳原子上, 因而反異構支鏈脂肪酸具有相比異構支鏈脂肪酸更高的流體化學性質和不同的官能團破壞次序[25]。此外, 反異構脂肪酸具有相比正構飽和脂肪酸和異構脂肪酸更大的橫截面積, 能夠分散緊密排列的脂肪酰基鏈, 增強細胞膜的流動性。
2.2 3-羥基脂肪酸指示環境變化的優勢
相比其他生物標志物, 3-羥基脂肪酸在指示環境變化和重建古氣候方面具有獨特的優勢(表2)。
所有基于3-羥基脂肪酸的pH代用指標都不受溫度、氣壓、降水和濕度的影響, 是獨立的微生物環境代用指標。其中RIAN建立了與pH的線性關系, 簡潔明了, 降低了計算難度; 支鏈指數在0~1變化, 這是其他pH指標不具備的優勢; RIN指標僅涉及正構和異構同系物, 不需要測定一般環境中含量最少的反異構同系物, 降低了測定難度和復雜度。有研究比較了3-羥基脂肪酸與其他生物指標在重建古pH時的優缺點[52], 認為相比硅藻組合、δ11B、B/Ca、brGDGTs等指標, 3-羥基脂肪酸的反演結果不受溫度、壓力等環境因素的影響, 然而作為一種新的生物標志物其成熟度不夠, 需要分析較多的樣品和多角度數據的支持。
3-羥基脂肪酸在反演過去環境中的溫度時獨立于pH, 在pH劇烈變化或者可能存在多個混雜變量的環境中存在強大的優勢[5]。有研究比較了基于3-羥基脂肪酸的RAN13與基于GDGT的溫度指標TEX86[10], 發現在高溫(>25 ℃)的熱帶區域RAN13與溫度的擬合更靈敏, 低溫時TEX86對溫度不敏感, 而RAN13即使在<6 ℃的極地低溫情況也與溫度有強相關。此外, 通過測定一個較短的柱狀沉積物中3-羥基脂肪酸反演過去58 a的溫度[10], RAN13記錄了1959年至2017年長期的增溫現象, 二十世紀七十至八十年代有4 ℃左右的強烈波動, 以及自二十世紀九十年代之后的持續增溫。相比之下, TEX86既不能重建長期增溫趨勢, 又無法精確地捕獲到二十世紀七十至八十年代的溫度振蕩[53]。這些都證明了RAN13是重建海洋古溫度的穩健的指標, 即使在西太平洋邊緣海不斷的季節性陸源輸入也未能掩蓋或疊加3-羥基脂肪酸及其溫度指標對海洋環境溫度的敏感響應[10]。
3 3-羥基脂肪酸指示環境變化的研究進展
過去3-羥基脂肪酸作為環境中革蘭氏陰性細菌的生物標志物, 在土壤[54]、生物膜[55]、大氣氣溶膠[56]、石筍[57]和新鮮雪水[58]等不同的地質體中檢測到。近年來, 王燦發等首次建立了3-羥基脂肪酸對pH和溫度的響應公式, 定義了基于3-羥基脂肪酸的環境代用指標體系, 并將其應用于陸地環境(土壤和石筍等)中[5, 30]。神農架26個土壤樣品的研究發現, 3-羥基脂肪酸的相對豐度與溫度和pH都存在顯著相關。具體地, 異構反異構3-羥基脂肪酸之和與總正構3-羥基脂肪酸之和的比值(即RIAN指數)、異構反異構3-羥基脂肪酸之和與總3-羥基脂肪酸的比值(即支鏈指數), 均與土壤pH顯著相關; 3-羥基脂肪酸C15和C17化合物的異構與正構之比(分別為RAN15和RAN17指數)與年均氣溫MAAT顯著負相關[5]。MAAT與RAN15和RAN17相關度相對較弱(表2), 將來的研究應進一步采集溫度差異顯著的不同地區土壤樣品, 加大樣本量, 進一步確定MAAT和RAN15、RAN17間的相互關系。不久前華中地區和尚洞石筍的研究首次將基于3-羥基脂肪酸的環境代用指標應用在古氣候重建中, 利用RAN15指數重建了全新世溫度, 結果與儀器監測的溫度及δ18O的記錄相吻合; 根據有效降水與pH之間的關系, 將pH指標RIAN作為定性水文指標重建了過去9 Ka BP的水文變化, 結果與全球模型和區域古氣候記錄吻合[30]。這些結果證實了3-羥基脂肪酸作為環境代用指標的可靠性。Huguet等[27]將基于3-羥基脂肪酸的環境代用指標推廣到國外, 驗證了其在坦桑尼亞西南部跨越溫帶和熱帶的39個土壤樣品中的適用性。結果表明, RAN15和RAN17隨著溫度降低而相對增加, 但由于坦桑尼亞(半濕潤)和神農架(濕潤)不同的濕度條件RAN15需要區域校正, RAN17則在0~25 ℃范圍之內得以通用。然而, RIAN和pH之間僅存在中等的相關度, 且離散度較大。因此, 基于RIAN重建環境中pH在pH<5和>8的情況下存在估算偏差, 需謹慎使用。
基于3-羥基脂肪酸的環境代用指標在海洋環境中的應用剛剛起步。最近的研究首次將3-羥基脂肪酸應用于海洋環境, 發現海洋沉積物中的溫度指標(RAN15和RAN17)與海洋表面溫度不相關[10]。鑒于此, 楊毅等利用北太平洋西部邊緣海的表層沉積物數據, 首次建立并校正了一個基于3-羥基脂肪酸的能夠獨立指代海水表層溫度的新指標RAN13(反異構和正構C133-OH-FAs之比), 并利用它重建了海洋沉積物中古溫度信息。結果表明, 該指標與古海洋溫度呈現顯著的指數關系[10]。同樣地, 陸地生態系統基于3-羥基脂肪酸的pH指標(支鏈比、支鏈指數、RIAN和RIN)也不能適用于海洋環境, 而3-羥基脂肪酸指示海洋環境中pH變化的成功應用尚未見報道。作為一項重要的細菌脂類生物標志物, 3-羥基脂肪酸在海洋環境中的研究還有待繼續開發和深入拓展。
4 結語與展望
探究示蹤全球環境變化的微生物代用指標意義重大, 3-羥基脂肪酸作為溫度和pH變化的代用指標具有獨特的優勢和巨大的潛力, 本文總結歸納了細菌源3-羥基脂肪酸的研究進展及其在指示環境變化中的應用。然而其在海洋生態系統中的研究剛剛起步, 區域研究需要參數校正, 具體的細菌分類學來源尚不確定。未來的研究可從以下幾個方面進一步深入探究:
(1) 3-羥基脂肪酸指示海洋環境變化指標體系的構建。3-羥基脂肪酸作為溫度代用指標在陸地和邊緣海環境中都有良好的應用, 然而作為海洋環境中的pH替代指標其應用尚未取得進展。實際上, 國際上目前尚未有成功應用有機生物標志物指標重建海水pH的先例, 3-羥基脂肪酸的研究提供了可能性。陸地和近海的環境指標不適用于深海大洋, 海洋緩沖體系的存在使得海洋環境中pH可以在一個較小的范圍內(7.7~8.3)保持穩定, 在如此小的變化范圍內將3-羥基脂肪酸應用于重建海水pH變化產生極大的挑戰, 需要大量模擬實驗數據和外海調查案例的支持和驗證。推廣和校正3-羥基脂肪酸指示海洋環境變化的研究, 在此基礎上探索基于3-羥基脂肪酸的環境代用指標在何種程度上能成為全球性的環境代用指標, 成為下一步工作的重點和難點。
(2) 基于3-羥基脂肪酸的新指標、新方法和新應用。3-羥基脂肪酸指示環境變化的研究存在所需數據量較大、最低樣品量較多及前處理時間較長等不足, 未來應繼續改進前處理方法、探索更加靈敏的檢測方法, 使其作為環境代用指標更加經濟高效。基于GDGT和3-羥基脂肪酸的環境代用指標各有利弊, 二者相互驗證可提高結果的可靠性。隨著氣相色譜-質譜分離技術的提高, 已有指標新的計算和反演方法、新環境下的參數校正、可能指示的新的環境參數或生態意義以及新指標的構建和應用, 依然是相關研究重要的突破方面。3-羥基脂肪酸在缺氧海水相對于含氧水體的顆粒物中較高的濃度, 以及沉積物中更高的濃度, 表明其可能由厭氧細菌產生, 3-羥基脂肪酸指示大洋缺氧水體的潛力可能成為其應用于海洋生態系統的突破口。
(3) 3-羥基脂肪酸的微生物來源判別。不同環境中3-羥基脂肪酸的生物合成來源存在很大的不確定性, 可能混淆或掩蓋其反映的環境信息, 判別細菌生物標志物準確的生物合成來源非常必要。目前已有的將3-羥基脂肪酸及細菌群落的空間關系耦合和定向菌株培養的方法分別存在巨大的缺陷, 如何限定更加具體的細菌屬/種來源, 對新的技術手段提出了要求, 也是下一步工作的難點。對微生物生理生態和代謝過程的理解有助于判別特定生態環境下的限制性因子, 彌補微生物環境代用指標在應用中的不足。弄清3-羥基脂肪酸所參與的生物化學過程和代謝路徑可能幫助厘清其生物合成來源, 技術上與高通量測序相結合仍是相關研究的重要手段, 微生物宏基因組和代謝組學可能能夠提供新的視角。
[1] 謝樹成, 楊歡, 黨心悅, 等. 地質微生物響應地質環境變化的若干問題——兼論環境代用指標的應用[J]. 地質論評, 2018, 64(1): 183-189.
Xie Sucheng, Yang Huan, Dang Xinyue, et al. Some issues in microbial responses to environmental change and the application of molecular proxies[J]. Geological Review, 2018, 64(1): 183-189.
[2] Sinensky M. Homeoviscous adaptation—a homeo-static process that regulates the viscosity of membrane lipids in Escherichia coli[J]. Proceedings of the National Academy of Sciences of the United States of America, 1974, 71(2): 522-525.
[3] Suutari M, Laakso S. Changes in fatty acid bran-ching and unsaturation ofandas a response to growth temperature[J]. Applied & Environmental Microbiology, 1992, 58(7): 2338.
[4] Kumar G S, Jagannadham M V, Ray M K. Low-temperature-induced changes in composition and fluidity of lipopolysaccharides in the antarctic psychro-trophic bacterium[J]. Journal of Bacteriology, 2002, 184(23): 6746-6749.
[5] Wang C, Bendle J, Yi Y, et al. Impacts of pH and temperature on soil bacterial 3-hydroxy fatty acids: Development of novel terrestrial proxies[J]. Organic Geochemistry, 2016, 94: 21-31.
[6] 謝樹成, 黃咸雨, 楊歡, 等. 示蹤全球環境變化的微生物代用指標[J]. 第四紀研究, 2013, 33(1): 1-19.
Xie Shucheng, Huang Xianyu, Yang Huan, et al. An overview of microbial proxies for the reconstruction of past global environmental change[J]. Quaternary Sciences, 2013, 33(1): 1-19.
[7] Li J, Naafs B D A, Pancost R D, et al. Distribution of branched tetraether lipids in ponds from Inner Mon-golia, NE China: Insight into the source of brGDGTs[J]. Organic Geochemistry, 2017, 112: 127-136.
[8] Damste J S S, Rijpstra W I C, Foesel B U, et al. An overview of the occurrence of ether- and ester- lin-ked iso-diabolic acid membrane lipids in microbial cultures of the Acidobacteria: Implications for brGDGT paleoproxies for temperature and pH[J]. Organic Geochemistry, 2018, 124: 63-76.
[9] Schouten S, Hopmans E C, Damsté J S S. The organic geochemistry of glycerol dialkyl glycerol tetraether lipids: A review[J]. Organic Geochemistry, 2013, 54: 19-61.
[10] Yang Y, Wang C, Bendle J A, et al. A new sea surface temperature proxy based on bacterial 3-hydroxy fatty acids[J]. Organic Geochemistry, 2020, 141: 103975.
[11] Szponar B, Norin E, Midtvedt T, et al. Limita-tions in the use of 3-hydroxy fatty acid analysis to determine endotoxin in mammalian samples[J]. Journal of Microbiological Methods, 2002, 50(3): 283-289.
[12] Bogumi?a S, Leonard K n, Tomasz H, et al. Distribution of 3-Hydroxy fatty acids in tissues after intraperitoneal injection of endotoxin[J]. Clinical Chemistry, 2020, 49(7): 1149-1153.
[13] Binding N, Jaschinski S, Werlich S, et al. Quantification of bacterial lipopolysaccharides (endo-toxin) by GC-MS determination of 3-hydroxy fatty acids[J]. Journal of Environmental Monitoring, 2004, 6(1): 65-70.
[14] Sordillo J E, Alwis U K, Hoffman E, et al. Home characteristics as predictors of bacterial and fungal microbial biomarkers in house dust[J]. Enviro-nmental Health Perspectives, 2010, 119(2): 189-195.
[15] Luo X, Wu W, Liang Y, et al. Tyrosine phospho-ry-lation of the lectin receptor-like kinase LORE regulates plant immunity[J]. Embo Journal, 2020, 39: e102856.
[16] Uhlig S, Neg?Rd M, Heldal K K, et al. Profiling of 3-hydroxy fatty acids as environmental markers of endotoxin using liquid chromatography coupled to tandem mass spectrometry[J]. Journal of Chroma-tog-raphy A, 2016, 1434: 119-126.
[17] Huang X, Cui J, Pu Y, et al. Identifying “free” and “bound” lipid fractions in stalagmite samples: An example from Heshang Cave, Southern China[J]. Applied Geochemistry, 2008, 23(9): 2589-2595.
[18] Yano I, Ohno Y, Masui M, et al. Occurrence of 2- and 3-hydroxy fatty acids in high concentrations in the extractable and bound lipids of Flavobacterium menin-gosepticum and Flavobacterium IIb[J]. Lipids, 1976, 11(9): 685-688.
[19] Li R, Yokota A, Sugiyama J, et al. Chemota-xo-nomy of planktonic cyanobacteria based on non‐polar and 3-hydroxy fatty acid composition[J]. Phycological Research, 2010, 46(1): 21-28.
[20] Sebolai O M, Pohl C H, Botes P J, et al. 3-hydroxy fatty acids found in capsules of Cryptoco-ccus neoformans[J]. Canadian Journal of Microbiology, 2007, 53(6): 809-812.
[21] Kock J L F, Venter P, Botha A, et al. Production of 3-hydroxy fatty acids by the yeast. Biological Implications[J]. Advances in Experimental Medicine & Biology, 1999, 469: 675-677.
[22] Alugupalli S, Portaels F, Larsson L. Systematic study of the 3-hydroxy fatty acid composition of mycobacteria[J]. Journal of Bacteriology, 1994, 176(10): 2962-2969.
[23] Schnürer J, Sj?gren J, Kenne L, et al. Anti-fungal 3-hydroxy fatty acids fromMiLAB 14[J]. Applied and Environmental Microbiology, 2003, 69(12): 7554-7557.
[24] Rietschel E T. Absolute configuration of 3-hydroxy fatty acids present in lipopolysaccharides from various bacterial groups[J]. European Journal of Biochemistry, 2008, 64(2): 423-428.
[25] Russell N. Mechanisms of thermal adaptation in bacteria: blueprints for survival[J]. Trends in Bioche-mical Sciences, 1984, 9(3): 108-112.
[26] Russell N J, Fukunaga N. A comparison of ther-mal adaptation of membrane lipids in psychrophilic and thermophilic bacteria[J]. Fems Microbiology Letters, 1990, 75(2-3): 171-182.
[27] Huguet A, Coffinet S, Roussel A, et al. Eva-luation of 3-hydroxy fatty acids as a pH and temperature proxy in soils from temperate and tropical altitudinal gradients[J]. Organic Geochemistry, 2019, 129: 1-13.
[28] Wakeham S G. Monocarboxylic, dicarboxylic and hydroxy acids released by sequential treatments of suspended particles and sediments of the Black Sea[J]. Organic Geochemistry, 1999, 30(9): 1059-1074.
[29] Wakeham S G, Pease T K, Benner R. Hydroxy fatty acids in marine dissolved organic matter as indi-cators of bacterial membrane material[J]. Organic Geo-chemistry, 2003, 34(6): 857-868.
[30] Wang C, Bendle J A, Zhang H, et al. Holocene temperature and hydrological changes reconstructed by bacterial 3-hydroxy fatty acids in a stalagmite from central China[J]. Quaternary Science Reviews, 2018, 192: 97-105.
[31] Pei H, Wang C, Wang Y, et al. Distribution of microbial lipids at an acid mine drainage site in China: Insights into microbial adaptation to extremely low pH conditions[J]. Organic Geochemistry, 2019, 134: 77-91.
[32] 楊歡. 中國土壤微生物類脂物對現代過程的響應及其古環境意義[D]. 武漢: 中國地質大學, 2010.
Yang Huan. The response of microbial lipids to the modern process and its paloenvironment implica-tions[D]. Wuhan: China University of Geoscien-ces, 2010.
[33] Li Y L, Peacock A D, White D C, et al. Spatial patterns of bacterial signature biomarkers in marine sediments of the Gulf of Mexico[J]. Chemical Geology, 2007, 238(3): 168-179.
[34] Parker J H, Smith G A, Fredrickson H L, et al. Sensitive assay, based on hydroxy fatty acids from lipopolysaccharide lipid A, for Gram-negative bacteria in sediments[J]. Applied & Environmental Microbiolo-gy, 1982, 44(5): 1170-1177.
[35] 岳麗娜. 細菌內毒素檢測中問題的研究[D]. 大連: 大連理工大學, 2005.
Yue Lina. Study on Bacterial Endotoxin Test[D]. Dalian: Dalian University of Tech-nology, 2005.
[36] Hiroshi O, KAZUO K. Grouping ofspecies on the basis of cellular fatty acid composition and the quinone system with special reference to the existence of 3-hydroxy fatty acids[J]. Journal of General & Applied Microbiology, 1983, 29(1): 17-40.
[37] Miyagawa E, Azuma R, Suto T. Cellular fatty acid composition in Gram-negative obligately anaero-bic rods[J]. The Journal of General and Applied Microbiolo-gy, 1979, 25(1): 41-51.
[38] Hedrick D B, Peacock A D, Lovley D R, et al. Polar lipid fatty acids, LPS-hydroxy fatty acids, and respiratory quinones of threestrains, and variation with electron acceptor[J]. Journal of Industrial Microbiology & Biotechnolog, 2009, 36(2): 205-209.
[39] Edlund A, Nichols P D, Roffey R, et al. Extractable and lipopolysaccharide fatty acid and hydroxy acid profiles fromspecies[J]. Journal of Lipid Research, 1985, 26(8): 982-988.
[40] Blyth A J, Farrimond P, Jones M. An optimised method for the extraction and analysis of lipid biomar-kers from stalagmites[J]. Organic Geochemistry, 2006, 37(8): 882-890.
[41] Wang C, Zhang H, Huang X, et al. Optimization of acid digestion conditions on the extraction of fatty acids from stalagmites[J]. Frontiers of Earth Science, 2012, 6(1): 109-114.
[42] Yang Y, Wang C, Zhang H, et al. Influence of extraction methods on the distribution pattern and concentration of fatty acids and hydroxy fatty acids in soil samples: Acid digestion versus saponification[J]. Geochemical Society of Janpan, 2016, 50(5): 439-443.
[43] Jones P M, Bennett M J. 3-Hydroxy-Fatty Acid Analysis by Gas Chromatography-Mass Spectrometry[J]. Methods in Molecular Biology, 2010, 603: 229- 243.
[44] Saraf A, Park J H, Milton D K, et al. Use of quadrupole GC-MS and ion trap GC-MS-MS for determining 3-hydroxy fatty acids in settled house dust: relation to endotoxin activity[J]. Journal of Environmental Monitoring, 1999, 1(2): 163-168.
[45] Larsson L, Saraf A. Use of gas chromatography ion trap tandem mass spectrometry for the detection and characterization of microorganisms in complex samples[J]. Molecular Biotechnology, 1997, 7(3): 279-287.
[46] 傅博強, 唐治玉, 王晶. 細菌內毒素脂多糖中羥基化脂肪酸的GC-MS/MS分析方法研究[C]//中國毒理學會.第12屆生物毒素研究及醫藥應用學術大會論文集, 2015年10月9日, 陜西延安, 2015: 35.
Fu Boqiang, Tang Zhiyu, Wang Jing. GC-MS/MS analysis of hydroxylated fatty acids in bacterial endotoxin lipopolysaccharide[C]//Chinese Society of Toxi-cology. The 12th Academic Conference on Biotoxin Research and Medical Applications, October 9, 2015, Yan’an, Shanxi Province, 2015: 35.
[47] Li J, Xu J, Zhang R, et al. Strategy for global profiling and identification of 2-and 3-hydroxy fatty acids in plasma by UPLC-MS/MS[J]. Analytical Chemistry, 2020, 92(7): 5143-5151.
[48] Mcelhaney R N, Gier J D, Van Deenen L L M. The effect of alterations in fatty acid composition and cholesterol content on the nonelectrolyte permeability ofB cells and derived liposomes[J]. Biochimica et Biophysica Acta (BBA)-Biomembranes, 1970, 219(1): 245-247.
[49] Denich T J, Beaudette L A, Lee H, et al. Effect of selected environmental and physico-chemical factors on bacterial cytoplasmic membranes[J]. Journal of Microbiological Methods, 2003, 52(2): 149-182.
[50] Mitchell P. Chemiosmotic coupling in oxidative and photosynthetic phosphorylation[J]. Biochimica Et Biophysica Acta, 2011, 1807(12): 1507-1538.
[51] Suutari M, Laakso S. Microbial fatty acids and thermal adaptation[J]. Critical Reviews in Microbiology, 1994, 20(4): 285-328.
[52] 石鑫, 宋金明, 李學剛, 等. 海洋古pH重建的技術方法[J]. 海洋環境科學, 2019, 38(6): 954-962.
Shi Xin, Song Jinming, Li Xuegang, et al. Methods for reconstruction of oceanic paleo-pH[J]. Marine Environmental Science, 2019, 38(6): 954-962.
[53] Lu X, Yang H, Song J, et al. Sources and distribution of isoprenoid glycerol dialkyl glycerol tetraethers (GDGTs) in sediments from the east coastal sea of China: Application of GDGT-based paleothermometry to a shallow marginal sea[J]. Organic Geochemistry, 2014, 75: 24-35.
[54] Zelles L. Fatty acid patterns of phospholipids and lipopolysaccharides in the characterisation of microbial communities in soil: a review[J]. Biology and Fertility of Soils, 1999, 29(2): 111-129.
[55] Kein?Nen M M, Korhonen L K, Martikainen P J, et al. Gas chromatographic–mass spectrometric detection of 2- and 3-hydroxy fatty acids as methyl esters from soil, sediment and biofilm[J]. Journal of Chromatography B Analytical Technologies in the Biomedical & Life Sciences, 2003, 783(2): 443-451.
[56] Lee A K Y, Chan C K, Fang M, et al. The 3-hydroxy fatty acids as biomarkers for quantification and characterization of endotoxins and Gram-negative bacteria in atmospheric aerosols in Hong Kong[J]. Atmospheric Environment, 2004, 38(37): 6307-6317.
[57] Huang X, Cui J, Yang P, et al. Identifying “free” and “bound” lipid fractions in stalagmite samples: An example from Heshang Cave, Southern China[J]. Applied Geochemistry, 2008, 23(9): 2589-2595.
[58] Tyagi P, Yamamoto S, Kawamura K. Hydroxy fatty acids in fresh snow samples from northern Japan: long-range atmospheric transport of Gram-negative bacteria by Asian winter monsoon[J]. Biogeosciences Discussions, 2015, 12(16): 13375-13397.
Bacterial 3-hydroxy fatty acids as a biomarker of environ-mental change
SUN Qi-qi1, 2, 3, SONG Jin-ming1, 2, 3, 4, YUAN Hua-mao1, 2, 3, 4, LIXue-gang1, 2, 3, 4
(1. Key laboratory of marine ecology and environmental sciences, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266237, China; 3.Center for Ocean Meta-Science, Chinese Academy of Sciences, Qingdao 266071, China; 4. University of Chinese Academy of Sciences, Beijing 100049, China)
3-hydroxy fatty acids; Gram-negative bacteria; environmental proxies; temperature; pH
The bacteria-derived 3-hydroxy fatty acid (C10–C18) has a good application prospect as a biomarker of environmental changes, but the related research is still not systematic, and its application in the marine environment has just started. 3-hydroxy fatty acid is mainly used for the reconstruction of the pH and temperature in the environment, through the significant postitive correlation between its branching ratios ( the ratios of the sum ofandto the total3-hydroxy fatty acids ) and pH to inverse the pH in the environment, through the significant negative correlations between the average annual atmospheric temperature and the ratios of theto3-hydroxy fatty acids of the C15or C17homologues (RAN15and RAN17) to inverse the temperature in the environment. 3-hydroxyl fatty acids have significant advantages over environmental proxies based on glycerol dialkyl glycerol tetraethers (GDGT) or other biomarkers. However, the environmental proxies based on 3-hydroxy fatty acids in terrestrial ecosystems are not applicable to the marine environment. A new marine temperature index (RAN13) based on 3-hydroxy fatty acids has been proposed in the latest research. However, the successful application of 3-hydroxy fatty acids as a proxy of pH in the marine environment has not been reported to the best of our knowledge. According to strain culture experiments or coupling of 3-hydroxy fatty acids and specific bacterial communities, the bacterial 3-hydroxy fatty acids presumably originated from bacteria such asand. The analysis shows that more data and evidence are needed to support 3-hydroxy fatty acids as effective proxies of global environmental change, and further research can be carried out from the aspects of marine applicability, new indicator system and microbial sources of 3-hydroxy fatty acids in the future.
Sep. 16, 2020
the Key Deployment Projects of Ocean Meta-Science Center, Chinese Academy of Sciences, No. COMS2019Q12; the Key Special Projects of Marine Science and Technology Funds of Shandong Province, No. 2018SDKJ0504-1; The Strategic Priority Research Program of the Chinese Academy of Sciences, No. XDA23050501]
孫棋棋(1989—), 女, 山東惠民人, 博士, 主要從事海洋環境化學研究, E-mail: sunshine19890707@163.com; 宋金明(1964—), 男,通信作者, 河北棗強人, 博士, 研究員, 主要從事海洋生物地球化學方面的研究, E-mail: jmsong@qdio.ac.cn; 袁華茂(1975—), 男, 通信作者, 江蘇南通人, 博士, 研究員, 主要從事海洋生物地球化學研究, E-mail: yuanhuamao@qdio.ac.cn
O623
A
1000-3096(2021)08-0098-11
10.11759/hykx20200916001
2020-09-16;
2020-10-23
中國科學院海洋大科學研究中心重點部署項目 (COMS2019Q12); 山東省重大科技創新工程專項(2018SDKJ0504-1); 中國科學院戰略先導性專項(XDA 23050501)
(本文編輯: 趙衛紅)

