藥品GMP法規邏輯的數字化探索
王濤 朱馨 曹萌
摘 要 隨著藥品新法落地,藥品相關數據真實、充分、可靠的要求更加嚴格。藥品生產全鏈條過程和記錄的合規性研究迫切需要聚焦現代化手段提升技術水平。信息化引領藥品管理現代化,特別是藥品生產數字化質量保證理念近些年受到越來越多的關注。本文從藥品生產的數字化管理角度出發,介紹了數字化質量保證技術在監督和促進生產過程合規的應用思路,分析了GMP法規的數字化實施方法,討論了在藥品質量保證領域自動化監督、預防和提醒的一些探索,并對相關研究的推進意義以及相關新技術應遵循的標準規范進行了展望。
關鍵詞 數字化質量保證 藥品生產 藥品生產質量管理規范
中圖分類號:R951 文獻標志碼:C 文章編號:1006-1533(2021)15-0061-04
Exploration on digitalization of good manufacturing practice regulation logics
WANG Tao, ZHU Xin, CAO Meng
(Shanghai Center for Drug Evaluation and Inspection, Shanghai 201203, China)
ABSTRACT With the implementation of new legislation, more stringent requirements have been put forward for drugrelated data integrity. The compliance research of the entire chain of drug production processes and records urgently needs to focus on modern means to improve the technical level. In recent years, informatization leads the modernization of drug management, especially the concept of digital quality assurance in drug production has drawn more and more attention. This paper introduced the thoughts on applications of digital quality assurance technology in supervision and promote the process compliance from drug management perspective, demonstrated digital implementation method for GMP rules, discussed some explorations of the automation, prevention and warning in the field of drug quality supervision, and also gave an insight on the significant advance of pilot projects applying related technical innovations and the possible standards that should be followed.
KEY WORDS digital quality assurance; drug manufacture; GMP
以信息化引領藥品管理現代化是近年來快速發展的方向之一,特別是用新理念引領新方向、用新技術提升新效能將在產業競爭力提升和藥品安全治理方面發揮更加積極的作用[1-2]。新《藥品管理法》強調了對藥品全生命周期管理數據可靠和藥品可追溯的相關要求。藥品生產的質量保證是藥品全生命周期管理的一個核心,是全鏈條過程中鏈接前期研發和上市后流通等環節的重要支點[3]。近年來,隨著藥品生產信息化水平的不斷提升,各種用途的計算機化系統在藥品生產企業的應用范圍不斷擴大,藥品生產數據的可靠性和過程的合規性相關領域的研究迫切需要現代化手段對技術水平提升加以聚焦[4-6]。從發展的角度出發、在發展中解決問題,將數字化質量保證(quality assurance, QA)的理念引入藥品生產的全鏈條,是進一步促進生產企業GMP體系有效保證的一個重要研究方向。
1 藥品生產的數字化管理
企業生產活動的法規符合性主要是由企業質量保證人員負責內部核查和監督,目前還是主要依賴人工手段。從現狀來看,一方面,商業化藥品生產相關信息系統的開發更多地聚焦于生產活動本身的數據采集與管理,傾向于在質量體系、實驗室、生產、物料、設施設備、包裝標簽等體系中的某一個細分子系統的精細化管理和自動化實現方面進行深入研究,例如生產電子記錄系統、生產設備管理、生產環境監測、生產過程控制管理、質量體系文件管理、培訓、偏差變更管理、實驗室數據管理、倉儲管理系統等;另一方面,系統的設計通常來自所屬細分體系的用戶需求,往往難以在子系統開發之初就直接面向法規要求而考慮質量保證抓手的全局設計思路,各個子系統之間的數據對接相對不夠便捷,QA自查自檢方面順暢程度有待提高。有效貫徹落實法規要求,從整體角度無死角、無盲點地開展質量保證工作,讓法規抓手真正通過信息技術延伸至具體生產活動,并實現生產質量保證能隨著法規的更新、改革而同步聯動,需要對藥品GMP法規邏輯的數字化開展探索。
借助新技術解決這一發展問題的有效途徑之一就是數字化QA的運用。數字化依托科學風險評估并通過將法規邏輯加以算法化實現,把GMP條款“寫”進數字化系統,將為企業QA人員提供有效的支援,充分地擴大內部自查自檢范圍,更加實時可靠地開展監督和復核工作,幫助企業在較高的質量保證水平下更充分地加深對其產品和過程理解,協調更多的人力資源以關注風險評估、問題根源分析和產品創新,從而在降低合規風險的同時從長遠發展角度提升產業競爭力。藥品生產數字化QA通過生產過程中的大數據對偏差、不良趨勢和故障等進行及時預警,結合法規邏輯算法,提高發現風險問題的能力,推動實時在線管理作為事后管理的重要補充。通過無縫電子數據集采或錄入,按照業務需要對數據進行關聯分析和深度挖掘,為品種風險回顧、質量屬性理解、工藝參數優化、管理運營改進等提供自動化輔助,方式更靈活、工作更高效。通過數字化的控制和實施過程所積累的高度格式化數據,可更便利地提煉隱含產品知識,用來指導持續改進和創新研發,實現生產全鏈條的不斷精益化改善,推進品種生命周期的良性循環。
2 探索GMP法規邏輯的數字化
法規的具體要求往往是具有很強的邏輯性的,這與計算機代碼有很多相似之處。GMP法規的數字化可以理解為GMP條款邏輯的算法化,也就是從GMP語言到軟件代碼語言的翻譯過程。比如法規對藥品生產中對于管理和操作人員資質(含學歷、培訓和衛生健康狀況)的要求,就有可能通過系統的數據控制,在授權操作前對相關資質不符合要求情況發出提醒,使質量保證人員及時了解,或者對相關資質不符合人員的系統操作動作實行攔截;可以考慮采用電子化的批記錄以減少混淆與人為差錯,精準控制生產和檢驗人員的操作步驟,避免與預先設定好的經過批準的操作規程發生偏離。
本文通過選取若干條款要求為示例,通過利用電子化的藥品生產數據探索計算機語言實施框架,分析采用數字化手段將法規條款內涵的合規要求加以自動化監督、預防和提醒。以下示例探索僅以概要論述為目的,并非面面俱到,實際應用中的算法框架應結合風險評估和企業實際情況具體問題具體分析。
2.1 舉例1:產品放行規定的數字化探討
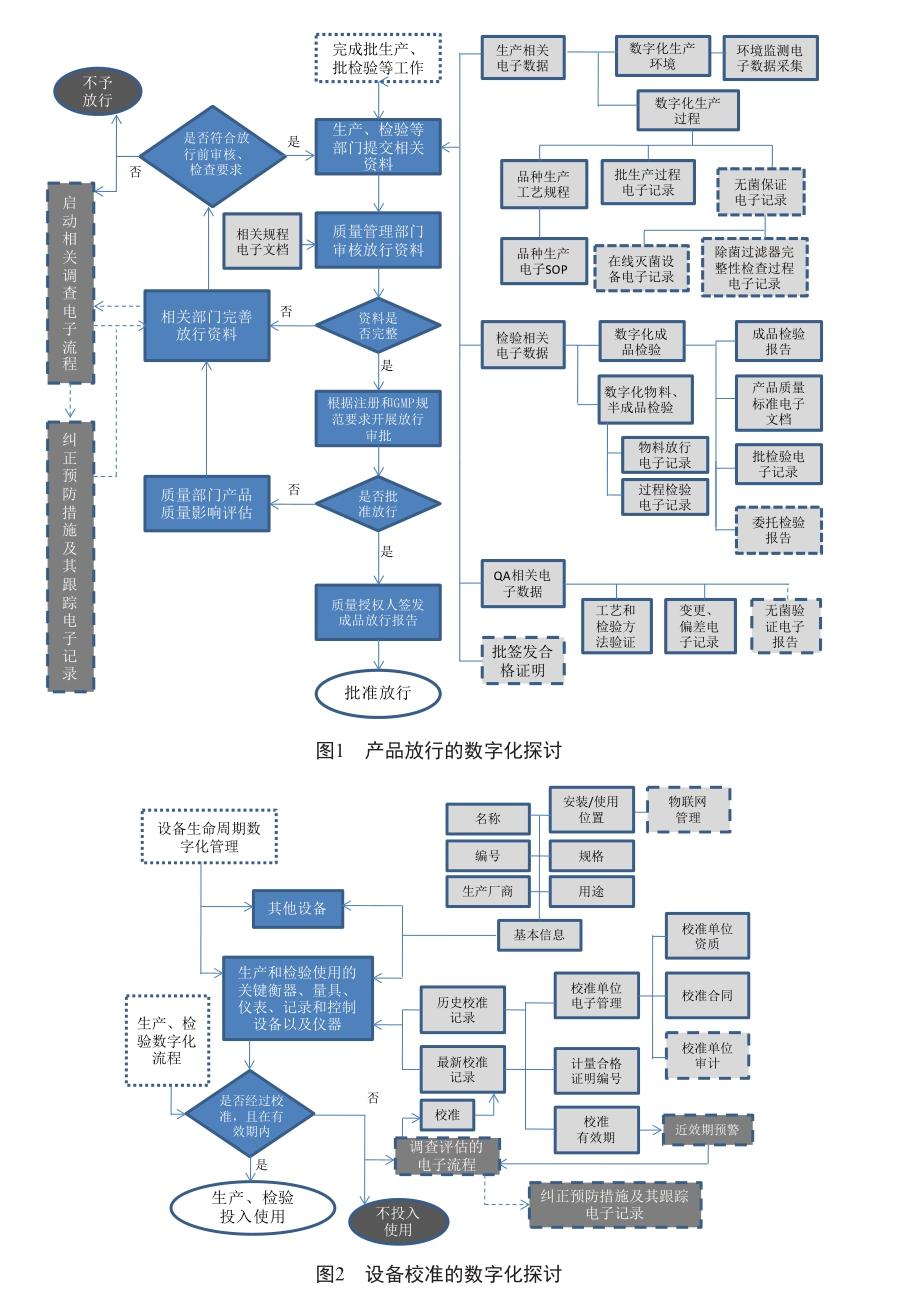
根據藥品生產質量管理規范第二百三十條的要求,數字化QA的算法邏輯設計可考慮對放行相關的電子數據加以監控和預審,對相應信息不完整或存有疑問的,及時提醒質量部門和授權人加以復核,必要時開展詳細的質量風險評估(圖1)。
此外,可考慮設置算法對生產檢驗過程產生的電子數據進行實時電子監控,出現偏差時自動抓取并推送質量保證相關模塊,督促相應的調查確認。對于過程不符合放行要求,或部分需要放行審核的內容尚未經相關負責人電子簽名確認等情況,可考慮設計邏輯限制,對違規放行的相關操作由系統加以攔截。
2.2 舉例2:設備校準規定的數字化探討
根據藥品生產質量管理規范第九十條的要求,數字化QA的算法邏輯設計可考慮對按規定需要進行校準的設備進行校準狀態的監控,并根據實際情況對即將超過校準有效期的設備進行電子標記,同時將該類預警推送至質量部門、工程部門和設備使用部門(圖2)。
對于校準已失效的設備,算法可關注其在GMP體系中使用登記前進行阻止,并提醒相關負責崗位,對是否開展基于風險的調查評估或停用淘汰等相關操作進行確認,輔助數字化質量管理體系對設備全生命周期管理。
3 展望
在藥品生命周期質量可靠保證基礎上充分地理解產品屬性和過程參數,最大限度地降低生產過程中污染和交叉污染以及混淆、差錯等風險的原則,是藥品上市許可持有人落實主體責任的重要前提。促進藥品安全治理體系共建共享、互聯互通,提高監管的預見性、靶向性、時效性,需要監管科學創新,需要法規邏輯數字化探索。運用大數據、物聯網、5G、人工智能技術等對生產企業的“非現場監管”,應用“區塊鏈”等技術加強監管對象的信用治理,是科學監管的發展方向,也對藥品生產數字化質量保證提出了更高的要求。推進這一領域研究,有利于更加精準而且自動化地事前預警、事中控制、事后分析評價,對藥品質量風險防控具有積極意義。
推進打造生產企業與監管銜接的在線平臺,通過數據、模型和工具的結合,充分應用數字化QA風險防控信息數據,可以推動全社會對藥品質量信任、信心的扎實回歸。在藥品生產數字化QA方面,上海藥品審評核查中心跨前一步推進試點,希望通過服務產業充分研究新技術手段加強我市部分高風險藥品生產企業藥品質量風險的防控能力,探索可復制、可推廣的監管科學研究成果。
作為藥品管理相關的計算機化系統,運用數字化QA發揮自查自檢作用,也需要對其相關的軟硬件進行合理的設計和全面充分的評估。如果應用于藥品生產GMP體系,則應在該套系統自身的生命周期內按照相關原則保證其驗證狀態,符合質量保證體系相關要求,其相應的調整改進也應納入變更管理,加以全過程基于科學的質量風險管控。數字化QA涉及到的代碼和算法設計、開發、測試、發布等實施過程,也應遵循相應的軟硬件行業良好工作規范。為推進相關工作的規范化,上海藥品審評核查中心和上海醫藥行業協會也在聯合相關企業積極推進藥品生產數字化質量保證相關團體標準的起草工作,以進一步促進上海市生物醫藥產業高質量健康發展。
參考文獻
[1] 趙燕君, 柴雄, 周鳳舞, 等. 信息化建設與監管業務的正向反饋模式實踐研究[J]. 中國醫藥導刊, 2019, 21(1): 37-42.
[2] 李桂桂, 張喆, 張京梅, 等. 國家藥品智慧監管平臺設計與研究[J]. 中國醫藥導刊, 2020, 22(10): 718-722.
[3] 曹萌, 王沖, 付秋雁, 等. 新時代下藥品監管模式的探討與實踐[J]. 上海醫藥, 2018, 39(3): 5-9; 13.
[4] 桑凌岳, 丁薇麗, 周立新. 區塊鏈技術在藥品智慧監管的應用與思考[J]. 中國醫藥導刊, 2020, 22(9): 659-660.
[5] 董正龍, 曹萌. 信息技術在生物制藥工業中的應用[J]. 中國醫藥工業雜志, 2019, 50(11): 1262-1267.
[6] 曹萌, 李建平. 基于品種的監管信息管理系統探索[J]. 中國新藥與臨床雜志, 2019, 38(4): 210-214.

