右美托咪定對脂多糖致急性肺損傷小鼠p38MAPK-HSP27通路與炎癥反應的影響
康 蘆,王德明
(1.湖南醫藥學院第一附屬醫院麻醉科,湖南 懷化 410021;2.南華大學附屬第二醫院麻醉科,湖南 衡陽 421001)
急性肺損傷(acute lung injury,ALI)是由各種直接、間接致傷因素導致的肺泡上皮細胞與毛細血管內皮細胞的損傷,而引起彌漫性肺間質水腫、肺泡水腫等損害肺功能的癥狀,最終可造成急性低氧性呼吸功能不全。有研究表明,ALI的發病機制復雜,主要歸因于過度的炎癥反應引起的肺組織破壞,而肺泡血管內皮細胞與肺成纖維細胞可合成p38分裂原激活蛋白激酶(p38MAPK),從而激活熱休克蛋白27(HSP27),誘導炎性因子產生,損害肺部組織,且細胞因子相互介導的級聯炎性反應能加重肺組織損傷[1-2]。右美托咪定屬于一種高選擇性腎上腺素受體激動劑,具有鎮靜、鎮痛、催眠及抑制交感神經活性等作用[3]。為探究右美托咪定治療ALI的作用機制,本研究將BABL/cJ小鼠作為試驗對象,旨在探討右美托咪定對脂多糖致ALI小鼠p38分裂原激活蛋白激酶(p38MAPK) -?熱休克蛋白27(HSP27)通路與炎癥反應的影響,現報道如下。
1 材料與方法
1.1 材料
1.1.1 實驗動物 BABL/cJ小鼠,均為雌性,體質量14~16 g,平均(15.11±0.07) g;所選動物均由南華大學提供,動物合格證號:SYXK(湘)2020-0002。本實驗方案已經湖南醫藥學院第一附屬醫院實驗動物倫理委員會批準。
1.1.2 儀器與設備 脂多糖(美國Sigma-Aldrich公司);鹽酸右美托咪定注射液(江蘇恒瑞醫藥股份有限公司,國藥準字H20090248,規格:2 mL∶200 μg);酶聯免疫試劑盒(Beyotime Biotechnology Co.,LTD,中國);BCA蛋白定量試劑盒(美國Thermo Fisher公司);辣根過氧化物酶標記的山羊抗兔抗體(北京華夏遠洋科技有限公司);ELC化學法顯色系統(美國Thermo Fisher公司);蛋白電泳儀、轉膜槽、蛋白電泳槽(美國Bio-Rad公司)等。
1.2 方法選取30只BABL/cJ小鼠為試驗對象,隨機取10只小鼠作為空白對照組;剩余20只小鼠建立脂多糖致ALI小鼠動物模型,建模前常規禁食12 h,并于腹腔內注射脂多糖5 mg/kg,連續注射3 d,若小鼠出現呼吸急促、抱團取暖、口唇發鉗或抓取時無力反抗狀態時則表明建模成功[4]。將建模成功后的小鼠隨機分為兩組,模型對照組和右美托咪定組,各10只。空白對照組與模型對照組小鼠均腹腔注射0.9%的氯化鈉溶液(0.1 mL)干預,而右美托咪定組小鼠于注射LPS前30 min腹腔注射右美托咪定0.1 mL。24 h后評估各組干預效果。
1.3 觀察指標 ①對比3組小鼠干預后24 h的炎性因子水平。3組小鼠均于干預后24 h以頸椎脫臼法處死,取尾靜脈血3 mL,以3 000 r/min的轉速離心10 min分離血清,后放置在 -20 ℃冰箱中備用,采用酶聯免疫吸附法測定3組小鼠的腫瘤壞死因子 -α(TNF-α)、白介素-6(IL-6)、白介素-1β(IL-1β)水平。②干預后24 h進行肺組織蘇木精 - 伊紅(HE)染色[5]。小鼠處死后取肺部組織,放置在濃度為4%多聚甲醛中,固定病灶組織,常規石蠟包埋,后制備4 μm切片,并完成HE染色,于光學倒置顯微鏡下觀察小鼠肺部組織變化情況,每只小鼠取切片5張,每張切片觀察5個不同的視野;③對比3組小鼠干預后24 h肺損傷指標,根據小鼠HE染色,觀察小鼠肺組織并進行肺損傷評分[6],分值為0~16分,分數越高,肺部損傷越重,并取右肺上葉組織,分別稱量其濕重與干重,其中左肺上葉清洗后稱重為濕重,然后將其置于80℃的烤箱,烘烤48 h后測量干重,計算濕重與干重的比值。④對比3組小鼠干預后24 h的p38MAPK-HSP27通路蛋白表達情況。取3組小鼠部分左肺部組織,加入細胞裂解液后勻漿30 min,離心15 min后,提取肺部蛋白,利用蛋白質印跡法(Western blotting)[7]檢測p38MAPK、HSP27蛋白表達情況,采用BCA蛋白定量試劑盒測定蛋白濃度,取蛋白上樣品50 μg,加入樣緩沖液,進行十二烷基硫酸鈉聚丙烯酰胺凝膠(SDS-PAGE)電泳,取200 mA凝膠穩流轉移至聚偏二氟乙烯膜上后,采用含5%脫脂奶粉的TBST緩沖液完成2 h封閉,洗膜后加入辣根過氧化物酶標記的山羊抗兔抗體,室溫孵育1 h。TBST洗膜后,加入ECL發光液,采用凝膠成像系統報告。
1.4 統計學方法 采用SPSS 24.0統計軟件處理數據,計量資料使用(±s?)表示,采用t檢驗;多組間計量資料比較采用單因素方差分析。以P<0.05為差異有統計學意義。
2 結果
2.1 炎性因子 右美托咪定組和模型對照組小鼠血清TNF-α、IL-6、IL-1β水平均高于空白對照組,但右美托咪定組低于模型對照組,差異均有統計學意義(均P < 0.05),見表1。
表1 3組小鼠炎性因子比較( ?±s?, pg/mL)
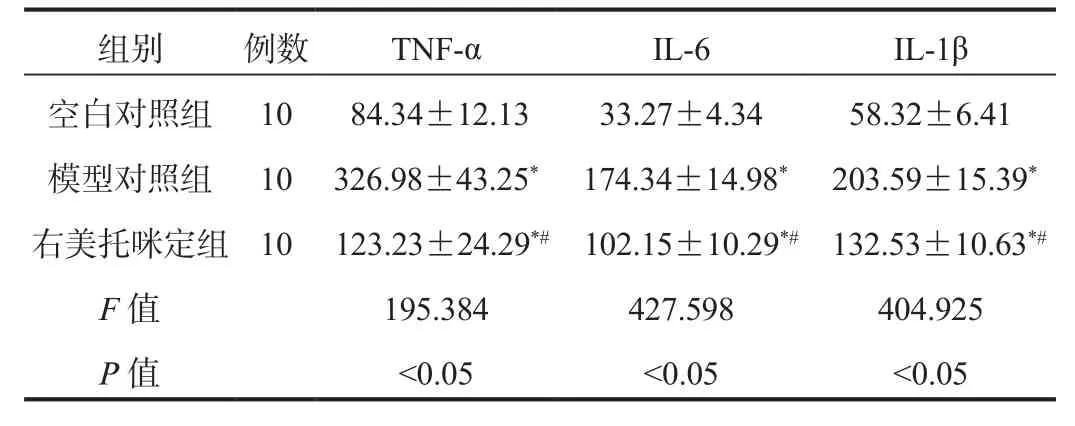
表1 3組小鼠炎性因子比較( ?±s?, pg/mL)
注:與空白對照組比,*P<0.05;與模型對照組比,#P<0.05。TNF-α:腫瘤壞死因子 -α;IL-6:白介素 -6;IL-1β:白介素 -1β。
組別 例數 TNF-α IL-6 IL-1β空白對照組 10 84.34±12.13 33.27±4.34 58.32±6.41模型對照組 10 326.98±43.25* 174.34±14.98* 203.59±15.39*右美托咪定組 10 123.23±24.29*# 102.15±10.29*# 132.53±10.63*#F值 195.384 427.598 404.925 P值 <0.05 <0.05 <0.05
2.2 HE染色 HE染色結果顯示,空白對照組肺組織變化不明顯,且結構完整,肺泡腔清晰,未見炎癥細胞浸潤;模型對照組肺泡結構破壞嚴重,大量炎癥細胞浸潤;右美托咪定組顯示肺泡結構破壞與出血程度較輕,見圖1。
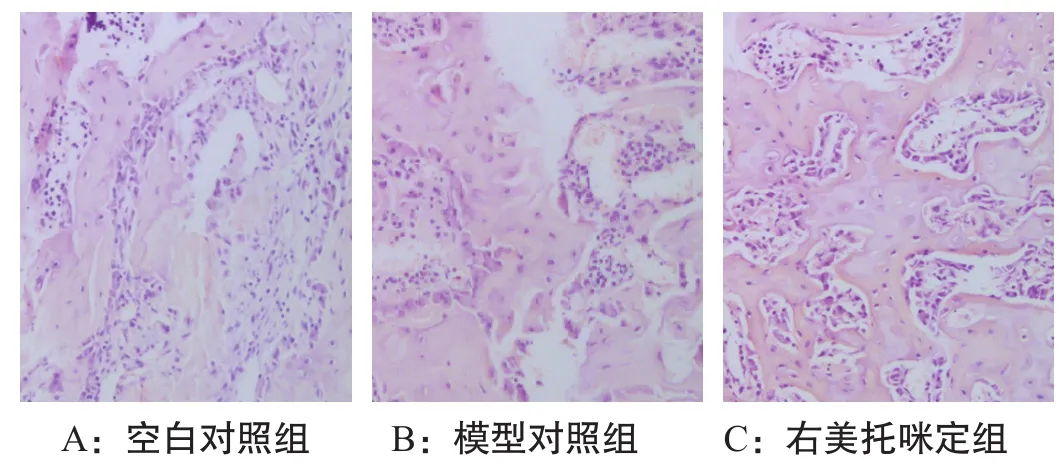
圖1 HE染色結果(×100)
2.3 肺損傷指標 右美托咪定組和模型對照組小鼠肺損傷評分、W/D水平均高于空白對照組,但右美托咪定組低于模型對照組,差異均有統計學意義(均P < 0.05),見表2。
表2 3組小鼠肺損傷指標比較(?±s?)
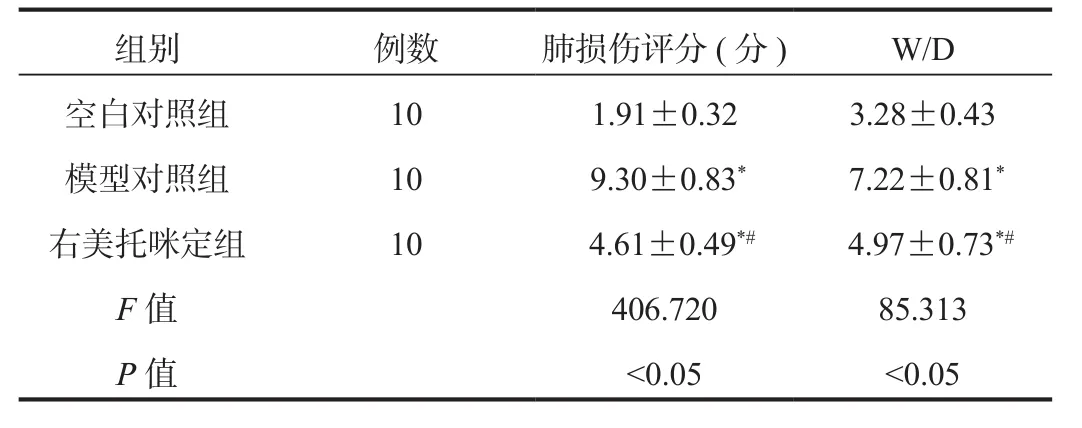
表2 3組小鼠肺損傷指標比較(?±s?)
注:與空白對照組比,*P <0.05;與模型對照組比,#P < 0.05。W/D:濕重與干重比。
組別 例數 肺損傷評分(分) W/D空白對照組 10 1.91±0.32 3.28±0.43模型對照組 10 9.30±0.83* 7.22±0.81*右美托咪定組 10 4.61±0.49*# 4.97±0.73*#F值 406.720 85.313 P值 <0.05 <0.05
2.4 p38MAPK-HSP27通路蛋白表達情況 Western blotting法結果顯示,模型對照組與右美托咪定組小鼠肺組織中p38MAPK、HSP27蛋白含量均高于空白對照組,但右美托咪定組低于模型對照組,見圖2。
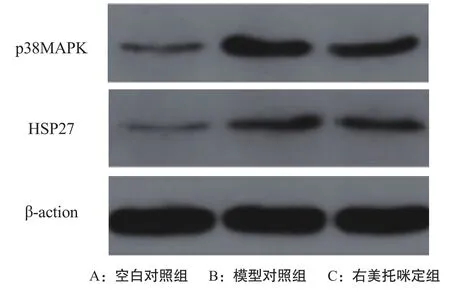
圖2 p38MAPK-HSP27通路蛋白表達情況
3 討論
ALI是臨床常見的急危重癥,與中性粒細胞的廣泛浸潤、炎癥細胞的過度激活、促炎介質的過量產生有關,患者主要特征有急性肺心源性肺水腫、頑固性低氧血癥等,其臨床致死率較高,因此,尋求規范化、創新性藥物是進一步改善ALI患者預后的重點。
右美托咪定是一種有效的α2腎上腺素受體激動劑,其具有高親和力、半衰期較短的特點,具有一定的選擇性,可發揮抗焦慮、鎮靜、鎮痛及神經保護等作用,進而穩定血流動力學,緩解氣管插管及手術應激反應,是臨床重病監護治療的常用藥物[8]。血清TNF-α、IL-6、IL-1β是臨床常見的炎性因子,其可通過HSP27通路活化而被誘導產生,從而介導ALI的發生。本研究通過對右美托咪定組小鼠進行右美托咪定干預,并對3組小鼠肺部進行HE染色,結果顯示,右美托咪定組小鼠肺損傷評分、W/D及血清TNF-α、IL-6、IL-1β水平均低于模型對照組,但高于空白對照組;HE染色顯示,空白對照組小鼠肺組織變化不明顯,并具有完整結構,肺泡腔清晰,未見炎癥細胞浸潤變化;模型對照組小鼠肺泡結構破壞嚴重,大量炎癥細胞浸潤;右美托咪定組小鼠肺泡結構破壞與出血程度較輕,提示將右美托咪定用于脂多糖致ALI小鼠中可減輕小鼠機體的炎癥反應,從而減輕肺泡結構的損害,保護肺功能。
研究表明,p-p38MAPK含量可隨ALI炎癥反應程度加重而逐漸增加;而MAPK是細胞內重要的信號系統,能調控細胞增生、分化、凋亡及基因表達,當p38MAPK磷酸化后,可調節下游的HSP27表達,進而加重ALI[9]。本研究通過Western blotting檢測顯示,模型對照組與右美托咪定組小鼠肺組織中p38MAPK、HSP27蛋白含量均高于空白對照組,但右美托咪定組低于模型對照組,提示右美托咪定能抑制脂多糖致ALI小鼠肺組織p38MAPK-HSP27通路蛋白表達,繼而抑制機體炎性反應,達到治療ALI的目的,可為ALI患者的臨床治療提供新的思路。
綜上,右美托咪定用于脂多糖致ALI小鼠中可減輕小鼠機體的炎癥反應,抑制p38MAPK-HSP27通路活化,保護肺功能,為ALI的臨床治療提供新思路,值得臨床進一步研究。

