基于標準加入法的改進計算公式測定蘋果中毒死蜱、戊唑醇殘留量
武 源,覃慧麗
(柳州市質量檢驗檢測研究中心,廣西柳州 545006)
毒死蜱、戊唑醇常用于蘋果病蟲害的防治,屬于蘋果病蟲害化學防治中的高頻農藥[1]。戊唑醇主要用于枝干輪紋病、干腐病、斑點落葉病、褐斑病等病害的防治[2],毒死蜱常用于桃小食心蟲、蘋果綿蚜等蟲害的防治。農藥在保障作物生長、提高作物產量的同時,也會對環境和人體產生一定副作用,例如戊唑醇屬于難降解農藥,在土壤、水體中的降解半衰期大于180 d[3],容易引發農藥再殘留問題。中高毒農藥毒死蜱在蘋果上的檢出率高,在殘留風險等級中屬于高風險農藥[4]。合理有效的檢測手段有助于農藥殘留日常監督管理,從而提升食品安全生產質量,降低存在的殘留和安全風險。
質譜法可提供化合物的分子質量和結構信息,由于質譜屬于通用型檢測器,在多農殘快速篩查領域的應用越來越廣泛[5-7]。食品中農藥殘留GC分析領域常見基質效應,是指待測組分受基質共流物的影響而導致響應增強或抑制的現象[8-12]。基質標準溶液替代溶劑標準溶液可以很好地解決基質效應帶來的定量不準確的影響[13-15],但不是所有的樣品都能找到不含待測物的空白基質[16],尤其面對能力驗證實驗樣品或者待測物為內源性物質等復雜多樣的樣品[17-19]。
標準加入法是在待測樣品中加入不同濃度的標準物質,保證了樣品溶液和基質標準溶液在基質效應上的一致性,消除了基質共流物對分析物的影響,是目前解決基質效應最為可靠有效的定量方法[20-22]。查閱大量文獻發現,標準加入法定量通常將標準工作曲線反向延長至與橫坐標延長線相交,交點與原點之間的距離即為待測物的質量濃度[23-26]。基于標準加入法測定樣品溶液濃度,傳統計算公式視待測組分的響應值為曲線截距,且忽略了曲線截距與待測組分的響應值之間的距離對定量結果帶來的偏差影響,所得濃度是不夠準確的。筆者基于標準加入法,對比了傳統計算公式和改進計算公式所得樣品含量結果的差異,以“z-比分數”評價測得結果的滿意度,為樣品的準確定量提供新的解決方案。
1 材料與方法
1.1 材料與試劑
提取包5982-5650CH:4 g MgSO4,1 g NaCl,1 g檸檬酸鈉,0.5 g三水合二檸檬酸二鈉及1顆陶瓷均質子;凈化試劑管5982-5256:885 mg MgSO4,150 mg PSA,15 mg GCB,美國安捷倫公司。
乙腈(色譜純),德國Merck公司;丙酮(色譜純),上海安譜實驗科技股份有限公司;乙酸乙酯(色譜純),上海安譜實驗科技股份有限公司;毒死蜱(純度99.89%)、戊唑醇(純度99.30%)、環氧七氯B(純度98.70%),德國Dr.Ehrenstorfer公司。
1.2 儀器與設備
7890B-7000D氣質聯用儀、VF-1701MS色譜柱(30 m×0.25 mm×0.25μm),美國安捷倫公司;XP26微量電子天平,瑞士Mettler Toledo公司;IKA VORTEX 4 basic渦旋振蕩器,德國IKA公司;IKA VXR basic圓周振蕩器,德國IKA公司;TTL-DCⅡ型氮吹儀,北京同泰聯科技發展有限公司;SIGMA 3-30K離心機,德國SIGMA公司。
1.3 方法
1.3.1 標準溶液的配制
待測物儲備液:精密稱取毒死蜱、戊唑醇標準品于10 mL容量瓶中,丙酮溶解并定容至刻線。
內標儲備液:精密稱取環氧七氯B標準品于10 mL容量瓶中,乙酸乙酯溶解并定容至刻線。
混合標準溶液(10μg/mL):精密吸取適量的毒死蜱、戊唑醇標準儲備液于20 mL容量瓶中,用乙酸乙酯定容,配制成混合標準溶液。
內標工作液(5μg/mL):精密吸取一定量的內標儲備液,用乙酸乙酯配制成內標工作液。
系列混合標準工作液:根據實驗需求,精密吸取不同體積混合標準溶液,用乙酸乙酯稀釋定容,配制成所需混合標準工作液。
標準加入法標準曲線:準確稱取若干份10 g不含待測物的空白樣品于50 mL離心管,根據1.3.2樣品前處理步驟制備好回收樣品溶液(0.02、0.05、0.1 mg/kg 3個添加水平)氮吹近干,加20μL內標工作液并加入1 mL從0開始遞增的一系列混合標準工作液復溶。以復溶加入標準工作液的質量濃度為橫坐標,待測組分定量離子與內標定量離子響應值之比為縱坐標繪制標準曲線。
1.3.2 樣品前處理
準確稱取10 g待測樣品于50 mL塑料離心管中,加10 mL乙腈并加入提取包5982-5650CH,蓋上離心管蓋,振蕩器劇烈振蕩1 min后于4 200 rpm離心5 min,吸取8 mL上清液至凈化試劑管5982-5256中,立即搖散,渦旋混勻1 min,4 200 rpm離心5 min,準確吸取1 mL上清液于10 mL試管中,40℃水浴中氮吹至近干,加入20μL的內標工作液,加入1 mL乙酸乙酯復溶,0.22μm濾膜過濾后上機測定。
1.3.3 GC-MS/MS條件
1.3.3.1 色譜條件
1.3.3.2 質譜條件
電子轟擊源:70 eV;離子源溫度:280℃;傳輸線溫度:280℃;溶劑延遲:3 min;多反應監測MRM模式。化合物采集離子對信息見表1。
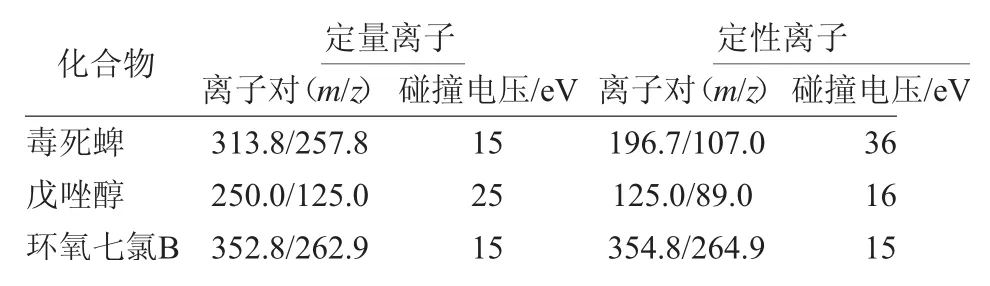
表1 化合物定量離子對、定性離子對和碰撞能量
2 結果與分析
2.1 質譜條件的優化
化合物質譜分析的子離子選自其在質譜離子源轟擊中形成的碎片離子,不同子離子抗干擾能力也有差異。優化電壓,選擇抗干擾能力強、豐度值高的離子對有助于提高定量的準確性和靈敏度,提高化合物在儀器上的響應。取1μg/mL溶劑標液進樣,優化化合物離子對參數。
毒死蜱常見的離子對有313.8/285.5、313.8/257.8、196.7/107.0、313.8/193.8,其中313.8/285.5和313.8/193.8離子對響應弱,信噪比遠遠低于其他2對離子對的信噪比。通過優化電壓得到最強豐度響應,313.8/257.8最適電壓為15 V,196.7/107.0最適電壓為36 V,選擇響應最高的313.8/257.8為定量離子對。
戊 唑 醇 離 子 對 有252.0/127.0、250.0/125.0、125.0/99.0、125.0/89.0。4對離子對中,252.0/127.0和125.0/99.0響應較弱,不利于定量分析,故選擇250.0/125.0、125.0/89.0為確定離子對。進一步優化得到250.0/125.0、125.0/89.0的最佳電壓分別是25 V和16 V,選取豐度值最高的250.0/125.0為定量離子對。
同理優化得到環氧七氯B定量離子對為352.8/262.9,電壓為15 V,定性離子對為354.8/264.9,電壓為15 V。
2.2 線性關系和基質效應
準確稱取空白樣品若干份,根據1.3.2樣品前處理步驟制備得空白基質溶液。精密吸取1 mL凈化后的空白基質溶液于40℃水浴氮吹近干,加入20μL的內標工作液,并準確加入1 mL系列濃度的混合標準溶液復溶,以待測組分與內標響應值之比(y)對復溶加入標準溶液的質量濃度(x)做基質標準曲線。毒死蜱在21.86~874.4 ng/mL線性范圍內線性良好,線性方程y=0.021 7x-0.259 1,相關系數為0.999 0;戊唑醇在24.16~966.4 ng/mL線性范圍內線性良好,線性方程y=0.041 8x-0.236 2,相關系數為0.999 2。
以基質標準曲線與溶劑標準曲線斜率的比值考察基質效應(ME)[27]。由于儀器浮動的影響,當斜率比值為0.9~1.1,基質效應忽略不計;當斜率比值>1.1,為基質增強效應;當斜率比值<0.9,為基質抑制效應[28]。本實驗結果顯示,毒死蜱ME值為7.4,戊唑醇ME值為25.9,毒死蜱和戊唑醇均為基質誘導增強效應,且戊唑醇基質增強效應大于毒死蜱。蘋果基質共流物對毒死蜱和戊唑醇的誘導影響較大,基質標準溶液可消除內源性和外源性共流物對分析物的影響,定量更準確。對于無法得到空白基質的樣品,標準加入法結合本實驗改進計算公式可準確獲得陽性樣品溶液濃度。
2.3 回收率、精密度和定量限
準確稱取若干份10 g空白蘋果樣品,分別加入不同濃度的混合標準溶液(0.02、0.05、0.1 mg/kg 3個添加水平),靜置30 min后,按照1.3.2樣品前處理步驟制備樣品溶液,不同添加水平樣品制備6份平行樣以考察方法可行性及穩定性。結果表明,3個添加水平下蘋果中毒死蜱回收率在99.3%~106.0%,精密度在3.6%~4.9%;蘋果中戊唑醇回收率在96.3%~103.8%,精密度在3.3%~4.2%,回收率和精密度均符合實驗室質量控制的要求[29](表2)。
水利樞紐工程安全監測系統在設計開發中,不僅涉及多個學科,還會涉及多個專業,因而在設計過程中能夠集中多個領域的優勢。從專業知識的角度來說,水利樞紐工程安全監測系統設計主要設計的專業有傳統的水利專業、現代的微電子專業、通信專業以及自動控制專業等。水利樞紐工程安全監測系統開發是一項整體的工程,且建成后會發揮重要的作用。
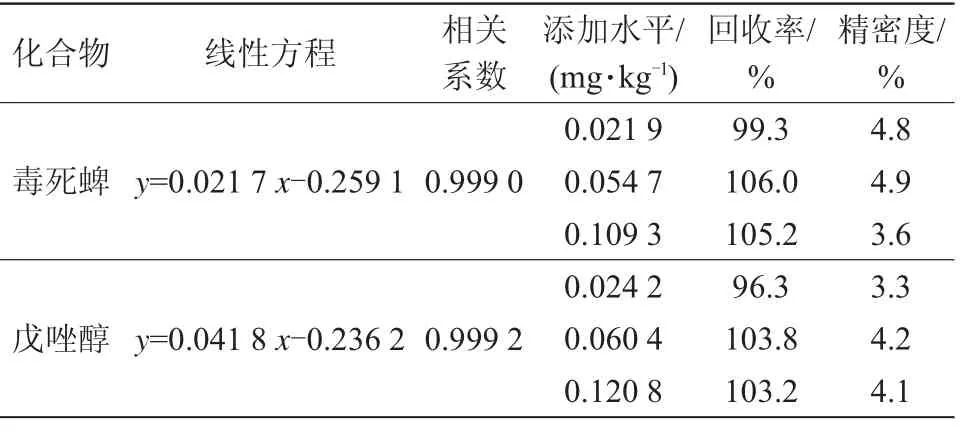
表2 毒死蜱、戊唑醇線性方程及添加回收結果(n=6)
以10倍信噪比對應的添加水平確定方法定量限。根據前處理稀釋倍數及樣品稱樣量,得到蘋果中毒死蜱和戊唑醇方法定量限分別為0.003 mg/kg、0.001 mg/kg,滿足日常檢測的需要[30]。
2.4 標準加入法改進計算公式推導
對陽性待測樣品采用標準加入法進行定量時,以加入樣品中標準溶液的質量濃度為橫坐標(x軸),待測組分響應值為縱坐標(y軸)繪制陽性樣品的基質標準曲線(圖1a)。常規的標準加入法計算方式[23-26]是將標準曲線反向延長至與x軸相交,交點與原點間的距離對應的質量濃度即為待測組分的質量濃度(y′=0時所對應的x值),詳見常規式(1)。
式中:C為從基質標準曲線得到的待測組分溶液濃度,單位與橫坐標一致;b′為標準加入法基質標準曲線的截距;k′為標準加入法基質標準曲線的斜率。
假設存在與測定樣品匹配的空白基質,則以此空白基質溶液同法可配制得陰性樣品的基質標準曲線(圖1b)。比較2條標準曲線可知,同類樣品基質效應相同,陰性基質標準曲線與陽性基質標準曲線各點的加標質量濃度相同,各點響應值差別只有陽性樣品本底值A′。由于同一陽性樣品溶液中質量濃度水平恒定,則本底濃度在相同儀器條件下的響應值A′保持恒定,因此理論上2條標準曲線是斜率相等,截距不同的平行線段,截距差值即為陽性樣品的響應值帶來的本底增量A′。故2條標準曲線關系有k′=k0,b0=b′-A′。
色譜分析中,空白基質應未檢出目標物質,即陰性基質標準曲線0點的響應值A0=0。在陽性樣品溶液中加入從0開始遞增的一系列混合標準溶液,陽性基質標準曲線0點的測得響應值為A測=A′+A0=A′+0=A′。采用基質標準曲線法定量,將待測物質在儀器上的響應A測帶入陰性基質標準曲線y=k0x+b0即可得出待測組分溶液濃度[31-32]。根據上述推導關系得改進的式(2)。未知量k0、b0均轉化至已知k′、b′、A測,陽性樣品含量可解。
式中:A測為標準加入法陽性基質標曲0點的測得響應值(內標法則為待測組分與內標響應值之比)。
根據“最小二乘法”原則確定回歸方程,A測為標準加入法陽性基質標曲0點的測得響應值,與直線方程存在一定的偏離度[33-34],A測往往與b′并不重合,即|b′-A測|≠0。傳統計算公式以b′/k′計算樣品濃度,直接用截距b′代表陽性樣品響應值A測,從而忽略了b′與A測之間差值對定量結果帶來的誤差,導致所得濃度不夠準確。改進計算公式克服了上述不足,更好地詮釋了濃度與響應值之間的定量關系,由此得到更準確的待測組分溶液濃度。
2.5 標準加入法的2種計算公式對結果的影響
按照1.3.2樣品前處理步驟,以回收樣品溶液為測定溶液,氮吹近干后加入20μL的內標工作液,加入1 mL從0開始遞增的一系列混合標準溶液,以復溶加入標準溶液的質量濃度為橫坐標,待測組分定量離子與內標定量離子響應值之比為縱坐標繪制標準曲線。用“z-比分數”評價標準加入法的2種計算公式定量結果的準確性,詳見式(3)。
式中:x為樣品測定值;X為指定值(本實驗為添加水平),σ為標準差。當|z|≤2時,測得結果滿意;當2<|z|<3時,測得結果有問題(可疑);當|z|≥3時,測得結果不滿意(離群)。
從表3看出,2種計算公式得到的毒死蜱、戊唑醇樣品含量結果的z值均小于2,測試結果均滿意;2種組分根據改進計算公式得到的z值均小于傳統計算公式得到的z值,改進算法優于傳統算法。2種計算公式得到的z值在低濃度添加水平下(0.02 mg/kg)差異不顯著,但在中高濃度添加水平下(0.05、0.1 mg/kg)z值差異顯著。改進的計算公式得到的z值遠遠小于傳統計算公式計算的z值,與真值更接近。基于標準加入法采用改進公式計算樣品含量,得到的樣品結果準確性更高,可靠性更強,為樣品準確定量提供了新的解決方案。
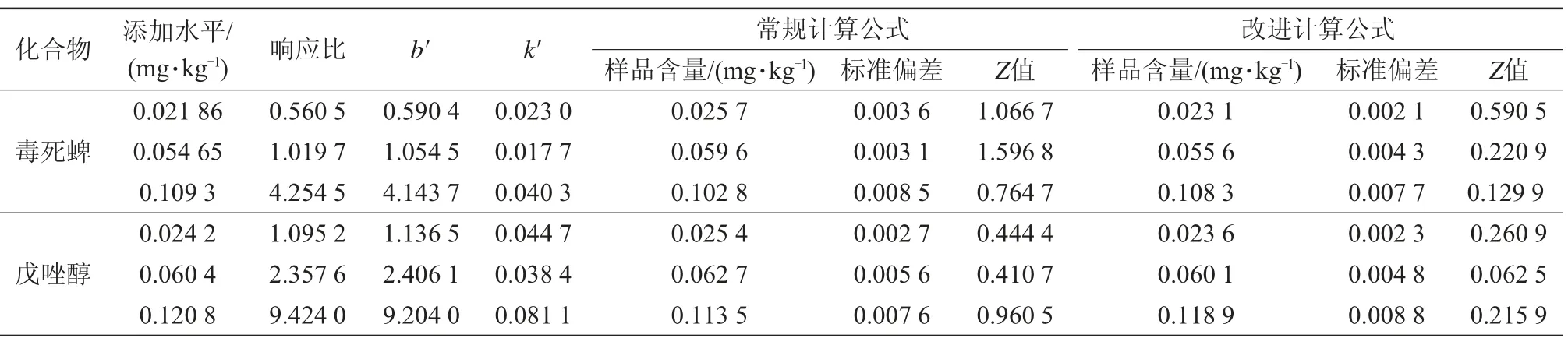
表3 標準加入法不同計算方式對定量結果的影響(n=6)
3 結 論
本試驗前處理在食品安全國家標準GB 23200.113的基礎上,基于標準加入法建立了蘋果中毒死蜱、戊唑醇殘留量的分析。在標準加入法定量方式上,采用2種計算公式計算樣品含量。結果顯示,常規和改進計算公式均能滿足常規定量使用,但改進計算公式得到的樣品含量準確性和可靠性更高,適用于果蔬基質中農殘的準確定量。當前處理方法回收率滿足測定要求,操作穩定性好。樣品中待測物質溶液濃度在儀器上有較好的響應時,基于標準加入法結合改進計算公式,也可用于能力驗證樣品、特殊基質樣品和內源性物質樣品的準確定量。

