無機化學教學中基礎知識與前沿研究的協同作用
蔡蘋,胡鍇,羅威,程功臻
武漢大學化學與分子科學學院,武漢 430072
無機化學是一門既“傳統”又“時尚”的專業基礎課,它不僅包含經典的基本化學原理和常見元素及其化合物的性質,而且要討論科學研究的前沿、熱點問題,可見其課程內容之豐富多樣。然而,在有限的學時內,如何讓學生既扎實地掌握基礎知識,又能了解無機化學的最新研究進展,并將這些基礎知識用于解釋新的研究成果或者提出新的疑問,則對“教”和“學”提出了更高的要求。我們既有“不積跬步,無以至千里;不積小流,無以成江海”的名言,也有“問渠那得清如許,為有源頭活水來”的名句,可見夯實基礎和緊跟前沿研究是缺一不可的,事實上,二者也是相輔相成的,我們應當在講授基礎知識時水到渠成地將前沿問題引入教學中。
然而,如何協調好基礎知識講解和前沿研究引入的時間分配,是個實際問題,因為學時數是不變的。以武漢大學化學專業的無機化學課程為例,課程共96學時,分上、下兩學期完成,上學期主要講授基本原理,下學期主要講授元素化學,學時非常有限。以前我們也曾嘗試過讓學生利用課外時間自主閱讀文獻并進行文獻討論,但是在實行過程中,對于大一的新生,收效并不明顯,他們大多數的討論并不深入,找不到基礎理論和文獻報道實例的契合點。因此,在后來的教學中,我們提出將基礎知識的教學與前沿文獻的引入協同進行,即,在講解基礎知識時,不僅引用經典的實例,還將最新的文獻報道作為例子來分析講解,將基礎知識講解和文獻閱讀融為一體,這樣的好處是減少了學生的盲目閱讀、提高了學生的學習興趣、豐富了教學內容、提高了教學效果,而且也不用擔心學時的分配問題。然而,這需要教師在備課過程中下足功夫,仔細挑選文獻,并進行合適的教學安排,比如,改編成題目,幫助學生加深對基礎知識的理解;作為熱點介紹,幫助學生認識到所學知識的重要用途,等等。
1 引入前沿研究,深化基礎知識
化學是一門以實驗為基礎的學科,比如原子軌道能級圖和原子核外電子的排布都是依據大量的光譜實驗和量子力學計算所得到的結果,且是針對基態原子而言,那么激發態呢?大部分教材都沒有專門把激發態的情況拿出來討論。再如,利用配體的配合穩定作用,零價態元素在過渡金屬化合物中較為常見,如Ni(CO)4、Pd(PPh3)4等。然而,含零價態主族元素的化合物極為少見。在這種時候,我們就可以查找相關文獻,拋磚引玉引導學生去進一步學習。比如s區元素除了金屬單質以外(零價氧化態),僅存在相應的正價或負價態。然而,2016年,德國Julius-Maximilians-Universit?t Würzburg的Holger Braunschweig教授成功分離表征了首例卡賓穩定的s區同素異形體Be(0) (圖1)[1]。教師在備課時可以收集整合文獻報道中的相關信息,如C―Be―C三個原子位于一條直線上,Be(0)的電子組態與其基態的電子組態不一樣,并且卡賓配體與Be之間除了存在σ-配鍵外,還存在著π鍵,提出以下問題幫助學生思考:
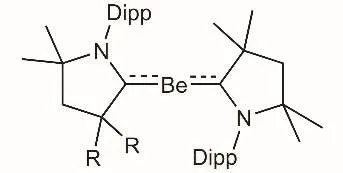
圖1 單雜卡賓穩定的Be(0)化合物分子結構示意圖
(1) 此化合物中Be(0)的電子組態為________,采用的原子軌道雜化方式是________ 。參考答案:1s22s02p2,sp雜化。
(2) 卡賓配體與Be之間存在的是________中心________電子π鍵,該π電子來自于________原子。參考答案:3,2,Be,具體分析參見圖2。
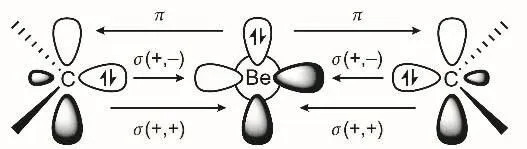
圖2 Be(0)化合物的成鍵模式圖
(3) 若往化合物中加入質子強酸,對該化合物會有何影響?參考答案:加入當量的質子強酸會導致化合物的分解。
通過將這一篇文獻的引入講解,強調我們通常寫出來的原子的電子組態及軌道能量的排布都是指原子在基態下的,激發態時,則需要具體情況具體對待。可見在基礎教學過程中引入前沿研究,可以幫助學生深化基礎知識。
2 深化基礎知識,構建知識體系
當學生將基礎知識掌握牢固,并能融會貫通時,其創新能力自然會得到提升。因而在授課過程中,教師除了深入淺出地講解知識點之外,還需要舉例告訴學生這些知識如何應用,雖然教材上也有,但教材的更新速度遠不如文獻更新得快。
比如,在學習氫元素時,我們的重點都放在氫(H)的正離子形式H+,而氫負離子H-,因其極不穩定,所以強調得不多。
由于H-只含有一個質子,對核外兩個電子的控制力較弱,導致其可壓縮性和變形性都很高,且是一個強的二電子σ給體。其與除Be以外的堿金屬和堿土金屬形成的都是離子型化合物,比如LiH、NaH和CaH2等,它們遇水發生劇烈反應,產生H2,能與鹵化物發生復分解反應,也能和Lewis酸發生加合反應。在與過渡金屬(離子)反應時,H-充當二電子的σ給體,與中心體形成配合物。事實上,包含H-的過渡金屬氧氫化物(transition-metal oxyhydrides)已有諸多報道,這些含H-的化合物不僅在儲氫材料中表現出極大的潛力,而且由于其離子擴散能力高,在電池材料方面的研究也引人矚目。讓人驚喜的是,新的研究還表明H-是非常好的π軌道的阻斷劑,可用于新型材料的研究中心以降低材料的維度。
2018年,日本京都大學的Hiroshi Kageyama教授聯合英國牛津大學的John E. McGrady教授和Michael A. Hayward教授等研究人員在高壓下對H-的性質進行了深入細致的研究[2]。他們利用H-與O2-離子半徑相近的特點,用立方型SrVO3與CaH2反應產生四方型SrVO2H (圖3a,3b),這個含H-的氧氫化物具有層狀結構,VIIIO4平面層和SrH層相互間隔。這是因為用一個H-取代SrVO3(圖3a,3c)中一個O2-離子(價軌道為p軌道)成為SrVO2H時,層與層間的金屬V (價軌道為d軌道)的π–π重疊就被有效阻斷(對比圖3c和3d),從而顯著地改變了SrVO2H的軌道重疊方式。即便V―H鍵的可壓縮性是V―O鍵的兩倍,高壓下也確實能實現SrVO2H從絕緣體到金屬的相變,但是由于位于VIIIO4層間的H-沒有π對稱價軌道,導致上下層中釩的π對稱d軌道無法相互作用,所以材料仍然是二維結構,其能帶沿著ab平面而不是沿著c軸有更大的分散是SrVO2H轉變到金屬相的驅動力。可見正是由于氫負離子π阻斷劑的作用,當SrVO3轉變成SrVO2H時,三維Vdπ–O2pπ–Vdπ網狀結構減小到二維層狀結構。
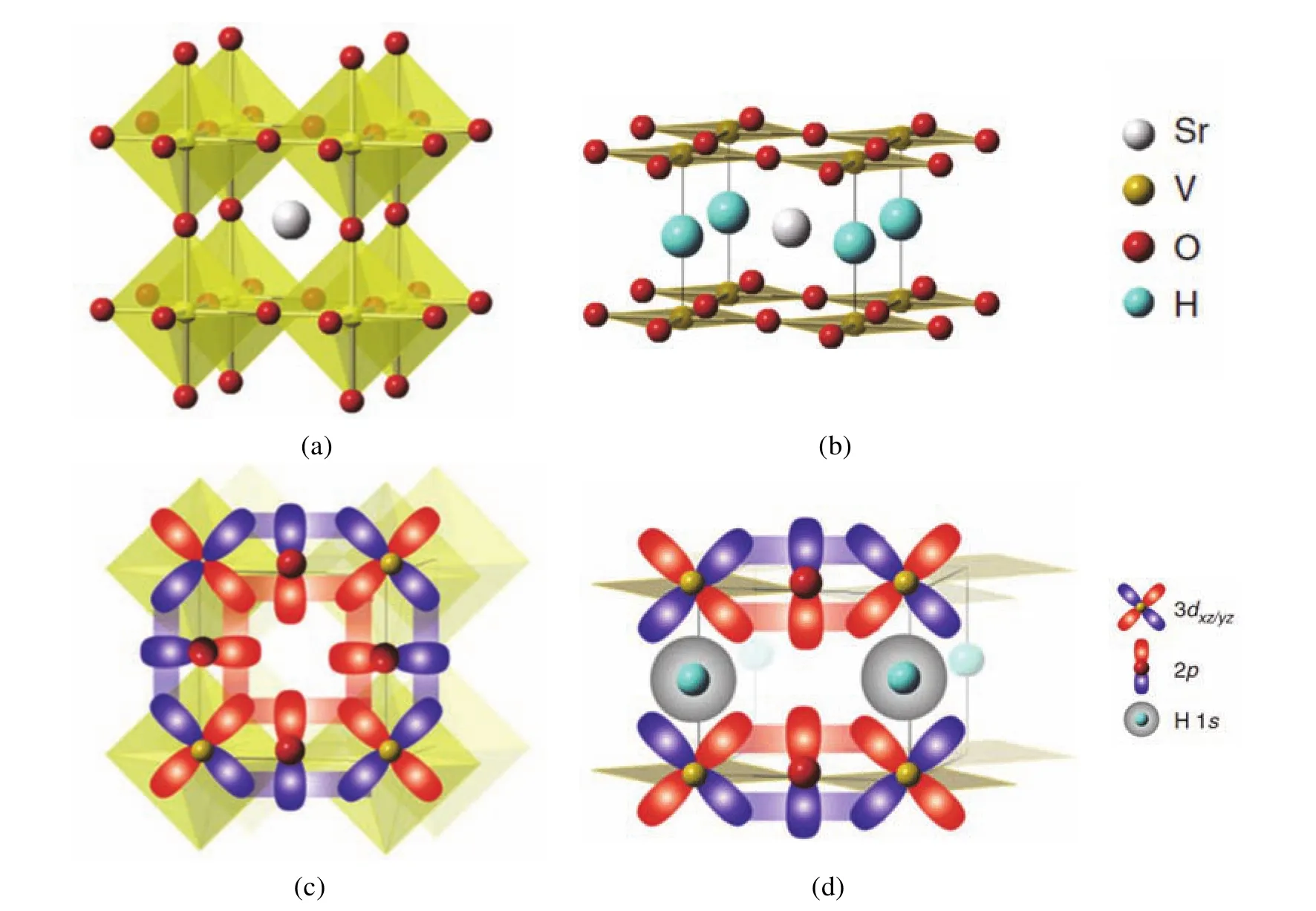
圖3 (a) SrVO3的晶體結構圖;(b) SrVO2H的結構示意圖;(c) SrVO3層間和層內軌道重疊示意圖;(d) SrVO2H層間和層內軌道重疊示意圖
這篇文獻的亮點是氫負離子作為π阻斷劑,但核心基礎知識是氫負離子沒有π對稱價軌道,于科學研究來講是典型的利用“經典知識”進行創新。當我們把這些文獻中的具體知識引入實際教學過程中時,則可以幫助學生構建起完整的知識體系。
下面,我們以氫元素的教學為例來說明在教學中如何讓基礎知識與前沿研究協同作用。設計思想:結構決定性質,理論聯系實踐,基礎知識與前沿研究相結合,依據教學需要引入文獻。
從氫元素的核外電子組態1s1,講授到其可能的成鍵類型,即共價鍵和離子鍵,其中離子鍵又可通過H+和H-離子來成鍵。講授H+離子成鍵時,聯系到離子極化學說的內容,H+由于極化能力非常強,導致NaHCO3的熱穩定性比Na2CO3差,同時聯系到侯氏制堿法的原理。
講授H-單元成鍵時,除了講授其與堿金屬和堿土金屬形成的離子化合物,還要補充講解H-單元與過渡金屬形成配位鍵的文獻,其中H-單元提供一對電子給個過渡金屬原子或離子,形成σ配位鍵,如圖4a所示。通過對該配合物中心金屬的氧化態、配位構型、磁性、可能的立體異構體,以及相對穩定構型的分析和討論,掌握H-單元作為配體的特點(具有較大的反式效應)。
氫由于其結構特點(半徑小),因而具備形成多中心氫橋鍵的能力,通過對乙硼烷中三中心兩電子鍵的闡述舉例說明這一特點(圖4b),同時引導學生閱讀相關文獻。
不僅H-單元可以作為配體,H2分子單元也可以作為配體與金屬中心或缺電子中心配位,聯系H2分子軌道能級圖,闡明在配位過程中,H2分子將成鍵軌道上的電子給出,相當于降低了H2分子的鍵級,削弱了H―H鍵,從而起到活化H2分子的作用,由此引申到催化劑,并引導學生閱讀相關催化加氫的文獻(圖4c)[3]。
講完H形成化學鍵后,繼續講授其在分子間作用力中的表現,即分子間氫鍵和分子內氫鍵,分子內氫鍵使物質的熔沸點降低,熱力學穩定性變差;而分子間氫鍵則使物質的熔沸點升高,同時,有可能是一些本來不穩定的物質變得相對穩定,以N-5五氮唑為例[4],如圖4d,要求學生課后閱讀五氮唑相關文獻,進一步了解其特殊性,為氮族元素的學習做準備。
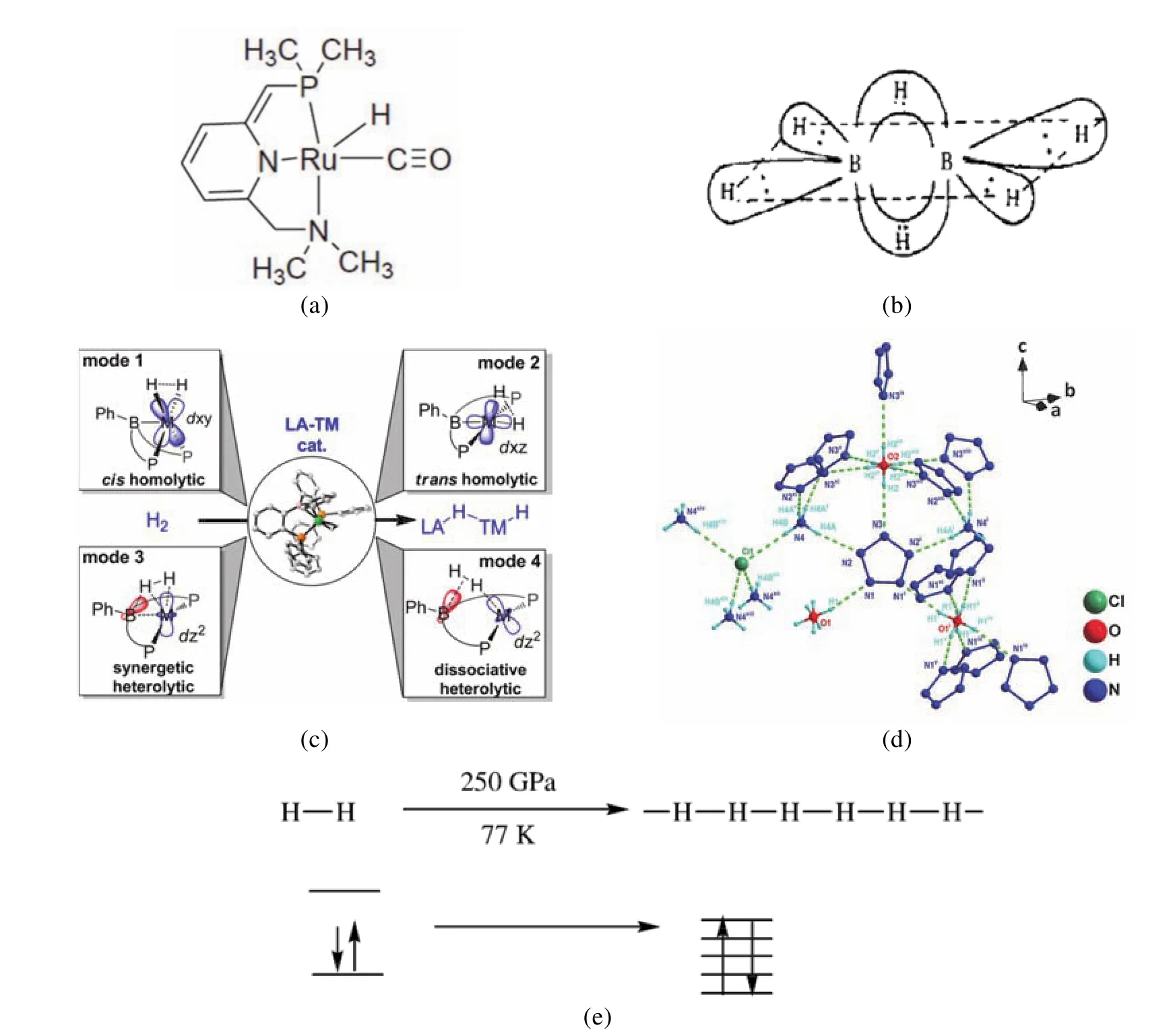
圖4 教學過程中涉及到的相關圖片
關于氫元素,我們不得不提的還有非常重要的一筆,那就是金屬氫。2017年1月,哈佛大學物理學家艾薩克·席維拉團隊宣布,制造出了地球上最稀有、最珍貴的材料——金屬氫[5],雖然,研究團隊后來宣布,這塊金屬氫不見了,但是論文中的許多物理和化學過程,我們卻可以拿到課堂上來講授或者討論。比如:氫分子在高壓下,其中的氫原子間由兩電子兩中心的共價鍵轉變為金屬鍵的過程中(圖4e),是否涉及到高壓下分子間作用力向原子間作用力的轉變,或者說分子間作用力向化學鍵的轉變,這都是可以引導學生討論的問題,在討論的過程中,培養學生的質疑精神和創新能力。
當然,通過引入前沿研究來深化基礎知識和通過深化基礎知識來構建知識體系的例子還有很多,需要作為教師的我們大量閱讀文獻,花大量的時間和精力挖掘文獻中的基礎知識,充分利用基礎知識與前沿研究間的協同關系,提升教學質量,培養出基礎扎實、有創新能力的學生。

