五味子酯甲通過抑制CCAT1和PI3K-AKT信號通路抑制肺癌細胞的遷移和侵襲
譚暉 王吉昌 董丹鳳 李恩孝 李毅


摘要 目的:探究五味子酯甲(SA)對肺癌細胞生長和轉移的潛在作用機制。方法:本研究以非小細胞肺癌細胞系A549和H1299作為實驗對象,將SA溶解在二甲基亞砜中,用不同劑量的SA(0 μmol/L、5 μmol/L、10 μmol/L、20 μmol/L、50 μmol/L)孵育A549和H1299細胞24 h、48 h和72 h。采用細胞計數盒-8檢測細胞增殖,采用FC500流式細胞儀分析細胞凋亡,采用傷口愈合實驗評價細胞遷移,采用Transwell檢測細胞侵襲。通過實時定量逆轉錄聚合酶鏈反應(qRT-PCR)檢測細胞中CCAT1 mRNA水平;通過Western Blotting檢測細胞中p-PI3K、PI3K、p-AKT、AKT、PTEN、E-cadherin、MMP2和MMP9的蛋白表達水平。結果:與未處理的細胞比較,SA以劑量和時間依賴性方式降低了A549和H1299的細胞活力(P<0.05)。與DMSO組比較,SA 10 μmol/L組的A549和H1299細胞凋亡率顯著升高了5.71倍和3.48倍(P<0.001),傷口愈合面積顯著降低了63.42%和59.15%(P<0.001),侵襲細胞數顯著降低了53.98%和53.36%(P<0.001)。與DMSO組比較,SA 10 μmol/L組A549和H1299細胞中E-cadherin的蛋白表達水平升高,而MMP-2和MMP-9的蛋白表達水平降低(P<0.01),CCAT1的mRNA表達水平均降低(P<0.01),p-PI3K和p-AKT的蛋白表達水平顯著降低(P<0.01),PTEN的蛋白表達水平顯著升高(P<0.01),而PI3K和AKT蛋白表達水平無明顯變化(P>0.05)。結論:SA通過抑制CCAT1和PI3K/AKT信號通路抑制肺癌細胞的生長和轉移。
關鍵詞 五味子酯甲;肺癌;遷移;侵襲;增殖;凋亡;結腸癌相關轉錄本-1;PI3K/AKT信號通路
Abstract Objective:To explore the potential effect and mechanism of Schisantherin A(SA) on the growth and metastasis of lung cancer cells.Methods:In this study,the non-small cell lung cancer cell lines A549 and H1299 were used as experimental objects.SA was dissolved in dimethyl sulfoxide(DMSO),and A549 and H1299 was incubated with different concentrations of SA(0 μmol,5 μmol,10 μmol,20 μmol,50 μmol) for 24 h,48 h and 72 h.Then,Cell Counting Kit-8(CCK-8) was used to detect cell proliferation,FC500 flow cytometer was used to analyze cell apoptosis,wound healing experiment was used to evaluate cell migration,and Transwell was used to detect cell invasion.Real-time quantitative reverse transcription polymerase chain reaction(qRT-PCR) was used to detect CCAT1mRNA levels in cells.Western blot was used to detect the protein expression levels of p-PI3K,PI3K,p-AKT,AKT,PTEN,E-cadherin,MMP2 and MMP9 in cells.Results:Compared with untreated cells,SA reduced the cell viability of A549 and H1299 in a concentration and time-dependent manner(P<0.05).Compared with the DMSO group,the apoptosis rate of A549 and H1299 cells in the SA 10 μmol group was significantly increased by 5.71 times and 3.48 times(P<0.001),the wound healing area of A549 and H1299 cells in the SA 10 μmol group was significantly reduced by 63.42% and 59.15%(P<0.001),and the number of invasion cells of A549 and H1299 cells in the SA 10 μmol group was significantly reduced by 53.98% and 53.36%(P<0.001).Compared with the DMSO group,the protein expression levels of E-cadherin in A549 and H1299 cells in the SA 10 μmol group increased,while the protein expression levels of MMP-2 and MMP-9 decreased(P<0.01); the mRNA and protein expression levels of CCAT1 in A549 and H1299 cells in the SA 10 μmol group were lower(P<0.01); the protein expression of p-PI3K and p-AKT in A549 and H1299 cells in SA 10 μmol group decreased significantly(P<0.01),PTEN protein expression level increased significantly(P<0.01),while PI3K and AKT protein expression levels did not change significantly(P>0.05).Conclusion:SA inhibits the growth and metastasis of lung cancer cells by inhibiting the CCAT1 and PI3K/AKT signaling pathways.
Keywords Schisantherin A; Lung cancer; Migration; Invasion; Proliferation; Apoptosis; CCAT1; PI3K/AKT signaling pathway
中圖分類號:R734.2,R285.5文獻標識碼:Adoi:10.3969/j.issn.1673-7202.2021.13.009
肺癌是公認的發病率和死亡率都很高的常見惡性腫瘤,非小細胞肺癌(Non-small Cell Lung Carcinoma,NSCLC)是最常見的肺癌亞型,占所有病例的近85%[1-3]。傳統的化療藥物在NSCLC患者中引起的不良反應較大,這些不良反應往往直接導致患者死亡。此外,分子靶向治療藥物的療效有限。因此,治療NSCLC的新藥仍然是迫切需要的。目前,植物來源的天然藥物是抗癌藥物的熱點領域。五味子酯甲(Schisantherin A,SA)是從中藥五味子中分離得到的一種主要的生物活性木脂素。最近的研究顯示其具有改善腦功能、減輕肝腎缺血再灌注損傷的保護作用[4-6]。然而,目前尚無文獻報道SA對肺癌細胞是否具有抗癌作用及其可能的機制。
長度超過200個核苷酸的長鏈非編碼RNA(LncRNAs)在不同水平的腫瘤過程中扮演了主要角色,包括轉錄和轉錄后加工[7]。LncRNA介導致癌或抗癌作用,但許多參與腫瘤發生發展的LncRNA的具體調控機制尚不清楚,需要進一步闡明。PI3K/AKT信號通路是人類腫瘤中最頻繁激活的信號通路之一,參與調控腫瘤活性及抗癌藥物的耐藥性[8-11]。本研究檢測了SA對肺癌細胞遷移和侵襲的干預作用,及其對肺癌中LncRNA CCAT1和PI3K/AKT信號通路的影響,旨在探討SA對肺癌細胞遷移和侵襲的影響,從而為抗癌藥物的研發提供基礎數據。
1 材料與方法
1.1 材料
1.1.1 細胞系 NSCLC細胞系(ATCC,美國,類型:A549和H1299)。本研究獲得西安交通大學第一附屬醫院醫學倫理委員會批準(倫理審批號:XJTU2BE2019JCS-065)。
1.1.2 藥物 五味子酯甲(SA)(TargetMol公司,美國,貨號:T2913);青霉素-鏈霉素(Gibco公司,美國,貨號:15140163)。
1.1.3 試劑與儀器 胎牛血清(Gibco公司,美國,貨號:0014020DJ);DMEM培養基(Gibco公司,美國,貨號:A4192101);二甲基亞砜(DMSO)(Sigma公司,美國,貨號:D2650);蛋白酶抑制劑(Sigma公司,美國,貨號:11206893001);磷酸酶抑制劑(Sigma公司,美國,貨號:P2850);細胞計數盒-8(CCK-8)(碧云天生物技術研究所,貨號:C0037);結晶紫(碧云天生物技術研究所,貨號:C0121);RIPA裂解緩沖液(碧云天生物技術研究所,貨號:P0013B);Annexin V-FITC細胞凋亡檢測試劑盒(碧云天生物技術研究所,貨號:C1062S);Transwell(Corning公司,美國,貨號:3428);Matrigel購自(BD Pharmingen公司,美國,貨號:BD356234);TRIzol試劑(Invitrogen公司,美國,貨號:15596018);PrimeScriptTMRT-PCR試劑盒(Takara公司,日本,貨號:RR037A);SYBR Premix Ex TaqTMⅡ(Takara公司,日本,貨號:RR820A);BCA試劑盒(Thermo Fisher Science公司,美國,貨號:23228);ECL化學發光檢測試劑盒(BioRad公司,美國,貨號:1705062);p-PI3K(Cell Signaling Technology公司,美國,貨號:17366);PI3K(Cell Signaling Technology公司,美國,貨號:4257);p-AKT(Cell Signaling Technology公司,美國,貨號:4060);AKT(Cell Signaling Technology公司,美國,貨號:4691);PTEN(Cell Signaling Technology公司,美國,貨號:9188);E-cadherin(Cell Signaling Technology公司,美國,貨號:3195);MMP2(Cell Signaling Technology公司,美國,貨號:87809);MMP9(Cell Signaling Technology公司,美國,貨號:13667);GAPDH(Cell Signaling Technology公司,美國,貨號:5174);辣根過氧化物酶標記的抗兔IgG抗體(Cell Signaling Technology公司,美國,貨號:7074)。分光光度計(Thermo Scientific公司,美國,Nanodrop 2000型);流式細胞儀(Beckman Coulter公司,美國,FC500型)。實時熒光定量PCR系統(Applied Biosystem公司,美國,ABI 7500型)。
1.2 方法
1.2.1 細胞培養與給藥處理 A549和H1299細胞均在添加了10%胎牛血清、100 U/mL青霉素和100 μg/mL鏈霉素的DMEM培養基中,培養條件為37 ℃、5% CO2。將SA溶解在DMSO中。采用不同劑量的SA(0 μmol/L、5 μmol/L、10 μmol/L、20 μmol/L、50 μmol/L)孵育A549和H1299細胞24 h、48 h和72 h。
1.2.2 細胞增殖檢測 采用細胞計數盒-8(CCK-8)檢測A549和H1299細胞增殖情況。將細胞置于96孔板中,細胞密度為3×104個/孔。每孔加入10 μL CCK8,37 ℃孵育2 h,按照CCK-8說明書的方法每隔24 h檢測各組細胞增殖情況,以DMSO作為陰性對照組。
1.2.3 細胞凋亡分析 根據說明書的操作步驟,收集每組細胞(3×105個細胞)并用PBS洗滌。然后,將細胞轉移到試管中,并在400 mL的結合緩沖液中重懸。將Annexin V(5 mL)和碘化丙啶(PI,5 mL)添加到細胞懸液中,并在室溫黑暗中孵育15 min。收集細胞并使用FC500流式細胞儀分析。
1.2.4 傷口愈合實驗 將3×105個細胞接種在12孔板上。細胞達到80%融合后,用200 μL移液槍尖頭做一細胞劃痕,用磷酸鹽緩沖液沖洗3次,去除脫落細胞,采用劑量為10 μmol/L的SA孵育24 h,分別于0 h和24 h觀察并拍照。
1.2.5 細胞侵襲分析 使用Transwell(孔徑8 μmol/L)檢測細胞侵襲。采用劑量為10 μmol/L的SA處理細胞24 h。收集3×105個細胞并放入含有200 μL無血清培養液的上室中,上室預先用Matrigel涂覆。下室加入600 μL含有10%胎牛血清的培養液。24 h后,用4%多聚甲醛固定侵襲至下室的細胞,用1%結晶紫染色,顯微鏡下隨機選擇5個視野計數。
1.2.6 實時定量逆轉錄聚合酶鏈反應 使用TRIzol試劑分離細胞總RNA,并通過Nanodrop 2000分光光度計定量。使用PrimeScriptTMRT-PCR試劑盒從1 μg提取的總RNA樣品中合成cDNA。使用SYBR Premix Ex TaqTMⅡ在ABI 7500型實時熒光定量PCR系統上進行PCR。使用2-△△Ct方法計算mRNA的相對表達。GAPDH用作CCAT1內部對照。具體的引物序列設計如下:CCAT1,正向,5′-CAGCGAAGGGGTTGAATGCA-3′,反向,5′-ACCTTAGCCCAGGAGCATAC-3′;GAPDH,正向引物,5′-GTGTTCACCTATTACTTGGTCC-3′,反向引物,5′-GTGACTGCTCTATTCTTACCAT-3′。
1.2.7 Western Blotting分析 用RIPA裂解緩沖液提取細胞蛋白,用BCA試劑盒測定蛋白濃度。將等量的蛋白質(50 μg)進行10%十二烷基硫酸鈉聚丙烯酰胺凝膠電泳,然后轉移至PVDF膜進行條帶分離。隨后,在含有Tween-20(TBS-T)的Tris緩沖鹽水中用10%脫脂牛奶將膜封閉。將膜與p-PI3K(1∶1 000)、PI3K(1∶1 000)、p-AKT(1∶2 000)、AKT(1∶2 000)、PTEN(1∶2 000)、E-cadherin(1∶3 000)、MMP2(1∶3 000)、MMP9(1∶3 000)和GAPDH(1∶2 000)在4 ℃孵育過夜。第二天用0.1% PBS洗滌后,將膜與辣根過氧化物酶標記的山羊抗兔IgG抗體(1∶2 000)一起孵育,并通過ECL化學發光檢測試劑盒進行顯影。將目的蛋白水平標準化為GAPDH的蛋白水平。
1.3 統計學方法
采用SPSS 21.0統計軟件進行數據分析,其中計數資料以百分率表示,采用χ2檢驗,計量資料以均數±標準差(±s)表示,采用t檢驗,以P<0.05為差異有統計學意義。
2 結果
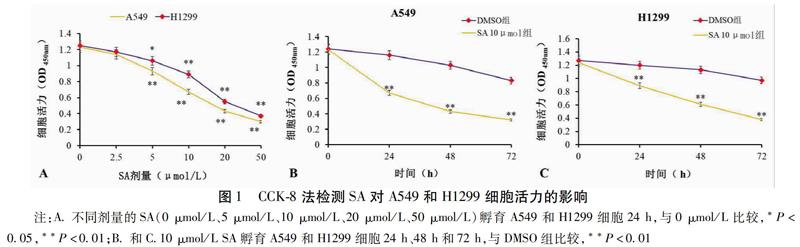
2.1 SA降低肺癌細胞活力
在第24 h,與0 μmol/L比較,5 μmol/L、10 μmol/L、20 μmol/L、50 μmol/L處理的A549和H1299細胞活力顯著降低,2種細胞活性均呈劑量依賴性下降(P<0.05)。本研究中10 μmol/L的SA處理A549和H1299細胞24 h均顯著降低了細胞活力(P<0.01),因此選擇10 μmol/L的SA進行后續實驗。用10 μmol/L SA處理2種細胞,在處理24 h、48 h和72 h時,與DMSO組比較,SA 10 μmol/L組的A549和H1299細胞活力均呈時間依賴性下降(P<0.05)。見圖1。
2.2 SA誘導肺癌細胞凋亡
通過流式細胞術檢測細胞凋亡,與DMSO組比較,SA 10 μmol/L組的A549和H1299細胞凋亡率顯著升高了5.71倍(3.14±0.15%相比21.06±1.13%,t=11.142,P<0.001)和3.48倍(4.21±0.21%相比18.85±0.94%,t=12.336,P<0.001)。見圖2。
2.3 SA抑制肺癌細胞的遷移和侵襲
通過傷口愈合實驗檢測細胞遷移能力,與DMSO組比較,SA 10 μmol/L組A549和H1299細胞的傷口愈合面積顯著降低了63.42%[(61.32±3.35)%相比(22.43±1.54)%,t=14.352,P<0.001]和59.15%[(57.35±2.65)%相比(23.43±1.06)%,t=14.325,P<0.001]。通過Transwell檢測細胞侵襲能力,與DMSO組比較,SA 10 μmol/L組A549和H1299細胞的侵襲細胞數顯著降低了53.98%[(387.21±22.07)%相比(178.18±7.80)%,t=9.542,P<0.001]和53.36%[(367.43±19.41)%相比(171.38±8.02)%,t=11.313,P<0.001]。通過Western Blotting檢測細胞中E-cadherin、MMP-2和MMP-9的蛋白表達,與DMSO組比較,SA 10 μmol/L組A549細胞中E-cadherin的蛋白表達水平升高了3.15倍,而MMP-2和MMP-9的蛋白表達水平降低了71.43%和51.56%(P<0.001);SA 10 μmol/L組H1299細胞中E-cadherin的蛋白表達水平升高了1.14倍,而MMP-2和MMP-9的蛋白表達水平降低了64.71%和60.66%(P<0.001)。見圖3~5。
2.4 SA抑制肺癌細胞中CCAT1的表達
通過qRT-PCR檢測細胞中CCAT1的mRNA表達,與DMSO組比較,SA 10 μmol/L組A549和H1299細胞中CCAT1的mRNA表達水平分別降低了73.00%和77.00%(P<0.01)。見圖6。
2.5 SA抑制肺癌細胞中PI3K/AKT信號通路
通過Western Blotting檢測細胞中PI3K/AKT信號通路關鍵分子的蛋白表達,與DMSO組比較,SA 10 μmol/L組A549細胞中p-PI3K和p-AKT的蛋白表達水平顯著降低了73.21%和70.69%(P<0.01),PTEN的蛋白表達水平顯著升高了1.95倍(P<0.01),而PI3K和AKT蛋白表達水平無明顯變化(P>0.05)。與DMSO組比較,SA 10 μmol/L組H1299細胞中p-PI3K和p-AKT的蛋白表達水平顯著降低了64.18%和73.91%(P<0.01),PTEN的蛋白表達水平顯著升高了1.45倍(P<0.01),而PI3K和AKT蛋白表達水平無明顯變化(P>0.05)。見圖7。
3 討論
五味子酯甲(Schisantherin A,SA)是從中藥五味子中提取的主要藥效成分。據報道,SA可以抑制核因子κB和MAPK的活性以發揮其抗炎作用,被認為是一種核因子κB抑制劑[12]。許多研究也證實SA對神經和肝臟損傷有保護作用[5-6]。另外,在治療癌癥方面,Wang等[13]研究顯示,SA通過素通過激活ROS/JNK和抑制Nrf2信號通路誘導人胃癌細胞凋亡,并抑制細胞遷移。然而,目前尚無文獻報道SA在肺癌中的作用。因此,本研究考察了SA對肺癌細胞的作用及其機制。
本研究結果顯示,SA對A549和H1299細胞的活力均有抑制作用,且呈濃度和時間依賴性。此外,SA誘導了A549和H1299細胞的凋亡。上述結果提示,SA可能是一種新型肺癌治療藥物。腫瘤轉移涉及許多生物學過程,如細胞黏附、細胞外基質降解、腫瘤細胞遷移和侵襲等。本研究中,SA抑制了A549和H1299細胞的遷移和侵襲。此外,SA處理后,A549和H1299細胞中細胞黏附E-cadherin的表達增加,而基質金屬蛋白酶MMP-9和MMP-2的表達水平則降低。這些發現表明SA可以顯著抑制肺癌細胞的轉移能力。
近年來,LncRNAs已成為腫瘤研究的熱點,參與調節腫瘤細胞的增殖、侵襲、遷移、凋亡等生物學過程。LncRNAs的異常表達與癌癥的發生發展密切相關。雖然LncRNA參與腫瘤發生發展的具體調控機制尚不清楚,但已證實多種LncRNA促進癌細胞的增殖、遷移、侵襲和轉移,其中包括HOX基因的反義基因間RNA、轉移相關肺腺癌轉錄本-1、SLC7A11-AS1、LINC01606等[14-17]。結腸癌相關轉錄本-1(Colon Cancer Associated Transcript-1,CCAT1)位于染色體8q24.21上,全長2 628個核苷酸,是一種與多種腫瘤相關的致癌基因,可被c-Myc激活,促進癌癥的發展[18-20]。CCAT1在各種類型的腫瘤中異常表達并表現出致癌作用,例如胃癌、肝癌和肺癌[21-23]。更重要的是,在耐多西他賽的肺癌細胞中,CCAT1被發現起癌基因的作用并促進其化學耐藥性[21]。在胃癌中,敲除Carlo-5基因降低了ERK和MAPK(P38)的磷酸化[24]。有研究證實CCAT1通過激活PI3K/AKT在FTC-133甲狀腺癌細胞中發揮致癌作用[25]。本研究發現SA抑制了A549和H1299細胞中CCAT1的表達。因此,SA的對肺癌細胞轉移的抑制作用可能是通過抑制CCAT1介導的。
磷脂酰肌醇3-激酶(Phosphatidylinositol 3-kinase,PI3K)是生長因子受體酪氨酸激酶(Receptor Tyrosine Kinase,RTK)下游的主要信號成分,它可以激活AKT,調節一系列調控細胞增殖、成活、生長和其他過程的靶蛋白[9]。PI3K/AKT信號通路是人類腫瘤中最頻繁激活的信號通路之一,與腫瘤細胞對特定治療藥物的敏感性或耐藥性有關,并參與控制上皮細胞向間充質細胞的轉化[10]。PI3K/AKT信號通路具有防止細胞凋亡和促進惡性轉化的作用。AKT的激活促進腫瘤轉移和侵襲,拮抗細胞周期停滯和血管生成,并使mTOR蛋白激酶磷酸化。據報道,CCAT1作為一種癌癥增強子RNA(eRNA),通過與TP63和SOX2以及與EGFR DNA分子相互作用來激活PI3K/AKT信號通路[26]。此外,PI3K/AKT信號通路的活性受RAS的正向調節和PTEN的負向調節[27]。本研究顯示,SA抑制了A549和H1299細胞中PI3K和AKT的磷酸化,并上調了抑癌基因PTEN的表達。表明SA通過抑制PI3K/AKT信號通路來抑制肺癌細胞的生長和轉移。
總之,本研究表明SA通過抑制CCAT1和PI3K/AKT信號通路抑制肺癌細胞的生長和轉移。通過對SA進行結構和化學修飾來提高其溶解性并降低其對正常細胞的毒性,有望將其開發成一種新型抗癌藥物。
參考文獻
[1]Jonna S,Subramaniam DS.Molecular diagnostics and targeted therapies in non-small cell lung cancer(NSCLC):an update[J].Discov Med,2019,27(148):167-170.
[2]Osmani L,Askin F,Gabrielson E,et al.Current WHO guidelines and the critical role of immunohistochemical markers in the subclassification of non-small cell lung carcinoma(NSCLC):Moving from targeted therapy to immunotherapy[J].Semin Cancer Biol,2018,52(Pt 1):103-109.
[3]Proto C,Ferrara R,Signorelli D,et al.Choosing wisely first line immunotherapy in non-small cell lung cancer(NSCLC):what to add and what to leave out[J].Cancer Treat Rev,2019,75:39-51.
[4]Gong J,Wang X.Schisantherin A protects renal tubular epithelial cells from hypoxia/reoxygenation injury through the activation of PI3K/AKT signaling pathway[J].J Biochem Mol Toxicol,2018,32(7):e22160.
[5]Liu C,Sun W,Li N,et al.Schisantherin A Improves Learning and Memory of Mice with D-Galactose-Induced Learning and Memory Impairment Through Its Antioxidation and Regulation of p19/p53/p21/Cyclin D1/CDK4/RB Gene Expressions[J].J Med Food,2018,21(7):678-688.
[6]Zheng N,Liu F,Lu H,et al.Schisantherin A protects against liver ischemia-reperfusion injury via inhibition of mitogen-activated protein kinase pathway[J].Int Immunopharmacol,2017,47:28-37.
[7]Nasrollahzadeh-Khakiani M,Emadi-Baygi M,Schulz WA,et al.Long noncoding RNAs in gastric cancer carcinogenesis and metastasis[J].Brief Funct Genomics,2017,16(3):129-145.
[8]Alzahrani AS.PI3K/Akt/mTOR inhibitors in cancer:At the bench and bedside[J].Semin Cancer Biol,2019,59:125-132.
[9]Costa R,Han HS,Gradishar WJ.Targeting the PI3K/AKT/mTOR pathway in triple-negative breast cancer:a review[J].Breast Cancer Res Treat,2018,169(3):397-406.
[10]Hoxhaj G,Manning BD.The PI3K-AKT network at the interface of oncogenic signalling and cancer metabolism[J].Nat Rev Cancer,2020,20(2):74-88.
[11]O′Donnell JS,Massi D,Teng M,et al.PI3K-AKT-mTOR inhibition in cancer immunotherapy,redux[J].Semin Cancer Biol,2018,48:91-103.
[12]Liao S,Zhou K,Li D,et al.Schisantherin A suppresses interleukin-1β-induced inflammation in human chondrocytes via inhibition of NF-κB and MAPKs activation[J].Eur J Pharmacol,2016,780:65-70.
[13]Wang Z,Yu K,Hu Y,et al.Schisantherin A induces cell apoptosis through ROS/JNK signaling pathway in human gastric cancer cells[J].Biochem Pharmacol,2020,173:113673.
[14]Chiyomaru T,Fukuhara S,Saini S,et al.Long non-coding RNA HOTAIR is targeted and regulated by miR-141 in human cancer cells[J].J Biol Chem,2014,289(18):12550-12565.
[15]Hirata H,Hinoda Y,Shahryari V,et al.Long Noncoding RNA MALAT1 Promotes Aggressive Renal Cell Carcinoma through Ezh2 and Interacts with miR-205[J].Cancer Res,2015,75(7):1322-1331.
[16]Luo Y,Tan W,Jia W,et al.The long non-coding RNA LINC01606 contributes to the metastasis and invasion of human gastric cancer and is associated with Wnt/β-catenin signaling[J].Int J Biochem Cell Biol,2018,103:125-134.
[17]Luo Y,Wang C,Yong P,et al.Decreased expression of the long non-coding RNA SLC7A11-AS1 predicts poor prognosis and promotes tumor growth in gastric cancer[J].Oncotarget,2017,8(68):112530-112549.
[18]Coni P,Madeddu A,Kuqi L,et al.LncRNA colon cancer-associated transcript 1(CCAT1) in ovarian cancer[J].Eur Rev Med Pharmacol Sci,2018,22(6):1525-1527.
[19]Lai XJ,Cheng HF.LncRNA colon cancer-associated transcript 1(CCAT1) promotes proliferation and metastasis of ovarian cancer via miR-1290[J].Eur Rev Med Pharmacol Sci,2018,22(2):322-328.
[20]Yang C,Pan Y,Deng SP.Downregulation of lncRNA CCAT1 enhances 5-fluorouracil sensitivity in human colon cancer cells[J].BMC Mol Cell Biol,2019,20(1):9-19.
[21]Chen J,Zhang K,Song H,et al.Long noncoding RNA CCAT1 acts as an oncogene and promotes chemoresistance in docetaxel-resistant lung adenocarcinoma cells[J].Oncotarget,2016,7(38):62474-62489.
[22]Deng L,Yang SB,Xu FF,et al.Long noncoding RNA CCAT1 promotes hepatocellular carcinoma progression by functioning as let-7 sponge[J].J Exp Clin Cancer Res,2015,34(1):18-27.
[23]Yang F,Xue X,Bi J,et al.Long noncoding RNA CCAT1,which could be activated by c-Myc,promotes the progression of gastric carcinoma[J].J Cancer Res Clin Oncol,2013,139(3):437-445.
[24]Zhang Y,Ma M,Liu W,et al.Enhanced expression of long noncoding RNA CARLo-5 is associated with the development of gastric cancer[J].Int J Clin Exp Pathol,2014,7(12):8471-8479.
[25]Yang T,Zhai H,Yan R,et al.lncRNA CCAT1 promotes cell proliferation,migration,and invasion by down-regulation of miR-143 in FTC-133 thyroid carcinoma cell line[J].Braz J Med Biol Res,2018,51(6):e7046.
[26]Jiang Y,Jiang YY,Xie JJ,et al.Co-activation of super-enhancer-driven CCAT1 by TP63 and SOX2 promotes squamous cancer progression[J].Nat Commun,2018,9(1):3619-3621.
[27]Stambolic V,Suzuki A,de la Pompa JL,et al.Negative regulation of PKB/Akt-dependent cell survival by the tumor suppressor PTEN[J].Cell,1998,95(1):29-39.
(2020-11-19收稿 責任編輯:吳珊,徐穎)

