雞傳染性貧血的診斷與防控措施
鞏新民 祝永華 張鵬 郭龍宗 李玉燕
中圖分類號:S858.31? ? ? ? 文獻標識碼:C? ? ? ? 文章編號:1673-1085(2021)6-0017-04
雞傳染性貧血又稱藍翅病、出血綜合征或貧血性皮炎綜合征,是由雞傳染性貧血病毒(Chicken infectious anemia virus,CAV)引起的以雛雞再生障礙性貧血和全身性淋巴組織萎縮為主要特征的免疫抑制病[1]。雞傳染性貧血病毒是圓環病毒科環狀病毒屬的成員之一[2],無囊膜,病毒顆粒呈20面體對稱,平均直徑為25~26.5 nm。CAV的基因組為單股負鏈環狀DNA,大小為2298 bp或2319 bp,編碼3種病毒蛋白(VP1、VP2和VP3)[3]。目前發現的CAV毒株只有一個血清型,但是世界各地分離的CAV毒株的基因組序列存在差異,毒力也有所不同[3-5] 。
崔現蘭等[6]1992年在我國發病雞群中首次分離到該病毒,從而確證了該病在我國的存在。目前CAV已在各種不同雞群中廣泛傳播,甚至在某些SPF雞群中也檢測到CAV的存在[7]。根據近幾年的流行病學調查,雞傳染性貧血病毒在我國雞群中的感染率約在40%~70%。2021年3月,某客戶送檢的種雞群從6周齡開始,一些雞只出現生長緩慢、發育不良、消瘦、貧血等癥狀。臨床剖檢病死雞發現胸腺萎縮、骨髓顏色發黃,疑似雞傳染性貧血病毒感染,但調研發現該種雞群還未免疫雞傳染性貧血疫苗。本研究采集死亡雞只骨髓、脾等組織樣品進行病毒的PCR鑒定,同時采集雞群的血清進行CAV抗體檢測,鑒定結果顯示,該種雞群發病為雞傳染性貧血感染。為了預防該病的發生,臨床需要制定相應的防控措施。
1 材料與方法
1.1 材料與試劑
PCR引物由生工生物工程(上海)股份有限公司合成;DNA提取試劑盒、PCR反應試劑盒、2000bp Marker、瓊脂糖、TAE均購自北京全式金生物技術有限公司。雞傳染性貧血病毒抗體檢測試劑盒購自IDEXX公司,批號:GS518,有效期至2022年5月20日。CAV陽性對照購自英特威國際有限公司,批號02440060,有效期至2022年8月20日。
1.2 病料處理
采集疑似感染CAV雞的骨髓、脾等病料,加入滅菌生理鹽水充分研磨成5%~10%的勻漿液。將懸液移至離心管中充分搖震后,4 ℃,12000 r/min離心3 min,取上清液用于提取核酸。
1.3 樣品的鑒定
1.3.1 引物 以提取核酸為模板,采用針對CAV的PCR檢測引物,上游引物序列為:5-GCATTCCGAGTGGTTACTATTCC-3,下游引物序列為:5-CGTCTTGCCATCTT-ACAGTCTTAT-3,擴增目的片段大小為842 bp。
1.3.2 目的片段的擴增 PCR反應25μL體系:2×Easy Taq PCR SuperMix 12.5μL,上下游引物(10 ?mol/L)各1μL,DNA模板3μL,ddH2O 7.5μL。PCR反應程序為:94 ℃預變性5 min,94 ℃ 40 s,55 ℃40 s,72 ℃1 min,32個循環,72 ℃延伸10 min,于4 ℃保存,備用。
反應結束,取7μL PCR產物經1%瓊脂糖凝膠電泳,于凝膠成像儀中觀察并記錄結果。
1.4 CAV抗體的檢測
由于該雞群尚未免疫雞傳染性貧血疫苗,可以參照IDEXX公司雞傳染性貧血病毒ELISA抗體檢測試劑盒說明方法,檢測血清中CAV的野毒抗體水平,共檢測92份血清。
2 結果
2.1 臨床癥狀及剖檢變化
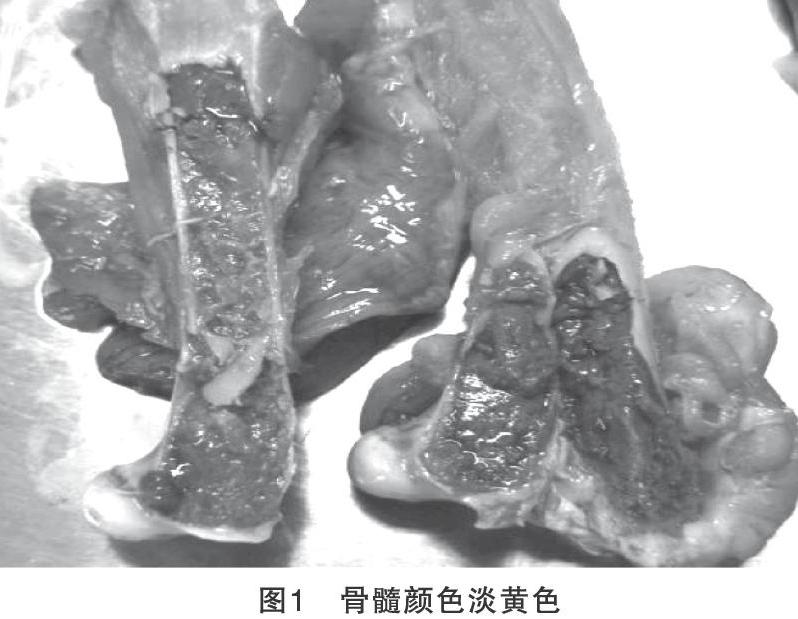
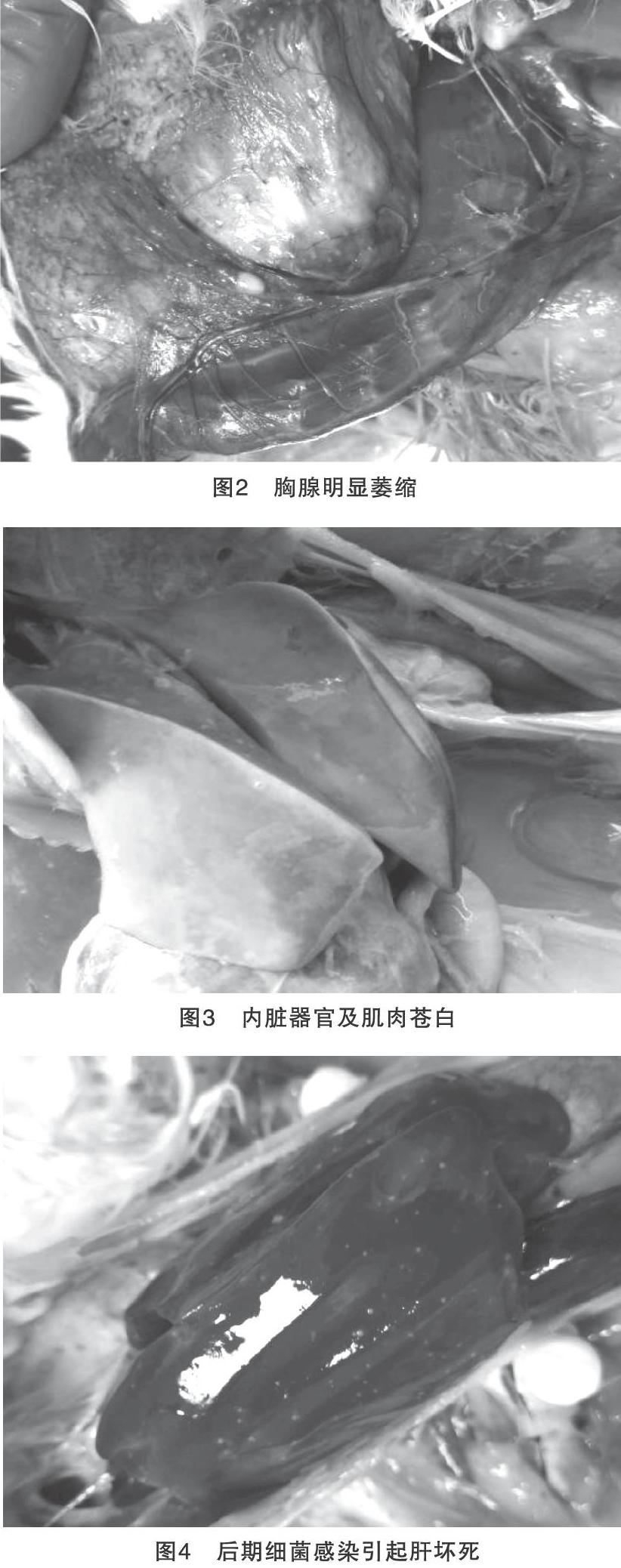
該種雞群主要表現為精神沉郁、消瘦,肉髯、可視粘膜、皮膚蒼白,臨床剖檢血液凝固不良,骨髓顏色淡黃色(圖1),胸腺明顯萎縮(圖2),內臟器官及肌肉蒼白(圖3),法氏囊、脾臟有不同程度的萎縮,后期繼發細菌感染引起肝壞死(圖4)。
2.2 CAV 的 PCR鑒定
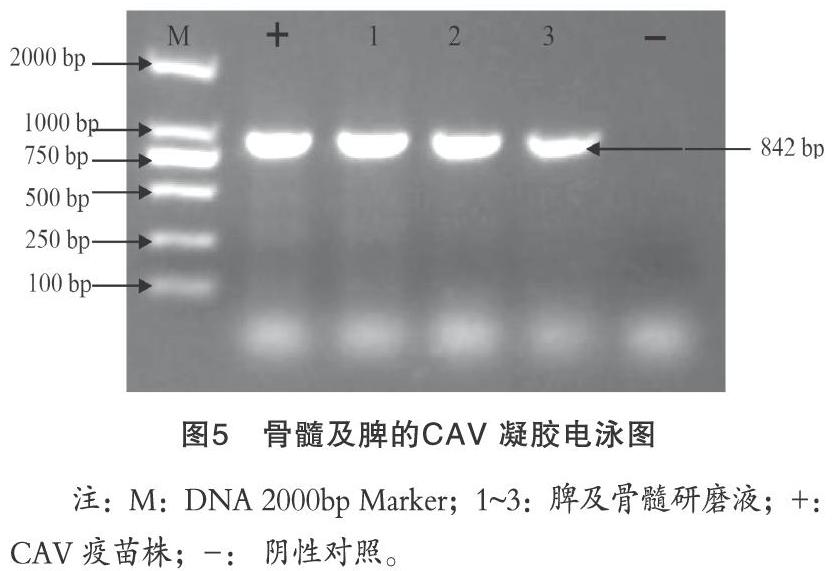
采集脾臟以及淡黃色的骨髓提取DNA,進行CAV的PCR擴增,瓊脂糖凝膠電泳結果顯示擴增出的目的條帶(圖5),符合預期片段大小,可以確診所分離的病毒為CAV。
2.3 CAV 抗體檢測
92份血清檢測CAV野毒抗體陽性率為31.52%(29/92),證實該雞群存在CAV的野毒感染。
3 雞傳染性貧血病的防控
3.1 免疫接種
目前規模化養殖場防治雞傳染性貧血最有效的方法是對種雞群接種CAV疫苗,臨床常免疫活疫苗2次,可使雞群獲得良好的免疫保護,同時保護后代雞群獲得較高的母源抗體,避免早期感染。本種雞場CAV感染在母源抗體的空窗期,是抗體保護力不足導致的。需要注意的是,種雞群在產蛋前3~4周和40日齡以內的雛雞不適宜接種CAV弱毒疫苗[8]。
3.2 加強生物安全防控
養殖場采取全進全出制度,嚴禁從有發病史的雞場引入。場區做好日常的消毒管理工作,使用消毒劑(如戊二醛、碘酸混合溶液、次氯酸鈉溶液或者過硫酸氫鉀復合物粉)進行嚴格消毒[8],雞舍可使用衛可、5%雙鏈季銨鹽絡合碘等消毒劑輪換帶雞噴霧消毒,確保不留死角。雞舍做好通風管理,控制好雞群飼養密度,給雞群創造一個舒適的環境,避免有害氣體危害雞群健康。同時做好人員、物資、車輛的消毒管理工作,預防病原的侵入。
3.3 CAV抗體監測
定期檢測雞群的CAV抗體,在疫苗免疫前檢測CAV野毒抗體,評估是否存在CAV野毒感染。在開產前評估CAV的抗體水平,制定抗體基線保證雞群產蛋期免受CAV的感染,防止垂直傳播。
3.4 防止活苗污染
在某些弱毒活疫苗中發現REV、CAV等外源性病毒污染,使用了被污染的SPF雞胚引起的,李陽等[9]首次報道在中國SPF雞中檢測到CIAV,并分離鑒定一個毒株(命名為SD1403),推測這可能是減毒疫苗被CAV污染的重要原因。種雞群在整個飼養周期需要多次免疫活苗,在雞群活疫苗的常規免疫過程中,一定在SPF雞群和活苗中進行CAV等外源性病原的檢測,保障疫苗的使用安全和免疫效果,特別是雞痘、馬立克氏疫苗的免疫,防止活疫苗中因CAV污染而感染雞群。
3.5 控制繼發感染
當雞群感染雞傳染性貧血時,由于機體免疫力下降,導致繼發某些細菌性感染,特別是與其他免疫抑制性疾病共感染時,導致臨床雞群死淘率升高,產生更嚴重的免疫抑制。因此,在加強飼養管理的同時,針對繼發性感染疾病需制定科學、有效的防控措施。
參考文獻:
[1] 林歡,么帥、脫添蓓,等.一株雞傳染性貧血病毒的分離鑒定及全基因組序列分析[J].中國預防獸醫學報,2017,39(6):436 - 438.
[2] SCHAT K A. Chicken anemia virus[J] . Curr Top Microbiol Immunol,2009,331:151-183.
[3] 李岳,閆娜娜,劉愛晶,等.中國部分地區雞傳染性貧血流行病學調查及病原分離鑒定[J].中國預防獸醫學報,2020,42(8):761 - 765.
[4] DUCATEZ M F, CHEN H, GUAN Y, et al. Molecular epidemiology of chicken anemia virus (CAV) in Southeastern Chinese live birds markets [J]. Avian Dis, 2008, 52(1): 68-73.
[5] OLSZEWSKA-TOMCZYK M, EDYTA SWIETON, MINTA Z, et al.Occurrence and phylogenetic studies of chicken anemia virus from Polish broiler flocks [J]. Avian Dis, 2016, 60(1): 70-74.
[6] 崔現蘭,辛桂香,吳東來. 雞傳染性貧血病毒的鑒定[J]. 中國畜禽傳染病,1992(6):3-5.
[7] LI Y, WANG Y X, FANG L C, et al. Genomic analysis of the chicken infectious anemia virus in a specific pathogen-free chicken population in China[J/OL]. BioMed Research International, 2016. http://dx.doi.org/10.1155/2016/4275718.
[8] 薛冬梅. 雞傳染性貧血的流行病學、臨床特征、實驗室診斷和防控措施[J].現代畜牧科技,2021,75(3):129-130.
[9] LI Y,WANG Y,FANG L,et al.Genomic Analysis of the Chicken Infectious Anemia Virus in a Specific Pathogen Free Chicken Population in China[J].BioMedResearch International,2016:4275718.

