光敏Z親和肽-堿性磷酸酶重組蛋白的構建及其生物學活性研究①
于曉甜 張曉坤 高曉藝 楊洪鳴 唐金寶(濰坊醫學院藥學院,濰坊261053)
標記免疫分析技術是將抗原-抗體結合反應的特異性和各種標記物的可測量性相結合的分析技術,標記抗體是該技術中不可或缺的重要試劑[1-2]。目前,基于交聯抗體分子內活性氨基酸殘基的化學共價偶聯技術是抗體標記的主要技術,但由于抗體表面上存在的多個活性位點(如1個IgG分子表面有86個-NH2)都可能參與偶聯,一旦偶聯反應的氨基酸殘基位于Fab端,則影響抗體與抗原的結合,導致標記后抗體的抗原結合活性降低[3-4]。因此,開發一種特異性偶聯抗體Fc位點的抗體標記技術,對于保持標記后抗體的抗原結合活性具有重要意義。蛋白A能通過疏水作用結合兔、人及小鼠等多種動物IgG的Fc段,根據這一特性,除廣泛應用于動物血清IgG和單克隆抗體純化外,還被多種標記物(過氧化物酶、堿性磷酸酶、膠體金等)偶聯標記用于免疫測定[5-6]。Z親和肽是源于蛋白A的IgG結合結構域,分子量為7 kD[7-8]。本研究以密碼子擴展修飾蛋白質技術(aminoacyl-tRNA synthetase/suppressor tRNA,aaRS/tRNA)將含有光敏基團的非天然氨基酸(4-苯甲酰基-L-苯基丙氨酸,p-benzoylphenylalanine,Bpa)引入Z親和肽的氨基酸序列,并在其C-端重組引入堿性磷酸酶,構建帶光敏基團的ZBpa-AP重組蛋白,利用Z親和肽與IgG-Fc的親和特異性以及Bpa的共價鍵形成能力,實現堿性磷酸酶對抗體Fc位點的共價偶聯標記,以期為構建一種新型的酶標抗體奠定實驗基礎。
1 材料與方法
1.1 材料pTXB1、pEVOL-pBpF質粒分別購自NEB公司和Addgene公司;Bpa購自廣州氪道公司;His-Trap Chelating HP購自Amersham Biosciences公司;超濾離心管(50 kD)購自Millipore公司;兔IgG抗體購自BBI公司;Rabbit anti-goat F(ab′)2片段購自Jackson公司;BCIP/NBT堿性磷酸酶顯色試劑盒購自碧云天生物公司;pDAP2質粒及E.coliBL21放于藥學專業實驗室保存;其他生化及化學試劑為進口或國產分析純。
1.2 方法
1.2.1 光敏ZBpa-AP融合蛋白表達載體的構建根據GenBank數據庫登錄的Z親和肽基因序列(No.M74186),將第17位氨基酸密碼子突變為琥珀密碼子(UAG),分別在5′及3′端設計NdeI及SalI限制性內切酶酶切位點,上述基因序列委托上海生工生物合成并克隆至pTXB1質粒,構建中間質粒載體pTXB1-ZTAG。根據大腸桿菌堿性磷酸酶基因序列,設計1對引物(上游引物:5′-GCGTCGACATGCCTGTTCTGG-3′;下游引物:5′-CAGGAAGAGCCCTCGAGTTAATG-3′,下劃線分別為SalI及XhoI酶切位點),以pDAP2質粒為模板PCR方式獲取AP基因并克隆至pTXB1-ZTAG,構建表達載體pZTAG-AP。
1.2.2 光敏ZBpa-AP融合蛋白的表達與純化pZTAGAP和pEVOL-pBpF共轉化至感受態菌E.coliBL21,涂布于含氯霉素(50 mg/L)和氨芐青霉素(100 mg/L)的LB平板37℃下培養12 h。陽性單克隆菌落于含氯霉素(50 mg/L)和氨芐青霉素(100 mg/L)的LB培養基中培養12 h后,以1/50的接種量在LB培養基中37℃培養至OD600nm為0.6~0.8。然后將終濃度為300 mmol/L的Bpa加入到培養基中,并繼續生長1 h后,分別加入阿拉伯糖和異丙基β-D-1-硫代吡喃半 乳 糖 苷(IPTG)至 終 濃 度 為0.2%(m/v)和0.5 mmol/L,誘導表達6 h后,離心收集菌體,用含咪唑20 mmol/L的20 mmol/L PBS溶液重懸菌體,反復凍融直至菌液變得黏稠,8 000 r/min離心10 min,取上清。HisTrap Chelating HP純化目的蛋白,Amicon?Ultra-4(分子截留量50 kD)對咪唑洗脫組分進行超濾濃縮脫鹽,12%SDS-PAGE檢測。
1.2.3 ZBpa-AP與抗體光激發共價偶聯終濃度分別為10μmol/L和50μmol/L的抗體(兔IgG)和ZBpa-AP溶液于石英比色皿中混合,4℃下孵育1 h。混合物置于冰上,365 nm紫外燈照射,并分別在照射時間0 min、30 min、60 min、90 min、120 min取樣,12%變性和非變性SDS-PAGE分析偶聯效果。
1.2.4 對照實驗兔F(ab')2片段與ZBpa-AP以物質的量比1:5混合,4℃下孵育1 h。365 nm紫外燈于冰上照射120 min,12%變性SDS-PAGE分析。
1.2.5 Western blot將1.2.3項取樣樣品經12%非變性SDS-PAGE分離后,轉至PVDF膜。轉膜結束后,經PBST洗滌3~4次后,PVDF膜浸入BCIP/NBT顯色液,室溫振蕩染色,直至出現明顯條帶。
2 結果
2.1 光敏ZBpa-AP融合蛋白表達載體的構建化學合成第17位突變為TAG的Z親和肽序列片段經測序后亞克隆至pTXB1質粒獲得pTXB1-ZTAG質粒;PCR方式擴增AP基因片段,經測序正確后雙酶切插入pTXB1-ZTAG質粒,獲得pZTAG-AP表達載體(圖1)。
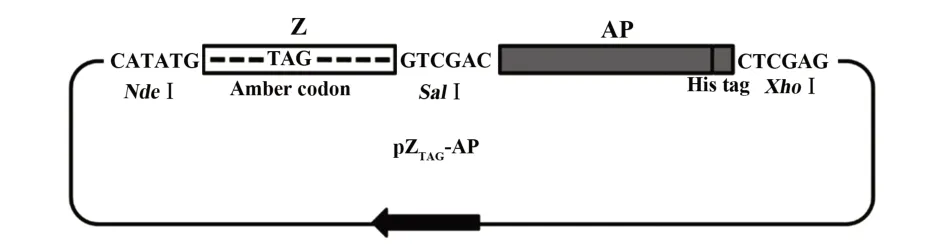
圖1 pZTAG-AP質粒圖譜Fig.1 Plasmid profile pZTAG-AP
2.2 光敏ZBpa-AP融合蛋白的表達與純化培養基含有Bpa培養的工程菌與不含Bpa培養的工程菌相比,在56 kD左右出現蛋白條帶,與ZBpa-AP融合蛋白理論值相符(圖2)。菌體凍融上清流通HisTrap層析柱,300 mmol/L咪唑(20 mmol/L PBS,150 mmol/L NaCl,pH=7.4)洗脫目的蛋白,其電泳純度可達90%。
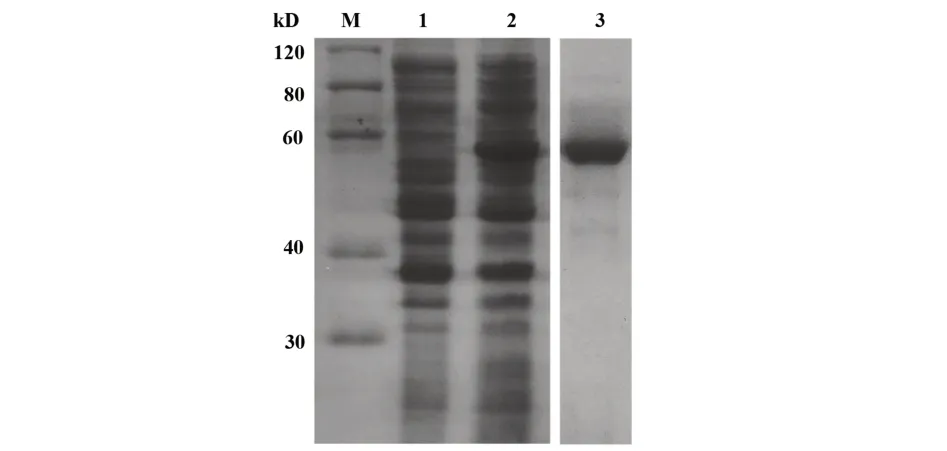
圖2 12%SDS-PAGE分析目的蛋白的表達及純化Fig.2 12%SDS-PAGE analysis of expression and purification of target protein
2.3 ZBpa-AP與抗體的光共價偶聯結果如圖3所示,非還原電泳結果顯示,光照產物在IgG抗體上方出現兩條帶,且隨著光照時間的延長,最上方條帶著色加深,而抗體及ZBpa-AP蛋白條帶變淺,表明越來越多的抗體被兩分子ZBpa-AP偶聯,凝膠灰度掃描表明約90%的IgG被ZBpa-AP分子共價偶聯。還原SDS-PAGE結 果 表 明,ZBpa-AP與IgG重 鏈(heavy chain,HC)偶聯。為進一步考察ZBpa-AP與HC偶聯部位,兔F(ab')2片段與ZBpa-AP按物質的量濃度比1:5混合,4℃下孵育1 h。冰浴條件下UV光照偶聯2 h。還原SDS-PAGE結果顯示(圖4),ZBpa-AP不能偶聯F(ab')2片段。因此,根據ZBpa-AP與IgG、F(ab')2偶聯產物的電泳結果,可證明ZBpa-AP與抗體發生共價偶聯的部位是抗體Fc段。

圖3 12%非變性與變性SDS-PAGE分析光照產物Fig.3 12% non-reducing and reducing SDS-PAGE analysis of photoconjugation

圖4 12%變性SDS-PAGE分析ZBpa-AP與F(ab′)2的光照產物Fig.4 12% reducing SDS-PAGE analysis of ZBpa-AP photoconjugated F(ab′)2 fragment
2.4 Western blot結果顯示偶聯物條帶顯色,且隨照射時間延長顏色變深,而ZBpa-AP條帶隨照射時間延長顏色變淺(圖5B、D),與考馬斯亮藍染色結果一致(圖5A、C),表明偶聯物具有堿性磷酸酶活性。
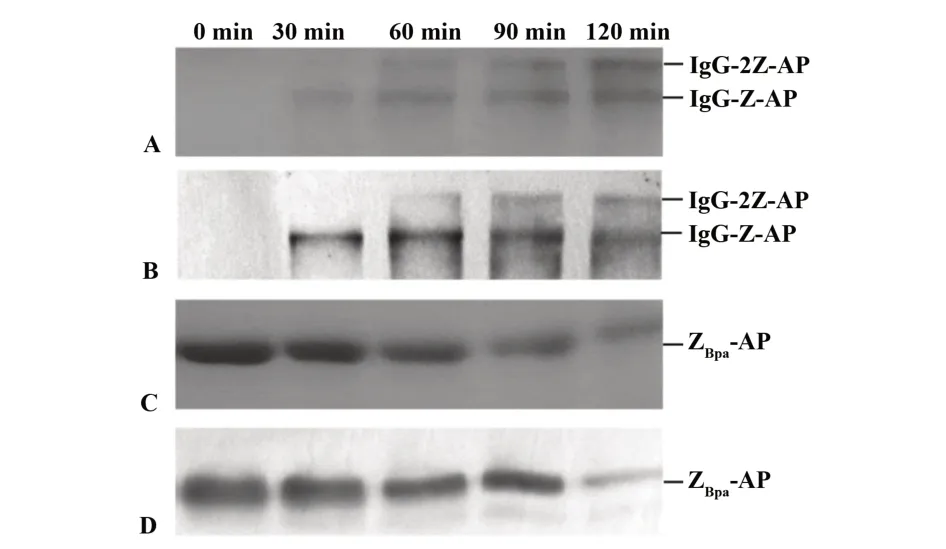
圖5 偶聯產物的堿性磷酸酶活性分析Fig.5 Activity analysis for alkaline phosphatase of coupling produt
3 討論
通過基因工程技術構建融合蛋白可避免化學隨機偶聯標記技術對標記蛋白生物學活性的影響,如蛋白A與標記蛋白(綠色熒光蛋白、堿性磷酸酶及熒光素酶等)構建融合蛋白,能充分保持蛋白A及標記蛋白的生物學活性,提高基于蛋白A免疫分析的特異性與靈敏度[9-11]。然而蛋白A與兔、人、小鼠等動物IgG是可逆性結合,如以蛋白A融合的蛋白應用于人血清疾病標志物檢測時,血清中內源性人IgG抗體會競爭性結合蛋白A融合蛋白,干擾測定的準確性[12-13]。如果將蛋白A與抗體的可逆親和轉變為共價偶聯,則能突破蛋白A在臨床免疫檢驗的應用瓶頸。光親和標記技術可實現受體蛋白與配體蛋白之間共價結合,光敏衍生物修飾的配體與受體蛋白生物結合后,再光照激發使光敏衍生物在結合部位與受體蛋白形成共價鍵[14-15]。以Z親和肽為親和配基,研究顯示光敏基團在其第17位氨基酸位置時與兔IgG的光共價偶聯效率最高[6,16]。本研究中,為實現該融合蛋白與抗體的共價偶聯,利用遺傳密碼擴展技術(aaRS/tRNA)將Z親和肽的第17位氨基酸替換為光敏基團的Bpa,構建光敏ZBpa-AP融合蛋白。實驗結果表明,光敏ZBpa-AP具有IgG-Fc的親和特性、Bpa的共價結合能力以及堿性磷酸酶的酶學活性,實現了堿性磷酸酶對抗體Fc位點的共價偶聯標記,這對于開發基于抗體特異性位點的抗體標記技術具有重要意義。下一步研究重點是該光偶聯標記方式對偶聯后抗體的免疫學活性以及其對標記免疫分析檢測效能的影響。

