基于數據挖掘的便秘動物模型應用分析
王 萍,方曉艷,苗明三
(河南中醫藥大學,鄭州 450046)
便秘是一種功能性胃腸道(GI)疾病[1],在我國的發病率為6.07%,2016年最新版的羅馬Ⅳ標準(RomeⅣcriteria)將其更加全面的定義為以排便困難、排便次數減少或除腹瀉型腸道應激綜合征(IBSD)外引起的排便不盡感為主的癥狀[2];長期便秘可繼發痔瘡,誘發心腦血管疾病,增加腸癌等的患病風險等[3],由于飲食結構改變、生活節奏加快和社會心理因素等影響,便秘患者逐漸增多,嚴重影響患者的生活質量[4]。便秘的相關研究越來越受到醫學界的重視和關注。可通過建立與臨床高度吻合的便秘動物模型,從而促進便秘病因病機、新藥篩選等方面的研究。筆者通過歸納分析近5年便秘動物模型特點,以期為今后便秘實驗研究提供參考。
1 資料和方法
1.1 數據來源
以“便秘”和“動物模型”為主題,在中國知網、萬方和維普數據庫中檢索2015年1月~2020年7月全部實驗性期刊文獻。
1.2 歸納標準
選用便秘動物實驗研究的全部動物;會議、碩博論文等不作為納入的范疇;排除綜述類和資料不全的文獻。共篩選出符合納入標準的文獻142篇。
1.3 數據處理
實驗動物名稱、種類等均參照《實驗動物和動物實驗技術》[5]進行規范總結。
1.4 統計學方法
將實驗動物種類、陽性藥、造模給藥方式、造模方法、檢測指標等錄入Excel 2013進行統計和分析。
2 結果
2.1 實驗動物選擇
將選用的142篇實驗文獻中的全部實驗動物種類進行統計[6-22],共有7類實驗動物,累積頻率142次。實驗動物多選擇:SD大鼠,雌雄各半,體重以(200±20)g為主;KM小鼠,雌雄各半,以(20±2)g為主。便秘實驗動物種類、性別、體重分布情況詳情見表1。
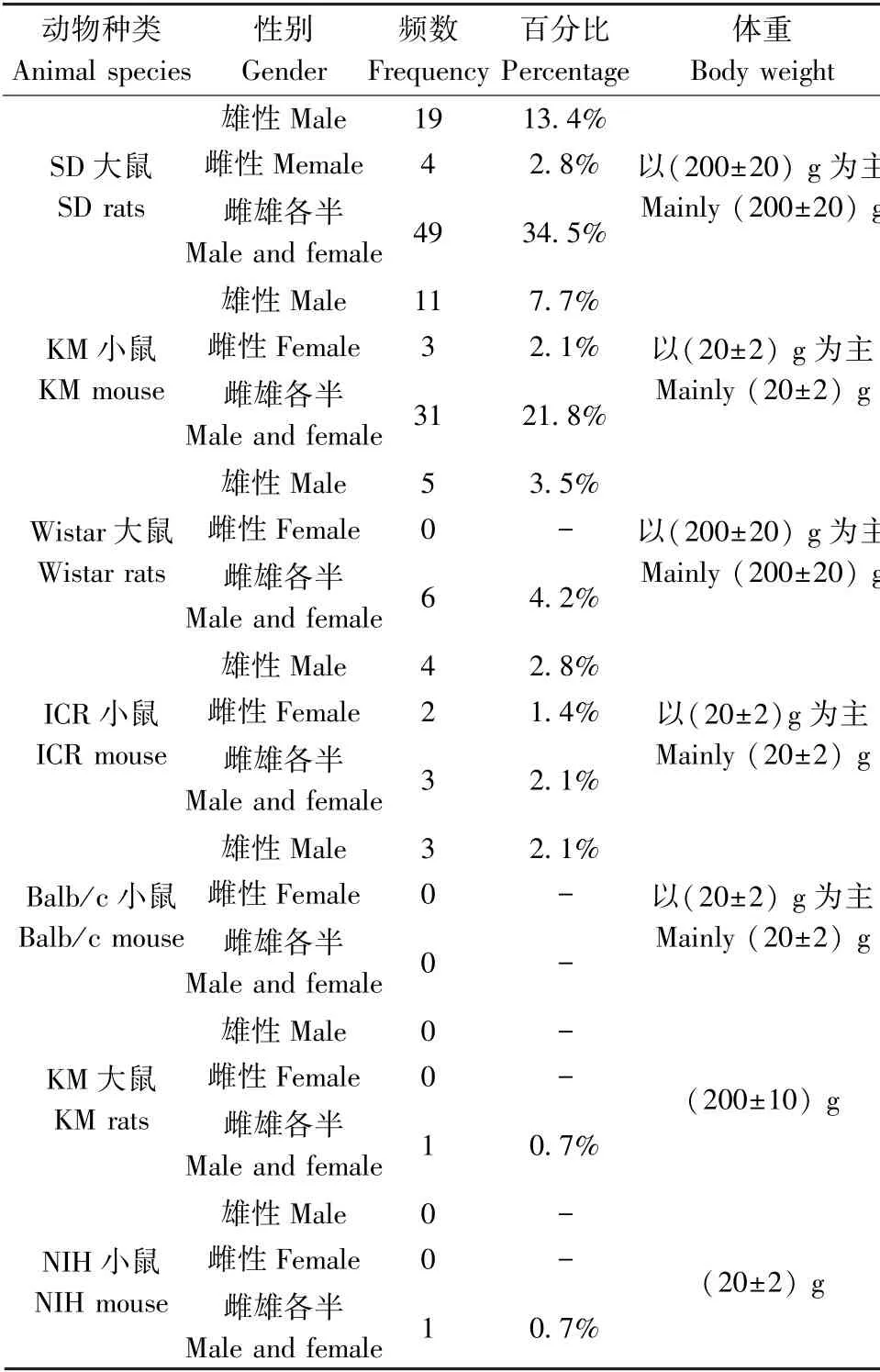
表1 便秘實驗動物種類分布Table 1 Types distribution of experimental animals for constipation
2.2 造模方式
將142篇實驗文獻所采用的造模給藥方式進行分類共包括了3種造模方式。以灌胃(128次,90.1%)為主。便秘造模方式分布見圖1。
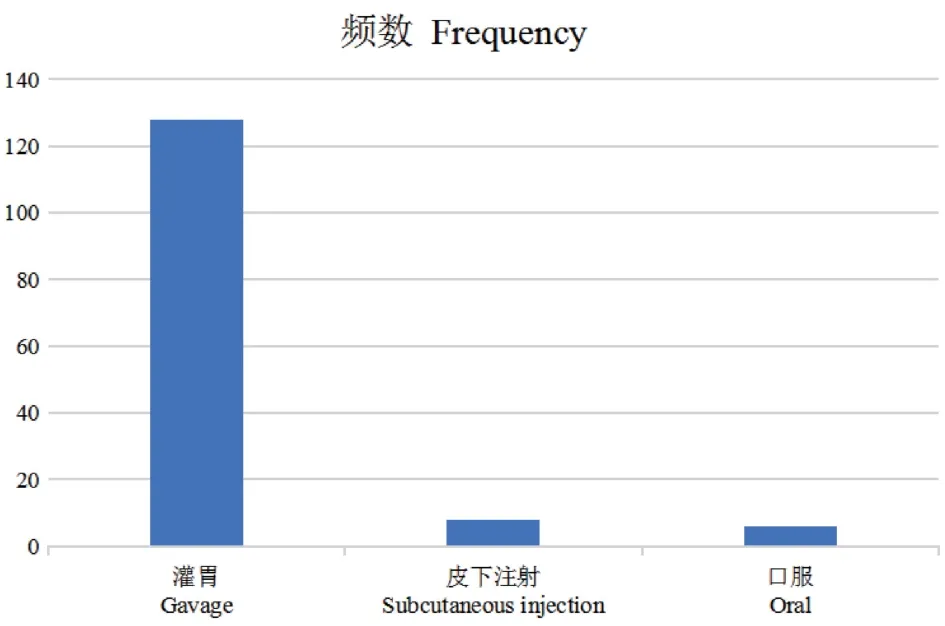
圖1 便秘造模方式分布Figure 1 Distribution of constipation models
2.3 造模方法
經分析,142篇便秘實驗文章共包括了12種造模方法。其中復方地芬諾酯法(57次,40.1%)和洛哌丁胺法(34次,24.0%)使用較多。便秘造模方法統計見表2。
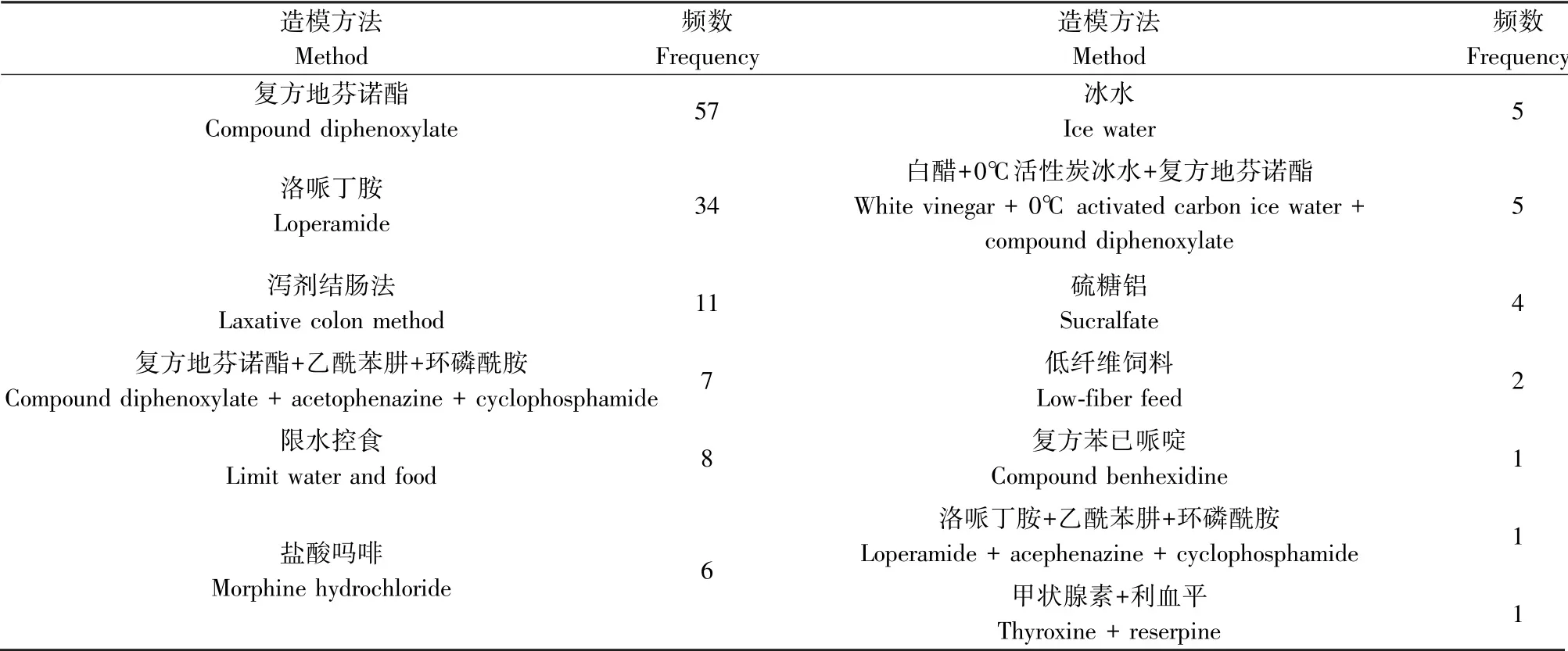
表2 便秘造模方法統計表Table 2 Statistical table of constipation modeling methods
2.4 陽性藥
統計得出,便秘動物實驗多選擇麻仁丸、麻仁軟膠囊和枸櫞酸莫沙必利片作為陽性對照藥物,其次為西沙比利片、琥珀酸普蘆卡必利片、常通舒顆粒、優樂多益生元和酚酞片等。
2.5 建模周期
統計結果顯示,便秘動物模型建模周期大多以7 d和14 d為主,慢傳輸型便秘時間最長為120 d,詳情見表3。
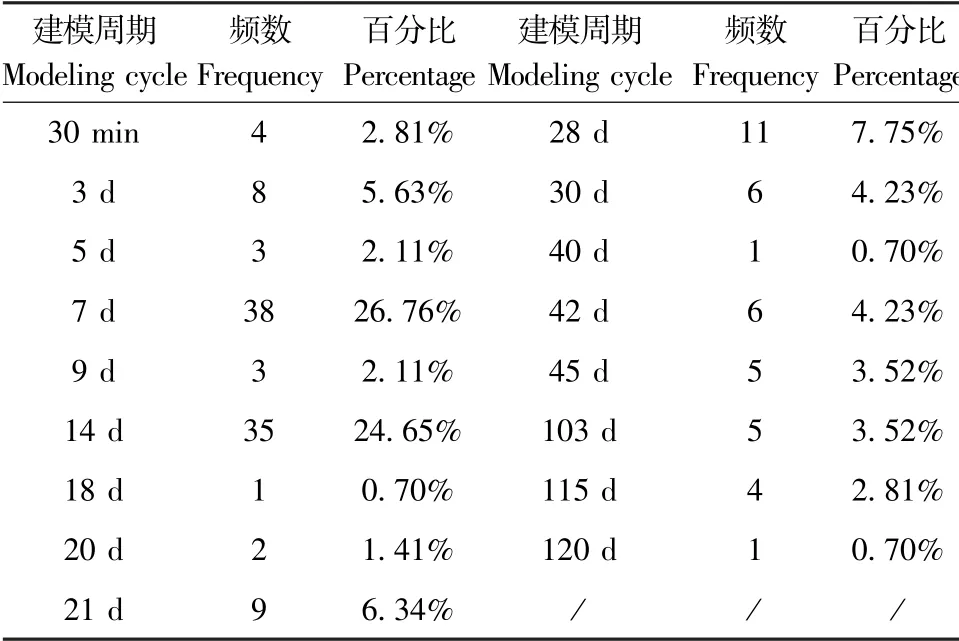
表3 便秘建模周期統計表Table 3 Statistical table of constipation modeling cycle
2.6 實驗相關指標
統計結果得出,便秘實驗相關指標可細分為15類,見表4。如果同一組織被劃分為不同的檢測指標,需分開統計,如同一實驗中結腸組織既要做病理又要做免疫組化;如果同一組織被同時檢測多個同類型指標,歸納為一類[6]。如血清中血清中P物質(SP)、血管活性腸肽(VIP)、腸神經遞質5羥色胺(5-HT)、NO等,則把這些指標統稱為血清指標,同一實驗只計入一次。
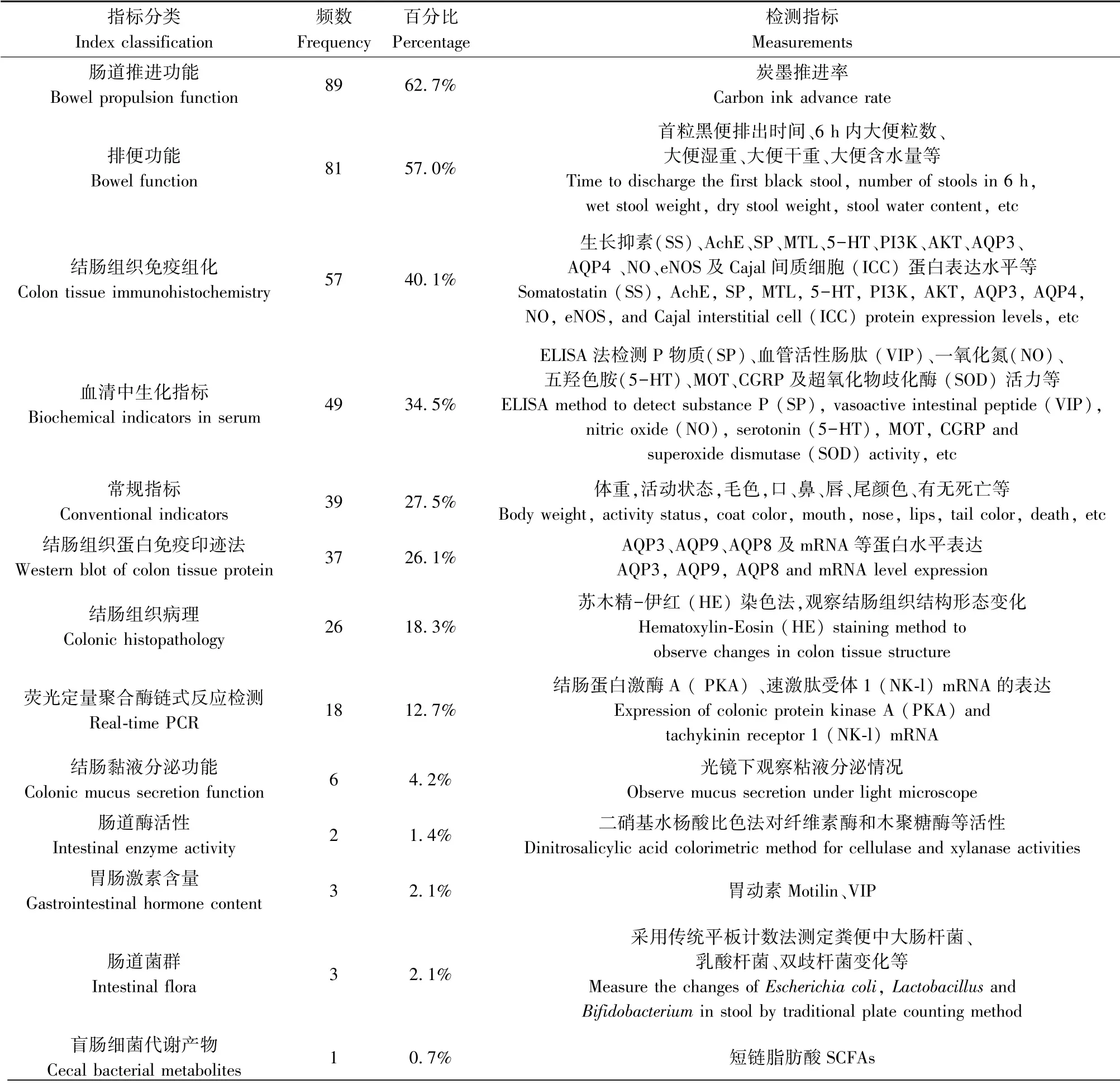
表4 便秘實驗檢測指標分類Table 4 Classification of constipation test indicators
3 討論
現代研究表明,長期服用瀉藥、不良的生活習慣、影響結直腸功能的疾病以及自身心理因素均可誘發便秘。便秘的發病機制與結腸動力異常、結腸平滑肌異常、腸神經系統(ENS)及腸神經遞質或胃腸激素異常、結腸Cajal間質細胞(ICC)功能異常、水通道蛋白(AQPs)表達異常等有關[23-27]。中醫學認為,便秘的發生,病位在大腸,且與肺、脾、胃、肝、腎關系密切[28]。《醫貫》指出:"大腸者,傳導之腑,以通為順",故大腸傳導功能失常,或熱,或氣郁,或氣血虧虛,或寒凝,均可導致大腸傳導失職,腸腑不通而成便秘[29]。
便秘發病率呈上升趨勢,單純的西藥治療方法包括潤滑劑、瀉藥、改善腸道動力藥物等,療效不理想[30];中醫臨床常采用內治法、外治法、針灸療法、按摩療法等來治療便秘,體現了中醫辨證論治的基本特點,效果顯著,不良反應小[31]。但尚未找到能夠根治的治療方法,仍需進一步增加動物實驗研究,為今后便秘發病機制、新藥篩選等方面提供更好的研究基礎。目前尚未有與人類完全相同的動物自發性便秘模型,仍需要人工加以復制,常用于建立便秘模型的動物為SD大鼠和KM小鼠,均具有易得、經濟的優點[32]。目前我國最常用于便秘研究的大鼠為SD大鼠,本文所統計得出結果也印證了這一說法。小鼠耐受力不及大鼠,不適宜長期造模給藥。小鼠多用于觀察排便試驗,大鼠多用于觀察腸道水吸收試驗,觀察胃腸運動則大、小鼠均可[33]。此外,經統計分析還發現在動物性別選擇上,大多實驗文章選擇雌雄各半分配動物,這樣可以減少僅用雌鼠分泌較多炎性因子對檢測指標造成誤差。
本文統計發現使用最多的造模方式為灌胃,在全部實驗文章的給藥方式中占比90.1%。目前有多種便秘模型制備方法,如可通過藥物誘導(復方地芬諾酯、洛哌丁胺、嗎啡、大黃等)、物理刺激(冰水灌胃、限水限食等)、手術、低纖維飲食等方法建立[34]。對其進行分析評價,均有其局限性,復方地芬諾酯法與臨床癥狀相似,操作簡單,有利于快速篩選具有潛在通便藥效的物質。是目前運用較多的制備方法之一,但給藥劑量多樣,無確切的量化標準,實驗前應做預實驗;洛哌丁胺法有助于探討抗便秘藥物的作用機制[35],同時洛哌丁胺可聯合(慢性失血、甲狀腺素、冰水刺激)復制血虛便秘、陰虛便秘、陽虛便秘大鼠模型,目前可用于開展虛癥便秘的基礎研究[36];復方苯已哌啶法可用于制備慢傳輸型便秘,但該法建模周期長,應用不多;限水控食法適用于功能性便秘的發生機制和通便藥物的治療作用研究[37],但建模周期長,穩定性差,由于長時間缺水,模型組可能會出現無便現象,治療組開始給藥時正常飲水,對模型組的影響還需進一步深究;瀉劑結腸法適用于臨床因長期服用瀉劑導致結腸型便秘機制的研究,造模時間長,且長期服用大黃可導致結腸神經系統病變[34];復方地芬諾酯+乙酰苯肼+環磷酰胺法可用于血虛型便秘的研究,與臨床中真實生理特征相符度低,過程復雜;食醋+活性炭冰水法制備的模型癥狀與臨床陽虛便秘證有一定的相似度,該模型穩定性較差,模型動物的排便時間和排便粒數受環境溫度的影響較大[38],應嚴格控制活性炭濃度及冰水溫度,且小鼠較大鼠耐受性差,此法常用大鼠作為建模對象;硫糖鋁法與嗎啡法可用于制備藥物依賴性模型;饑飽失常+過度疲勞+缺水燥結法可用于制備脾虛型便秘模型。便秘動物模型建模時間以7 d和14 d為主,通常慢傳輸型便秘模型建模時間較長,小鼠耐藥性較大鼠差,多選擇大鼠為建模對象。便秘動物模型的特征可以在炭墨推進率、排便功能、血清中生化指標和結腸組織免疫組化等指標中體現。經本文統計發現,142篇實驗文獻中所測得指標較多的為:(1)常規指標表現:毛發狀況、體重、攝食飲水量、尿量、排便次數等;(2)排便功能:6 h內糞便粒數、糞便重量、糞便含水率以及首次排便時間;(3)生化指標:腸神經遞質5-羥色胺(5-HT)、一氧化氮(NO)、腸內P物質(SP)、血管活性腸肽(VIP)、水通道蛋白3(AQP3)、水通道蛋白4(AQP4)、水通道蛋白8(AQP8)及其mRNA的含量、血清中AVP和cAMP的含量、腸道Cajal細胞陽性表達面積以及結腸c-kit mRNA陽性表達率等,這些指標通過免疫組化、蛋白免疫印跡法及病理學觀察測定[39-41],可以有效評價便秘的程度。
綜上所述,在復制便秘動物模型時常選擇雌雄各半的SD大鼠和KM小鼠,采用復方地芬諾酯或洛哌丁胺灌胃法來造模,現有的動物模型常以藥物誘導法單因素建模,缺乏多因素建模評價體系,如限水控食法和低纖維飲食法雖較符合真實便秘的致病因素,但目前相關研究較少,便秘模型研究多傾向于腸道排便功能、結腸組織病理結構和血清中生化指標等來評價受試藥物。便秘的發病機制仍需進一步探尋,有研究學者提出“腦-腸軸”與便秘密切相關,即大腦可通過腦-腸軸將信號沖動下傳來調控胃腸道功能,胃腸道功能異常也會影響大腦功能[42],其中腦腸肽對胃腸運動起著關鍵作用,如便秘動物模型常檢測的指標VIP、P物質、5-HT、生長抑素、NO、胃動素等腦腸肽,既存在于胃腸道也存在于腦組織中,享有神經遞質和神經激素雙重身份,是腦-腸軸雙向調節的媒介[43],研究表明,便秘患者腸道菌群紊亂,腸道菌群的變化,可促使微生物代謝產物發生改變,進而改變腸道運動,誘發便秘[44],但在現有的動物模型檢測指標中對腸道菌群的檢測占比較少,且目前腦-腸相互作用機制尚不明確,可在今后便秘動物實驗中繼續完善指標,增加相關機制研究。

