Kummell病行椎體強化術后發生骨水泥滲漏的危險因素
潘 丹,黃慶華,歐陽驍杰,陳大勇
Kummell病起始為經歷了微小創傷,其后的數周乃至數月無明顯癥狀,隨后出現臨床癥狀并進一步加重發生后凸畸形,甚至伴神經癥狀。經皮椎體成形術(PVP)和經皮椎體后凸成形術(PKP)是治療Kummell病的常用術式,但容易發生骨水泥滲漏等并發癥[1-2]。目前臨床上對骨質疏松性椎體骨折患者術后發生骨水泥滲漏的危險因素研究較多[3],但對Kummell病患者術后發生骨水泥滲漏的危險因素研究非常少。本研究分析2010年1月~2020年1月在我科采用PVP 或PKP 治療的172例Kummell病患者資料,對術后發生骨水泥滲漏的危險因素進行logistic回歸分析,報道如下。
1 材料與方法
1.1 病例選擇納入標準:① 骨密度T值<-2.5 SD,MRI檢查顯示抑脂像存在椎體裂隙征或真空征,病理結果提示骨組織壞死;② Kummell病Ⅰ、Ⅱ期;③ 非手術治療無效行PVP或PKP。排除標準:① 脊柱感染、結核、腫瘤、代謝性疾病等引起的骨折;② 既往有非椎體強化類脊柱手術史;③ 合并脊髓及神經壓迫癥狀;④ 合并有嚴重的心、肝、腎功能不全。
1.2 病例資料本研究共納入172例,男26例,女146例,年齡62~92(76.11±7.86)歲;采用PVP治療 71例,PKP治療101例;單側椎弓根入路105例,雙側椎弓根入路67例。手術均由同一組醫師共同操作完成。根據術后是否發生骨水泥滲漏分為滲漏組(n=45)和非滲漏組(n=127)。收集患者以下資料:性別、年齡、Kummell病分期、病變節段、骨密度、手術次數、手術方式、手術入路、骨水泥注入量、病變椎體終板及后壁的完整性。
1.3 治療方法2%利多卡因局部浸潤麻醉。患者俯臥位,腹部懸空。C臂機透視下定位病變椎體,單側穿刺者經一側椎弓根穿刺建立工作通道,雙側穿刺者由2位術者同時經兩側椎弓根穿刺建立工作通道。依據椎體壓縮情況及復位效果酌情選擇PVP或PKP。術后給予鈣劑、骨化三醇、雙磷酸鹽等藥物抗骨質疏松治療。術后24 h患者可下地活動。
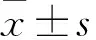
2 結果
2.1 兩組發生骨水泥滲漏危險的單因素分析見表1。Kummell病分期、手術方式、骨水泥注入量、病變椎體終板及后壁完整性兩組比較差異均有統計學意義(P<0.05),提示這些因素是骨水泥滲漏的危險因素;性別、年齡、病變節段、骨密度、手術次數和手術入路兩組比較差異均無統計學意義(P>0.05),提示這些因素與骨水泥的滲漏無相關性。

表1 兩組發生骨水泥滲漏危險的單因素分析
2.2 多因素logistic回歸分析見表2。篩選危險因素中有統計學意義的數據進行多因素logistic回歸分析,結果顯示:Kummell病Ⅱ期、PVP手術方式、骨水泥注入量、病變椎體終板及后壁不完整是骨水泥滲漏的獨立危險因素(P<0.05)。

表2 多因素logistic回歸分析
2.3 兩組典型病例見圖1~8。

圖1 患者,女,62歲,Kummell病Ⅰ期,行初次雙側PVP,術中灌注骨水泥8.0 ml,術后發生骨水泥滲漏 A、B.術前X線片及MRI,顯示L1椎體壓縮性骨折,T2像表現為椎體前柱內高信號區,且與周圍椎體信號界限清晰;C.術后1 d X線片,顯示骨水泥向上方椎間隙及椎體前方滲漏 圖2 患者,女,80歲,Kummell病Ⅰ期,行初次雙側PKP,術中灌注骨水泥7.5 ml,術后發生骨水泥滲漏 A、B.術前X線片及MRI,顯示L1椎體壓縮性骨折,抑脂像表現為椎體前柱內高信號區,且與周圍椎體信號界限清晰;C.術后1 d X線片,顯示骨水泥向椎體后方滲漏 圖3 患者,女,68歲,Kummell病Ⅰ期,行初次雙側PVP,術中灌注骨水泥4.0 ml,術后發生骨水泥滲漏 A、B.術前X線片及MRI,顯示T9椎體壓縮性骨折,T2像表現為椎體內低信號區,與周圍椎體信號界限清晰;C.術后1 d X線片,顯示骨水泥向上方椎間隙滲漏 圖4 患者,女,80歲,Kummell病Ⅰ期,行初次雙側PVP,術中灌注骨水泥7.0 ml,術后發生骨水泥滲漏 A、B.術前X線片及MRI,顯示L2椎體壓縮性骨折,抑脂像表現為椎體內低信號區,與周圍椎體信號界限清晰;C.術后1 d X線片,顯示骨水泥向椎體后方及側方滲漏
3 討論
3.1 Kummell病的分期和治療雖然Kummell病發病率較低,但非手術治療效果不佳,骨折很難自愈,學者們[4]建議采用手術治療。根據MRI表現可將Kummell病分為3期:Ⅰ期——椎體壓縮<20%,伴有或不伴有鄰近椎間盤退變;Ⅱ期——椎體壓縮≥20%,伴有鄰近椎間盤退變;Ⅲ期——伴有脊髓神經壓迫癥狀。Kummell病Ⅲ期合并嚴重后凸畸形和神經癥狀應首選開放手術治療;Kummell病Ⅰ期和Ⅱ期患者一般無神經癥狀,手術主要目標是消除骨折椎體微動,重建脊柱穩定性,首選PVP或PKP等微創手術治療,可獲得滿意的臨床療效,但骨水泥滲漏是常見并發癥,其發生率為22%~82%[5-6]。
3.2 骨水泥滲漏發生率的危險因素分析① 病變分期。Kummell病是一種特殊類型的骨折,病變椎體內由裂隙、上下的硬化面和前方的前縱韌帶形成了一個封閉的空間,Nieuwenhuijse et al[7]認為,真空裂隙征是聚甲基丙烯酸甲酯骨水泥滲漏的不利因素,骨水泥滲漏由真空裂隙征、病變分期以及骨水泥的注射速度、注入量、注射壓力決定。壓縮嚴重的骨折椎體形變程度大,注入骨水泥過程中椎體中心壓力過大,導致骨小梁重新分布,產生骨小梁分布相對稀疏的薄弱區,即可能出現滲漏[8]。本研究中,滲漏組中Kummell病Ⅱ期占比明顯高于非滲漏組。因此,術者應在術前仔細閱讀影像學資料,對于壓縮嚴重的骨折應謹慎操作。② 手術方式。相關文獻[9]報道,在降低骨水泥滲漏發生率方面,PKP比PVP更有優勢。PKP術中需通過球囊擴張來恢復病變椎體高度,擴張后椎體內部形成了空腔,與 PVP 相比,減小了骨水泥注入時的壓力。本研究中,PKP術后骨水泥滲漏發生率為16.83%(17/101),明顯低于PVP的39.44%(28/71),考慮原因可能是PKP術中球囊擴張壓實了椎體裂隙內的松質骨,使骨水泥在低壓狀態下注入,降低了滲漏率。③ 骨水泥注入量。椎體強化術的最佳骨水泥注入量尚存在爭議。Molly et al(2003年)的臨床結果表明,一般恢復傷椎的骨剛度,胸椎節段僅需要2 ml骨水泥,胸腰段、腰椎節段則分別需要4、8 ml的骨水泥;恢復椎體強度所需的骨水泥量約4 ml。Kim et al[10]報道顯示,骨水泥注入量達椎體體積30%時可恢復椎體剛度。對于Kummell病患者,學者們[11]建議將骨水泥填滿整個真空裂隙,但因骨水泥注入量與滲漏的發生呈正相關,即隨著骨水泥注入量的增加,骨水泥滲漏的風險也相應增加。本研究顯示,骨水泥注入量是骨水泥發生滲漏的獨立危險因素。因此,為降低骨水泥的滲漏發生率,術前應規劃目標注入量,且術中無需刻意要求骨水泥的注入量,應當以安全為原則,到達目標量或者骨水泥填充滿整個真空裂隙時即可停止灌注。④ 病變椎體終極及后壁完整性。本研究中,終板不完整的椎體滲漏率為43.66%(31/71),后壁不完整的椎體滲漏率為42.25%(30/71),多因素分析結果表明病變椎體終版和后壁不完整是骨水泥發生滲漏的危險因素。分析原因可能是骨皮質缺損與骨折線相連接,導致骨水泥注入過程中沿著骨折線彌散,最終彌散至椎體外圍甚至椎管內[2]。應用溫度梯度骨水泥灌注技術[12]或者采用骨填充網袋[13]均可有效降低骨水泥滲漏發生率。

圖5 患者,女,73歲,Kummell病Ⅱ期,行初次單側PKP,術中灌注骨水泥4.0 ml,骨水泥無滲漏 A、B.術前X線片及MRI,顯示T12椎體壓縮性骨折,椎體裂隙征明顯,抑脂像表現為椎體內高信號區,且與周圍椎體信號界限清晰;C.術后1 d X線片,顯示T12椎體骨折明顯復位,骨水泥彌散在椎體液化空洞區,呈團塊狀分布,骨水泥無滲漏 圖6 患者,男,79歲,Kummell病Ⅰ期,行初次單側PKP,術中灌注骨水泥4.5 ml,骨水泥無滲漏 A、B.術前X線片及MRI,顯示L1椎體壓縮性骨折,抑脂像表現為椎體內低信號區,且與周圍椎體信號界限清晰;C.術后1 d X線片,顯示L1椎體骨折明顯復位,骨水泥彌散過中線,骨水泥無滲漏 圖7 患者,女,79歲,Kummell病Ⅰ期,行初次單側PVP,術中灌注骨水泥6.0 ml,骨水泥無滲漏 A、B.術前X線片及MRI,顯示L1椎體陳舊壓縮性骨折,抑脂像表現為L2椎體內高信號區,且與周圍椎體信號界限清晰;C.術后1 d X線片,顯示L1椎體骨水泥彌散滿意,骨水泥無滲漏 圖8 患者,女,76歲,Kummell病Ⅱ期,行再次雙側PKP,術中灌注骨水泥4.5 ml,骨水泥無滲漏 A、B.術前X線片及MRI,顯示T12椎體成形骨水泥強化術后改變,骨水泥彌散滿意,無滲漏,T11椎體壓縮性骨折,T11椎體前柱內高信號區,且與周圍椎體信號界限清晰;C.術后1 d X線片,顯示T11椎體骨水泥位置滿意,骨水泥無滲漏
綜上所述,Kummell病Ⅱ期、PVP手術方式、骨水泥注入量、病變椎體終板及后壁不完整是Kummell病患者行椎體強化術后發生骨水泥滲漏的獨立危險因素。本研究的不足:為單中心回顧性研究,病例數有限,篩選的因素也不多,仍需要長期的、多中心、大樣本研究來進一步分析Kummell病椎體強化術后發生骨水泥滲漏的危險因素。

