紫蘇組織培養的研究
楊紅媛,張厚德,朱煜景,遲昕宜,牛銳利,譚冰,宗憲春
(牡丹江師范學院生命科學與技術學院,黑龍江 牡丹江 157011)
紫蘇(PerillafrutesceusL.Britt)為唇形科(Labiatae)一年生草本植物,具特異芳香,是我國傳統的藥食、油料作物,也是衛生部第一批規定的既是藥品又是食品的60種作物之一,是一種極具開發利用的天然產物。目前有關紫蘇組織培養及快繁技術雖然取得了一些進展,但如何建立起一套完善的高頻的紫蘇離體快繁體系研究的還不夠深入。本研究以紫蘇為材料,通過對其子葉、下胚軸、幼嫩葉片最佳外植體的篩選、愈傷組織誘導、不定芽分化及生根培養,建立紫蘇的離體培養再生體系,為紫蘇種質資源保存及快速繁殖提供理論依據和技術支撐。
1 材料與方法
1.1 實驗材料
本文使用的紫蘇種子購買于牡丹江花鳥魚市場,產于哈爾濱金龍農業有限公司。所使用的激素:6-BA(6-benzylaminopurine,6-芐基嘌呤)、NAA(1-naphthyla-cetic acid,萘乙酸),IAA(Indolyl-3-acetic acid,吲哚乙酸)均為北京拜爾迪生物技術有限公司產品。
1.2 實驗方法
1.2.1 不同消毒時間處理對紫蘇種子萌發的影響。將紫蘇種子在清水中浸泡6 h,然后放入0.1%的升汞中分別消毒4、6、8、10、12 min;然后將種子取出,用無菌水沖洗5次,再將種子播種在裝有事先配制好的MS培養基的培養瓶中。整個過程均在無菌超凈工作臺進行。培養15 d后觀察并統計種子的污染率和發芽率。篩選消毒的最佳時間。
1.2.2 培養基種類不同對紫蘇種子萌發的影響。用0.1%的升汞對紫蘇種子消毒8 min,無菌水沖洗5次后將種子分別播種到盛有MS和1/2MS培養基中進行培養,15 d后觀察并計算種子的發芽率。篩選適合種子生長的最佳培養基。
1.2.3 愈傷組織誘導。下胚軸長約4 cm、子葉展開時,將下胚軸切成1.0 cm的小段,將子葉切成0.5 cm×0.5 cm的小塊。將無菌苗的幼葉也切成0.5 cm×0.5 cm的小塊,然后接種在6-BA(1.0、2.0、3.0 mg/L)和NAA(0.1、0.2、0.3 mg/L)不同配比的MS誘導培養基中,見表2-1。每種培養基接20個外植體,每處理重復3次。3 d后觀察外植體的變化和愈傷組織的生長狀況。35 d后計算愈傷組織的誘導率。
1.2.4 愈傷組織的分化培養。將子葉和葉片形成的愈傷組織轉接至6-BA(1.0、2.0、3.0 mg/L)和NAA(0.1、0.2、0.3 mg/L)不同配比的MS誘導培養基中,具體見表1。每種培養基分別接種20個愈傷組織,重復相同處理程序,共3次。成長35 d后觀察培養基,比較來自不同外植體(子葉,葉片)的愈傷組織分化情況,并計算不同外植體的愈傷組織的分化率。
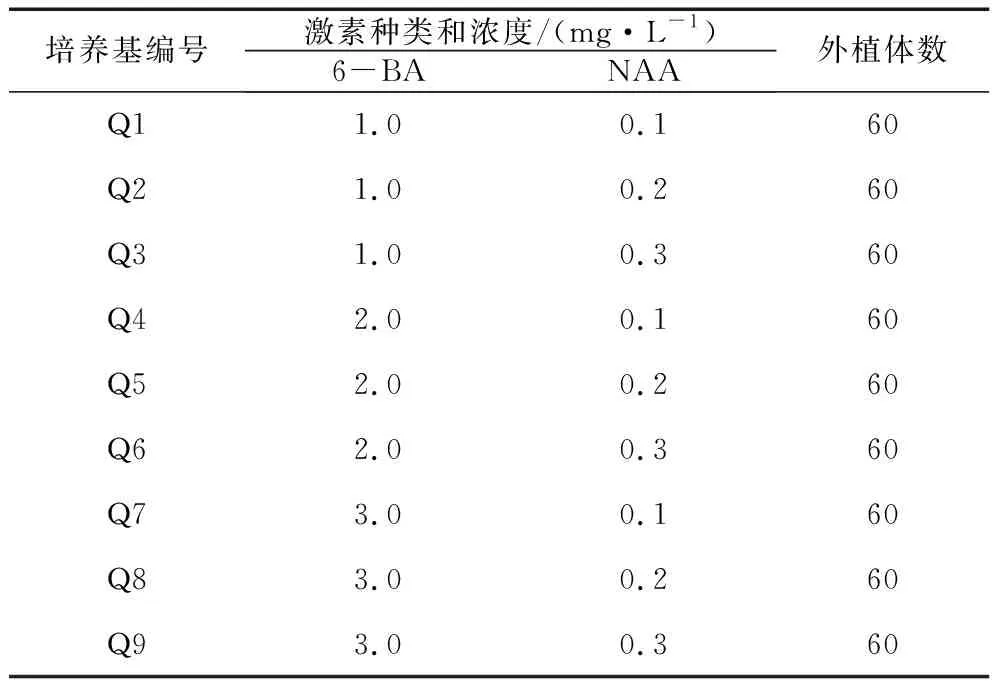
表1 愈傷組織誘導和分化培養基的激素組成
1.2.5 試管苗的生根。當不定芽長至約2~3 cm高時,轉到附加不同激素IAA(0.1、0.2、0.3 mg/L)、NAA(0、0.1、0.2、0.3 mg/L)的1/2MS生根培養基中進行誘導生根,20 d后統計根的生長情況并計算生根率。
1.3 培養條件
本試驗以MS為基本培養,添加相同種類的植物激素,控制唯一變量為激素濃度。其它附加物為30 g/L的蔗糖,6 g/L的瓊脂。用1 mol/LNaOH溶液或1 mol/LHCl調節pH至5.8左右。培養條件:(25±2)℃,光照強度1600 Lx,光照時間12 h/d。
1.4 數據處理
萌發率=(萌發的種子數/接種的種子數)×100%。
污染率=(接種污染數/接種總數)×100%。
出愈率=(有愈傷組織形成的外植體數/接種外植體數)×100%。
分化率=(有芽形成的外植體數/接種的愈傷組織數)×100%。
生根率=(有根形成的芽數/接種芽數)×100%。
測試結果的基本數據由Excel處理,使用Spss統計軟件對測試數據進行分析。
2 結果與分析
2.1 不同消毒時間處理對紫蘇種子萌發的影響
不同消毒時間對紫蘇種子萌發的影響見表2。從數據統計結果不難發現,種子的消毒時間不同,后期的萌發率亦不同。用0.1%升汞消毒總時長為4 min時萌發率為76%,污染率為30%;消毒總時長為6 min時種子的萌發率為88%,污染率為11%、消毒總時長達到8 min時萌發率最好,為94%,污染率最低,為6%;然而當升汞消毒時間大于8 min時,種子萌發率開始降低。污染率又逐漸升高。因此,本試驗無菌接種時采用0.1%升汞消毒8 min。
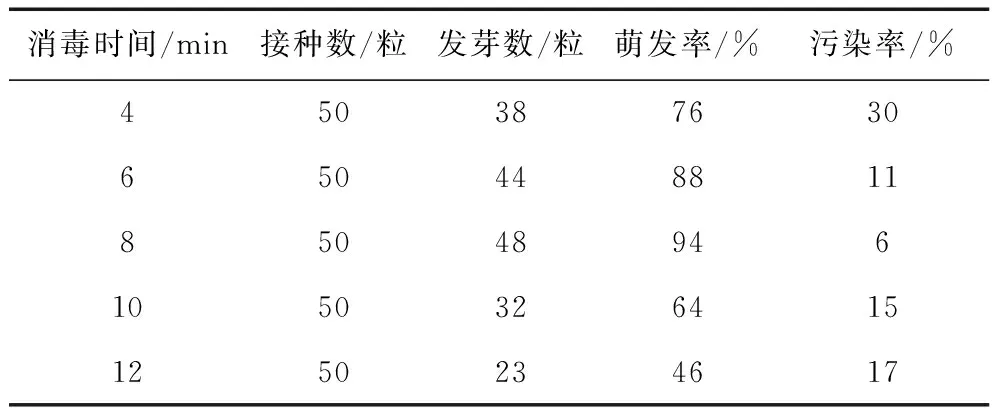
表2 不同消毒時間對紫蘇種子萌發的影響
2.2 不同培養基對紫蘇種子萌發的影響
紫蘇種子經8 min消毒后接種在MS和1/2MS培養基中,兩種培養基對種子萌發的影響見表3。由此表可知,種子在兩種培養基中的萌發率差異不大,也就是說在不同培養基中的萌發率基本相同,但在1/2MS培養基中的芽纖細,故本試驗所采用的外植體均來自MS培養基上培養的無菌苗。
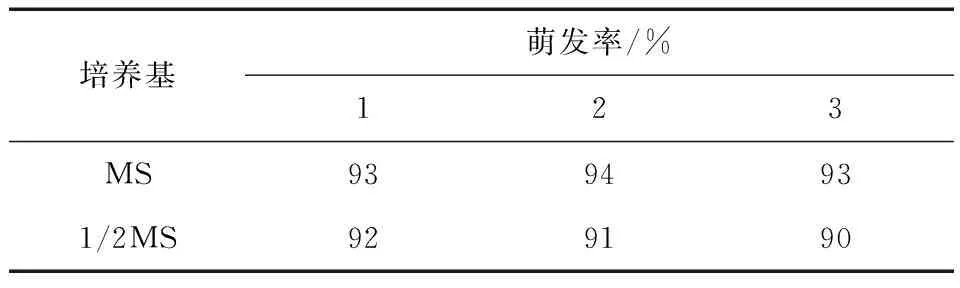
表3 不同培養基對紫蘇種子萌發的影響
2.3 不同培養基對紫蘇不同外植體愈傷組織誘導的影響
2.3.1 不同培養基對葉片愈傷組織誘導的影響。將紫蘇葉片剪成0.5 cm×0.5 cm小塊后接入到Q1-Q9培養基中,葉片在不同的培養基中培養,3 d后觀察發現葉片向背面卷曲,10 d左右,從葉片邊緣漸漸出現愈傷組織,顏色呈現綠色或淺綠色。從表4可以發現,葉片在不同培養基中培養,其愈傷組織生長狀況和誘導率有所不同。在培養基Q9即6-BA3.0 mg/L+NAA 0.3 mg/L培養基時,其愈傷組織生長旺盛、誘導率最高,為97.5%;在Q1培養基即6-BA1.0 mg/L+ NAA0.1 mg/L培養基上愈傷組織生長一般、誘導率相對較低,只有45%。因此,從愈傷組織誘導率和生長狀況來看,誘導紫蘇葉片愈傷組織最佳培養基為MS+6-BA3.0 mg/L+NAA0.3 mg/L,愈傷組織誘導率最高,為97.5%。
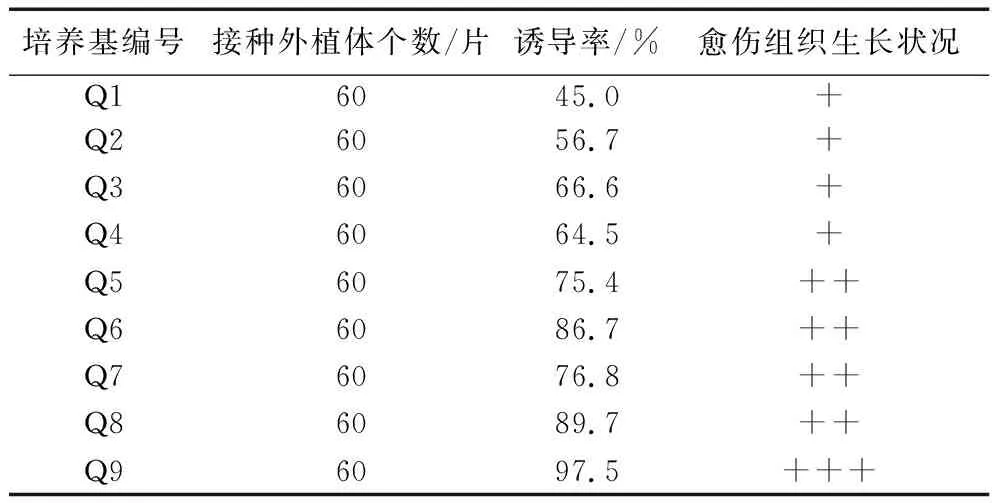
表4 不同培養基對葉片愈傷組織誘導的影響
2.3.2 不同培養基對下胚軸愈傷組織誘導的影響。將紫蘇的下胚軸切成1.0 cm的小段后接入到Q1-Q9培養基中進行培養。培養5 d后,下胚軸兩端略微膨大,顏色變淺,10 d后部分外植體開始形成愈傷組織。培養28 d后觀察發現,(見表5)。由表5可知,不同培養基其愈傷組織的誘導率和生長狀況不同。接種于Q8培養基時,即6-BA3.0 mg/L+NAA 0.2 mg/L培養基時,外植體下胚軸的愈傷組織生長較旺盛、誘導率相對較高為83.3%,因此確定下胚軸誘導愈傷組織的最佳培養基為Q8,即MS+ 6-BA3.0 mg/L + NAA0.2 mg/L。
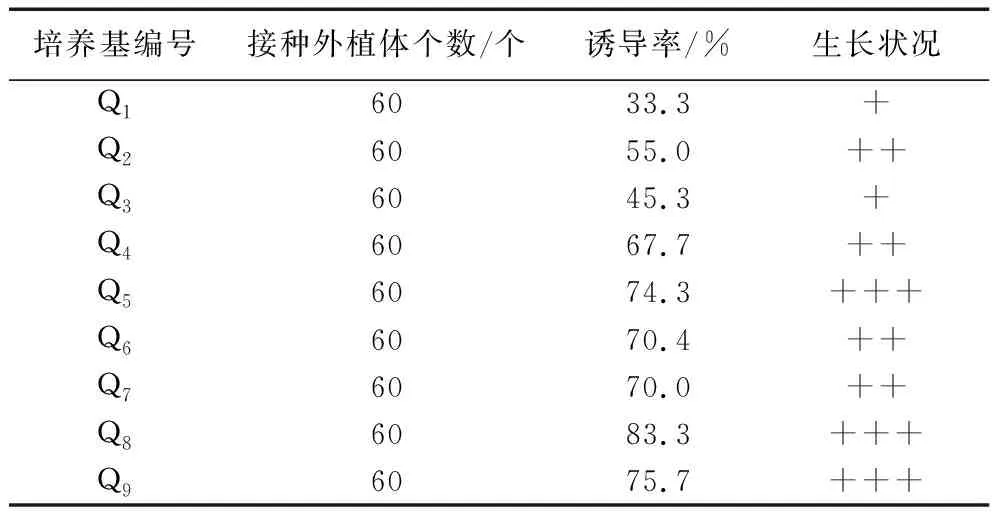
表5 不同培養基對下胚軸愈傷組織誘導的影響
2.3.3 不同培養基對子葉愈傷組織誘導的影響。將紫蘇子葉剪成0.5 cm×0.5 cm小塊后接入到Q1-Q9培養基中進行培養,6 d后子葉膨大,10 d后其邊緣形成少量愈傷組織。培養35 d觀察,不同培養基對子葉愈傷組織誘導率和生長狀況影響見表6。由此表可知,子葉愈傷組織誘導最佳培養基為Q9,即MS+ 6-BA 3.0 mg/L + NAA 0.3 mg/L,愈傷組織誘導率最高,為91.7%。
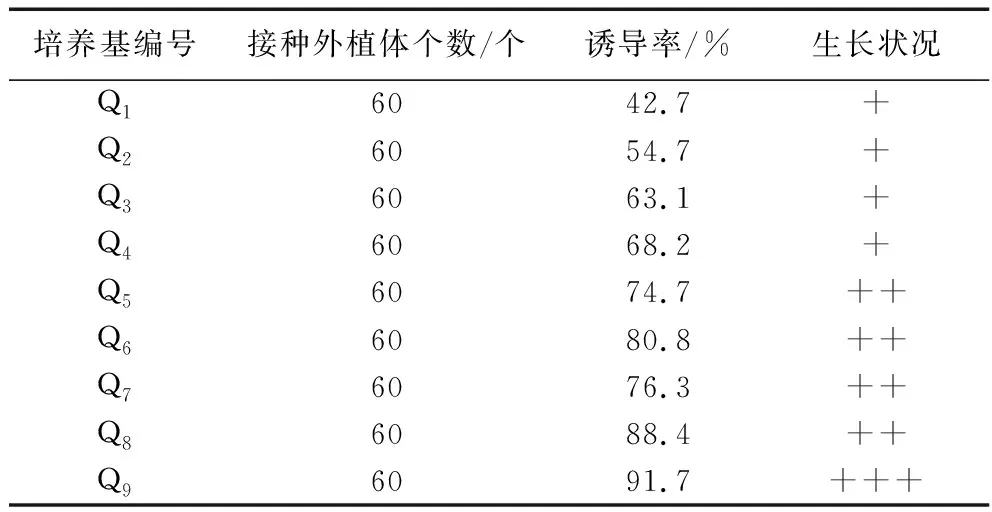
表6 不同培養基對子葉愈傷組織誘導的影響
2.3.4 細胞分裂素6-BA和生長素NAA對愈傷組織誘導的影響。在不同濃度6-BA和NAA配比的培養基上,大部分外植體都有所生長,培養6 d時,外植體與培養基接觸部位開始膨大或彎曲,下胚軸兩端顏色變淺。10 d時,子葉、下胚軸和幼嫩葉片均有愈傷組織出現,35 d左右,不同濃度6-BA和NAA處理的外植體,在出愈率、生長狀況已表現出明顯的差異(見圖1)。從出愈時間看,下胚軸出愈傷組織時間略早,但從誘導率及愈傷組織的生長狀況看,幼嫩葉片愈傷組織的誘導率高于子葉和下胚軸。當6-BA濃度分別為 1.0、2.0、3.0 mg/L 時,可以發現,三種外植體的愈傷組織誘導率隨著NAA濃度的增加呈現上升趨勢。當NAA濃度分別為0.1、0.2、0.3 mg/L 時,三種外植體的愈傷組織誘導率隨著6-BA濃度的增加呈現上升趨勢。在同一培養基(6-BA和NAA的配比相同)中培養三種不同的外植體,愈傷組織誘導率表現為葉片>子葉>下胚軸;當6-BA濃度為3.0 mg/L時,NAA濃度為0.3 mg/L 時表現更為明顯。
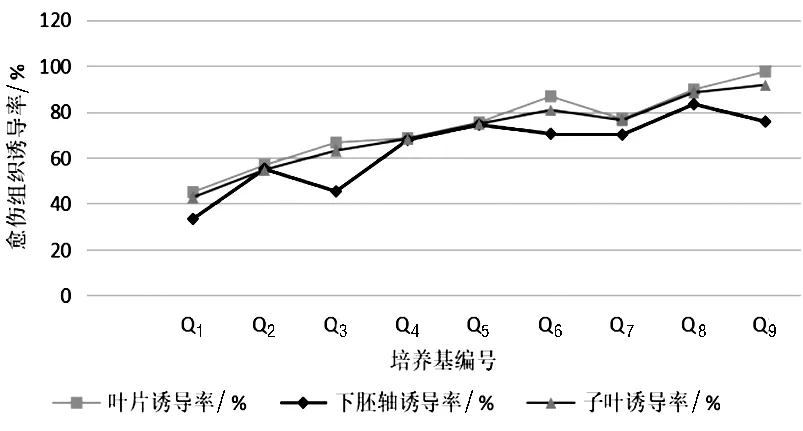
圖1 細胞分裂素及生長素對愈傷組織誘導的影響
綜合考慮,進行紫蘇組織培養時,外植體選取其子葉和葉片較為適合。因其具有較高的誘導率。適宜的培養基為:6-BA3.0 mg/L+ NAA0.3 mg/L,誘導率葉片為97.5%,子葉為91.7%。
2.4 不同培養基對紫蘇愈傷組織分化的影響
將紫蘇子葉和幼嫩葉片誘導出的愈傷組織接入到原培養基相對應的Q1-Q9培養基中培養。25 d后,兩種不同外植體愈傷組織分化情況見表7。從表中分化率可以看出:不同的培養基,其愈傷組織的分化率也不同。在同一水平細胞分裂素6-BA(1 mg/L、2 mg/L或3 mg/L)的作用下,葉片和子葉形成的愈傷組織的分化率隨著NAA濃度增加呈現逐漸上升的趨勢,形成生長健壯的不定芽;當NAA濃度一定時,隨著6-BA濃度增加,愈傷組織的分化率逐漸上升。6-BA濃度為3 mg/L,NAA濃度為0.3 mg/L時,此時分化率達到峰值,分化出的不定芽生長健壯,葉片分化率為68.11%,子葉分化率為58.57%,均維持在較高水平,而葉片的分化率要優于子葉。因此應選擇高濃度的6-BA(3 mg/L)和較高濃度的生長素NAA(0.2 mg/L)組合進行愈傷組織的分化培養。紫蘇葉片和子葉愈傷組織分化的最佳培養基是Q8。即MS+6-BA3 mg/L+NAA 0.2 mg/L為篩選紫蘇愈傷組織分化的最佳培養基。
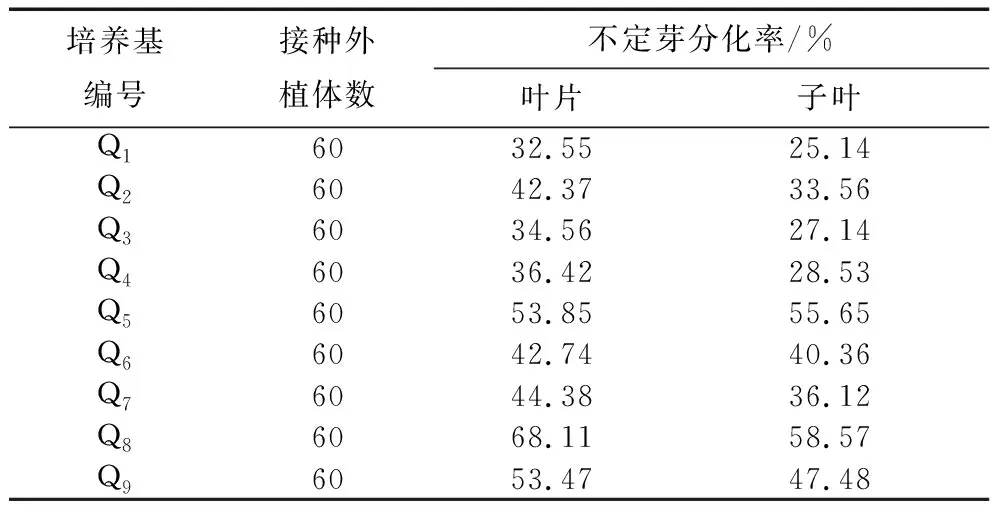
表7 不同培養基對子葉和葉片愈傷組織分化的影響
2.5 生根培養基的篩選
將生長狀況良好株高2~3 cm的不定芽,接至R1-R7的生根培養基中進行生根培養。從表8可知:不含生長素的1/2 MS培養基生根率較低,生長素NAA對于紫蘇不定芽的生根效果高于IBA。當NAA的濃度為0.1 mg/L時,所有不定芽都能成功生根。且根系發達,主根明顯。因此,R2培養基即MS+NAA0.1 mg/L為最佳生根培養基。
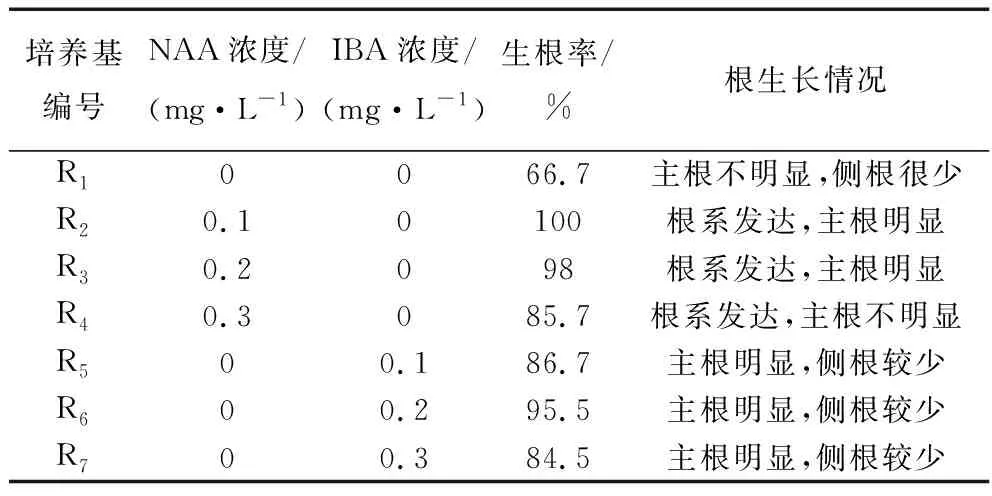
表8 不同培養基對生根的影響
3 結論
通過對紫蘇子葉、下胚軸、幼嫩葉片最佳外植體的篩選、愈傷組織誘導、不定芽分化及生根培養,建立了紫蘇的離體培養再生體系。紫蘇種子萌發最佳培養基為MS培養基;最佳消毒方法為0.1% 升汞消毒8 min。此時種子萌發率最高達96 %。離體培養最佳外植體為葉片。紫蘇葉片和子葉誘導愈傷組織的最佳培養基為MS+ 6-BA3.0 mg/L+NAA0.3 mg/L,誘導率分別為97.5%和91.7%;愈傷組織分化的最佳培養基為MS+6-BA 3.0 mg/L+NAA 0.2 mg/L,葉片優于子葉。最佳生根培養基為1/2MS+NAA0.1 mg/L,生根率為100%。

