不同抗鹽性蘋果砧木對鹽脅迫的生理響應
張 德,張 瑞,張夏燚,吳玉霞,趙 婷,張仲興,王雙成,王延秀
(甘肅農業大學園藝學院,甘肅 蘭州 730070)
土壤鹽漬化是世界范圍的資源和生態問題,嚴重威脅農作物的生長[1]。中國西北黃土高原為蘋果栽培的優勢產區,但由于土壤鹽漬化以及持續應用化肥導致次生鹽漬化嚴重,限制了該區域蘋果產業的發展[2]。垂絲海棠(MalushallianaKoehne)原產于甘肅河西走廊干旱、鹽堿生境,是一種耐鹽堿的蘋果砧木資源。本項目組基于對不同生境垂絲海棠的耐鹽性比較試驗,獲得高抗鹽堿系‘9-1-6’[3-4],但其高抗鹽機理仍不明確。山定子(MalusbaccataBorkh)原產于東北,是蘋果生產上常用的砧木,耐寒、耐旱,但不耐鹽堿[5]。
圍繞農作物、蔬菜或耐鹽模式植物的鹽脅迫生理研究已有報道[6],且一致認為鹽脅迫下植物通常受到滲透脅迫、離子脅迫和氧化損傷3種危害,從而導致膜透性改變、生理代謝紊亂和有毒物質積累,引起植物生長發育和形態建成改變[7-8]。研究表明,鹽脅迫破壞包括光合系統、葉綠素熒光、滲透調節物質和抗氧化防御機制等生理過程[9]。Flexas等[10]研究認為氣孔關閉是鹽脅迫下降低CO2同化能力并導致光合效率下降的主要因素。孫璐等[11]在高粱的研究中得出,鹽脅迫破壞了光系統Ⅱ反應中心,使PSⅡ原初光能轉換效率受到抑制,需要啟動熱耗散機制保護光合系統。長期逆境條件下,植物自身會合成大量滲透調節物質和一些抗氧化酶來提高植物的抗逆性[12]。馬鈴薯中CAT、POD和SOD等抗氧化酶活性的提高增強了其抵御鹽脅迫的能力[13]。NaCl脅迫下,蘋果屬植物八棱海棠、湖北海棠和山荊子的葉片游離脯氨酸含量增加[14],王佺珍等[15]研究表明脯氨酸積累與植物耐滲透脅迫存在正相關。前人的研究多集中于不同材料的抗鹽特性或耐鹽性比較,而對于不同耐性材料之間的生理機制差異少見報道。本研究以抗性明顯不同的兩種蘋果砧木垂絲海棠‘9-1-6’(本課題組篩選)和山定子為材料,測定其光合熒光對鹽脅迫的響應,探討抗鹽性不同的蘋果砧木抗氧化酶活性和滲透調節物質含量的差異,以期豐富蘋果砧木抗鹽生理的內容,試驗結果可望為優質蘋果砧木的開發提供理論依據。
1 材料與方法
1.1 材 料
2020年1月將垂絲海棠‘9-1-6’(MalushallianaKoehne,抗鹽性強)和山定子(MalusbaccataBorkh,抗鹽性弱)種子用0.2%高錳酸鉀消毒30 min,自來水沖洗12 h,置于4℃下沙藏35 d。3月中旬選擇發芽一致的種子播于含有育苗基質的塑料花盆(11.2 cm × 16.8 cm,含1 kg基質)中,置于甘肅農業大學避雨棚(N 36°1′-37°9′,E 106°21′-107°44′)中,統一管理,定期除草澆水。幼苗生長至4片真葉時,移入大小及營養土重量相同的花盆中,每盆1株。
1.2 鹽脅迫處理
2020年5月20日選取株高相似、葉片數相近的垂絲海棠‘9-1-6’和山定子各40株進行鹽脅迫處理。試驗設對照(CK,pH 6.8)和鹽脅迫(SS,pH 7.0)兩種處理,每處理5次重復,每重復4盆。根據預試驗,選擇100 mmol·L-1為脅迫處理濃度。CK組澆Hoagland營養液,處理組澆Hoagland營養液+100 mmol·L-1NaCl溶液。為避免鹽激反應,處理濃度按50 mmol·L-1每天遞增,達到設定濃度后開始計算脅迫時間。間隔3 d,于17∶00—18∶00澆灌500 mL營養液。脅迫處理開始第1次取樣時間為2020年5月20日07∶00,依次在處理第3、40 d時選取位于植株中上部的功能葉進行各項指標測定,并拍攝形態表型照片。
1.3 測定指標及方法
1.3.1 光合特性指標 于晴天09∶00—11∶00,選取同一節位的功能葉,用光合儀(Li-6400,LI-COR公司,美國)測定凈光合速率(Pn)、氣孔導度(Gs)、蒸騰速率(Tr)和胞間CO2濃度(Ci),重復5次。采用IMAGING-PAM葉綠素熒光儀和Imaging WinGegE軟件(Walz,Effeltrich,德國)測定初始熒光(F0)、最大光化學效率(Fv/Fm)、表觀光合電子傳遞速率(ETR)、PSII實際光化學效率(ΦPSII)、調節性能量耗散(Y(NPQ))、非調節性能量耗散(Y(NO))、光化學猝滅系數(qP)和非光化學熒光淬滅系數(qN)。
測定光合熒光參數后,采集葉片,擦去表面污物并去掉葉脈,-80℃保存待測其他指標。
1.3.2 抗氧化酶和滲透調節物質 參照張春梅[16]的方法測定H2O2含量及SOD和POD活性;采用參考文獻[17-18]中方法測定APX活性、AsA和蔗糖含量;游離Pro含量用酸性茚三酮法測定[19];山梨醇含量測定采用Burg等[20]的方法。
1.4 數據處理
采用SPSS 22.0軟件進行單因素Duncan檢驗方差分析,使用Origin 9.0軟件制圖,Imaging WinGegE軟件選取熒光圖片。
2 結果與分析
2.1 鹽脅迫下垂絲海棠‘9-1-6’和山定子葉片的表型變化
隨著脅迫的持續,兩種砧木葉片發生不同程度的變化(圖1)。脅迫3 d時,抗鹽性砧木‘9-1-6’葉片無明顯變化,而鹽敏感型砧木山定子老葉失水并出現黃化、葉緣干枯。脅迫40 d,兩種砧木葉片均出現干枯,但‘9-1-6’葉片僅邊緣出現干枯斑點,而山定子葉片葉緣變褐,枯萎,部分葉片死亡脫落。

注:CS—垂絲海棠‘9-1-6’;SDZ—山定子;SS—鹽脅迫。下同。Note: CS— Malus halliana ‘9-1-6’;SDZ—Malus baccata; SS—salt stress. The same below.圖1 鹽脅迫下垂絲海棠‘9-1-6’和山定子葉片表型的變化Fig.1 Changes of salt stress in Malus halliana and Malus baccata leaf phenotype
2.2 鹽脅迫對垂絲海棠‘9-1-6’和山定子葉片光合參數的影響
隨著脅迫時間的延長,兩種砧木葉片Pn、Gs、Tr均降低,而Ci升高(圖2)。脅迫3 d后,兩種砧木葉片Pn、Gs和Tr均顯著低于CK,但垂絲海棠‘9-1-6’葉片Pn、Gs和Tr顯著高于山定子。脅迫40 d,兩種砧木葉片Pn、Gs、Tr降至最低,與CK相比,Pn的降幅為58.4%、91.9%,Gs為57.9%、82.4%,垂絲海棠‘9-1-6’降幅顯著小于山定子;Tr下降后分別為0.47 mmol·m-2·s-1和0.5 mmol·m-2·s-1,無顯著差異;兩種砧木葉片Ci脅迫40 d后均顯著高于CK,分別為CK的1.69、2.13倍,且垂絲海棠‘9-1-6’葉片的Ci顯著低于山定子,僅為其76.6%。
2.3 鹽脅迫對垂絲海棠‘9-1-6’和山定子熒光參數的影響
2.3.1 鹽脅迫對垂絲海棠‘9-1-6’和山定子F0、Fv/Fm、ETR、ΦPSII的影響 由圖3可以看出,脅迫0 d時,垂絲海棠‘9-1-6’葉片的F0顯著高于山定子,為其1.26倍,且垂絲海棠‘9-1-6’葉片F0在短期脅迫下無顯著變化,而山定子葉片的F0隨著脅迫的持續呈不斷上升的趨勢。脅迫40 d時,與CK相比,兩種砧木葉片F0分別上升了22.8%和56.9%。
隨著脅迫的持續,垂絲海棠‘9-1-6’和山定子葉片Fv/Fm和ΦPSII呈下降趨勢。其中,垂絲海棠‘9-1-6’葉片Fv/Fm和ΦPSII短期脅迫下無顯著變化,而山定子顯著低于CK。脅迫40 d時,兩種砧木葉片的Fv/Fm和ΦPSII均顯著低于CK,相比CK,分別下降了12.9%、83.9%和67.0%、84.2%,垂絲海棠‘9-1-6’的降幅顯著小于山定子;垂絲海棠‘9-1-6’葉片ETR先升后降,而山定子葉片ETR不斷下降,40 d時,垂絲海棠‘9-1-6’葉片ETR顯著高于山定子葉片,為其3.7倍,與CK相比,兩種砧木葉片ETR分別下降了66.5%和91.7%。
2.3.2 鹽脅迫對垂絲海棠‘9-1-6’和山定子Y(NPQ)、Y(NO)、qP和qN的影響 如圖4、圖5,隨著脅迫的持續,垂絲海棠‘9-1-6’葉片Y(NPQ)、Y(NO)和qN呈上升的趨勢,而qP呈下降趨勢;山定子葉片Y(NPQ)呈先升后降趨勢,Y(NO)、qN和qP變化趨勢與垂絲海棠‘9-1-6’一致,但不同抗性的砧木變幅不同。脅迫0 d時,‘9-1-6’葉片的qN顯著低于山定子,為其83.5%。脅迫至3 d,兩種砧木葉片Y(NPQ)和qN均顯著高于CK,山定子葉片Y(NO)顯著高于CK。脅迫40 d時,垂絲海棠‘9-1-6’葉片Y(NPQ)顯著高于CK和山定子,分別為CK和山定子的258%和320%;兩種砧木葉片Y(NO)和qN分別為CK的2.27、3.88倍和1.80、1.81倍,qP分別為CK的0.50、0.25倍,山定子葉片Y(NO)和qN顯著高于垂絲海棠‘9-1-6’,而qP顯著低于垂絲海棠‘9-1-6’。
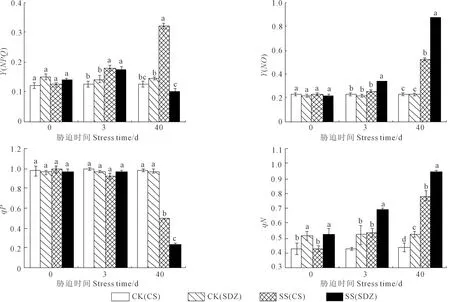
圖4 鹽脅迫對垂絲海棠‘9-1-6’和山定子葉片Y(NPQ)、Y(NO)、qP和qN的影響Fig.4 Effects of salt stress on Y(NPQ)、Y(NO)、qP and qN of M. halliana and M. baccata leaves

圖5 鹽脅迫下垂絲海棠‘9-1-6’(左)和山定子(右)葉片F0、ΦPSII、Y(NPQ)、Y(NO)、qP和qN的變化Fig.5 Changes of salt stress on F0、ΦPSII、Y(NPQ)、Y(NO)、qP and qN of M. halliana (left) and M. baccata (right) leaves
2.4 鹽脅迫對垂絲海棠‘9-1-6’和山定子葉片抗氧化系統的影響
圖6顯示,隨著脅迫的持續,兩種砧木葉片APX、SOD和POD活性呈先升后降趨勢,而ASA和H2O2呈不斷上升的趨勢。脅迫0 d時,垂絲海棠‘9-1-6’葉片POD活性和ASA含量顯著高于山定子。脅迫3 d后,兩種砧木葉片APX活性和ASA含量均顯著高于CK,山定子葉片H2O2含量顯著高于CK和垂絲海棠‘9-1-6’。脅迫40 d時,垂絲海棠‘9-1-6’葉片APX、SOD和POD活性均顯著高于山定子,與CK相比,兩種砧木葉片APX活性升幅分別為72.2%和48.6%,SOD和POD活性降幅分別為20.1%、38.5%和20.5%、28.9%;垂絲海棠‘9-1-6’葉片ASA含量顯著高于CK和山定子,分別為CK和山定子的1.50、1.17倍;垂絲海棠‘9-1-6’葉片H2O2含量與CK無顯著差異,但顯著低于山定子,僅為其83%。
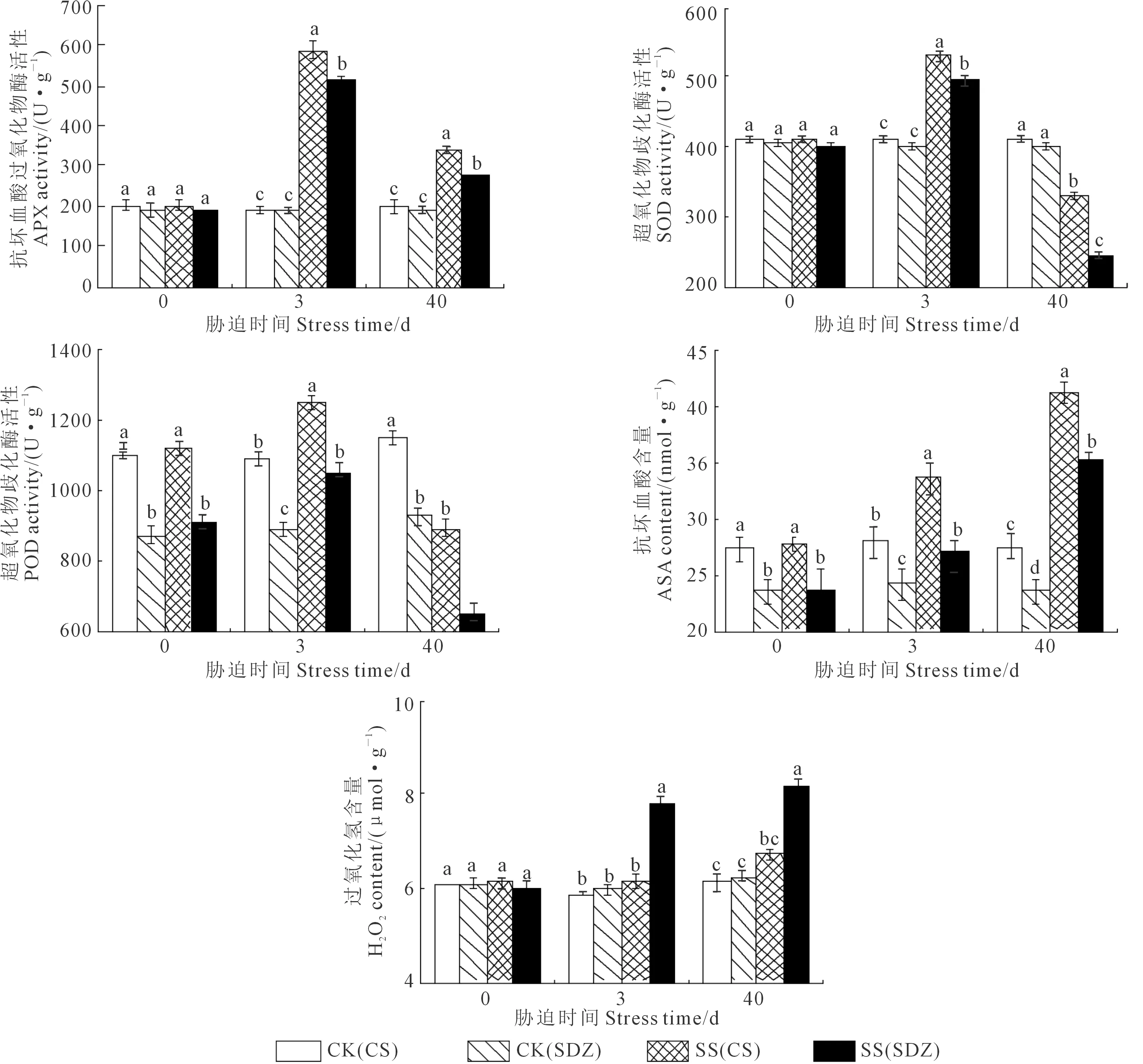
圖6 鹽脅迫對垂絲海棠‘9-1-6’和山定子葉片APX、SOD、POD活性及ASA、H2O2含量的影響Fig.6 Effects of salt stress on the activities of APX, SOD, POD and the contents ofASA、H2O2 of M. halliana and M. baccata leaves
2.5 鹽脅迫對垂絲海棠‘9-1-6’和山定子葉片滲透調節物質含量的影響
由圖7可知,隨著脅迫的持續,兩種砧木葉片中蔗糖和山梨醇含量呈不斷上升的趨勢;垂絲海棠‘9-1-6’葉片Pro含量不斷增加,而山定子Pro含量先升后降。脅迫0 d時,垂絲海棠‘9-1-6’葉片蔗糖和山梨醇含量顯著高于山定子,為其1.30、1.19倍。短期(3 d)脅迫下,兩種砧木葉片Pro和山梨醇含量均顯著高于CK,垂絲海棠‘9-1-6’葉片蔗糖含量顯著高于CK。脅迫40 d時,垂絲海棠‘9-1-6’葉片Pro含量顯著高于CK和山定子,分別為CK和山定子的1.88、2.52倍,山定子葉片顯著低于CK,僅為其0.69倍;兩種砧木葉片蔗糖和山梨醇含量均顯著高于相應CK,且垂絲海棠‘9-1-6’葉片蔗糖和山梨醇含量顯著高于山定子,為其1.4、1.1倍。
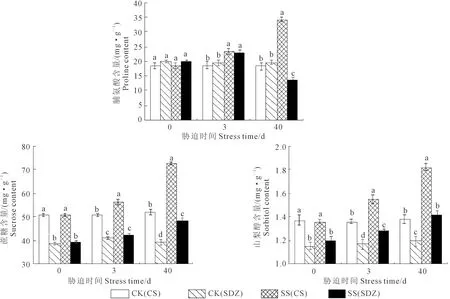
圖7 鹽脅迫對垂絲海棠‘9-1-6’和山定子葉片滲透調節物質的影響Fig.7 Effects of salt stress on osmolytes of M. halliana and M. baccata leaves
3 討 論
3.1 垂絲海棠‘9-1-6’和山定子響應鹽脅迫的光合熒光特性
鹽脅迫下植物光合作用的變化一直是學者研究的熱點。Farquhar等[21]研究表明,引起Pn降低的氣孔或非氣孔限制因素可根據Ci變化判斷,當Pn和Ci均降低時,表明光合作用受氣孔限制因素影響,當Pn降低而Ci升高則表示光合作用受非氣孔限制的影響。本研究中,兩種砧木葉片Pn的降低均伴隨著Ci的升高,說明非氣孔限制可能是兩種蘋果砧木葉片Pn下降的主要因素,即光合細胞機構和功能受到損傷所致。此外,鹽脅迫也顯著影響兩種砧木葉片Tr和Gs,表現為Tr和Gs下降,這與羅達等[22]在鹽脅迫雜種榛中的研究結論一致。脅迫40 d時,垂絲海棠‘9-1-6’Pn、Gs和Ci變幅顯著小于山定子,而Tr無顯著差異,可能是垂絲海棠‘9-1-6’葉片利用熒光或熱耗散的方式耗散過多的光能,以保護光合機構免受損傷,保持較高的光合效率,表現出良好的耐鹽性,張潭[23]在沙棗等樹木的研究中也得出了相似的結論。
植物活體葉綠素發出的熒光信號包含豐富的光合信息,通過葉綠素熒光可深入了解脅迫對植物PSII的影響以及其對脅迫的適應機制[24]。本試驗中,100 mmol·L-1NaCl不同程度地降低了兩種砧木葉片PSII反應中心的潛在活性、Fv/Fm和ETR,增加了通過非光化學途徑的能量耗散,這和前人對葡萄、玉米等[25-26]的研究結論一致。PSII天線色素的熱耗散常導致F0降低,而PSII反應中心的破壞或可逆失活則引起F0的增加,Fv/Fm降低表明葉片PSII發生光抑制[27]。脅迫3 d時,山定子葉片F0顯著高于CK,而垂絲海棠‘9-1-6’葉片F0無顯著變化,可能是垂絲海棠‘9-1-6’葉片在短期脅迫下通過熱耗散來保護PSII反應系統的動態平衡,而山定子葉片在感受到脅迫后PSII反應系統即失去平衡,使光系統中心遭受損壞所致。長期脅迫下,兩種砧木葉片F0均顯著增加,說明此時兩種砧木葉片PSII反應中心均可能遭受破壞,且在相同的鹽脅迫條件下兩種砧木增幅不同,抗鹽砧木垂絲海棠‘9-1-6’能夠保持較高的Fv/Fm和ETR,其原因可能是耐鹽植物比鹽敏感植物色素含量變化小,而葉綠素含量的高低直接影響色素蛋白復合體的功能,從而影響葉綠體對光能的吸收、傳遞和轉化[28]。
鹽脅迫下,qP和ETR值降低,表明PSII天線色素捕獲光能用于光化學電子傳遞的份額減少,為避免光合器官受到損傷,PSII反應中心需要啟動保護性調節機制來耗散剩余光能[29],Y(NPQ)和qN可反映其耗散能力,Y(NO)反映光損傷程度[30]。鹽脅迫下垂絲海棠‘9-1-6’葉片Y(NPQ)、Y(NO)和qN不斷升高,而qP降低,表明垂絲海棠‘9-1-6’在鹽脅迫下仍可通過熱耗散等方式保持PSII光化學活性和光合電子正常進行;而山定子葉片Y(NPQ)和Y(NO)分別為CK的69.0%和400%,變幅顯著大于垂絲海棠‘9-1-6’,表明山定子在100 mmol·L-1NaCl長期脅迫下幾乎失去了自我保護能力,PSII反應中心受到了不可逆損傷。垂絲海棠‘9-1-6’相比山定子具有較高的光化學效率,可能是其啟動熱耗散機制緩解了鹽脅迫對PSII反應中心的傷害,更進一步證實了由F0得出的結果,這與秦玲等[26]在葡萄中的研究結果相似。Ma等[31]在大豆研究中發現耐鹽性強弱也可能與蛋白含量有關,說明鹽脅迫對高等植物不同抗性品種光化學效率的影響存在差異,其響應鹽脅迫的機制也不盡相同。
3.2 垂絲海棠‘9-1-6’和山定子響應鹽脅迫的抗氧化酶和滲透調節特性
ROS可作為鹽脅迫信號分子激發植物體內抗氧化防御系統[32],包括酶促與非酶促系統,他們協同使植物體內ROS的產生與猝滅處于動態平衡。鹽脅迫容易破壞ROS的平衡,促進細胞內膜脂降解,引發細胞死亡[33]。本試驗中SOD和POD均呈現出先升后降趨勢,相對于CK,抗鹽性砧木葉片的增幅大于鹽敏感砧木,降幅小于鹽敏感砧木,這與楊佳鑫等[34]在梅花中的研究結果一致。同一脅迫條件下不同抗鹽性品種酶促防御系統的反應差異,表明植物較高的耐鹽能力可能源于保護酶活性的增強。AsA是植物體普遍存在的一種非酶促抗氧化劑,AsA-GSH在APX作用下能夠有效清除葉綠體中的H2O2[35]。長期(40 d)鹽脅迫下,垂絲海棠‘9-1-6’葉片AsA含量和APX活性均顯著高于山定子,而H2O2含量顯著低于山定子,且與CK無顯著性差異,表明抗鹽砧木‘9-1-6’在鹽脅迫下能夠維持AsA-GSH循環的有效進行,有效抑制H2O2增加,這與李琲琲等[36]在大豆中的研究結果一致。兩種砧木葉片非酶促防御系統的不同反應,表明葉片APX活性和AsA含量可作為植物耐鹽能力的判斷依據。
當植物處于鹽漬環境中時,液泡內易積累Na+、K+和Cl-等,使液泡內滲透壓升高,這時細胞質中會合成如山梨醇、蔗糖和脯氨酸等有機物來平衡液泡膜兩側的水勢,減輕鹽害[20]。本研究中垂絲海棠‘9-1-6’葉片脯氨酸(Pro)含量持續增加,這與孫聰聰等[37]在銀杏葉片中的研究結果一致,脯氨酸積累提高了葉片耐滲透脅迫能力,從而提高葉肉細胞保水能力和對鹽脅迫的適應能力;而山定子葉片Pro含量先升后降,可能是100 mmol·L-1NaCl脅迫超出了山定子的耐受范圍,從而表現出弱抗性,Liu等[38]在擬南芥鹽脅迫的研究中也得到了相同結果。果樹在鹽漬、干旱等逆境條件下可積累大量山梨醇緩解脅迫的危害[39];陳少良等[40]研究得出耐鹽性較強的胡楊苗木脅迫后葉片中蔗糖含量的提高可維持液泡和原生質之間滲透勢的平衡,還可在高鹽條件下保持細胞質中多種酶的活性,耐鹽性較弱的群眾楊則缺乏這種調節能力。本研究中抗鹽系‘9-1-6’葉片蔗糖和山梨醇含量在試驗前后均顯著高于CK和鹽敏感砧木山定子(圖7),與前人[39-40]研究結論相一致。
4 結 論
相比鹽敏感砧木山定子,抗鹽性強的砧木垂絲海棠‘9-1-6’通過保持較高的光合能力(Pn和Fv/Fm),積累大量滲透調節物質(蔗糖、山梨醇和Pro)和維持較高的抗氧化酶(APX、SOD、POD)活性,以調節光合機能、維持細胞滲透平衡及清除H2O2響應鹽脅迫。

