夏末亞熱帶太平洋至楚科奇海微微型浮游植物群落
袁 超,徐勤增,邵和賓,鄭 洲,張學雷*
(1.自然資源部 第一海洋研究所,自然資源部海洋生態環境科學與技術重點實驗室,山東 青島266061;2.青島海洋科學與技術試點國家實驗室 海洋生態與環境科學功能實驗室,山東 青島266071;3.中國極地研究中心,上海201306)
微微型浮游植物是粒徑最小(<2μm)的浮游植物,包括聚球藻(Synechococcus,Syn)、原綠球藻(Prochlorococcus,Pro)和微微型真核藻(Picoeukaryotes,Peuk)三大類群。微微型浮游植物雖然個體較小,但分布廣泛、數量龐大、周轉率高,是海洋生態系統中浮游植物生物量和初級生產的重要貢獻者[1-2],在海洋生態系統的物質循環和能量流動中扮演著重要的角色[3]。
長期以來,相關學者已利用流式細胞術對西北太平洋的微微型浮游植物群落結構的時空分布特征進行了廣泛而深入的研究。Jiao等[4]對東海微微型浮游生物群落的季節變化進行了研究,發現Pro豐度在夏季高于冬季,而Peuk豐度在冬季高于夏季。在南黃海,微微型浮游植物群落由Syn和Peuk組成,其分布主要受光照和溫度的影響[5]。在亞北極太平洋和白令海南部,微微型浮游植物群落由Syn和Peuk構成,豐度在103~104個/m L。2個類群的紅色熒光和前向散射光均表現出顯著的水平和垂直差異[6]。在第三次北極科學考察期間,張芳等[7]發現Syn和Peuk細胞大小和色素含量之間存在同向變化。這些研究為闡明微微型浮游植物群落對區域生態環境的響應機制,進一步探索不同海區群落結構的變化特征等積累了寶貴資料。
先前的研究均局限在對小范圍的微微型浮游植物群落結構的分析,大空間尺度范圍的微微型浮游植物群落組成和細胞特性等相關問題尚未得到很好的驗證和分析。溫度個體大小準則(Temperature-Size Rule,TSR)指出成體大小與環境溫度呈負相關[8]。TSR準則在各類生物中均存在,包括動物、植物、原生生物、細菌甚至浮游植物[9-12]。然而,對于微微型浮游植物是否遵從TSR準則仍存在爭議。Morán等[13]報道東北大西洋Pro和Syn的平均細胞大小與溫度呈負相關,而Sato等[14]在太平洋的研究指出微微型浮游植物細胞大小與溫度不存在顯著相關關系。此外,光照強度是影響微微型浮游植物色素含量的重要因素。從垂向變化來看,微微型浮游植物的色素含量隨深度而增加[6,15-16]。光照強度通常隨緯度升高而降低,微微型浮游植物色素含量在緯度方向是否會隨光照強度降低而升高有待進一步探究。
本研究擬利用流式細胞術,針對亞熱帶太平洋至楚科奇海海域的近表層樣品,分析其群落結構和細胞光學特征,研究在不同海區之間的差異和共性,探討影響微微型浮游植物豐度、細胞大小和色素含量的主要環境控制因子,為明確大空間尺度范圍的微微型浮游植物群落組成和細胞特性等相關問題奠定基礎。
1 材料與方法
1.1 調查站位和理化分析
2019-08-22—09-15在中國第十次北極考察期間乘“向陽紅01號”科考船,利用船載表層水采樣系統在白令海、楚科奇海和北太平洋(162°06′E~168°42′W,37°48′~73°12′N)進行樣品采集(圖1)。對于微微型浮游植物樣品,在各站位采集海水4.5 m L,加入終濃度為1%的多聚甲醛固定15 min后,放入-80℃冰箱中保存。各站位的溫度和鹽度通過船載CTD直接讀取。總葉綠素a(Chla)和營養鹽濃度的取樣和測定方法參照《海洋調查規范》(GB/T 12763—2017)[17]。在各站位,泵取的近表層(~7 m)海水經Whatman GF/F濾膜過濾后,將濾膜放入-80℃冰箱保存;過濾后的海水裝入250 m L高密度聚乙烯瓶中,保存于-20℃冰箱。返回實驗室后,利用萃取熒光法進行Chla濃度的測定;用Qu AAtro連續流動分析儀分析測定海水中的硝酸鹽和磷酸鹽濃度。

圖1 研究海區站位和流向Fig.1 Sampling stations and currents in the surveyed area
1.2 微微型浮游植物測定原理和方法
利用BD FACSCalibur流式細胞儀進行微微型浮游植物的分類和計數。BD FACSCalibur流式細胞儀配有波長為488 nm的激發光,可以對流動細胞或顆粒的物理和熒光特征進行檢測。所測參數中,前向散射光(Forward Scattering,FSC)與細胞長度有關;側向散射光(Side Scattering,SSC)與細胞的內容物含量有關。相關研究表明,FSC和SSC均與微微型浮游植物細胞直徑呈顯著正相關[18-20]。FL1,FL2和FL3分別為綠色(530/30 nm)、黃橙色(585/42 nm)和紅色(>670 nm)熒光的強度。將Pro、Peuk和Syn三類微微型浮游植物按細胞大小和細胞葉綠素a(或二乙烯基葉綠素a)含量進行排序,則2類要素均有Pro<Syn<Peuk的關系。這3類微微型浮游植物均具有葉綠素a(或二乙烯基葉綠素a),被激發后會產生紅色熒光,具有較高的FL3值。其中,Syn特有的藻膽蛋白被激發后會產生橙色熒光,具有較高的FL2值。本研究中,樣品檢測均在統一參數設置下一次完成,以便于樣品間比較。取1 m L樣品,加入1μm熒光微球(PolyScience)為內參,上機檢測3 min。通過SSC對FL2和FL3對FL2雙參數圖對微微型浮游植物進行區分和計數。微微型浮游植物的生物量通過固定碳轉換系數進行估算。Syn和Peuk的碳轉換系數分別為250和2 100 fg/個。
1.3 數據分析
用Ocean Data View 4.7軟件分析微微型浮游植物細胞的豐度、細胞大小(以SSC指示)和色素含量(以FL2和FL3指示)的水平分布狀況。將細胞豐度和光學參數數據進行lgx+1轉換后,在R軟件Vegan包中進行冗余分析(Redundancy Analysis,RDA),研究與環境因子間的相關性。
2 結 果
2.1 水文環境
按照環境條件,研究海區可以劃分為亞熱帶太平洋、亞北極太平洋、白令海盆、白令海陸架區和楚科奇海 五個區域(圖1和圖2)。亞熱帶太平洋包括研究海區最南部4個站位,具有高溫(>20℃)、高鹽(>34)、寡硝酸鹽濃度和低Chla濃度特征。亞北極太平洋包括東側阿留申群島南部2個站位,具有約12℃的相對低溫、低鹽、高硝酸鹽濃度和低Chla濃度特征。白令海盆區包括研究海區西側斷面的6個站位,具有相對低溫、低鹽、低硝酸鹽濃度和低Chla濃度特征。白令海陸架區的6個站位位于白令海東側,其相對白令海盆具有較高的硝酸鹽濃度和Chla濃度。楚科奇海的3個站位位于研究海區最北端,具有最低溫度和鹽度、低硝酸鹽濃度和低Chla濃度的特征(圖2)。

圖2 2019年夏季亞熱帶太平洋至楚科奇海溫度、鹽度、硝酸鹽濃度和葉綠素a濃度豐度分布Fig.2 Distribution of temperature,salinity,nitrate concentrations and Chl a concentrations from subtropical Pacific to Chukchi Sea in summer,2019
2.2 微微型浮游植物豐度和生物量
本研究未檢測到Pro,僅檢測到Syn和Peuk。Syn豐度變化范圍為(0.1~46.7)×103個/m L,平均值為12.1×103個/m L。Syn豐度最高值出現在白令海陸架區,而最低值出現在楚科奇海。Peuk豐度變化范圍為(1.1~43.2)×103個/m L,平均值為10.3×103個/m L。Peuk豐度高值出現在白令海陸架區,低值出現在亞熱帶太平洋(圖3)。

圖3 2019年夏季亞熱帶太平洋至楚科奇海邊緣海聚球藻豐度、微微型真核藻豐度、微微型浮游植物總碳生物量和聚球藻碳生物量占比分布Fig.3 Distribution of Synechococcus abundance,picoeukaryotes abundance,total picophytoplankton carbon biomass and proportion of Syn to total picophytoplankton carbon biomass from subtropical Pacific to Chukchi Sea in summer,2019
微微型浮游植物碳生物量范圍為2.8~102.3μg/L,平均值為24.7μg/L。其最大值出現在白令海陸架區,最小值出現在亞熱帶太平洋。Syn和Peuk雖然豐度相近,但后者具有更高的碳轉化系數,因此碳生物量占比更高。Syn和Peuk碳生物量占比的分布趨勢相反。Syn碳生物量占比的均值為13.6%,高值出現在白令海陸架區和亞熱帶太平洋,而在楚科奇海則小于1%。
2.3 微微型浮游植物細胞大小和色素含量
Syn和Peuk的細胞大小(Syn_SSC和Peuk_SSC)和色素含量(Syn_FL2,Syn_FL3和Peuk_FL3)等光學參數存在兩倍以上的變化,且隨緯度不存在一致變化關系(圖4)。Syn_SSC在白令海盆和亞北極太平洋最低,在亞熱帶太平洋和白令海陸架區較高,在楚科奇海最高。Syn_FL2和Syn_FL3顯著正相關,在亞北極太平洋和白令海海峽口較高,而在楚科奇海和亞熱帶太平洋最低。Peuk_SSC在亞熱帶太平洋和白令海盆最低,而在白令海峽口和亞北極太平洋最高。Peuk_FL3與Peuk_SSC顯著正相關,最大值同樣出現在白令海峽口和亞北極太平洋(圖4和圖5)。

圖4 2019年夏季亞熱帶太平洋至楚科奇海Syn_SSC、Syn_FL2、Syn_FL3、Peuk_SSC和Peuk_FL3分布Fig.4 Distribution of Syn_SSC,Syn_FL2,Syn_FL3,Peuk_SSC and Peuk_FL3 from subtropical Pacific to Chukchi Sea in summer,2019

圖5 微微型浮游植物細胞豐度、細胞大小和色素含量的相關性Fig.5 Pearson’s correlation heatmap between abundance,cell size and pigments of picophytoplankton
2.4 微微型浮游植物豐度、細胞大小和色素含量與環境因子的關系
RDA分析結果顯示,第一和第二約束軸共解釋了79%微微型浮游植物豐度、細胞大小和色素含量的變異(圖6)。由圖6可見,Peuk豐度與營養鹽濃度呈顯著正相關,而與溫度呈負相關;Syn豐度與鹽度成正比,而與緯度呈反比。Peuk_SSC和Peuk_FL3與環境因子表現為同向變化,與Chla正相關,而與鹽度呈負相關;Syn_SSC與緯度正相關,與鹽度負相關;Syn_FL2和Syn_FL3與硝酸鹽和磷酸鹽濃度呈正相關,而與緯度和鹽度無明顯相關關系。
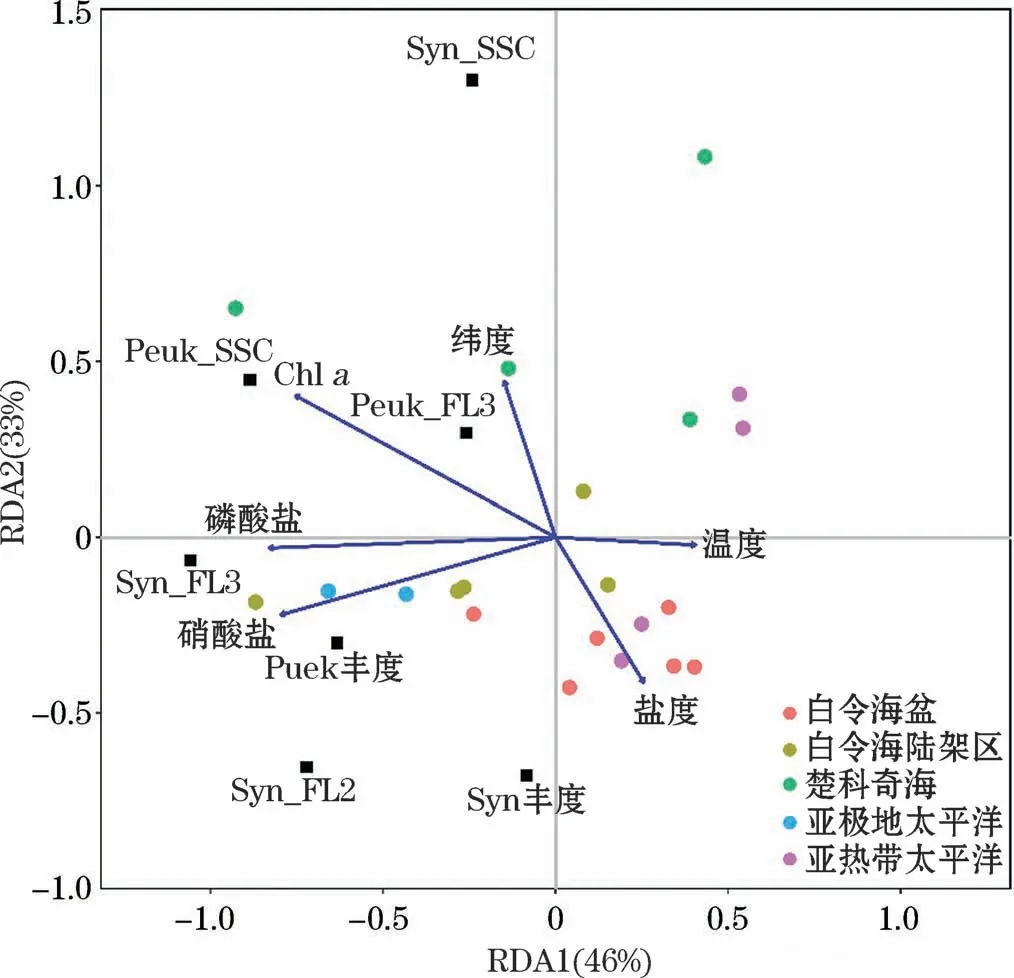
圖6 微微型浮游植物豐度和細胞光學特性與環境因子的冗余分析Fig.6 Redundancy analysis between picophytoplankton abundance and cell optical properties and environmental factors
3 討 論
3.1 微微型浮游植物豐度和生物量分布及其影響因素
在微微型浮游植物群落中,各站位均檢測到Syn和Peuk,而未檢測到Pro。Pro是熱帶和亞熱帶寡營養海區豐度最高的自養類群,但在高緯度(或低溫)和近岸海域其豐度會顯著下降[21]。在東海夏季,原綠球藻的分布主要受到黑潮移動和淡水輸入的影響。在北太平洋夏季,較低的溫度和鹽度將原綠球藻限制在45°N以南區域[6]。本研究中,亞北極太平洋及以北海域受地表徑流和融冰影響顯著,可能是導致Pro沒有分布的原因。在亞熱帶太平洋,表層Pro具有非常低的熒光值,在檢測過程中易與非生物顆粒混淆,也會引起Pro未被檢出。
研究海區環境條件變化劇烈,對微微型浮游植物豐度分布存在顯著影響。Syn和Peuk豐度高值均出現在白令海陸架區,表明兩個類群均適宜生長在營養鹽濃度較高的水域。受白令海渦流運動的影響,白令海盆區的高營養鹽深層水不斷向白令海陸架區補充,維持了陸架區較高的生產力水平。然而,夏季海冰融水的覆蓋引起白令海盆和楚科奇海水體層結增強,當上層營養物質被浮游植物耗盡后,產生了不利于Syn和Peuk生長的寡營養條件。低溫可能是影響Syn分布的另一重要因素。第3次北極科學考察期間,僅在白令海峽周邊海域少量站位檢出Syn。張芳等[7]認為該海域的Syn為耐寒型,而非嗜寒型。分子生物學結果表明Syn低溫適應類群Clade I和Clade IV是北冰洋大西洋扇區和白令海海區的主要類群[22-23]。在大西洋扇區,Syn可以向北分布至82°30′N,且在2℃下仍存在凈生長。因此,楚科奇海Syn豐度的最低值可能是由低溫和寡營養鹽兩個限制因素共同造成。相對而言,Peuk更能夠耐受低溫。低溫適應型微胞藻是北極海域Peuk群落的優勢種,金藻和溝鞭藻也可能有著重要的貢獻[24-26]。
本研究中,雖然Peuk和Syn具有相近的細胞豐度,但Peuk對碳生物量的貢獻更高。利用固定碳轉換系數來計算2個類群(尤其是Peuk)的碳生物量具有很大的不確定性[27]。尤其是在較大空間尺度上,Peuk_SSC和Syn_SSC均存在很大變異(圖4)。然而,Peuk_SSC的平均值約為Syn_SSC的4倍。即使Peuk用最小的碳轉化系數,也會不影響我們的研究結果,這一點與前期的研究結果是一致的[6]。
3.2 微微型浮游植物細胞大小和色素含量及其影響因素
Syn和Peuk的細胞大小(Syn_SSC和Peuk_SSC)均未與緯度(或溫度)表現出較強的正(或負)相關關系(圖4和圖5),表明它們在群落水平上均不服從TSR準則。晝夜節律是影響微微型浮游植物細胞大小的一個重要因素。微型和微微型浮游植物均有著近似同步的細胞分裂周期。細胞一般在傍晚最大而清晨最小,表明其可能利用白天光合作用產生的能量進行細胞分裂[14,28-30]。有報道指出若不考慮細胞生長階段,TSR準則將無法在Pro和Syn中得到揭示[30]。本研究樣品覆蓋白天和黑夜(每隔6或8 h取樣),但細胞大小在同一海區保持相對穩定,表明晝夜節律不是影響細胞大小的重要因素。
Syn細胞大小不存在隨緯度一致變化的趨勢,可能是由于各海區具有不同優勢物種所造成的。Xia等[23]利用rpoC1基因序列揭示研究海區Syn的物種組成,發現Clade II和CRD-1C分別在亞熱帶和亞北極太平洋占優勢,而Clade I是白令海和楚科奇海的優勢物種。在相似群落條件下,Syn_SSC自白令海盆向北至楚科奇海漸增。這種變化趨勢不能只歸因于緯度或溫度的影響。研究期間,整個白令海海區的海表溫度維持在10~12℃。Syn_SSC在寡營養的白令海盆區明顯低于高營養鹽的白令海陸架區,表明營養鹽限制可能會引起細胞體積的縮小。Syn_SSC向北的繼續升高則體現出低溫的影響。
Peuk相對Syn具有更豐富的物種多樣性,細胞大小和色素組成差別更大,且不同類群的Peuk可能占據不同的生態位[31]。由于低溫適應型微胞藻具有較小的細胞直徑,因此Peuk_SSC在最北部站位降低。個體小的細胞具有高比表面積和薄的擴散邊界層,有利于營養鹽的跨膜轉運,使其在寡營養條件下占據優勢[32-34]。因此,Peuk_SSC在白令海盆和西北太平洋出現低值,而在白令海陸架區出現高值。亞北極海域屬于高硝酸鹽低葉綠素a區,微微型浮游植物是浮游植物生物量的主要貢獻者[6]。該海域Peuk_SSC較高而Syn_SSC較低,表明2個類群可能采取不同的策略來應對鐵限制。此外,微型浮游動物攝食等其他因素也可能會對細胞大小產生顯著影響[35-36]。
Syn和Peuk細胞內色素含量與緯度(或溫度)也不存在正(或負)相關關系,表明表層光強不是影響浮游植物色素含量的重要因素(圖4)。Syn細胞內色素含量表現出同向變化,與第3次北極科學結果一致[7]。由于Syn細胞藻膽色素含量與細胞大小呈微弱負相關,白令海盆的Syn具有最高的單位體積色素含量。與Syn不同,Peuk細胞色素含量和細胞大小呈顯著正相關。這可能與兩個類群各自的物種組成和不同的環境適應性有關。
北極是受全球氣候變暖影響最嚴重的區域,海冰面積以每10 a約3%的速率遞減。2019年聯合國氣候變化政府間專家委員會(Intergovernmental Panel on Climate Change,IPCC)發布北極海冰面積出現自20世紀70年代以來的歷史第二低值。海冰融化和溫度升高加劇了水體層化,導致上層水體處于寡營養狀態,限制了浮游植物的生長。近些年來,浮游植物小型化的趨勢正得到廣泛的關注[10,26,37]。在北冰洋和白令海的開放水體,微微型浮游植物是Chla和初級生產力的主要貢獻者[26,38-39]。由于微微型浮游植物豐度主要受到異養鞭毛蟲和微型浮游動物攝食的控制,其生物量很大程度上在微食物環中循環,而對牧食食物鏈的貢獻很小。因此,北極冰蓋的減少更利于“浮游植物-浮游動物”的生態系統,而非經典的“冰藻-底棲生物”生態系統[40]。這種生態系統的轉變減少了有機碳的輸出和浮游生物與底棲生物的耦合,進而對北冰洋海洋生態系統的食物鏈和能量流動產生重要的影響[41-43]。
4 結 論
本文基于第十次北極科學考察走航期間的表層樣品,研究了夏末亞熱帶太平洋至楚科奇海微微型浮游植物的群落結構、豐度和細胞光學參數的變化規律,主要結論如下:
①微微型浮游植物群落由聚球藻和微微型真核藻組成,其豐度范圍分別為(0.1~46.7)×103個/m L和(1.1~43.2)×103個/m L。兩類群豐度的升高均與營養鹽可獲得性增加密切相關;
②聚球藻和微微型真核藻的細胞大小(以側向散射光指示)不遵循溫度-個體大小準則,可能還受到營養狀態和種類組成等其他因素的調控;
③在微微型真核藻中,細胞色素含量與大小呈顯著正相關,而對于聚球藻兩者不相關。
本研究為探索大空間尺度微微型浮游植物群落豐度、細胞大小和色素熒光強度的變化規律提供了資料基礎,未來需結合分子生物學手段對其物種組成進行鑒定和分析。
致謝:“向陽紅01”科考船全體船員和科考隊員在第十次北極科學考察期間在樣品采集中給予的幫助和支持。

