外源赤霉素調控胡椒花穗形成及增產機理
祖超 李蓉蓉 李志剛 王燦 魚歡 鄭維全 楊建峰
摘 ?要:花穗數目是影響胡椒產量的關鍵因素之一,前人研究發現噴施赤霉素可以增加胡椒花穗數目,但是增穗機理尚不明確。為了揭示赤霉素調控植物由營養生長向生殖生長轉變的機理,選用幼齡胡椒為試材,設置不同濃度赤霉素(20、40、60、100 mg/L)和赤霉素抑制劑多效唑(1500 mg/L),以清水為對照,進行噴施試驗。研究測定胡椒的產量、花量,葉片的形態、光合生理、糖類物質含量、糖代謝相關酶活性。結果表明,外源赤霉素濃度為60 mg/L時,胡椒產量相對于對照顯著提高了1.46倍,花穗數目增加了1.26倍。分析花穗數目增加的原因,發現噴施60 mg/L赤霉素提高了胡椒葉面積、促進了胡椒葉片光合作用,這有利于源器官碳水化合物含量的增加,該處理還促使碳水化合物向源葉中的淀粉分配,降低葉片蔗糖淀粉比。海藻糖代謝的反饋調控可能是促使碳水化合物向淀粉分配的原因之一,淀粉合成酶活性顯著增加可能是促使淀粉累積的又一原因,所以,噴施赤霉素可以適度降低胡椒葉片海藻糖含量,提升淀粉合成酶活性,使淀粉累積實現促花。研究結果為生產中采用適當的技術措施促進成穗,獲取高產胡椒提供實用的理論指導,同時也有助于拓展赤霉素在農業生產中的應用領域。
關鍵詞:花穗數目;光合作用;淀粉;蔗糖;海藻糖
Abstract: Inflorescence quantity is one of the key factors affecting pepper yield. Previous studies have found that gibberellin spraying can increase pepper inflorescence quantity, but the mechanism of inflorescence quantity increase is still unclear. To reveal the mechanism of gibberellin regulating the transition from vegetative growth to reproductive growth, in this study, young pepper was selected as the test material, with the treatment of spraying clear water as CK, different concentrations of gibberellin (20, 40, 60, 100 mg/L) and gibberellin inhibitor paclobutrazol (1500 mg/L). The yield, inflorescence quantity, leaf morphology, photosynthetic physiology, carbohydrate content and enzyme activity related to sugar metabolism of pepper were measured. The results showed that when the concentration of exogenous gibberellin was 60 mg/L, the yield of pepper increased by 1.46 times compared with that of the control group, and inflorescence quantity increased by 1.26 times. The reasons for the increase in inflorescence quantity were analyzed and found that spraying 60 mg/L of gibberellin improved the pepper leaf area, promoted the pepper leaf photosynthesis, it was beneficial to the increase of the content of carbohydrate source organs. The treatment also promoted carbohydrate distribution to the starch in the source leaves, reducing the sucrose to starch ratio in the leaves. The feedback regulation of trehalose metabolism may be one of the reasons to promote carbohydrate distribution to starch, and the significant increase of starch synthase activity may be another reason to promote starch accumulation. Therefore, the application of gibberellin can moderately reduce trehalose content and increase starch synthase activity in pepper leaves and promote starch accumulation to increase inflorescence. The results of this study would provide practical theoretical guidance for the adoption of appropriate technical measures to promote inflorescence formation and obtain high yield pepper in production, and also help to expand the application field of gibberellin in agricultural production.
Keywords: inflorescence quantity; photosynthesis; starch; sucrose; trehalose
胡椒是多年生藤本植物,因為胡椒的花芽是混合芽,營養生長和生殖生長是同時進行的,一年可以多次開花,主花期在每年的9—11月,在開展胡椒花期調控和胡椒果實性狀對產量影響的研究中發現,胡椒花果穗數與產量相關性最大[1-2],所以,胡椒主花期花量是影響產量的關鍵因子。但是目前生產中慣用的調花增產措施施肥量大、肥料利用率低,所以,急需尋求新的調控胡椒開花的方法,實現胡椒栽培管理中的提質增效。
已有研究表明植物激素是調控花量的重要內部信號[3],在短日照植物中,因為缺乏光周期開花途徑的調控,赤霉素途徑扮演了重要的角色,成為了必須的調控途徑[4]。胡椒為短日照植物,噴施赤霉素已成為促成栽培措施中的主要措施[5-6],適宜濃度噴施可以顯著提高花穗數目。赤霉素的成花調控機制,在模式植物與多年生木本植物中是不同的[7],比如,在擬南芥的研究中發現赤霉素促進植物由營養生長向生殖生長轉變[8],但是在芒果[9]和蘋果[10]中赤霉素對花芽分化是抑制的。增強赤霉素信號可以促進植物提前開花[11],但是赤霉素水平過高也會抑制植物成花[12]。糖類物質在植物成花中扮演著重要角色[13],其中,蔗糖和淀粉是影響植物由營養生長向生殖生長轉變的關鍵光合同化產物。淀粉代謝參與調控植物開花的關鍵階段,植物進入生殖生長時期,葉片過渡型淀粉被重新活化,源淀粉儲備的改變會影響生殖發育[14]。而蔗糖和淀粉含量的變化,主要受代謝過程中相關酶的調控,已有研究表明調控葉片中蔗糖和淀粉代謝的酶有多種,首先是影響光合碳同化途徑的關鍵酶磷酸烯醇式丙酮酸羧化酶(Rubisco),Rubisco的活性影響光合產物總量。在蔗糖和淀粉代謝中,白天,6-磷酸海藻糖(T6P)影響葉片中蔗糖和淀粉的相對含量,夜晚T6P調控淀粉降解以滿足植物對蔗糖的需求,T6P經磷酸化合成海藻糖[15],可以調控葉片蔗糖和淀粉含量[16]。蔗糖磷酸合成酶(SPS)活性增加促進蔗糖合成[17],可溶性酸性轉化酶(SAI)是水解蔗糖和促進蔗糖向淀粉轉化的關鍵酶,在植物生長發育和信號傳導中發揮著重要作用[18],同時該酶受赤霉素和光強的共同調控[19]。葉片中影響淀粉合成的關鍵酶為淀粉合成酶(SSS),影響淀粉降解的關鍵酶為β-淀粉酶。在對胡椒的研究中發現適宜光強可以增加胡椒葉片淀粉含量和赤霉素含量實現促花增產[20],所以赤霉素和淀粉之間存在某種調控關系,實現了胡椒的增產,具體機理尚不明確。本研究擬采用噴施赤霉素的方法,主要研究赤霉素調控蔗糖和淀粉代謝以調控胡椒花穗形成和增產的機理,為生產中采用適當的技術措施促進成花,獲取高產優質胡椒提供實用的理論指導。
1 ?材料與方法
1.1 ?材料
本試驗以中國熱帶農業科學院香料飲料研究所的胡椒試驗示范基地(181? N,11013? E)內的2齡‘熱引1號(Piper nigrum L. cv. Reyin No.1)幼齡胡椒為試材。其中葉片形態、光合生理、碳代謝相關參數選取花所在葉位下一葉位的完全穩定葉,即倒二葉為試材[21],。該區域年均溫24.6?℃左右,日照時數1804~2300 h,年均降水量約2164 mm。
1.2 ?方法
1.2.1 ?赤霉素噴施試驗 ?此研究在2018年9月—2019年7月進行,試驗于9月上旬開始,以噴施清水為對照(T1),設置4個赤霉素濃度梯度處理(T2、T3、T4、T5),分別為20、40、60、100 mg/L,以噴施濃度為1500 mg/L的赤霉素抑制劑多效唑(T6)驗證赤霉素作用,每個處理選取3株長勢基本一致的植株(噴施赤霉素之前將已有的胡椒花穗全部摘除),每株作為1個重復。種植園胡椒株行距為2 m×2.5 m,植株高約1.5 m,冠幅約1.4?m,東西走向。
1.2.2 ?產量測定 ?待1穗果實有3~5粒變紅即為成熟,對胡椒進行分批采摘回實驗室,55?℃烘干至恒重,統計黑胡椒產量(g/株)。
1.2.3 ?花穗數目測定 ?在處理30 d時,采摘各處理的花穗長度為新抽生、2 cm、5 cm和8 cm的花穗帶回實驗室,分長度統計花穗數目。
1.2.4 ?光合參數測定 ?在噴施赤霉素10 d后用Li6400型便攜式光合儀測定胡椒花穗所在葉位下一葉位完全展開葉9:00—11:30時的凈光合速率(Pn)、氣孔導度(Gs)、蒸騰速率(Tr)、胞間二氧化碳濃度(Ci)。
1.2.5 ?胡椒葉片形態指標測定 ?處理40 d和55 d的上午9:00—11:30采集花穗長度為5 cm和8?cm的花穗對應的倒二葉,每株采10片,測量葉片葉面積(mm2)、葉厚度(mm)和葉重(g)。
1.2.6 ?蔗糖、淀粉和海藻糖含量測定 ?處理40 d和55 d的上午9:00—11:30采集花穗長度為5 cm和8 cm的花穗對應的倒二葉,每株采10片待測,采集的葉片在液氮中固定20 min左右,放入–80?℃超低溫冰箱中保存待用。
將葉片從–80?℃超低溫冰箱中取出,放在液氮中保存,測定時采集葉片的中間部分[22],稱取0.1 g胡椒樣本放入1.5 mL離心管中,蔗糖(mg/g)測定參考張志良等[23]的方法,淀粉(mg/g)測定采用蒽酮比色法[24],海藻糖(mg/g)測定采用蒽酮法[25]。
1.2.7 ?蔗糖代謝相關酶活性測定 ?Rubisco、SPS和SAI、SSS和β-淀粉酶活性以單位每克組織在單位時間內催化底物合成蔗糖的量表示。Rubisco活性[nmol/(min·g)]采用Wishnick等[26]的方法測定,SPS活性[μg/(min·g)]按Schrader等[27]的方法提取和測定,SSS活性[μg/(min·g)]的提取和測定參考Jiang等[28]的方法,SAI活性[μg/(min·g)]測定參考Miron等[29]的方法,β-淀粉酶活性[nmol/(min·g)]測定參考Dziedzoave等[30]的方法。
1.3 ?數據處理
文中每個數據點來自3個重復的平均值,采用GraphPad Prism軟件進行作圖,運用IBM SPSS Statistics 19軟件進行方差分析。
2 ?結果與分析
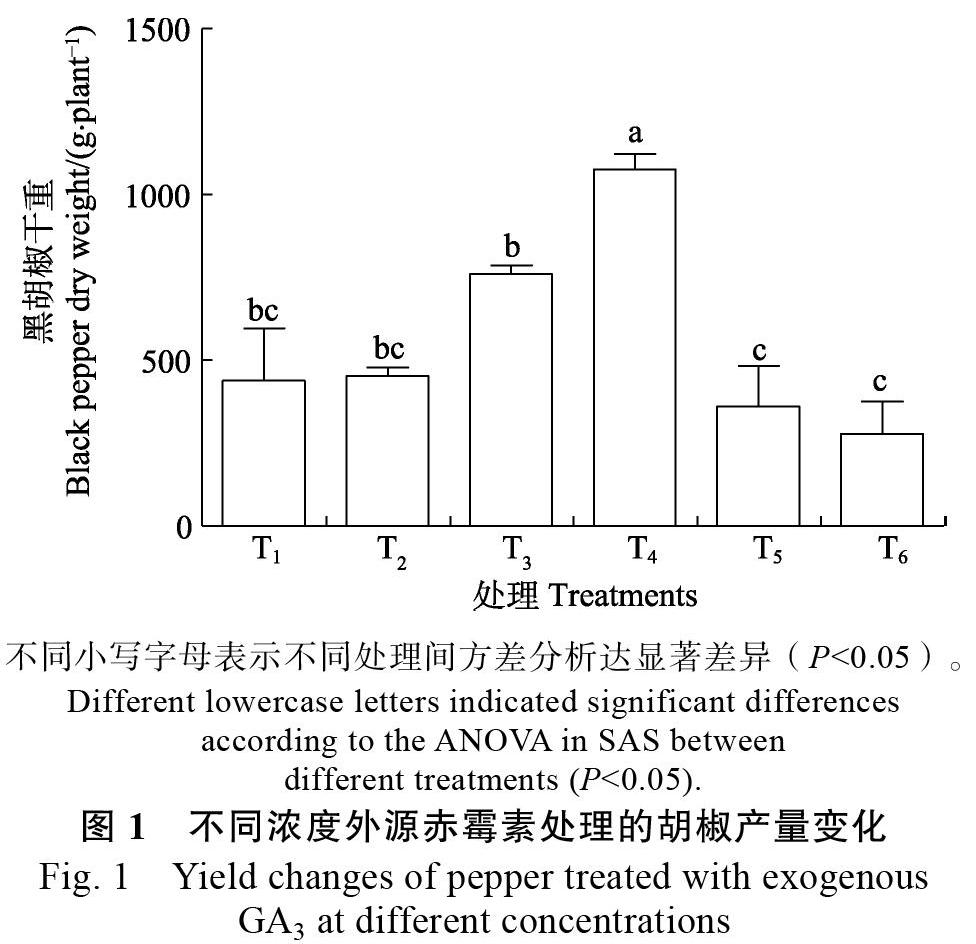
2.1 ?外源赤霉素對胡椒產量的影響
從圖1可見,適宜濃度赤霉素噴施,可以有效增加胡椒干重。其中T4處理(噴施赤霉素濃度為60 mg/L)可以顯著增加黑胡椒干重,相對于T1清水處理增加了1.46倍,但是T5處理(噴施赤霉素濃度為100 mg/L)卻降低了胡椒干重,相對于T1處理降低了17.74%。噴施赤霉素抑制劑多效唑的T6處理相對于T1處理降低了胡椒干重36.55%。
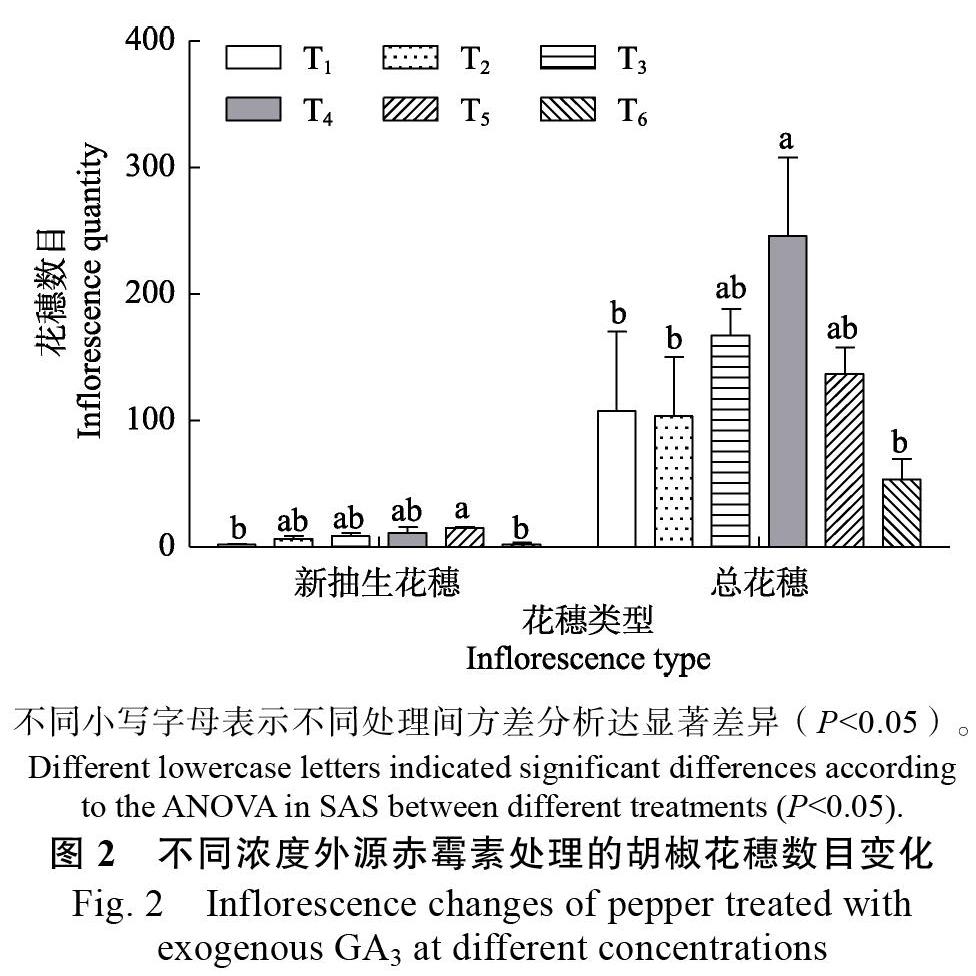
2.2 ?噴施赤霉素對胡椒花穗數目的影響
胡椒的花芽和葉芽是同時分化的,在水分養分充足時,花芽發育為正常的花穗,開花結果,當條件不適合時,植株營養生長過旺,花芽不能發育成正常花穗[31]。噴施適宜濃度赤霉素可以增加胡椒產量,所以推測噴施赤霉素可以調控胡椒混合芽向花芽發育為花穗的方向發展。從圖2可見,T2~T5處理相對于對照T1處理使胡椒新抽生花穗數目有所增加,其中,T5處理(噴施赤霉素濃度為100 mg/L)相對于T1可以顯著增加胡椒新抽生花穗數目,為T1處理的5.58倍;T3和T4處理都增加了胡椒總花穗數,其中T4處理顯著增加了胡椒總花穗數目,為T1處理的1.29倍。相對于T1處理,T6處理對胡椒花穗數目沒有顯著影響。所以,噴施適宜濃度赤霉素可以促進胡椒花穗數目增加,這是提升胡椒產量的原因之一,但是,赤霉素調花增產機理尚不明確,需要進一步研究。
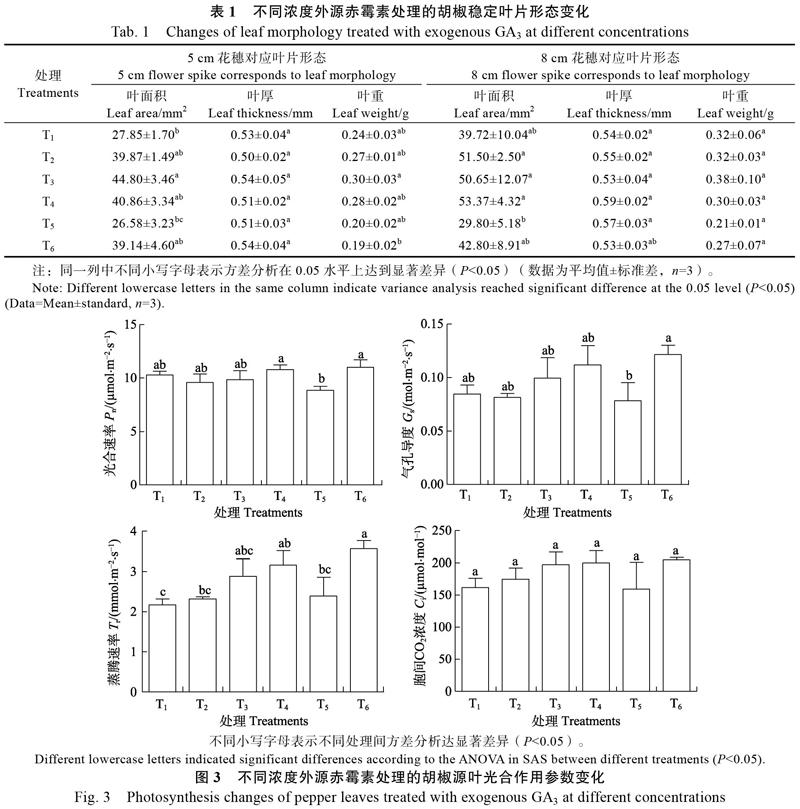
2.3 ?噴施赤霉素對胡椒源葉形態的影響
赤霉素不僅促進植物營養生長,還可以誘導植物生殖生長,因為胡椒的花芽和葉芽是同時分化的,也就是營養生長和生殖生長同時存在。從表1可見,待胡椒源葉生長趨于穩定后,噴施適宜濃度赤霉素處理有效增加了胡椒源葉面積,但赤霉素濃度過高會抑制胡椒源葉面積增加;不同處理對葉重的影響差異不顯著。可見噴施適宜濃度赤霉素對胡椒源葉面積的增加有一定的促進作用,這可能也是噴施赤霉素促進胡椒產量增加的又一原因。
2.4 ?噴施赤霉素對胡椒源葉生理的影響
2.4.1 ?噴施赤霉素對胡椒源葉光合作用的影響 ?赤霉素是植物光合作用的調節劑[32]。從圖3可見,噴施赤霉素的T4處理和噴施多效唑的T6處理會促進胡椒葉片光合速率(Pn)增加,T5處理會降低胡椒葉片光合速率,噴施赤霉素的T3和T4處理以及噴施多效唑的T6處理可以有效促進氣孔導度(Gs)和蒸騰速率(Tr)的提升,這就有利于提升胡椒獲得碳素量。所以,T3、T4和T6處理有利于提升胡椒葉片光合能力。
2.4.2 ?噴施赤霉素對胡椒源葉糖類物質含量的影響 ?赤霉素也是植物碳代謝的調節劑[32]。從圖4可見,在胡椒花穗長至5 cm時,噴施赤霉素的T3~T5處理下胡椒源葉蔗糖含量顯著增加,分別比對照增加了4.41%、5.35%和31.45%,其中T5處理達最大值;T6處理胡椒源葉蔗糖含量也顯著提高,這可能是噴施多效唑后,花穗數目減少,庫器官不能消耗蔗糖導致蔗糖在源葉中的累積;在噴施赤霉素后,花穗長至8 cm時,其對應源葉中的蔗糖含量只有T3處理有所提升,可能是這一赤霉素濃度處理條件下,源葉蔗糖濃度足夠供應花穗發育,還可以有較多積累,但是T4處理花穗數目多,可能蔗糖較多的輸送到庫器官供花穗發育,所以T4處理源葉中蔗糖含量下降,T2處理和T5處理花穗數目少,源葉蔗糖含量少,可能是低濃度赤霉素調控沒有增加源葉蔗糖含量。對于淀粉含量,T4處理在5 cm花穗對應源葉中有顯著累積,相對于T1處理增加了50.41%,說明T4處理條件下,源器官產生了足夠多的碳水化合物供庫器官利用,所以,在T4處理花穗數目較多情況下依舊可以使淀粉積累;在花穗長至8 cm時,T3和T4條件下,源器官產生的碳水化合物都足夠庫器官消耗,2個處理分別比T1顯著增加了32.82%和12.32%;而花穗數目較少的T6處理,胡椒源葉的淀粉積累量也高于對照T1處理。噴施赤霉素處理可以有效調控源葉蔗糖和淀粉含量,其中T4處理在花穗長至5 cm時蔗糖和淀粉含量都有顯著增加,但是淀粉含量相對增加量較高,所以蔗糖淀粉比顯著降低,有利于花穗發育,在花穗長至8 cm時,蔗糖含量顯著低于對照,但是淀粉含量顯著高于對照,這也使得在T4處理條件下蔗糖淀粉比顯著降低,但是低的蔗糖淀粉比并沒有影響胡椒花穗發育,因為淀粉的累積,說明庫器官不再需要過多的碳水化合物,使得其沒有轉化為蔗糖。源葉海藻糖含量與蔗糖含量變化較一致,花穗長至5 cm和8 cm時,葉片海藻糖和蔗糖含量均表現為極顯著正相關(R2=0.80**,R2=0.72**)。葉片源葉海藻糖含量升高會抑制淀粉降解[15],反之,會促進淀粉降解,但是為維持植物生長,淀粉不會無限制地降解[15],在本研究中,花穗長至5 cm時,T4處理條件下源葉海藻糖含量最低,相對于T1處理顯著降低10.80%,但T4處理對淀粉的累積相對于T1并沒有顯著降低;葉片長至8 cm時,T2和T4~T6處理相較于T1處理都顯著降低了海藻糖含量,但是這幾個處理淀粉含量都不低于T1處理,所以,海藻糖含量降低,源葉淀粉含量沒有顯著降解,這可能是因為源器官對庫器官碳水化合物的供應是足夠的。
2.4.3 ?噴施赤霉素對胡椒源葉蔗糖代謝相關酶活性的影響 ?蔗糖代謝的關鍵酶調控著源葉的糖類物質含量,其中,核酮糖-1,5-二磷酸核酮糖羧化/加氧酶Rubisco(EC 4.1.1.39)是植物光合作用中的一個關鍵酶,其活性的大小直接影響光合碳同化過程。從圖5可見,在胡椒花穗長至5 cm時,相對于T1處理,胡椒源葉的Rubisco活性在T2處理下有顯著升高,T4和T6處理顯著降低,在胡椒花穗長至8 cm時,T4和T6處理也顯著抑制了相應源葉Rubisco活性,所以,T4處理不是通過提高葉片Rubisco活性來提升5 cm花穗對應源葉蔗糖含量的,但是有可能是因為抑制了該酶活性,降低了8 cm花穗對應源葉的蔗糖含量。蔗糖不僅是重要的光合產物,也是植物體內運輸的主要物質,還是碳水化合物的貯存形式之一,SPS(EC 2.4.1.14)是影響蔗糖合成過程的關鍵酶,噴施赤霉素的T2、T4和T5處理,以及多效唑的T6處理對5 cm花穗相應源葉的SPS活性都有促進作用,T2、T3和T6處理對8 cm花穗相應源葉的SPS活性有促進作用,這就使得這幾個處理會有效增加胡椒源葉蔗糖含量。SAI(EC 3.2.1.26)是水解蔗糖的關鍵酶,花穗長至5 cm時,噴施赤霉素的T4處理會降低SAI活性增加蔗糖含量,噴施多效唑的T6處理可以有效提高SAI活性降低蔗糖含量;花穗長至8 cm時,噴施赤霉素的T2、T3處理和噴施多效唑的T6處理可以有效提高源葉SAI活性,降低蔗糖含量,T5處理顯著降低源葉SAI活性,有助于提高蔗糖含量。
2.4.4 ?噴施赤霉素對胡椒源葉淀粉代謝相關酶活性的影響 ?淀粉在葉片碳代謝中扮演著重要角色,它既是碳水化合物的儲存形式,又可以水解為供給植物生長需要的糖類物質,在葉片中的它和蔗糖的比例調控著開花時間,蔗糖淀粉比過高會延遲開花,所以,研究淀粉合成和分解相關酶的活性尤為重要。從圖6可見,噴施赤霉素和多效唑可以提高5 cm花穗對應葉片中可溶性淀粉合成酶SSS(EC 2.4.1.21)活性,其中T2~T4、T6處理可以顯著增加SSS活性,這就可以促進葉片淀粉含量的增加,但是,研究發現只有T4和T6處理提高了淀粉含量,所以,可能T2和T3處理的淀粉水解量增多了;在花穗長至8 cm時,T2~T4處理會降低SSS活性,減少淀粉的合成,這可能是因為這時需要更多的蔗糖供給花穗發育,但是,在花穗長至8 cm時,這3個處理相對于T1處理并沒有顯著降低源葉淀粉含量,所以,可能淀粉水解量減少了,這就需要測定葉片中淀粉水解酶β-amylase(3.2.1.2 EC)的活性。噴施赤霉素的T2、T3處理,在5 cm花穗對應的葉片中并沒有提高β-amylase活性,所以,T2和T3處理下,5 cm花穗對應葉片淀粉含量沒有增加,不只與淀粉代謝有關。同樣,在T2~T4處理下也沒有降低8 cm花穗對應葉片的β-amylase活性,所以,這3個處理下葉片淀粉含量增加也不是通過調控淀粉合成和代謝酶活性來實現的,有可能是源庫調節來實現的。
3 ?討論
國內市場胡椒供需矛盾突出,增產是推動產業發展的關鍵,研究光強調花促果過程中發現適宜光強提高了葉片淀粉和赤霉素含量后可以實現促花,但是淀粉和赤霉素如何調控花量實現增產的生理機理尚不清楚。本研究采用赤霉素噴施的方法,研究了赤霉素對胡椒源葉形態、光合作用、光合產物含量和代謝相關酶活性的影響,以此來探尋外源赤霉素調控胡椒源葉形態和生理實現增產的機理。
研究發現噴施赤霉素60 mg/L時胡椒產量達最大值,而影響胡椒產量的花穗數目此時最多,這是產量增加的主要原因。植物生殖生長過程主要是光合產物在源葉的產生和積累以及向花穗發育的庫器官的轉運過程[33]。在噴施赤霉素后胡椒葉面積增大,這就為源器官產生更多碳源奠定了基礎。根據溢流假說,當光合作用的速率超過葉片輸出或儲存蔗糖的能力時,就會合成淀粉[34-35]。本研究發現外源60 mg/L赤霉素噴施胡椒,增加了胡椒葉片光合速率,這就有利于胡椒葉片淀粉合成,但是葉片淀粉含量在該處理下有大量累積,所以,赤霉素可能通過改變糖代謝過程因子實現了對葉片蔗糖和淀粉比例的調控,使糖類物質更多地轉變為淀粉累積于葉片,誘導胡椒花穗數目增加[20]。所以接下來又分析了源葉蔗糖淀粉比,發現在花穗長至5 cm時,對應源葉的蔗糖和淀粉含量均高于對照,但是淀粉增加值相對較高,在花穗長至8 cm時,對應源葉的蔗糖低于對照,淀粉含量依舊高于對照,所以蔗糖淀粉比還是較低。所以,推測某種因子調控了蔗糖和淀粉在葉片中的占比,促使淀粉在葉片累積。
葉片形態的改變可以改變光合產物總量,但是光合和糖代謝的調控作用能夠誘導蔗糖和淀粉在葉片中分配比例,研究發現,外源60 mg/L赤霉素噴施胡椒并沒有誘導光合碳同化作用關鍵酶Rubisco活性的增加,所以,赤霉素沒有誘導光合碳同化總量增加。研究蔗糖代謝相關酶活性發現,外源60 mg/L赤霉素噴施胡椒,5 cm花穗對應葉片中,合成酶SPS活性增加和降解酶SAI活性降低促使蔗糖含量增加,8 cm花穗對應葉片,合成和降解都和對照沒有顯著差異,但是蔗糖含量卻顯著降低,這可能是海藻糖代謝調控消耗了蔗糖導致的[36]。淀粉代謝相關酶研究發現,5 cm花穗對應葉片中,合成酶SSS和降解酶β-淀粉酶活性都增加,淀粉含量高,8 cm花穗對應葉片,合成酶活性降低,降解酶活性增加,淀粉含量卻沒有減少,這可能是海藻糖代謝過程中6-磷酸海藻糖含量增加,抑制了淀粉的降解[15]。
已有研究表明6-磷酸海藻糖是調控葉片蔗糖淀粉比的關鍵因子,它能抑制淀粉降解[15],海藻糖含量降低,或者海藻糖與6-磷酸海藻糖的比值降低,都會增加花穗數目[16],所以,接下來又進行了源葉海藻糖含量的測定,研究發現,外源60?mg/L赤霉素噴施胡椒,源葉海藻糖含量較對照有顯著降低,海藻糖含量的降低,可能源于6-磷酸海藻糖含量的累積,6-磷酸海藻糖累積既抑制淀粉降解,所以,該處理條件下胡椒源葉淀粉顯著累積,花穗數目增加可能是海藻糖調控淀粉累積導致的,也可能是海藻糖含量降低直接誘導花穗數目增加的,這需要進一步研究海藻糖和淀粉間的代謝調控關系。
綜上所述,適宜濃度赤霉素噴施胡椒可以通過調控海藻糖代謝途徑,反饋調控淀粉代謝途徑,抑制淀粉降解,誘導胡椒花量增加,進而提高胡椒產量。所以生產上可以通過噴施赤霉素抑制淀粉降解,提高胡椒產量。
參考文獻
張華昌. 胡椒果實性狀與產量關系的研究[J]. 廣西熱作科技, 1997(3): 30-32.
Zu C, Wu G P, Li Z G, et al. Regulation of black pepper inflorescence quantity by shading at different growth stages[J]. Photochemistry and Photobiology, 2016, 92(4): 579-586.
Galv?o V, Schmid M. Regulation of flowering by endogenous signals[M]. In Advance in Botanical Research, Fornara F, Ed.; Elsevier: Amsterdam, The Netherlands, 2014: 63-102.
Porri A, Torti S, Romera-Branchat M, et al. Spatially distinct regulatory roles for gibberellins in the promotion of flowering of Arabidopsis under long photoperiods[J]. Development, 2012, 139(12): 2198-2209.
Xue J Q, Li T T, Wang S L, et al. Defoliation and gibberellin synergistically induce tree peony flowering with non- structural carbohydrates as intermedia[J]. Journal of Plant Physiology, 2019, 233: 31-41.
Guan Y R, Xue J Q, Xue Y Q, et al. Effect of exogenous GA3 on flowering quality, endogenous hormones, and hormone- and flowering-associated gene expression in forcingcultured tree peony (Paeonia suffruticosa)[J]. Journal of Integrative Agriculture, 2019, 18(6): 1295-1311.
Xing L B, Zhang D, Li Y M, et al. Transcription profiles reveal sugar and hormone signaling pathways mediating flower induction in apple (Malus domestica Borkh.)[J]. Plant & Cell Physiology, 2015, 56(10): 2052-2068.
Yamaguchi N, Winter C M, Wu M F, et al. Gibberellin acts positively then negatively to control onset of flower formation in Arabidopsis[J]. Science, 2014, 344: 638-641.
Nakagawa M, Honsho C, Kanzaki S, et al. Isolation and expression analysis of flowering locus T-like and gibberellin metabolism genes in biennial-bearing mango trees[J]. Scientia Horticulturae, 2012, 139: 108-117.
Wilkie J D, Sedgley M, Olesen T. Regulation of floral initiation in horticultural trees[J]. Journal of Experimental Botany, 2008, 59(12): 3215-3228.
Radi A, Lange T, Niki T, et al. Ectopic expression of pumpkin gibberellin oxidases alters gibberellin biosynthesis and development of transgenic Arabidopsis plants[J]. Plant Physiology, 2006, 140: 528-536.
陳 ?顯. 外源赤霉素對油茶成花調控機理的研究[D]. 長沙: 中南林業科技大學, 2013
Turnbull C. Long-distance regulation of flowering time[J]. Journal of Experimental Botany, 2011, 62: 4399-4413.
MacNeill G J, Mehrpouyan S, Minow M A A, et al. Starch as a source, starch as a sink: the bifunctional role of starch in carbon allocation[J]. Journal of Experimental Botany, 2017, 68(16): 4433-4453.
Martins M C M, Hejazi M, Fettke J, et al. Feedback inhibition of starch degradation in Arabidopsis leaves mediated by trehalose 6-phosphate[J]. Plant Physiology, 2013, 163(3): 1142-1163.
Carillo P, Feil R, Gibon Y, et al. A fluorometric assay for trehalose in the picomole range[J]. Plant Methods, 2013, 9(1): 21.
Huber S C, Huber J L. Role and regulation sucrose phosphate synthase in higher plants[J]. Annual Review Plant Physiology and Plant Molecular Biology, 1996, 47: 431-444.
Ruan Y L, Jin Y, Yang Y J, et al. Sugar input, metabolism, and signaling mediated by invertase: Roles in development, yield potential, and response to drought and heat[J]. Molecular Plant, 2010, 3(6): 942-955.
Rabot A, Portemer V, Péron T, et al. Interplay of sugar, light and gibberellins in expression of rosa hybrida vacuolar invertase 1 regulation[J]. Plant & Cell Physiology, 2014, 55(10): 1734-1748.
Zu C, Yang J, Wang C, et al. Carbohydrate activity regulation of floral quantity during the juvenile phase in black pepper[EB/OL]. (2018-09-10) [2020-01-12]. https://doi.org/ 10.1101/414938.
張華昌, 梁淑云, 譚樂和. 胡椒葉片營養診斷采樣方法的研究[J]. 熱帶作物學報, 1996, 17(1): 45-49.
魚 ?歡, 祖 ?超, 楊建峰, 等. 應用SPAD葉綠素儀測定不同位置胡椒葉片的SPAD值[J]. 熱帶作物學報, 2012, 33(10): 1890-1895.
張志良, 李小方. 植物生理學實驗指導[M]. 北京: 高等教育出版社, 2016.
López-Delgado H, Zavaleta-Mancera A H, Mora-Herrera E M, et al.?Hydrogen?peroxide increases potato tuber and stem starch content, stem diameter, and stem lignin content[J]. American Journal?of?Potato?Research, 2005, 82(4): 279-285.
李艷玲, 張顯忠, 苗 ?苗, 等. 蒽酮-硫酸法測定海藻糖含量顯色條件的改進[J]. 食品工業科技. 2009, 30(2): 296-298.
Wishnick M, Lane M D. Ribulose diphosphate carboxylase from spinach leaves[J]. Methods Enzymol, 1971, 23: 570 -577.
Schrader S, Sauter J J. Seasonal changes of sucrose- phosphate synthase and sucrose synthase activities in poplar wood (Populus × canadensis Moench ?robusta?) and their possible role in carbohydrate metabolism[J]. Journal of Plant Physiology, 2002, 159(8): 833-843.
Jiang H W, Dian W M, Wu P. Effect of high temperature on fine structure of amylopectin in rice endosperm by reducing the activity of the starch branching enzyme[J]. Phytochemistry, 2003, 63(1): 53-59.
Miron D, Schaffer A A. Sucrose phosphate synthase, sucrose synthase, and invertase activities in developing fruit of Lycopersicon esculentum Mill. and the sucrose accumulating Lycopersicon hirsutum Humb. and Bonpl[J]. Plant Physiology, 1991, 95(2): 623-627.
Dziedzoave N T, Graffham A J, Westby A, et al. Influence of variety and growth environment on b-amylase activity of flour from sweet potato (Ipomea batatas)[J]. Food Control, 2010, 21(2): 162-165.
邢谷楊, 林鴻頓. 胡椒高產栽培技術[M]. 海口: 海南出版社, 2003.
Li S, Tian Y H, Wu K, et al. Modulating plant growth-metabolism coordination for sustainable agriculture[J]. Nature, 2018, 560: 595-600.
Yu S M, Lo S F, Ho T H D. Source-sink communication: regulated by hormone, nutrient, and stress cross-signaling[J]. Trends in Plant Science, 2015, 20(12): 844-857.
Cseke C, Balogh A, Wong J H, et al. Fructose 2,6-bisphosphate: a regulator of carbon processing in leaves[J]. Trends in Biochemical Sciences, 1984,?9(12):?533-535.
Stitt M, Lunn J, Usadel B. Arabidopsis and primary photosynthetic metabolism: more than the icing on the cake[J]. The Plant Journal, 2010, 61(6): 1067-1091.
Lunn J E, Delorge I, Figueroa C M, et al. Trehalose metabolism in plants[J]. The Plant Journal, 2014, 79(4): 544-567.
責任編輯:沈德發

