胰島素自身抗體陰性外源性胰島素抗體綜合征1例報道
劉 陽,劉 柳,丁雄英,史 昕,周春歡,曹政媛
(1.貴航貴陽醫院檢驗科,貴州 貴陽 550004;2.貴航貴陽醫院內分泌科,貴州 貴陽 550004)
注射胰島素是臨床治療糖尿病的常用方法之一,但外源性胰島素治療后可能會誘發體內產生胰島素自身抗體(insulin antibody,IA),出現高胰島素血癥,表現為血糖波動大、嚴重胰島素抵抗(insulin resistance,IR)等,該組臨床表現被稱為外源性胰島素抗體綜合征(exogenous insulin antibody syndrome,EIAS)[1]。EIAS的主要臨床特征為:(1)通過外源性胰島素或類似物誘導;(2)常見嚴重的胰島素抵抗,甚至低血糖[2];(3)IA水平隨產生時間的延長逐漸下降。在實際工作中常遇見胰島素與C肽測定結果背離的現象,需要臨床根據病情、診斷和檢驗、檢查結果綜合判斷。本文介紹1例采用聚乙二醇(polyethylene glycol,PEG)沉淀法[3]輔助診斷IA陰性EIAS病例,為臨床提供參考。
1 病例資料
患者,女,62歲。因“發現血糖升高12年,視物模糊1周”于2019年8月6日至貴航貴陽醫院住院治療。患者12年前體檢發現血糖升高,具體結果不詳,未予特殊處理。10年前無明顯誘因出現乏力、頭昏、惡心,于貴航貴陽醫院完善相關檢查后明確診斷為2型糖尿病,給予二甲雙胍0.5 g口服(早、晚餐時)、精蛋白生物合成人胰島素皮下注射(早餐前16 U、晚餐前14 U)降糖至今。1周前無明顯誘因出現視物模糊。
體格檢查:體溫36.5 ℃,脈搏78次/min,呼吸18次/min,血壓19.95/11.44 kPa(150/86 mmHg)。口唇黏膜、心、肺、腹部無異常,雙下肢無浮腫。專科檢查:雙側下肢痛覺、溫度覺、觸覺、震動覺減退。輔助檢查:空腹血糖、餐后2 h血糖、糖化血紅蛋白、空腹胰島素監測結果見表1;空腹C肽1.96 ng/mL(參考區間為1.1~4.4 ng/mL),IgA 2.52 g/L,IgG 12.59 g/L,IgM 0.60 g/L,類風濕因子10.3 U/mL,抗鏈球菌溶血素O 10.3 U/mL。糖尿病自身抗體(外院檢測):抗胰島素抗體(IgG)(免疫印跡法)陰性,抗胰島細胞抗體(IgG)(免疫印跡法)陰性,抗谷氨酸脫羧酶抗體1.18 U/mL(參考區間為0.00~5.00 U/mL)。尿常規(干化學法):酮體±,葡萄糖±,蛋白質1+。尿微量白蛋白734.2 mg/L,尿微量白蛋白/肌酐(creatinine,Cr)比值107.42 mg/mmol Cr。大便隱血+。眼底照相示:糖尿病視網膜病變,眼底出血。血常規、糞便常規、血凝項目、肝功能、腎功能、電解質、心肌標志物、甲狀腺功能、心臟彩超、腹部超聲、頸部血管超聲、X線片、頭顱電子計算機斷層掃描、心電圖等均未見明顯異常。
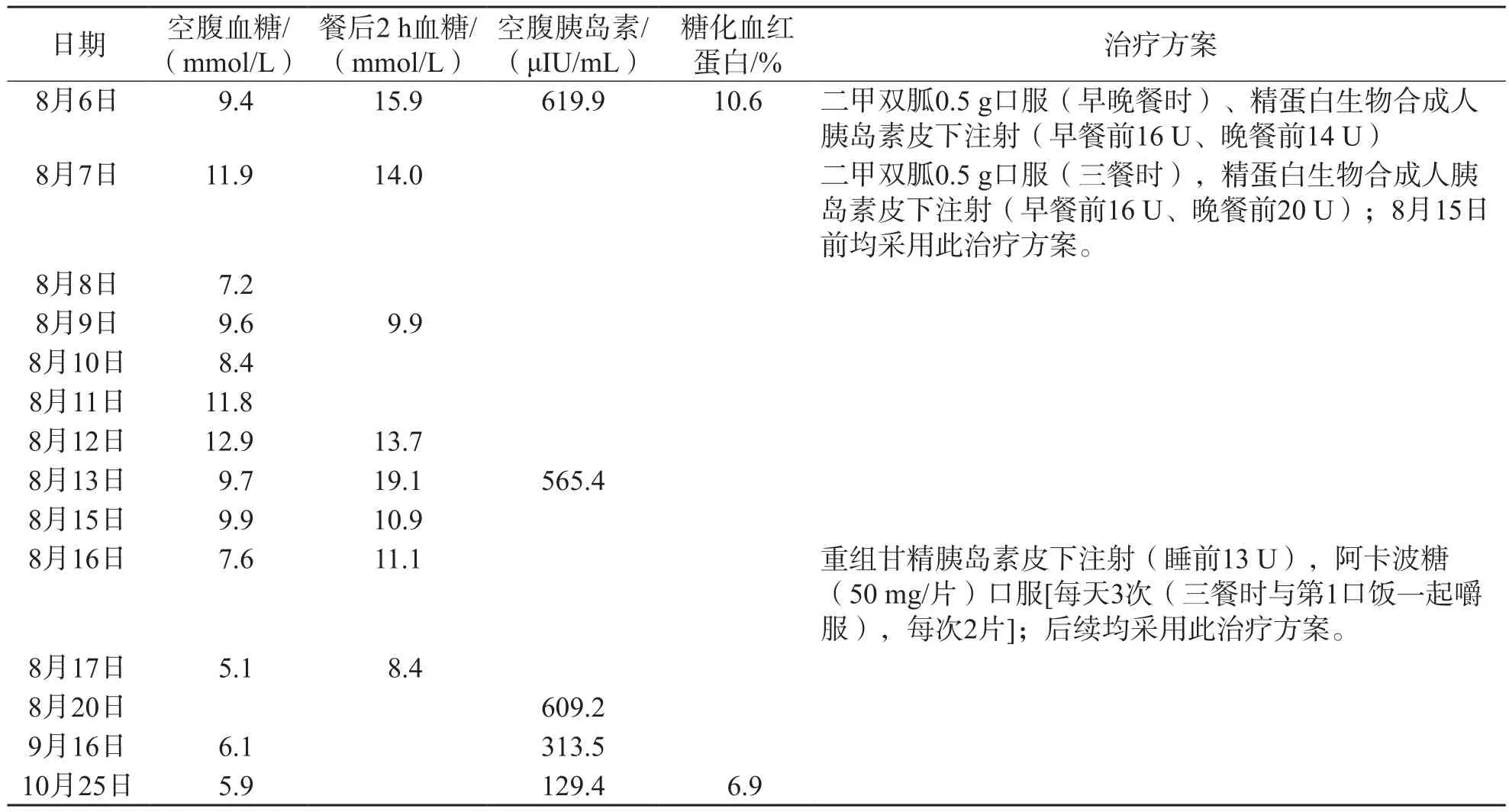
表1 患者血糖控制情況、相關檢查結果及治療方案
患者8月6日入院時的空腹血糖為9.4 mmol/L,餐后2 h血糖為15.9 mmol/L,空腹胰島素明顯升高(619.9 μIU/mL),與C肽的檢測結果(1.96 ng/mL)不匹配。8月7日參考《中國2型糖尿病防治指南》(2017年版)[4]調整降糖方案后檢測空腹血糖,結果為7.2~12.9 mmol/L,餐后2 h血糖為9.9~19.1 mmol/L,空腹胰島素仍明顯升高(565.4 μIU/mL)。
2 空腹胰島素升高原因及治療后監測結果
經過與臨床科室反復溝通,發現僅增加患者胰島素用量,血糖結果會短暫降低,隨后又再次增高,而胰島素檢測結果未見明顯下降,因此懷疑血清中存在某種與胰島素親和力高的物質影響了胰島素的檢測結果。采用PEG沉淀法處理患者血清。具體步驟:(1)配制25%PEG溶液,稱取25 g PEG6000(天津致遠化學試劑有限公司),加入60 mL18~25 ℃的去離子水,混勻15 min,定容至100 mL;(2)將800 μL血清樣本加入800 μL 25% PEG6000溶液中,混勻10 s,然后3 030×g離心10 min;(3)取上清液,采用cobas e601電化學發光免疫分析儀(瑞士羅氏公司)及配套試劑(電化學發光法)檢測胰島素水平,同時檢測未經PEG沉淀法處理的患者血清樣本。按照公式:回收率=(處理后胰島素結果×2)/處理前胰島素結果×100%計算回收率。不同時間的患者樣本采用PEG沉淀法處理后的胰島素水平及回收率見表2。
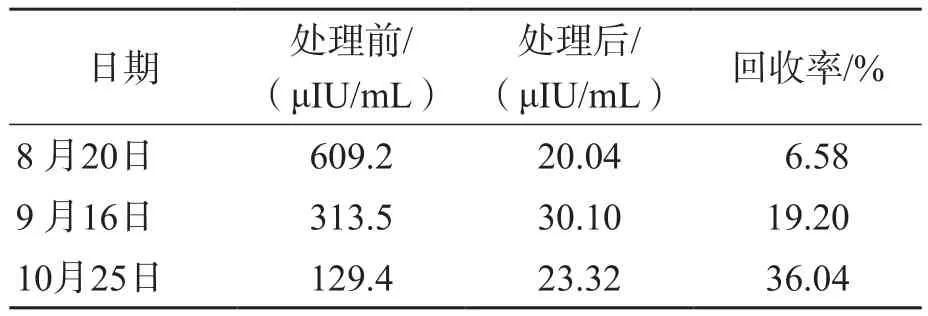
表2 采用PEG沉淀法處理前、后血清胰島素水平及回收率
由于患者除糖尿病自身抗體3項(抗胰島素抗體-IgG、抗胰島細胞抗體-IgG、抗谷氨酸脫羧酶抗體)為陰性外,其他檢查結果和體征均有EIAS的特征,因此臨床進一步調整方案進行對癥治療:將原方案中預混人胰島素(精蛋白生物合成人胰島素)更換成胰島素類似物(重組甘精胰島素),同時搭配阿卡波糖控制餐后血糖水平。8月20日的患者血清樣本采用PEG沉淀法處理后,胰島素為40.08 μIU/mL,回收率為6.58%。經過一段時間治療后,空腹血糖水平維持在6.0 mmol/L左右,糖化血紅蛋白為6.9%,PEG沉淀法處理前的胰島素水平明顯降低,回收率由6.58%上升至36.04%。
10月28日,對患者的糖尿病自身抗體進行第2次復查,結果顯示抗胰島素抗體、抗胰島細胞抗體均為陰性,抗谷氨酸脫羧酶抗體為1.18 U/mL,將樣本送貴州省人民醫院檢測抗胰島細胞抗體、抗谷氨酸脫羧酶抗體,結果均為陰性。另外,患者末梢血血糖的多次檢測結果顯示:空腹、餐后、睡前及凌晨均未出現低血糖結果,既往也無低血糖癥狀,但夜間血糖較低,空腹血糖較高。輔助檢查、體格檢查結果均否認胰島素瘤及黑棘皮病可能,否認服用含巰基藥物、中藥及成分不明藥物。
3 討論
胰島素自身免疫綜合征(insulin autoimmune syndrome,IAS)與EIAS一般有以下區別:(1)IAS一般由內源性的胰島素物質誘導產生,而EIAS一般由外源性胰島素誘導產生;(2)IAS產生的抗體具有高胰島素結合容量、低親和力的特點,IAS患者更易發生低血糖[5],而EIAS產生的抗體通常是低胰島素結合容量、高親和力[6],常導致嚴重的IR;(3)IAS與EIAS產生的抗體特征不同[7],通常外源胰島素所致抗體的滴度相對較低,可自愈[8]。結合上述特征,本例患者傾向診斷為EIAS。
在胰島素水平相同時,IAS患者體內的胰島素可結合更多抗體,但不緊密,在外部因素刺激的情況下易分離;而EIAS患者結合抗體數量少,且緊密,易出現高胰島素結果,采用PEG沉淀法可以去除抗體和抗體包裹的大分子物質,僅剩游離胰島素。見圖1。

圖1 IAS與EIAS產生的抗體在外部因素刺激時的變化
本研究采用PEG沉淀法的主要作用是去除胰島素-免疫球蛋白復合物[9]。糖尿病自身抗體多為IgG類,但有少數IgE、IgM類抗體的報道[10]。由于這些抗體相對分子質量均大于IgG類抗體,所以采用PEG沉淀法可去除胰島素-免疫球蛋白復合物的干擾。因為這類物質可能保留了免疫學活性,但喪失了降低血糖的生物學性質。檢測剩余未被抗體結合的游離胰島素,其結果越低,說明患者體內胰島素與抗體結合越接近飽和。此時若加大胰島素注射劑量,則可能出現低血糖風險。
由于本例患者急需進行眼部手術,因此只能將原本完全停用胰島素、更換為口服降糖藥的治療方案改為使用長效胰島素+口服藥物控制餐后血糖的方案。可能由于不同胰島素制劑的來源及結合位點不同,患者血糖控制尚可,胰島素回收率上升,表明IR正在緩解。
總之,糖尿病的發展過程是各組織、器官由量變到質變的過程,因此某些定性檢驗方法會因待測物尚未達到檢測“閾值”而出現假陰性結果。在EIAS的診療過程中無需等患者出現胰島素抗體陽性甚至低血糖癥狀[8]后再進行干預,血清胰島素與C肽出現背離現象、IR、PEG處理后胰島素回收率降低等有助于早期診斷EIAS。

