次氯酸鈉對德爾卑沙門氏菌生物被膜的抑制作用及機制
閆玉卿,張一敏,董鵬程,毛衍偉,梁榮蓉,朱立賢,*,羅 欣,2
(1.山東農業(yè)大學食品科學與工程學院,山東 泰安 271018;2.江蘇省肉類生產與加工質量安全控制協(xié)同創(chuàng)新中心,江蘇 南京 210095)
沙門氏菌(Salmonellaspp.)是一種可以使人畜患病的革蘭氏陰性腸道桿菌[1],在肉類食品中的污染率較高[2]。沙門氏菌易引起高暴發(fā)率食源性疾病,威脅著人類的健康,2008—2015年間,我國因微生物導致的食物中毒事件占62.02%,其中沙門氏菌所引起中毒事件占比為23%,居于首位[3]。生物被膜是一種附著在接觸表面上,由細菌和細菌分泌的細胞外聚合物(extracellular polymeric substance,EPS)共同形成的致密網(wǎng)絡結構[4]。研究發(fā)現(xiàn)生物被膜是引起細菌污染的重要原因之一,由食源性致病菌引起的食物變質和生物被膜的形成已成為食品工業(yè)中的嚴重問題[5]。一般而言,生物被膜中的細菌比懸浮狀態(tài)的浮游菌具有更高的抵抗環(huán)境脅迫(如干燥、紫外線或消毒劑)的能力[6],因而對生物被膜的控制更加困難。沙門氏菌可以分為不同的血清型,不同地區(qū)的沙門氏菌血清型的流行程度不同,到目前為止,已經(jīng)鑒定出2 600多種沙門氏菌血清型[7]。本課題組在2014年報道了我國肉牛屠宰環(huán)節(jié)沙門氏菌的檢出率是6.5%,S. Derby是分離的野生菌株中主要的血清型之一[8],且研究發(fā)現(xiàn)S. Derby在25 ℃條件下有較高的生物被膜形成能力[9],因而本實驗選取野生菌株S. Derby作為實驗菌株進行生物被膜的探究。
生物被膜的形成機制復雜,與細菌的黏附、EPS產生、生物被膜內細胞代謝活性等密切相關。次氯酸鈉具有良好的廣譜殺菌活性,因其高功效和低成本成為食品工業(yè)中廣泛使用的消毒劑[10],在水中,次氯酸鈉發(fā)生水解反應生成次氯酸,在滅活細菌方面比ClO-更有效[11]。據(jù)報道,次氯酸鈉可氧化細菌蛋白質并導致細菌死亡[12]。深入了解次氯酸鈉脅迫條件下沙門氏菌生物被膜的形成及其機制有助于提出更好的減少和消除食品行業(yè)生物被膜的策略。此前已有研究發(fā)現(xiàn)次氯酸鈉對于生物被膜具有一定的控制效果[13-15],但其作用機制尚不完全清楚,目前缺少定量評估次氯酸鈉影響沙門氏菌生物被膜EPS含量、運動性以及微觀結構等的報道。
因此,本研究將不同體積分數(shù)的次氯酸鈉作用于S. Derby及其生物被膜,探究其對浮游菌的抑制作用以及對生物被膜的抑制和清除效果。此外,從生物被膜內細胞的代謝活性、細菌的泳動能力、EPS含量和微觀結構方面分析不同體積分數(shù)次氯酸鈉對它們的影響,以探究次氯酸鈉對沙門氏菌生物被膜的抑制機制。本研究結果可以為肉類企業(yè)中生物被膜的消減提供參考。
1 材料與方法
1.1 菌株與試劑
S. Derby分離自山東省肉牛屠宰廠[8],由山東農業(yè)大學食品科學與工程學院畜產品加工實驗室保存。
胰蛋白胨大豆肉湯(tryptic soy broth,TSB)液體培養(yǎng)基、胰蛋白胨大豆瓊脂(tryptic soy agar,TSA)培養(yǎng)基、D/E中和肉湯培養(yǎng)基、葡萄糖、細菌瓊脂粉、LB培養(yǎng)基 北京陸橋技術股份有限公司;氯化鈉、結晶紫染料 國藥集團化學試劑有限公司;10%次氯酸鈉、95%乙醇 天津凱通化學試劑有限公司;磷酸鹽緩沖液(phosphate buffered saline,PBS)(0.01 mol/L,pH 7.2~7.4)、CCK-8試劑盒、刃天青 北京索萊寶科技有限公司;96 孔板、24 孔板、細菌培養(yǎng)板 美國康寧公司;BCA蛋白定量試劑盒 北京康為世紀生物科技有限公司;LIVE/DEAD熒光染液 美國賽默飛世爾科技有限公司。
1.2 儀器與設備
G154DWS滅菌鍋 廈門致微公司;多道移液槍德國Eppendorf公司;Epoch2型酶標儀 美國 BioTek公司;HF safe-MJQ1型紅外線滅菌器 上海力申科學儀器有限公司;LSM880激光共聚焦掃描顯微鏡 德國Zeiss公司。
1.3 方法
1.3.1 菌種活化及生物被膜定量
將凍存于-20 ℃的S. Derby融解,接種于新鮮的TSB液體培養(yǎng)基中,在37 ℃下過夜培養(yǎng)18 h進行活化,經(jīng)2 次活化后菌液濃度約為9(lg(CFU/mL)),備用。
將上述菌液在8 000×g、4 ℃下離心10 min,去上清液,無菌生理鹽水重復洗滌沉淀2 次,使用無菌生理鹽水調整菌液濃度至7(lg(CFU/mL)),在96 孔板中加入100 μL TSB培養(yǎng)液并接種100 μL上述菌液,以只加200 μL的新鮮TSB培養(yǎng)液作為陰性對照。每個樣本重復6 個孔。96 孔板加蓋后,放置在25 ℃培養(yǎng)箱培養(yǎng)7 d,期間每天對S. Derby生物被膜進行定量。
采用結晶紫染色法對生物被膜定量:棄去孔內培養(yǎng)液,用PBS沖洗3 次除去浮游菌,在室溫下自然風干45 min。避光條件下每個孔中加200 μL結晶紫染液,避光染色30 min。棄去孔內染液,用PBS沖洗3 次除去多余染料,在室溫下自然風干45 min。向每個孔中加200 μL體積分數(shù)95%乙醇溶液,洗脫與生物被膜定量結合的染液。30 min后使用酶標儀測定OD570nm[16-17]。
采用平板菌落計數(shù)法對生物被膜進行定量:棄去孔中的培養(yǎng)液,用200 μL無菌生理鹽水清洗3 次后,用刮刀將生物被膜細菌刮下,200 μL無菌生理鹽水重懸被膜,梯度稀釋,用TSA平板計數(shù)[18]。
1.3.2S. Derby的最小抑菌濃度與最小殺菌濃度測定
使用TSB培養(yǎng)液通過二倍稀釋法得到不同體積分數(shù)的次氯酸鈉溶液,分別取100 μL添加到96 孔板中。采用1.3.1節(jié)中的方法將活化的菌液濃度調整為5(lg(CFU/mL)),取100 μL該菌懸液加入96 孔板中與次氯酸鈉溶液混合,使次氯酸鈉溶液的終體積分數(shù)分別為0.32%、0.16%、0.08%、0.04%、0.02%、0.01%、0,每個樣本重復6 個孔。將96 孔板置于37 ℃恒溫培養(yǎng)箱中培養(yǎng)24 h。向每孔中加入10 μL 6.75 g/L的刃天青溶液(藍色),然后在37 ℃的培養(yǎng)箱中培養(yǎng)18 h。孔中溶液顏色由藍變紅即為有細菌生長,未發(fā)生顏色變化的最低體積分數(shù)即為最小抑菌濃度(minimum inhibitory concentration,MIC)[19]。將孔中混合菌液均勻涂布于TSA平板上,37 ℃培養(yǎng)24 h后無菌體生長的最低體積分數(shù)即為最小殺菌濃度(minimum bactericidal concentration,MBC)[15]。
1.3.3 次氯酸鈉抑制S. Derby生長曲線的測定
在96 孔板中加入100 μL TSB培養(yǎng)液,加入100 μL體積分數(shù)0.32%的次氯酸鈉后依次二倍稀釋。采用1.3.1節(jié)中的方法將菌液稀釋至7(lg(CFU/mL)),并接種菌液至96 孔板內,使得孔中的次氯酸鈉終體積分數(shù)分別為0(對照)、1/8 MIC、1/4 MIC、1/2 MIC、MIC,每個樣本重復6 個孔。將96 孔板置于25 ℃恒溫培養(yǎng)箱中培養(yǎng)24 h,每1 h取出使用酶標儀測其在600 nm波長處的OD值,收集數(shù)據(jù),繪制生長曲線[20]。
1.3.4 次氯酸鈉對S. Derby生物被膜的抑制率與清除率測定
按照1.3.3節(jié)中的方法制備含不同體積分數(shù)次氯酸鈉的混合菌液,于25 ℃培養(yǎng)4 d。利用結晶紫染色法測得每個處理組在570 nm波長處的OD值,記為OD1,不含次氯酸鈉的對照組記為OD0。次氯酸鈉對生物被膜的抑制率按公式(1)計算[21]。
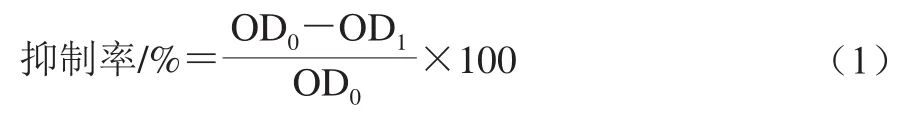
采用1.3.1節(jié)中的方法將活化的菌液濃度調整為7(lg(CFU/mL)),在96 孔板中加入100 μL TSB培養(yǎng)液并接種100 μL上述菌液,以只加200 μL的新鮮TSB培養(yǎng)液作為陰性對照。于25 ℃培養(yǎng)4 d(生物被膜達到成熟),棄去孔中的培養(yǎng)液,使用200 μL無菌生理鹽水清洗3 次。分別加入200 μL體積分數(shù)為0(對照)、1/4 MIC、1/2 MIC、MIC、2 MIC的次氯酸鈉溶液靜置處理15 min,吸出上清液;加入D/E中和肉湯培養(yǎng)基處理5 min后吸出上清液。使用刮刀將生物被膜細菌刮下,200 μL無菌生理鹽水重懸被膜,梯度稀釋,用TSA平板計數(shù)。每個樣本重復6 個孔。次氯酸鈉處理組計數(shù)為N1,對照組記為N0,次氯酸鈉對生物被膜的清除率按公式(2)計算[22-23]。
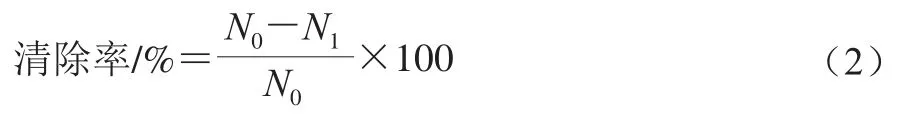
1.3.5S. Derby泳動能力的測定
菌株泳動能力的測定采用軟瓊脂平板法,單一泳動平板的配方:質量分數(shù)0.3%瓊脂、2.5 g/L葡萄糖、5 g/L NaCl、10 g/L胰蛋白胨。群集泳動平板的配方:質量分數(shù)0.5%瓊脂粉、0.5 g/L葡萄糖、25 g/L LB培養(yǎng)基。制作平板時加入次氯酸鈉溶液,使得平板中次氯酸鈉的最終體積分數(shù)分別是0(對照)、1/8 MIC、1/4 MIC、1/2 MIC、MIC。將1.3.1節(jié)中活化的菌液取3 μL接種于兩種平板的中心表面,在室溫下放置20 min使菌液充分吸收;將單一泳動平板置于25 ℃下培養(yǎng)24 h,將群集泳動平板置于25 ℃下培養(yǎng)48 h,用游標卡尺測定菌株擴散圈的直徑,每種平板重復3 次[24]。
1.3.6S. Derby生物被膜內細胞代謝活性的測定
按照1.3.3節(jié)中的方法制備含不同體積分數(shù)次氯酸鈉的混合菌液,于25 ℃培養(yǎng)4 d。用PBS沖洗3 次,去除表面浮游菌,再向每孔加入100 μL PBS和10 μL CCK-8試劑,37 ℃培養(yǎng)4 h,測其在450 nm波長處的OD值。次氯酸鈉處理組記為OD1,對照組記為OD0,次氯酸鈉對S. Derby生物被膜內細胞代謝活性的抑制率計算見公式(3)[25]。
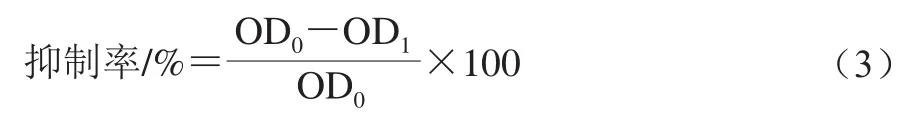
1.3.7S. Derby生物被膜胞外多糖、蛋白質量濃度測定
按照1.3.3節(jié)中的方法在24 孔板中制備含不同體積分數(shù)次氯酸鈉的混合菌液共1 mL,于25 ℃培養(yǎng)2~4 d。收集24 孔板中生物被膜并重懸于1 mL無菌去離子水中,加入0.4 mL 1 mol/L NaOH溶液,在4 ℃條件下培養(yǎng)3 h,加入0.6 mL 0.85 g/100 mL NaCl溶液,6 000×g、4 ℃下離心20 min,使用0.45 μm濾膜過濾得上清液,對濾液進行EPS分析[26]。用苯酚-硫酸法測定胞外多糖質量濃度,建立葡萄糖標準曲線,在490 nm波長處測定吸光度。利用BCA蛋白定量試劑盒測定胞外蛋白質量濃度,建立蛋白標準曲線,在562 nm波長處進行比色分析。
1.3.8 激光共聚焦掃描顯微鏡觀察
按照1.3.3節(jié)中的方法在細菌培養(yǎng)皿中制備含不同體積分數(shù)次氯酸鈉的混合菌液,于25 ℃培養(yǎng)4 d。用無菌去離子水洗滌3 次去除浮游菌,晾干。在避光條件下,對生物被膜進行染色,避光染色30 min。試劑盒中的探針SYTO-9(激發(fā)波長485 nm、發(fā)射波長498 nm)與PI(激發(fā)波長535 nm、發(fā)射波長637 nm)能分別使活、死細胞在激光共聚焦顯微鏡下呈現(xiàn)綠、紅熒光。而后使用無菌去離子水洗去多余的熒光染料,避光自然干燥,使用激光共聚焦掃描顯微鏡在63×油鏡下觀察[27]。
1.4 數(shù)據(jù)處理與統(tǒng)計分析
EPS采用SAS 9.0軟件的混合模型進行交互作用分析。采用SPSS 20.0軟件方差分析法對生物被膜定量、抑制率、清除率、代謝活性、泳動能力進行單因素方差分析。差異顯著水平為P<0.05,數(shù)據(jù)結果用平均值±標準偏差表示。使用Sigma Plot 12.5軟件作圖。
2 結果與分析
2.1 S. Derby生物被膜的形成能力
生物被膜黏附于食品加工器械表面會產生交叉污染,造成巨大的損失。有研究發(fā)現(xiàn)細菌在微孔表面形成生物被膜的量與其在食品加工器械表面的生物被膜形成量呈顯著正相關[28-29],因此,本研究通過結晶紫染色法和平板菌落計數(shù)法測定S. Derby在微孔表面生物被膜的形成情況。
圖1A、B分別為通過結晶紫染色法、平板菌落計數(shù)法測得的生物被膜形成能力。生物被膜形成量隨著培養(yǎng)時間的延長而增多。在1~4 d生物被膜處于對數(shù)增長期,生物被膜形成量顯著增加(P<0.05),在第4天進入穩(wěn)定期,達到最大黏附量(8.40(lg(CFU/mL))),生物被膜達到成熟,因此以第4天作為培養(yǎng)生物被膜成熟的時間點進行后續(xù)實驗。
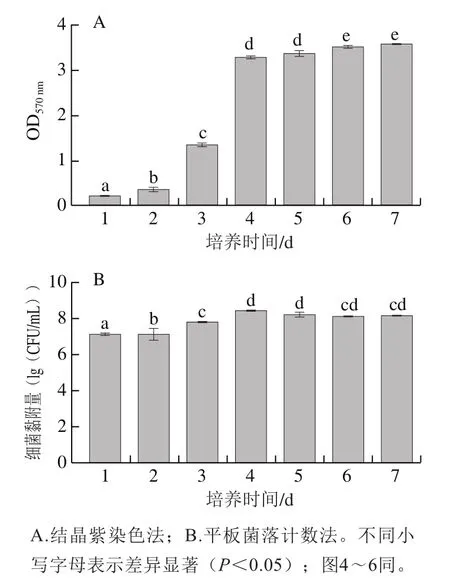
圖1 S. Derby生物被膜在培養(yǎng)7 d過程中的形成量Fig. 1 Biofilm formation capacity of Salmonella Derby during 7-day cultivation
結果顯示兩種測定方法下生物被膜的變化趨勢存在差異,這是由于生物被膜分泌的EPS易與結晶紫結合,因而結晶紫染色法主要以EPS的量來衡量被膜的生成量[30];而平板菌落計數(shù)法是通過測定生物被膜中細菌的黏附量來衡量生物被膜的形成量。通過兩種方法從不同角度來衡量生物被膜的形成能力,但均能得到隨著培養(yǎng)時間的延長,S. Derby生物被膜的形成量呈現(xiàn)上升趨勢的結論,這與Díez-García等[31]的研究結果一致。
2.2 次氯酸鈉對S. Derby的MIC與MBC
由圖2可以看出,當次氯酸鈉體積分數(shù)為0.32%、0.16%、0.08%時,孔內的液體顏色沒有變化,仍為藍色,而體積分數(shù)為0.04%、0.02%、0.01%、0的4 個孔內液體明顯變紅,孔中沒有顏色變化的次氯酸鈉最小體積分數(shù)(MIC)為0.08%。通過將孔內菌液涂布平板計數(shù)后的結果得到次氯酸鈉對S. Derby的MBC為0.08%(平板上單菌落小于5 個)。
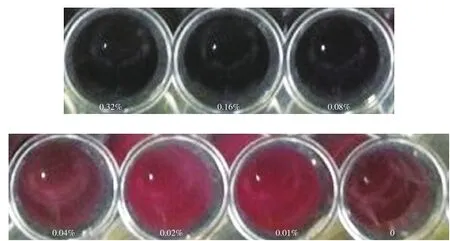
圖2 含不同體積分數(shù)次氯酸鈉的S. Derby培養(yǎng)孔板Fig. 2 The culture plate of S. Derby with different concentration of sodium hypochlorite
本研究發(fā)現(xiàn),次氯酸鈉對S. Derby的MIC為0.08%,Rodríguez-Melcón等[15]研究發(fā)現(xiàn)次氯酸鈉對于單增李斯特菌的MIC為0.32%,說明次氯酸鈉對于不同的菌MIC不同。在工業(yè)上使用次氯酸鈉消毒時體積分數(shù)通常為0.005%~0.020%,低于本實驗所測的數(shù)值,這是由于本實驗在稀釋次氯酸鈉時所用的是TSB液體培養(yǎng)基,而工業(yè)上是將次氯酸鈉在水中稀釋,TSB具有與次氯酸鈉相互作用的有機成分,但是水不具有有機成分,因此次氯酸鈉在水中的可用性更高[30]。
2.3 次氯酸鈉對S. Derby生長曲線的影響
加入不同體積分數(shù)次氯酸鈉后S. Derby在0~24 h的生長曲線如圖3所示,MIC次氯酸鈉能完全抑制浮游菌的生長,亞MIC(1/8 MIC、1/4 MIC、1/2 MIC)次氯酸鈉處理組與對照組的生長曲線均在約4 h時從遲滯期進入對數(shù)增長期,其中次氯酸鈉處理組浮游菌的增長速度與對照組相比較為緩慢。說明亞最小抑菌濃度次氯酸鈉對于浮游菌的生長具有一定的抑制作用,反映了浮游菌對低濃度常用消毒劑的敏感性,結果為食品工業(yè)控制微生物提供了優(yōu)化策略。
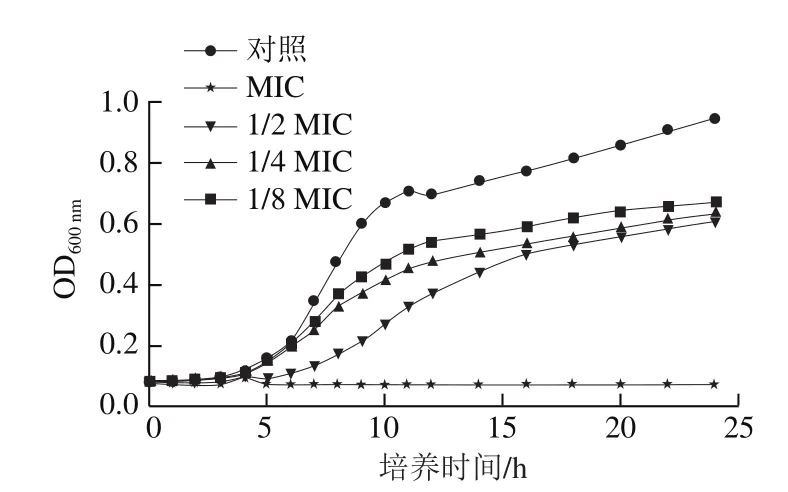
圖3 不同體積分數(shù)次氯酸鈉處理后S. Derby的生長曲線Fig. 3 Growth curves of S. Derby treated with different concentrations of sodium hypochlorite
2.4 次氯酸鈉對S. Derby生物被膜的抑制和清除作用
如圖4所示,加入不同體積分數(shù)的次氯酸鈉后,S. Derby生物被膜的形成受到抑制。在MIC、1/2 MIC下,次氯酸鈉對S. Derby生物被膜的抑制率分別達到了91.76%、90.26%,顯著高于1/4 MIC、1/8 MIC次氯酸鈉處理組(P<0.05);隨著次氯酸鈉體積分數(shù)的降低,其對生物被膜的抑制效果也逐漸減弱,當次氯酸鈉為1/8 MIC時,其對S. Derby生物被膜的抑制率降為61.45%。Bansal等[30]的研究同樣發(fā)現(xiàn),當鼠傷寒沙門氏菌暴露于體積分數(shù)0.03%的次氯酸鈉溶液中時,其生物被膜形成能力下降。在本研究中,MIC和亞MIC的次氯酸鈉均對S. Derby生物被膜具有很強的抑制作用,其中次氯酸鈉體積分數(shù)為MIC和1/2 MIC時的抑制率并無顯著差異。浮游菌的生長僅在次氯酸鈉體積分數(shù)為MIC時受到完全抑制,1/2 MIC條件下浮游菌保持較好的生長趨勢,但生物被膜形成仍被明顯抑制,可以推測次氯酸鈉并非僅靠抑制浮游菌的生長來抑制生物被膜,需從細菌代謝活性、泳動能力、胞外物質等角度探明其抑制機制。此外,本研究旨在探究次氯酸鈉對成熟階段生物被膜的抑制效果,而生物被膜的形成是一個動態(tài)的過程。浮游細菌首先可逆地附著在接觸表面,然后不可逆地結合在一起,這就導致了細菌細胞在表面的群落形成。在群體感應和其他信號分子的幫助下,生物被膜逐漸成熟并穩(wěn)定。隨后,生物被膜破裂,膜內的微生物釋放分散到新的表面黏附定植[32]。因此,在確定抑制效果的基礎上,將對次氯酸鈉發(fā)揮抑制作用的具體階段展開進一步的研究。
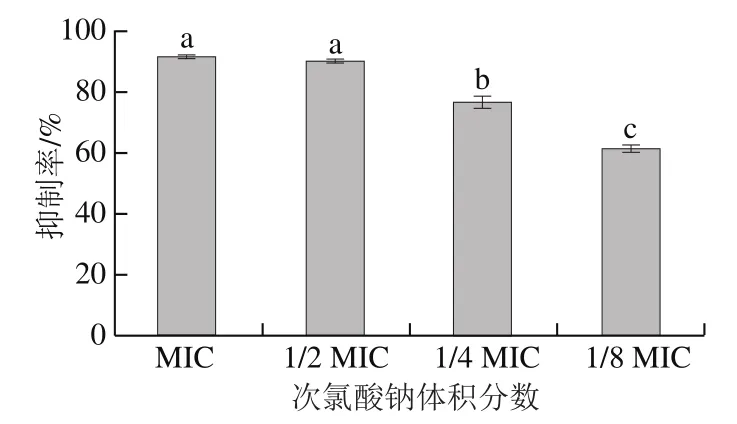
圖4 不同體積分數(shù)次氯酸鈉對S. Derby生物被膜的抑制率Fig. 4 Inhibitory rates of different concentrations of sodium hypochlorite on S. Derby biofilm
當前對于次氯酸鈉抑制生物被膜的研究相對較少,更多的是對次氯酸鈉清除生物被膜的研究。圖5顯示了不同體積分數(shù)次氯酸鈉對于成熟S. Derby生物被膜的清除作用。次氯酸鈉的清除效果隨著體積分數(shù)的降低而減弱,2 MIC下清除率最高,達到了52.60%,顯著高于1/4 MIC次氯酸鈉處理組(P<0.05),1/4 MIC下的清除效果顯著低于其他3 個體積分數(shù)處理組(P<0.05),清除率為22.03%。Gkana等[33]也證明了次氯酸鈉對沙門氏菌生物被膜及沙門氏菌與金黃色葡萄球菌的混合生物被膜具有顯著的清除作用(P<0.05)。此外,也有研究發(fā)現(xiàn)次氯酸鈉對于單增李斯特菌、大腸桿菌、熒光假單胞菌的生物被膜也具有清除作用,其中體積分數(shù)0.35%的次氯酸鈉對單增李斯特菌生物被膜的清除率能達到90%以上[34]。本研究中次氯酸鈉對S. Derby生物被膜清除率較低,也反映了生物被膜對于消毒劑的抗性。導致這一結果的原因可能是成熟的生物被膜具有較強的三維結構,并且EPS在膜內細菌中形成了一層保護屏障,因此更能耐受次氯酸鈉處理[35]。在后續(xù)的研究中可以考慮將次氯酸鈉與胞外物質分解酶類或植物精油等抑菌劑相結合,協(xié)同作用于生物被膜,以達到更好的抑制或清除效果[35-36]。
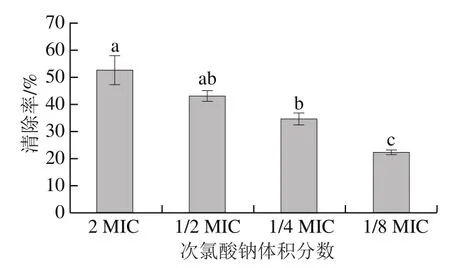
圖5 不同體積分數(shù)次氯酸鈉對S. Derby生物被膜的清除率Fig. 5 Scavenging rates of different concentrations of sodium hypochlorite on S. Derby biofilm
2.5 次氯酸鈉對S. Derby生物被膜的抑制機制
2.5.1 次氯酸鈉對S. Derby泳動能力的影響
生物被膜的形成經(jīng)歷了初始黏附、微菌落形成、成熟和分散4 個階段。浮游細菌可逆地附著在接觸表面稱為初始黏附[32],細菌的泳動能力在初始黏附過程中起著重要作用。泳動能力分為單一泳動和群集泳動,群集泳動是細菌的多細胞運動,它們以緊密結合的細胞群在固體基質上移動[37]。
表1顯示了添加不同體積分數(shù)的次氯酸鈉后S. Derby單一泳動和群集泳動能力的變化,經(jīng)次氯酸鈉處理后S.Derby單一泳動能力顯著高于對照組(P<0.05),由此可見次氯酸鈉對于S. Derby單一泳動能力并無抑制作用,反而存在一定的促進作用;對于S. Derby的群集泳動,僅MIC下的群集泳動能力顯著低于對照組(P<0.05),說明次氯酸鈉除體積分數(shù)為MIC時對S. Derby群集泳動有一定的抑制作用外,其他體積分數(shù)下均對群集泳動無顯著影響(P>0.05)。總體來說,次氯酸鈉對于S. Derby的泳動能力沒有抑制作用,因而可以推斷次氯酸鈉并未通過影響S. Derby的泳動能力來抑制其生物被膜的形成。

表1 不同體積分數(shù)次氯酸鈉對S. Derby生物被膜泳動能力的影響Table 1 Effects of different concentrations of sodium hypochlorite on swimming mobility of S. Derby biofilms
2.5.2 次氯酸鈉對S. Derby生物被膜內細胞代謝活性的影響
生物被膜的形成與其中代謝活性細胞的發(fā)展有關,細胞在發(fā)育期間進行線粒體呼吸[21]。CCK-8試劑中含有水溶性四唑鹽WST-8,WST-8在電子載體的作用下能被細胞線粒體中的脫氫酶還原為具有高度水溶性的橙黃色甲臢物,生成的甲臢物數(shù)量與活細胞數(shù)量成正比,通過酶標儀測量細胞液的OD405nm,便可檢測出待測細胞樣品的代謝活性[38]。
如圖6所示,次氯酸鈉對S. Derby生物被膜中細胞代謝活性具有較好的抑制效果。不同體積分數(shù)次氯酸鈉對S. Derby生物被膜中細胞代謝活性的抑制率差異顯著(P<0.05),隨著次氯酸鈉體積分數(shù)的升高,抑制率顯著升高(P<0.05)。其中1/8 MIC次氯酸鈉的抑制率為65.19%,MIC次氯酸鈉的抑制率達到93.88%。代謝活性實驗結果顯示次氯酸鈉能明顯降低生物被膜內細胞代謝活性,從而可以進一步推測,抑制細胞代謝活性是次氯酸鈉抑制生物被膜的原因之一。
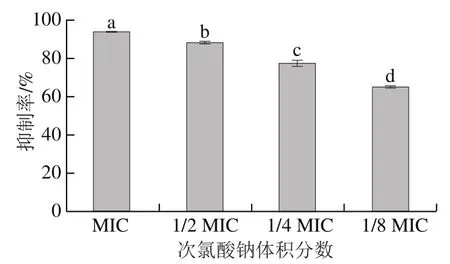
圖6 不同體積分數(shù)次氯酸鈉對S. Derby生物被膜內細胞代謝活性的抑制率Fig. 6 Inhibitory rates of different concentrations of sodium hypochlorite on biofilm metabolism of S. Derby biofilms
2.5.3 次氯酸鈉對S. Derby生物被膜胞外多糖和蛋白的影響
由表2可以看出,對照組中S. Derby生物被膜的胞外多糖質量濃度隨培養(yǎng)時間的延長而顯著上升(P<0.05),次氯酸鈉處理組在相同培養(yǎng)時間內的S. Derby胞外多糖質量濃度顯著低于對照組(P<0.05),由此可見,在培養(yǎng)2~4 d的過程中,次氯酸鈉均對S. Derby胞外多糖的產生有抑制作用,其中MIC時的抑制效果最好。

表2 不同體積分數(shù)次氯酸鈉對S. Derby生物被膜胞外多糖的影響Table 2 Effects of different concentrations of sodium hypochlorite on extracellular polysaccharides of S. Derby biofilms
由表3可知,次氯酸鈉處理組與對照組的S. Derby胞外蛋白質量濃度都隨著培養(yǎng)時間的延長而升高,在相同培養(yǎng)時間內,不同體積分數(shù)次氯酸鈉處理組的S. Derby胞外蛋白質量濃度均與對照組無顯著差異(P>0.05),由此可知,次氯酸鈉不能抑制S. Derby胞外蛋白的產生。
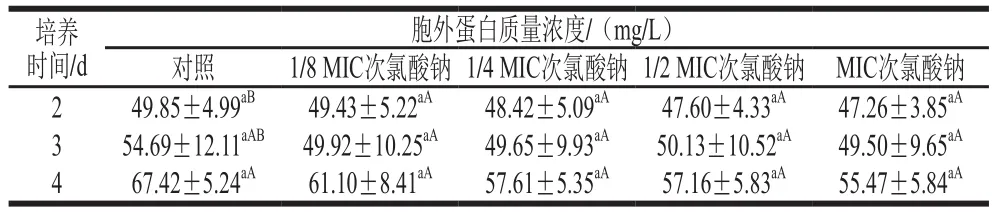
表3 不同體積分數(shù)次氯酸鈉對S. Derby生物被膜胞外蛋白的影響Table 3 Effects of different concentrations of sodium hypochlorite on extracellular proteins of S. Derby biofilms
EPS是生物被膜的重要組成部分,胞外多糖、胞外蛋白等共同組成生物被膜的三維立體結構[39]。在本研究中,隨著培養(yǎng)時間的延長,生物被膜內的胞外多糖和蛋白的質量濃度也相應增加,這與利用結晶紫染色法對生物被膜定量的結果相一致。纖維素、脂多糖等多糖成分可以支持細胞間的相互作用,介導生物被膜的三維結構生成,在培養(yǎng)基中添加不同體積分數(shù)的次氯酸鈉后,生物被膜中的胞外多糖質量濃度顯著降低(P<0.05),這表明次氯酸鈉主要通過抑制胞外多糖的生成來抑制生物被膜形成三維結構。卷曲菌毛、鞭毛等蛋白成分是細菌泳動和黏附的主要組件[40],加入次氯酸鈉后生物被膜中胞外蛋白的質量濃度沒有顯著變化(P>0.05),也印證了次氯酸鈉對于細菌的泳動能力沒有影響。纖維素由bcsABZC-bcsEFG基因編碼[41],卷曲菌毛由csgA、csgD等基因編碼[42],次氯酸鈉對胞外多糖和胞外蛋白的抑制情況不同,可能是由于其對于編碼胞外多糖和胞外蛋白的基因表達產生了不同的影響。此外,沙門氏菌生物被膜還受菌體內在的諸多基因和群體感應的調控[32],需要進一步從基因表達和群體感應調控的角度研究次氯酸鈉抑制沙門氏菌生物被膜形成的機制,目前相關研究正在開展進行中。
2.5.4 激光共聚焦掃描顯微鏡觀察S. Derby生物被膜結果

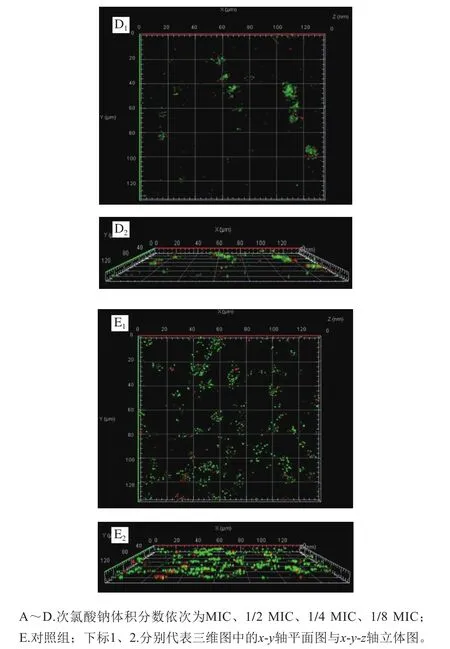
圖7 S. Derby生物被膜的激光共聚焦掃描顯微鏡圖Fig. 7 CLSM images of S. Derby biofilms
通過激光共聚焦掃描顯微鏡三維光學成像,對不同體積分數(shù)次氯酸鈉處理下S. Derby生物被膜進行了分析和比較。圖7是對照組與次氯酸鈉處理組S. Derby生物被膜的激光共聚焦顯微圖像,圖中綠色代表活菌,紅色代表死菌,立體圖可以展現(xiàn)生物被膜的厚度。對照組的顯微圖像顯示生物被膜中的細菌呈現(xiàn)團狀聚集,活菌數(shù)量遠遠大于死菌,生物被膜厚度較高。在次氯酸鈉處理組中,MIC下細菌量較少,且均為死菌,隨著處理的次氯酸鈉體積分數(shù)降低,活菌數(shù)量增加,死菌數(shù)量減少,細菌逐漸聚集,生物被膜厚度也增加,但仍遠小于對照組。與前面次氯酸鈉抑制沙門氏菌生物被膜的形成(圖4)的結果相一致。顯微鏡觀察結果顯示出沙門氏菌有較強的成膜能力,這一結果與Sadekuzzaman等[43]報道的結果一致。本研究也表明S. Derby生物被膜對目前工業(yè)中常規(guī)使用體積分數(shù)(0.01%、0.02%)的次氯酸鈉具有一定的耐受性。這可能是沙門氏菌在食品接觸面定植和引起交叉污染的原因,需要進一步尋找對沙門氏菌生物被膜具有更有效抑制和清除作用的措施。
3 結 論
沙門氏菌污染對于食品工業(yè)是一個重大的安全隱患,探究不同體積分數(shù)和類型的食品級消毒劑對該細菌的影響對優(yōu)化控制食品加工環(huán)境中安全問題尤為重要。本研究表明,次氯酸鈉對S. Derby的MIC為0.08%,在該體積分數(shù)下S. Derby的生長完全受到抑制,對生物被膜的抑制率達到91.76%;亞MIC(0.04%、0.02%、0.01%)次氯酸鈉對S. Derby生物被膜也具有明顯的抑制作用。不同體積分數(shù)的次氯酸鈉均能降低S. Derby生物被膜內細胞的代謝活性,減少胞外多糖的生成,激光共聚焦掃描顯微鏡結果也進一步印證了次氯酸鈉處理減少了生物被膜的生成量及活菌數(shù)。因此,本實驗所探索的次氯酸鈉抑制S. Derby生物被膜的形成機制主要有:延緩浮游菌的生長、降低生物被膜內細胞代謝活性、減少生物被膜胞外多糖的合成及生物被膜內菌體的數(shù)量。

