miR-96-5p調控FOXO4表達影響人瘢痕疙瘩成纖維細胞增殖和凋亡
張嵐 田榮
瘢痕疙瘩是皮膚組織受損后異常愈合的一種皮膚瘤,主要原因在于皮膚成纖維細胞異常增殖導致細胞膠原分泌量增加進而促使結締組織增生或變形最終形成瘢痕[1,2]。瘢痕疙瘩的形成已嚴重影響患者身心健康,目前臨床主要采用手術、藥物、激光等技術進行治療,但治療效果不佳,患者復發率高。研究表明促進成纖維細胞凋亡及抑制細胞增殖可有效改善瘢痕疙瘩[3]。因而基于瘢痕疙瘩形成的分子機制擬尋找治療靶點從而提高治療效果及降低復發率。微小RNA(microRNA,miRNA)可通過調控基因表達從而參與細胞增殖、凋亡等多種生物學過程,研究表明部分miRNA在瘢痕疙瘩中異常表達,并可調控多種基因表達,但關于其具體作用機制尚未闡明[4]。微小RNA-96-5p(microRNA-96-5p,miR-96-5p)可抑制肝細胞癌細胞凋亡,促進腫瘤發展進程[5]。研究表明miR-96-5p在宮頸癌中上調表達,抑制miR-96-5p表達可抑制宮頸癌進展[6]。但miR-96-5p在瘢痕疙瘩形成過程中的調控機制尚未可知。Starbase預測顯示叉頭樣轉錄因子O4(forkhead box O4,FOXO4)可能是miR-96-5p的靶基因,研究表明FOXO4在非小細胞肺癌中呈低表達,并可促進腫瘤細胞轉移[7]。目前miR-96-5p是否可通過調控FOXO4的表達參與瘢痕疙瘩形成過程尚未可知。本研究主要探討miR-96-5p在瘢痕疙瘩成纖維細胞中的表達及其對細胞增殖、凋亡的影響,分析其對FOXO4的調控作用,旨在為瘢痕疙瘩的診斷及治療提供新方向。
1 材料與方法
1.1 材料與試劑
1.1.1 瘢痕組織與正常皮膚組織來源:收集2017年6月至2018年3月我院外科需手術切除的瘢痕組織離體標本(30例),收集患者臨床病理資料,主要包括性別、年齡、皮損部位等,男16例,女14例;年齡20~35歲,平均年齡(25.54±5.46)歲。納入標準:患者均符合臨床診斷標準;向周圍侵襲性生長超出原損傷范圍;外科手術切除后復發;皮損部位無感染病灶。正常皮膚組織離體標本15例,其中男8例,女7例;年齡18~46歲,平均年齡(28.54±5.49)歲;患者接受皮膚外科手術中修整“貓耳”切除的正常皮膚組織作為正常組。本研究經醫院倫理委員會批準,患者知情且簽署同意書。
1.1.2 試劑與儀器:杜氏改良培養基(DMEM)購自美國Gibco公司;胎牛血清、胰蛋白酶、Lipofectamine2000購自美國Thermo Fisher公司;miR-96-5p特異性寡核苷酸抑制劑(anti-miR-96-5p)及陰性對照(anti-miR-NC)、miR-96-5p模擬物(mimics)、陰性對照(miR-NC)、FOXO4小干擾RNA(si-FOXO4)、亂序無意義陰性對照(si-NC)購自廣州銳博生物科技有限公司; pcDNA3.1購自上海遠慕生物科技有限公司;Trizol試劑購自美國Invitrogen公司;反轉錄試劑盒與SYBR Green試劑盒購自北京天根生化科技有限公司;甲基噻唑基四唑(methylthiazolyl tetrazolium,MTT)購自上海生工生物工程股份有限公司;膜聯蛋白V(Annexin V)-異硫氰酸熒光素(FITC)/碘化丙啶(Propidium Iodide,PI)細胞凋亡試劑盒購自上海翊圣生物科技有限公司;RIPA裂解液、二喹啉甲酸(bicinchoninicacid,BCA)蛋白定量檢測試劑盒、增強型化學發光試劑(electrochemiluminescence,ECL)購自北京全式金生物技術有限公司;兔抗人細胞周期蛋白1(CyclinD1)、活化的含半胱氨酸的天冬氨酸蛋白水解酶3(C-caspase-3)抗體購自美國Santa Cruz公司;兔抗人FOXO4抗體購自美國Abcam公司;辣根過氧化物酶(HRP)標記的山羊抗兔二抗購自武漢艾美捷科技有限公司。
1.2 方法
1.2.1 瘢痕疙瘩成纖維細胞與正常成纖維細胞的原代培養:取出瘢痕疙瘩組織與正常皮膚組織,除去表皮及皮下脂肪,無菌鹽水沖洗,剪切成1 cm×1 cm×1 cm的組織塊,接種至無菌培養瓶,加入2 ml含有10%胎牛血清的DMEM培養基,置于37℃、體積分數5%CO2培養箱培養,每2天更換一次培養液,待組織塊周圍長滿細胞時將其轉移至另一新的無菌培養瓶。取出培養瓶,棄舊培養液,PBS沖洗,加入1 ml含有10%胎牛血清的DMEM培養基,3~5 min后置于顯微鏡下觀察細胞狀態,加入2 ml含有10%胎牛血清的DMEM培養基終止消化,吹打混勻,4℃條件下經1 000 r/min轉速離心5 min,取上清液,加入含有10%胎牛血清的DMEM培養基,按照1∶2比例進行傳代培養。
1.2.2 細胞轉染與實驗分組:取對數期瘢痕疙瘩成纖維細胞,按照每孔3×105個/ml的密度接種于6孔板,待細胞融合度為30%時進行轉染,按照Lipofectamine 2000說明書分別將anti-miR-96-5p(anti-miR-96-5p組)、anti-miR-NC(anti-miR-NC組)、pcDNA-FOXO4(pcDNA-FOXO4組)、pcDNA-NC(pcDNA-NC組)、anti-miR-96-5p與si-NC(anti-miR-96-5p+si-NC組)、anti-miR-96-5p與si-FOXO4(anti-miR-96-5p+si-FOXO4組)轉染至細胞,轉染6 h后更換為含有10%胎牛血清的DMEM完全培養基,繼續培養48 h收集細胞。
1.2.3 實時熒光定量聚合酶鏈反應(Quantitative Real-time PCR,qRT-PCR)檢測細胞中miR-96-5p、FOXO4 mRNA的表達水平:采用Trizol法提取各組細胞總RNA,應用Nanodrop2000c超微量分光光度計檢測RNA濃度,根據反轉錄試劑盒將RNA反轉錄為cDNA。miR-96-5p正向引物5’-GCGCTCTTCTTTGCCTGTTT-3’,反向引物5’-AGCATGTCTGTCTTGTCCCA-3’;U6正向引物5’-GCTTCGGCAGCACATATACT-3’,反向引物:5’-GTGCAGGGTCCGAGGTATTC-3’;FOXO4 正向引物5’-TCCTCACTCCTACCATCCCA-3’,反向引物5’-GTCAAGAGAGCCTCCAGTGT-3’;β-actin正向引物5’-TGCTGTCCCTGTATGCCTCT-3’,反向引物5’-TGATGTCACGCACGATTT-3’,引物由上海生工生物工程股份有限公司設計合成。qRT-PCR反應體系:SYBR Green Master Mix 10 μl,正反向引物0.8 μl,cDNA 2 μl,RNase-Free ddH2O補足體系至20 μl;反應條件:95℃預變性2 min,95℃變性15 s,60℃退火30 s,72℃延伸30 s,共40次循環。miR-96-5p以U6為內參,FOXO4以β-actin為內參,采用2-ΔΔCt法計算miR-96-5p、FOXO4 mRNA相對表達量。
1.2.4 MTT檢測細胞增殖:收集各組轉染的瘢痕疙瘩成纖維細胞,0.25%胰蛋白酶消化,制備單細胞懸液,按照每孔100 μl的密度接種于96孔板,每組設置3個復孔,各組繼續培養48 h時每孔加入MTT溶液20 μl(質量濃度5 mg/ml),37℃、體積分數5%CO2培養箱繼續培養4 h,室溫條件下經1 300 r/min轉速離心5 min(離心半徑8 cm),棄上清,每孔加入150 μl二甲基亞砜(dimethylsulfoxide,DMSO),室溫避光孵育5 min,應用酶標儀檢測各孔吸光度值,計算細胞存活率。實驗設置3次重復。
1.2.5 流式細胞術檢測細胞凋亡:收集各組對數期瘢痕疙瘩成纖維細胞,0.25%胰蛋白酶消化,4℃條件下經1 000 r/min轉速離心6 min(離心半徑6 cm),棄上清,預冷PBS洗滌,加入5 μl Annexin V-FITC與5 μl PI,室溫孵育10 min,置于FACS Calibur流式細胞儀及應用Cellauest軟件檢測各組細胞凋亡。
1.2.6 雙熒光素酶報告基因檢測miR-96-5p的靶基因:starbase預測FOXO4與miR-96-5p存在結合位點,將結合位點插入熒光素酶報告基因載體構建野生型載體WT-FOXO4,利用基因突變技術將結合位點進行突變,將突變位點插入熒光素酶報告基因載體構建突變型載體MUT-FOXO4,取生長狀態良好的瘢痕疙瘩成纖維細胞,分別將WT-FOXO4、MUT-FOXO4與miR-NC、miR-96-5p mimics共轉染至細胞,轉染48 h后收集細胞,檢測相對熒光素酶活性。后續實驗中采用蛋白免疫印跡法(Western Blot)檢測miR-96-5p過表達或抑制miR-96-5p表達對FOXO4表達水平的影響,實驗分組:miR-NC組、miR-96-5p組、anti-miR-NC組、anti-miR-96-5p組。
1.2.7 Western Blot檢測FOXO4、CyclinD1、C-caspase-3蛋白表達:收集各組瘢痕疙瘩成纖維細胞,加入RIPA裂解液提取細胞總蛋白,采用BCA法測定蛋白濃度,十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE)分離蛋白,轉膜,封閉,室溫條件下孵育一抗(FOXO4 1∶800、CyclinD1 1∶1 000、C-caspase-3 1∶1 000)稀釋液,4℃孵育過夜,TBST洗滌,孵育二抗(1∶2 000)稀釋液,室溫孵育1 h,TBST洗滌,滴加ECL,曝光,顯影,應用凝膠成像分析系統及ImageJ軟件分析各條帶灰度值。
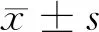
2 結果
2.1 瘢痕疙瘩成纖維細胞中miR-96-5p、FOXO4的表達情況 與正常組比較,瘢痕組瘢痕疙瘩成纖維細胞中miR-96-5p的表達水平顯著升高(P<0.05),FOXO4 mRNA及蛋白表達水平顯著降低(P<0.05)。見表1,圖1。
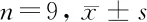
表1 瘢痕疙瘩成纖維細胞中 miR-96-5p和FOXO4表達量
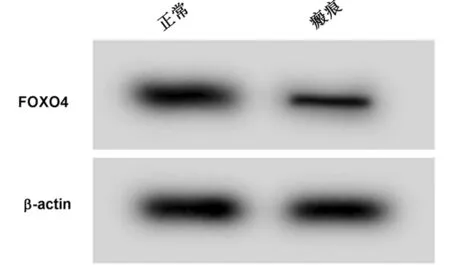
圖1 Western Blot檢測FOXO4
2.2 低表達miR-96-5p對瘢痕疙瘩成纖維細胞增殖和凋亡的影響 qRT-PCR檢測結果顯示,與anti-miR-NC組比較,anti-miR-96-5p組瘢痕疙瘩成纖維細胞中miR-96-5p的表達水平顯著降低(P<0.05)。提示成功降低瘢痕疙瘩成纖維細胞中miR-96-5p的表達。相對于anti-miR-NC組,anti-miR-96-5p組瘢痕疙瘩成纖維細胞存活率顯著降低(P<0.05),細胞凋亡率顯著升高(P<0.05),CyclinD1蛋白相對表達量顯著降低(P<0.05),C-caspase-3蛋白相對表達量顯著升高(P<0.05)。見表2,圖2。
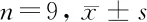
表2 低表達miR-96-5p對瘢痕疙瘩成纖維細胞增殖和凋亡的影響

圖2 低表達miR-96-5p對瘢痕疙瘩成纖維細胞增殖和凋亡的影響;A 流式細胞儀檢測細胞凋亡;B Western Blot檢測CyclinD1、C-caspase-3蛋白的表達
2.3 高表達FOXO4對瘢痕疙瘩成纖維細胞增殖和凋亡的影響 Western Blot檢測結果顯示,pcDNA-FOXO4組瘢痕疙瘩成纖維細胞中FOXO4蛋白相對表達量顯著高于pcDNA-NC組(P<0.05)。與pcDNA-NC組相比,pcDNA-FOXO4組瘢痕疙瘩成纖維細胞存活率顯著降低(P<0.05),細胞凋亡率顯著升高(P<0.05),CyclinD1蛋白相對表達量顯著降低(P<0.05),C-caspase-3蛋白相對表達量顯著升高(P<0.05)。見圖3,表3。
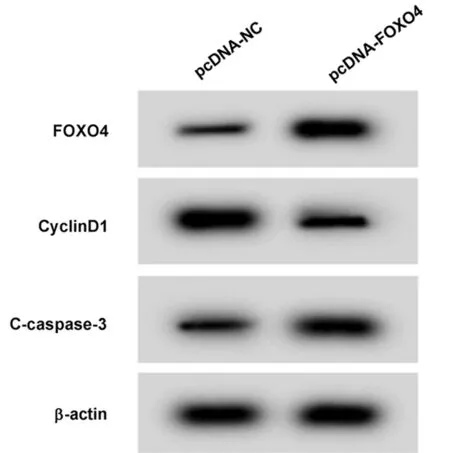
圖3 Western Blot檢測FOXO4、CyclinD1、C-caspase-3蛋白的表達
表3 高表達FOXO4對瘢痕疙瘩成纖維細胞增殖和凋亡的影響
2.4 miR-96-5p靶向FOXO4 starbase預測顯示FOXO4與miR-96-5p存在結合位點。雙熒光素酶報告實驗結果顯示,轉染野生型報告基因載體WT-FOXO4的細胞實驗中,miR-96-5p組熒光素酶活性顯著低于miR-NC組(P<0.05);轉染突變型報告基因載體MUT-FOXO4的細胞實驗中,miR-96-5p組熒光素酶活性相較于miR-NC組差異無統計學意義(P>0.05)。Western Blot檢測結果顯示,與miR-NC組相比,miR-96-5p組瘢痕疙瘩成纖維細胞中FOXO4蛋白相對表達量顯著降低(P<0.05);與anti-miR-NC組相比,anti-miR-96-5p組瘢痕疙瘩成纖維細胞中FOXO4蛋白相對表達量顯著升高(P<0.05)。見表4、5,圖4。
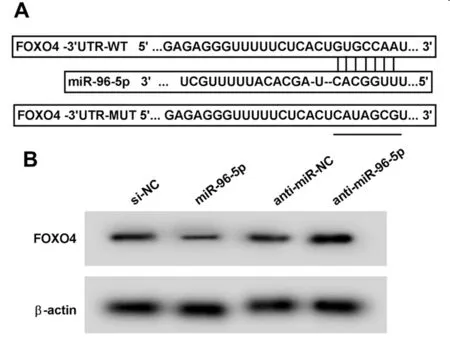
圖4 miR-96-5p靶向FOXO4;A starbase對FOXO4和 miR-96-5p結合進行預測示意圖;B Western Blot檢測FOXO4蛋白的表達
表4 miR-NC或miR-96-5p與FOXO4野生型及突變型報告質粒共轉染瘢痕疙瘩成纖維細胞瘢痕疙瘩成纖維細胞后雙熒光素酶活性檢測
2.5 低表達FOXO4可以部分逆轉miR-96-5p低表達對瘢痕疙瘩成纖維細胞增殖和凋亡的影響 實驗結果顯示,與anti-miR-96-5p+si-NC組相比,anti-miR-96-5p+si-FOXO4組瘢痕疙瘩成纖維細胞中FOXO4蛋白相對表達量顯著降低(P<0.05),細胞存活率顯著升高(P<0.05),細胞凋亡率顯著降低(P<0.05),CyclinD1蛋白相對表達量顯著升高(P<0.05),C-caspase-3蛋白相對表達量顯著降低(P<0.05)。見圖5,表6。
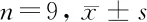
表5 Western Blot檢測FOXO4 蛋白的表達
圖5 Western Blot檢測FOXO4、CyclinD1、C-caspase-3蛋白表達
表6 低表達FOXO4可以部分逆轉miR-96-5p低表達對瘢痕疙瘩成纖維細胞增殖和凋亡的影響
3 討論
瘢痕形成與成纖維細胞異常增殖、膠原蛋白異常沉積密切相關,研究表明成纖維細胞增殖、凋亡等可能與抑癌基因失活及癌基因激活有關[8,9]。既往研究顯示miRNA在瘢痕形成過程過程發揮重要調控作用,但關于其調控機制尚未闡明[10]。因此本研究探尋新型miRNA并分析其在瘢痕形成過程中的作用機制,為揭示瘢痕疙瘩形成的分子機制奠定理論基礎。
miR-96-5p在結直腸癌細胞中呈高表達,其高表達量與患者預后不良密切相關[11]。研究表明miR-96-5p通過靶向FOXO3促進胃癌細胞的增殖[12]。相關報道指出miR-96-5p通過抑制Caveolae1促進卵巢癌細胞的增殖和遷移[13]。本研究結果顯示瘢痕疙瘩成纖維細胞中miR-96-5p的表達水平顯著升高,提示miR-96-5p表達量升高可能促進瘢痕疙瘩形成。本研究進一步檢測結果顯示抑制miR-96-5p的表達后瘢痕疙瘩成纖維細胞存活率顯著降低,細胞凋亡率顯著升高,提示抑制miR-96-5p的表達可通過抑制成纖維細胞增殖及促進細胞凋亡從而抑制瘢痕疙瘩形成。研究表明CyclinD1是G1期細胞增殖信號的關鍵蛋白,增生瘢痕中CyclinD1的表達量升高并可通過與細胞周期依賴蛋白激酶(CDK4/6)結合形成復合物從而促進細胞周期進展,促進細胞增殖[14]。相關報道指出caspase-3是caspase家族主要成員,其可破壞細胞結構而阻斷細胞DNA復制及修復進而促使細胞凋亡[15]。本研究結果顯示抑制miR-96-5p的表達后瘢痕疙瘩成纖維細胞中CyclinD1表達下調,C-caspase-3表達上調,提示抑制miR-96-5p的表達可能通過促進C-caspase-3表達及抑制CyclinD1表達從而抑制瘢痕疙瘩成纖維細胞增殖,誘導細胞凋亡。
FOXO4低表達量與膀胱癌患者不良預后密切相關[16]。研究表明FOXO4表達量降低可參與肝癌的發生[17]。miR-150通過靶向FOXO4促進宮頸癌細胞的生長[18]。本研究結果顯示FOXO4在瘢痕疙瘩成纖維細胞中的表達水平明顯降低,進一步研究顯示上調FOXO4的表達后瘢痕疙瘩成纖維細胞存活率顯著降低,細胞凋亡率顯著升高,CyclinD1蛋白表達水平顯著降低,C-caspase-3蛋白表達水平顯著升高,提示FOXO4過表達可能通過調控細胞增殖及凋亡相關蛋白表達從而促進成纖維細胞凋亡及抑制細胞增殖。本研究顯示,miR-96-5p可靶向結合FOXO4并負向調控FOXO4的表達,抑制FOXO4的表達聯合抑制miR-96-5p表達處理成纖維細胞,細胞存活率顯著升高,細胞凋亡率顯著降低,CyclinD1蛋白表達水平明顯升高,C-caspase-3蛋白表達水平顯著降低,說明抑制FOXO4表達可部分逆轉抑制miR-96-5p表達對瘢痕疙瘩成纖維細胞增殖和凋亡的影響。提示抑制miR-96-5p表達可通過上調FOXO4表達從而影響瘢痕疙瘩成纖維細
胞增殖及凋亡。
綜上所述,miR-96-5p可能通過下調FOXO4的表達從而促進瘢痕疙瘩成纖維細胞增殖并抑制細胞凋亡,為揭示瘢痕疙瘩形成機制奠定理論基礎,為以miR-96-5p為靶點的瘢痕疙瘩的防治提供理論依據。但關于miR-96-5p在瘢痕疙瘩成纖維細胞中介導的相關信號通路尚需進一步研究。

